亚香棒虫草内生真菌C-10转化多糖发酵工艺探讨
聂斌英,关爱国,袁波
(1.宜春学院化学与生物工程学院,江西宜春 336000;2.江西科技职业学院,江西南昌 330200;3.宜春学院化学与生物工程学院,江西宜春 336000)
亚香棒虫草内生真菌C-10转化多糖发酵工艺探讨
聂斌英1,关爱国2,袁波3
(1.宜春学院化学与生物工程学院,江西宜春 336000;2.江西科技职业学院,江西南昌 330200;3.宜春学院化学与生物工程学院,江西宜春 336000)
以亚香棒虫草中分离出的内生真菌C-10为试验菌种,利用培养基发酵培养C-10,用来转化多糖,通过单因素试验,探讨pH、光照情况、营养因子、振荡、金属离子对虫草多糖的影响。试验表明,亚香棒虫草内生真菌C-10在pH 6.2条件下发酵液中多糖较多,含量为0.3723mg/mL;pH 5.7条件下菌丝体中多糖量较多,含量为0.2909mg/mL。避光条件下菌丝体中多糖较多,含量为0.5035mg/mL;不避光条件下发酵液中多糖较多,含量为0.036mg/mL。正常摇荡条件下菌丝体中多糖较多,含量为0.3409mg/mL;前2d摇荡、后3d静置条件下发酵液中多糖较多,含量为0.0456mg/mL。加入甲硫氨酸的条件下,菌丝体和发酵液中的多糖都较多,菌丝体中多糖含量为0.7758mg/mL,发酵液中多糖含量为0.0478mg/mL;加入锰离子的培养条件下,发酵液中和菌丝体中多糖含量较多,分别为 0.6072mg/mL、0.1989mg/mL。
亚香棒虫草;内生真菌;多糖;发酵工艺
亚香棒虫草(Cordyceps hawkesiiGray)属植物界真菌门虫草菌属,药性甘,有益精止血、补益肺肾的功效,主治身体虚弱、肺结核。它生长于林中落叶层下的鳞翅目幼虫上,主要分布于湖南、贵州,也有少量分布于广西、广东、四川、湖北、安徽、云南等地[1]。亚香棒虫草含有氨基酸、多糖、麦角甾醇、甘露醇、生物碱、有机酸、烟酸、烟酰胺、维生素C、铁、铜、锌、锰、铬和钴等营养成分,因为有抗氧化、抗肿瘤、降低血液中三油甘酯和胆固醇含量等较多的药理作用而倍受关注[2]。
内生真菌是在宿主植物的茎和叶内生存并完成生活周期的真菌。这类真菌中,有许多种类很少形成孢子,或者在宿生植物上形成的孢子(或者孢子果)不容易识别。真菌感染植物组织,菌丝存在于细胞内和细胞间。与病原菌不同的是这些真菌对宿主植物几乎没有害处,它们和植物之间或者是相互依存的共生关系,或者是不太密切的共生关系。内生真菌生长在宿主植物的根茎叶等组织内部,最开始是在红豆杉的韧皮部位分离到安德氏紫杉霉,能够产生紫杉醇,由此引起了微生物学家、植物学家、生态学家对内生真菌的广泛兴趣。
虫草多糖具有抗肿瘤、抗传染病、增强性功能、补肾壮阳、益精气、防衰老、延年益寿,对老年人慢性支气管炎、肺源性心脏病有显著的功效,能提高肝脏的解毒能力,起到护肝、降血糖、降血脂的作用。贫血的患者可用于补血、增强脾脏的营养性血流量。虫草多糖生物活性强、适应性广,还具耐缺氧、镇痛、镇静等作用[3]。
菌丝体多糖具有和子实体多糖同样的药理活性,传统的真菌多糖提取多采用子实体为材料,但由于子实体栽培周期长、劳动强度大,受气候、环境的影响,产量及质量不稳定,且子实体木质化程度高[4],多糖提取利用率较低。与之相反,采用生物发酵技术生产菌丝体,周期短、成本低、产量大,且有工业化生产前景,因此,利用生物发酵技术生产真菌多糖已是大势所趋,有助于保护虫草资源。本试验探讨了pH、光照情况、营养因子、振荡、金属离子这几个因素对虫草内生真菌生产多糖的影响,旨在对虫草内生真菌产多糖的培养发酵条件进行优化,使其能够产更多更优质的多糖。
1 材料与设备
1.1 供试菌株
亚香棒虫草内生真菌C-10(菌丝细长紧密,颜色是鹅黄色),宜春学院化学与生物工程学院提供。
1.2 仪器与设备
生化培养箱,LRH-250;循环水真空泵,SHZ-3型;台式离心机,TDL-40B;快速混匀器,SK-1;超净工作台,SW-CJ-2D;摇床,ZWY-211B;立式自动电热压力蒸汽灭菌器,LX-B35L型;数显恒温水浴锅,HH-4;紫外可见分光光度计,UV-2800AH型;电子天平,YP1201N,上海舜宇恒平科学仪器有限公司;海尔冰箱,BCD-211BSA,青岛海尔股份有限公司。
1.3 试剂
琼脂、氨苄青霉素、维生素B1、豆粕、麸皮、玉米粉、葡萄糖、半乳糖、麦芽糖、甲硫氨酸、甘氨酸、苯丙氨酸、蛋白胨、酵母粉,以上为生化级试剂。
磷酸二氢钾、硫酸镁、硝酸铵、硫酸锌、磷酸氢二钾、硫酸铁、硫酸锰、硫酸、乙醇、乙醚、苯酚、蒽酮,以上为分析纯试剂。
2 试验方法
2.1 操作流程图
操作流程图见图1。

图1 操作流程图
2.2 操作要点
2.2.1 菌种活化
根据所需配制成的体积数,计算出各成分的含量,称取200g去皮马铃薯切碎,在锅中煮沸,煮沸后按马铃薯20%、葡萄糖2%、蛋白胨1%、磷酸二氢钾0.1%、硫酸镁0.1%、琼脂2.2%的配方加入溶解。为抑制细菌的污染需加入一定的抗生素,同时为了防止杀菌后的污染,往100mL的培养基中加0.1g氨苄青霉素,摇匀并分装成10根试管,把所有器具培养基接种环放入立式自动电热压力蒸汽灭菌器中,121℃杀菌30min,在超净工作台上分别向装有300mL培养基的三角瓶中加200mg/L的氨苄青霉素。将试验材料亚香棒虫草内生真菌C-10菌种接种到活化培养基上,接种时一定要防止染菌,接种后包扎好放入生化培养箱中培养,并设定温度25℃,培养7d。
2.2.2 种子液扩大培养
称取马铃薯200g,煮制马铃薯溶液,加入葡萄糖2%、蛋白胨1%、磷酸二氢钾0.1%、硫酸镁0.1%。水浴加热并不断搅拌,直至蛋白胨和葡萄糖完全溶解后,加水定容至2000mL,加入200mg/L氨卡青霉素,用250mL三角瓶按150mL装液量分装,进行高压蒸汽灭菌20min,冷却后,在超净工作台上,从活化培养基中挑选活化最好的菌丝,接种到种子液培养基上,菌丝接种4个培养基,接种时一定要防止染菌,放入摇床中,设置温度25℃,转速150r/min,时间 168h(7d)。
2.2.3 发酵转化
马铃薯溶液,加入玉米粉10g/L、麸皮3g/L、半乳糖10g/L、葡萄糖 7g/L、麦芽糖 20g/L、硝酸铵 2g/L、酵母粉4g/L、蛋白胨 4g/L、豆粕 4g/L、硫酸镁 0.5g/L、维生素 B10.1g/L、硫酸锌0.5g/L、磷酸二氢钾0.4g/L、磷酸氢二钾0.4g/L、硫酸铁0.2g/L、氨卡青霉素,制成溶液备用。在不同条件下,在生化培养箱中挑选培养最好的C-10菌种的种子液进行培养基优化,设定摇瓶条件25℃、150r/min,培养 5d。
2.2.4 发酵液多糖的分离提纯
取出发酵培养基,逐个真空抽滤出固体菌丝体保存并贴好标签,将过滤液进行离心处理,离心装置设置为4000r/min离心15min,取上清液浓缩,加入3倍于液体的95%乙醇(醇解多糖),沉淀10h过滤得到粗糖固体。用乙醚洗除去脂肪,再次过滤得到除去脂肪蛋白质的多糖,加水溶解得到多糖溶液,定容。
2.2.5 胞内多糖的分离提纯
将上面过滤出的固体菌丝体用等电点盐析法去除蛋白质,加水离心,取沉淀菌体再用30mL、80%乙醇溶解,放入三角瓶中超声30min,过滤得到固体沉淀,水浴超声10min,加20mL乙醚,再次过滤,得到上清液,定容。
2.3 测定指标与方法
2.3.1 标准曲线的制定
葡萄糖制成浓度0.1g/L,精密吸取0.20mL、0.40mL、0.60mL、0.80mL、1.00mL置于比色管中补充水到 2mL,在冰水中加蒽酮硫酸溶液(称取0.2g蒽酮,加入100mL硫酸溶解即得)5mL,注意保持混合物冷却,加完后密封,摇匀,于沸水浴中加热10min取出后用自来水冷却,同样方法处理空白对照,621nm下测吸光度。测得数据制成萄萄糖标准曲线。
2.3.2 样液的多糖测定
准确量取提取液0.1mL于10mL比色管中,加入1.9mL蒸馏水,再加入浓度2g/L的蒽酮硫酸溶液2mL,摇匀,迅速加入5mL浓硫酸摇匀静置10min,以0管为空白,于621nm波长测定得吸光度。葡萄糖标准曲线如图1。
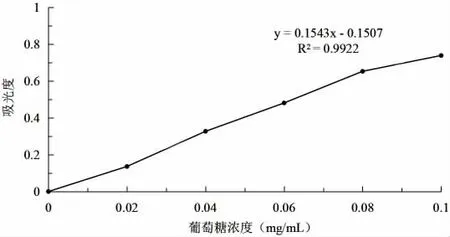
图1 葡萄糖标准曲线
3 结果与分析
3.1 pH对虫草多糖产量的影响
pH对微生物的生命活动有很大的影响,能使蛋白质、核酸等生物大分子所带电荷发生变化,从而影响其生物活性;还能引起细胞膜电荷变化,导致微生物细胞吸收营养物质能力改变;甚至改变环境中营养物质的可给性及有害物质的毒性[5]。虫草多糖内生真菌液体深层培养要求适宜的pH。为考察不同的初始pH对亚香棒虫草内生真菌产多糖的影响,取马铃薯溶液,分装到6个250mL锥形瓶内,两两分别调节pH至5.2、5.7、6.2,其他条件相同,并定容至100mL,在温度25℃、150r/min的条件下,培养5d,测定多糖含量。测定结果见表1。

表1 pH对于虫草多糖产量的影响
在pH 5.2的条件下,菌丝体内的多糖测得为0.1872mg/mL,发酵液多糖含量0.0658mg/mL。pH5.7的条件下,菌丝体内多糖测得为0.2909mg/mL,发酵液多糖含量0.036mg/mL。pH 6.2的条件下,菌丝体内多糖测得为0.1794mg/mL,发酵液多糖含量0.3723mg/mL。3个pH中,pH为6.2的条件下发酵液中多糖较多,pH为5.7时菌丝体产多糖较多。
3.2 振荡对于虫草多糖产量的影响
发酵液中溶氧量对于虫草内生真菌的生长有一定影响,振荡能够增加发酵液中的溶氧量,但振荡增加的发酵液中的氧气含量是否能够促进虫草内生真菌C-10产多糖,有待试验。由此设置以下试验条件。试验结果如表2。

表2 振荡对于虫草多糖产量的影响
振荡条件下,菌丝体内多糖测得为0.3409mg/mL,发酵液多糖含量0.036mg/mL。前2d振荡后、3d静置条件下,菌丝体内多糖测得为0.2909mg/mL,发酵液多糖含量0.0456mg/mL。静置条件下,菌丝体内多糖测得为0.2533mg/mL,发酵液多糖含量0.0151mg/mL。由表2可知,正常摇荡下,虫草内生真菌菌丝体产生多糖最多,前2d振荡、后3d静置条件下,发酵液中多糖量较多。
3.3 遮光对于虫草多糖产量的影响
光照强度对于虫草内生真菌的生物学效率和物质转换效率有影响[6]。为了考察光照对于虫草内生真菌产多糖的影响,对培养基进行遮光处理,作对比试验。试验结果如表3。

表3 避光对于虫草内生真菌产多糖的影响
遮光条件下,菌丝体内多糖测得为0.5035mg/mL,发酵液多糖含量0.0239mg/mL。不避光条件下菌丝体内多糖测得为0.2909mg/mL,发酵液多糖含量0.0360mg/mL。由数据可得,遮光条件下虫草真菌菌丝体多糖较多。不避光条件下,发酵液中多糖含量较多。
3.4 营养因子对于虫草多糖产量的影响
氨基酸作为有机氮源,是构成生物体蛋白质最最基础的物质,与生物体的活动有着密切联系,是生物体内不可缺少的营养成分之一[7]。为考察氨基酸对亚香棒虫草内生真菌产多糖的最佳氨基酸种类,另取马铃薯溶液,分装到8个250mL锥形瓶里;两两分别加入0.1g甲硫氨酸、0.1g甘氨酸、0.1g苯丙氨酸,另外两个加入0.033g甲硫氨酸、0.033g甘氨酸、0.033g苯丙氨酸,其他条件相同,定容到100mL,在其他培养条件一致的情况下,培养5d,测定多糖产量。测定结果如表4。
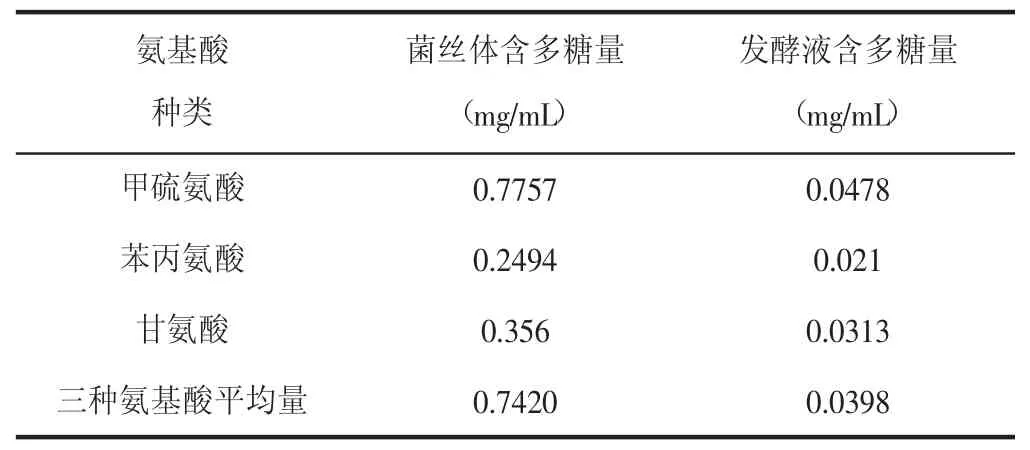
表4 营养因子对于虫草多糖产量的影响
加入甲硫氨酸的条件下菌丝体内多糖为0.7757mg/mL,发酵液多糖含量0.0478mg/mL。加入苯丙氨酸的条件下菌丝体内多糖测得为0.2494mg/mL,发酵液多糖含量0.0210mg/mL。加入甘氨酸的条件下菌丝体内多糖测得为0.3560mg/mL,发酵液多糖含量0.0313mg/mL。加入3种氨基酸平均量的条件下菌丝体内多糖测得为0.742mg/mL,发酵液多糖含量0.0398mg/mL。明显,加有甲硫氨酸的培养基虫草多糖显著增加,所以培养基中加入甲硫氨酸可以提高多糖的产量。
3.5 锰离子对虫草多糖产量的影响
锰离子对亚香棒虫草内生真菌有富集和耐受特性,能促进菌丝体对微量元素的吸收和抑制Mg的吸收[8]。因此,为了考察锰离子对亚香棒虫草内生真菌的影响,取马铃薯溶液,分装到4个250mL锥形瓶里,其中两个加入0.1g硫酸锰,另外两个不加,其他条件相同,定容至100mL,得到优化锰离子对虫草内生真菌产多糖的培养基。相同条件下,做加锰离子和不加锰离子的对比试验,试验结果如表5。
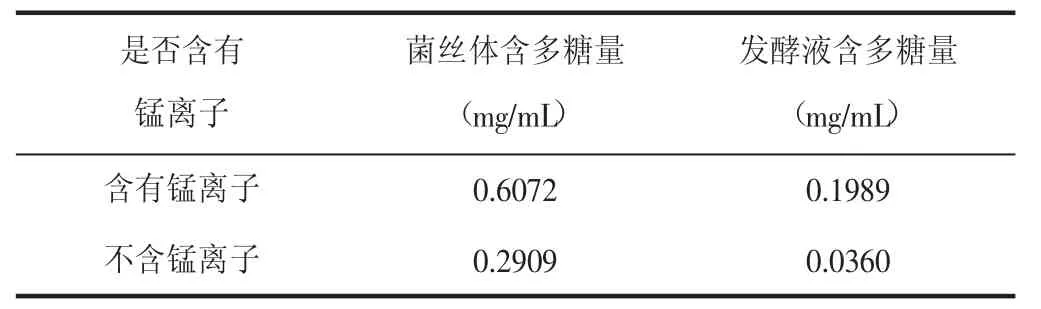
表5 锰离子对虫草多糖产量的影响
加了锰离子的条件下菌丝体内多糖测得为0.6072mg/mL,发酵液多糖含量0.1989mg/mL。不加锰离子的条件下菌丝体内多糖测得为0.2909mg/mL,发酵液多糖含量0.0360mg/mL。由此可以看出,培养基中适当加入锰离子,虫草多糖相比没有加锰离子的明显增加,所以建议在培养基中加锰离子。
4 结论
亚香棒虫草内生真菌C-10在pH 6.2条件下发酵液中多糖较多,含量为0.3723mg/mL,pH 5.7条件下菌丝体中多糖量较多,含量为0.2909mg/mL。避光条件下菌丝体中多糖较多,含量为0.5035mg/mL,不避光条件下发酵液中多糖较多,含量为0.0360mg/mL。正常摇荡条件下菌丝体中多糖较多,含量为0.3409mg/mL、,前2d摇荡、后3d静置条件下发酵液中多糖较多,含量为0.0456mg/mL。加入甲硫氨酸的条件下,菌丝体和发酵液中的多糖都较多,菌丝体中多糖含量为0.7758mg/mL,发酵液中多糖含量为0.0478mg/mL。加入锰离子的培养条件下,发酵液中和菌丝体中多糖含量较多,含量分别为0.6072mg/mL、0.1989mg/mL。所以,pH 6.2,不避光,加入甲硫氨酸,加入锰离子,前2d摇荡、后3d静置条件下对虫草内生真菌发酵液中多糖含量提升有促进作用。pH 5.7,避光,加入甲硫氨酸,加入锰离子,正常摇荡条件下能提高虫草内生真菌菌丝体中多糖产量。
[1]陈丽冰.北虫草固体培养残基中多糖和虫草素高效提取与纯化研究[D].荆州∶长江大学,2015.
[2]康超,文庭池,康冀川,等.不同培养条件和前体对蛹虫草液体发酵产虫草素的影响[J].菌物学报,2012,03∶389-397.
[3]彭日煌.虫草菌粉活性物质与营养成分研究 [D].南昌∶南昌大学,2005.
[4]郑静.囊菌虫草菌的分离、鉴定及其发酵工艺研究[D].杭州∶浙江大学,2005.
[5]陈磊.蛹虫草(Cordyceps militaris)生物学特性及发酵研究[D].北京∶中国协和医科大学,2009.
[6]于德洋.亚香棒虫草的培养特性及对锌锰的抗性和富集机制[D].烟台∶鲁东大学,2012.
[7]方尚瑜.营养因子对蛹虫草液体发酵生物活性代谢产物的影响[D].咸阳∶西北农林科技大学,2012.
[8]左言美.蛹虫草(Cordycep militaris)对锌锰离子耐受的生理生化机制研究[D].烟台∶鲁东大学,2013.
[9]暴增海,马桂珍,张昌兆.我国的虫草资源及其开发利用现状与展望[J].自然资源,1994.
[10]汪宗俊,施大文.我国近年来冬虫夏草研究进展[J].中药材,1986.
[11]杨振芳.孢虫草(Cordyceps bassiana)生物学特性及活性成分研究[D].青岛∶中国海洋大学,2009.
[12]白云娥,王毅,刘许媛,等.冬虫夏草、亚香棒虫草中多糖的含量测定[J].中国医院药学杂志,2001,01∶19-20.
[13]张琪,程显好,郭文娟,等.亚香棒虫草菌丝体金属硫蛋白的提纯及性质[J].微生物学通报,2014,06∶1035-1042.
[14]武忠伟.冬虫夏草深层培养及其多糖的研究与应用 [J].西安∶西北大学,2005.
[15]贲松彬,李惠娇,黄子琪,等.蛹虫草菌丝体发酵培养过程中氨基酸添加技术研究[J].食品科学,2010,23∶233-237.
Study on Fermentation Technology of Polysaccharides from Cordyceps Militaris Endophytic Fungus C-10
NIE Bin-ying1,GUANAi-guo2,YUANBo3
(1.School ofChemistryand Bioengineering,Yichun University,Yichun 336000,China;2.Jiangxi University ofScience and Technology,Nanchang 330200,China;3.College ofChemistryand Biological Engineering,Yichun University,Yichun 336000,China)
The endophytic fungus C-10 isolated from Cordyceps militaris was used as the test strain,and the endophytic fungi were cultured in medium to convert polysaccharide.Through single factor test,the effects of pH,light,nutritional factors,oscillation,and metal ions on Cordyceps polysaccharide were investigated.Test showed that polysaccharide in the fermented liquid produced by endophytic fungi C-10 under the condition of pH 6.2 was more,and the content was 0.3723mg/mL.Under the condition of pH 5.7 mycelium polysaccharide in quantity was more,and the content was 0.2909mg/mL.Under the condition of avoiding light conditions,the content of polysaccharides in the mycelium,was 0.5035mg/mL.The content of polysaccharide in fermented liquid was more,which was 0.036mg/mL under the condition of light.Under the condition of normal oscillation,the content of polysaccharides in the mycelium was more,which was 0.3409mg/mL.Under the condition of two days swing and three days static,the content of polysaccharide in the fermented liquid was more,which was 0.0456mg/mL.Under the condition of methionine,there were more polysaccharides in mycelia and fermentation broth,and mycelium polysaccharide content was 0.7758mg/mL,and the polysaccharide content in the fermented liquid was 0.0478mg/mL.Under the condition of adding manganese ion,the content of polysaccharide in the fermentation broth and in the mycelia was more,and the content was 0.6072mg/mL,0.1989mg/mL.
Cordyceps hawkesiiGray;endopHytic;polysaccharide;fermentation technology
Q815
A
1008-1038(2017)11-0006-05
10.19590/j.cnki.1008-1038.2017.11.002
2017-08-27
聂斌英(1969—),女,副教授,主要从事生物工程方面的科研和教学工作

