“鱼浮灵”增氧原理的实验探究
张晓红
摘要:以“鱼浮灵”作为探究对象,利用溶解氧传感器和pH传感器对“鱼浮灵”增氧原理进行了实验探究。结果发现,“鱼浮灵”中碳酸钠溶于水显碱性,碱性条件能促进H2O2的分解,从而达到缓解水体缺氧的目的。
关键词:溶解氧传感器;pH传感器;鱼浮灵;实验探究
文章编号:1005–6629(2017)11–0074–03 中图分类号:G633.8 文献标识码:B
1 问题提出
作为高考考查科目之一,江苏高考化学试卷命题以考查学生的科学素养和化学学科能力为主旨,重点考查学生的信息获取与加工、化学实验探究、从化学视角分析解决问题和化学学科思维等能力。要求学生能设计解决简单化学问题的实验探究方案,能运用观察实验、阅读资料等多种手段收集证据,能基于证据推理形成探究结论,并运用多种方式准确地表达探究结果[1]。笔者现从教高三,感觉高中化学教材中多为结合教材内容的简单定性或定量实验,与高考考查要求尚有一定距离。受启发于2016年江苏高考化学试卷第18题,题中涉及供氧剂过氧化钙(CaO2·8H2O)的制备以及过氧化钙溶于水后溶液中溶解氧的测定。另外考虑到简单易操作、实验安全、有探究价值等因素,本实验选择“鱼浮灵”作为研究对象,运用数字化手持技术探究“鱼浮灵”的增氧原理,与学生一起体验化学实验探究的历程。
2 实验原理
在水产养殖或运输过程中,如果水体缺氧会导致养殖的鱼虾等轻则出现浮头,重则泛池、窒息死亡,造成重大经济损失。渔民们通常采用机械增氧、生物增氧和化学增氧三种方法增加水中溶解氧,实验探究的“鱼浮灵”就是一种化学增氧剂。“鱼浮灵”溶于水后能迅速增加水体溶氧量并在长时间内维持,提高鱼苗及活鱼运输的成活率,缓解消除水体中有机酸及分子氨的积累,增加水生动物的抗病能力。通过产品说明和查阅资料,得知“鱼浮灵”主要成分是过氧碳酸钠(2Na2CO3·3H2O2),俗称固体双氧水。
3 实验设计
3.1 药品及仪器
药品:鱼浮灵、NaCl(s)、Na2CO3(s)、NaOH(6mol/L)、H2O2(4%)、蒸馏水
仪器:数据采集器(苏威尔软件)、溶解氧传感器、pH传感器、计算机、磁力搅拌器、100mL烧杯、洗气瓶、量筒等
3.2 操作要点
(1)pH传感器比较灵敏,使用前需要用pH=4和pH=9.18的标准液校准;溶解氧传感器比较稳定,一般出厂后不需要校准,但使用时要注意探头处不能有气泡。
(2)4% H2O2的密度约1.0g/mL,根据溶液质量分数和浓度的换算公式,可求出其物质的量浓度约为1.2mol/L。为使对比各组之间实验因素的影响尽量一致,通过计算求出80mL蒸馏水中加入“鱼浮灵”的质量约为6.7g,使其溶于水后H2O2浓度也等于1.2mol/L。
(3)NaOH固体溶于水放热,为了排除溫度对反应速率的影响,因此实验中选择用6mol/L的NaOH溶液调节溶液pH。
3.3 实验装置
实验装置如图1所示。
3.4 实验探究
(1)向100mL烧杯中加入80mL蒸馏水,插入溶解氧传感器探头、pH传感器探头,连接数据采集器,打开磁力搅拌器,加入6.7g“鱼浮灵”,绘制溶解氧(mg/L)和pH随时间变化的曲线。
(2)向100mL烧杯中加入80mL H2O2(4%),同(1)操作;待曲线变化平稳后加入少量NaCl固体,观察曲线变化;待曲线变化平稳后再加入少量Na2CO3固体,观察曲线变化。
(3)向100mL烧杯中加入80mL H2O2(4%),同(1)操作;待曲线变化平稳后加入少量NaOH溶液(6mol/L),观察曲线变化。
(4)图表分析。由于水中溶解氧量程为0~20(mg/L),pH量程为0~14,两者相差不大,可以在坐标轴上同时绘制溶解氧(mg/L)-时间(s)、pH-时间(s)两条曲线,以便于观察分析。(注:pH传感器探头从溶液中取出时pH会发生突变)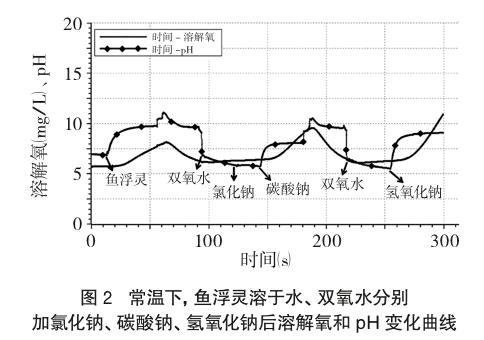

由图2、表1可知:常温下蒸馏水pH约为7,溶有少量O2;加入“鱼浮灵”后溶液pH大于7,显碱性,水中溶解氧明显增大。常温下H2O2 pH小于7,呈弱酸性,溶解氧大于纯水,且随时间递增,水中溶解氧缓慢增大,说明常温下H2O2能缓慢分解产生O2;加入NaCl后溶液呈弱酸性、溶解氧变化不明显;加Na2CO3后溶液pH增大,碱性增强,溶解氧增大;加NaOH后溶液pH增大,碱性增强,溶解氧明显增大。(注:表中数据取自加入不同试剂后,pH变化平稳再次突变前的点)
3.5 实验再探究
为了进一步确定溶液酸碱性对H2O2分解情况的影响,增加实验:向5个100mL烧杯中分别加入80mL H2O2(4%),用NaOH(6mol/L)调节五组溶液的酸碱性,使溶液的pH逐渐增大,依次插入溶解氧传感器探头、pH传感器探头,绘制溶解氧(mg/L)和pH随时间变化的曲线。
由上述图3、表2可知:除温度、浓度、催化剂等条件,溶液的酸碱性也能影响H2O2的分解速率。不同pH下H2O2分解产生O2的速率不同,一定pH范围内,pH越大,溶液碱性越强,H2O2分解速率越快,但是pH调至11.74后,由图3中溶解氧变化趋势及表2中数据分析,发现H2O2分解速率不升反降,可推测H2O2分解速率与pH并不是完全正相关。(注:表中数据取自五组H2O2分别加入不同体积NaOH溶液后,pH变化平稳再次突变前的点)endprint

