无黑色素普鲁兰多糖出芽短梗霉的选育
,,, ,,,继栋,,*
(1.广西大学轻工与食品工程学院,广西南宁 530004;2.广西蔗糖产业协同创新中心,广西南宁 530004)
无黑色素普鲁兰多糖出芽短梗霉的选育
张若璇1,孙帅楠1,孙钦菊1,刘鑫1,杭方学1,2,刘继栋1,2,*
(1.广西大学轻工与食品工程学院,广西南宁 530004;2.广西蔗糖产业协同创新中心,广西南宁 530004)
为选育一株高产无黑色素普鲁兰多糖的出芽短梗霉(Aureobasidiumpullulans),以A.pullulansAs.40329和A.pullulansAs.3#为出发菌株,通过紫外诱变(15 W)筛选出三株正突变菌株作为亲本。在此基础上,对三株亲本制备原生质体并采用35%的PEG4000介导进行全基因重组(Genome shuffling,GS)。随后,经双亲灭活筛选后获得A.pullulans的全基因重组菌F2-6。结果表明,菌株F2-6遗传性状稳定且发酵多糖产物中近乎无黑色素(OD654维持在0.02左右),多糖产量提高至(19.53±0.39) g/L,比原始菌As.3#提高119.69%,表明重组菌F2-6具有工业化生产普鲁兰多糖的潜能。
出芽短梗霉,普鲁兰多糖,全基因重组,黑色素
普鲁兰多糖是一种极性真菌胞外多糖,具有良好的成膜性[1]、抗菌性[2]、耐热性[3]等特性,广泛应用于食品和生物制药等领域[4-5]。目前,工业上多通过出芽短杆霉(Aureobasidiumpullulans)发酵生产普鲁兰多糖,但是普遍存在产量低、产物黑色素累积等问题,提高了纯化成本并限制了其应用范围[6]。学者曾通过控制培养基中碳源[7]、氮源[8]及pH[9]等方式调控A.pullulans的生产能力及多糖产物的黑色素含量,但仍未达到工业化生产的需要。因此,选育一株高产普鲁兰多糖且不积累黑色素的菌株是当前急需解决的关键科学问题之一。
目前,由于A.pullulans的表达系统构建仍未完善,从普鲁兰多糖合成机理及基因遗传机理入手改造出芽短杆霉菌株还面临诸多困难。虽然有报道中曾将普鲁兰多糖的编码基因在大肠杆菌(Escherichiacoli)等宿主菌内进行表达[10],但其多糖产物在食品、药品领域中的应用存在安全性争议[11]。当前,对A.pullulans的遗传改造仍以传统诱变方式为主。王雪松等[12]使用He-Ne激光对A.pullulans原生质体进行诱变,突变菌株普鲁兰多糖的含量增加到了26.65 g/L,是原始菌株的10.6倍,报道中并未提及诱变菌发酵产物的黑色素积累情况。靳建忠等[13]通过紫外诱变的方法对菌株A.pullulansNG进行改良,获得一株高产无黑色素普鲁兰多糖的突变株UVMU3-1,然其摇瓶水平的多糖产量在改组前后并未发生明显变化。万翠香[14]等采用紫外、亚硝基胍及硫酸二乙酯对A.pullulans进行了多轮诱变,获得的变异菌P1012的黑色素产量较低,其多糖的积累量提高至28.01 g/L。然而,由于传统诱变的方式需要进行大量诱变与筛选过程,正向突变发生的几率较小且不可控,导致育种效率较低。
基因改组技术基于对发菌株的遗传信息的保守性高效定向改造,并未进入任何外源遗传信息,可以使研究人员在短时间内选育到所需的菌株[15]。资料显示,两轮基因改组得到的结果大致相当于传统诱变方法20轮的诱变与筛选[16]。目前,在普鲁兰多糖的高产菌株选育方面,全基因重组(GS)得到了研究者的广泛关注。如冯印[17]等对A.pullulans进行全基因重组获得的改组菌的多糖产量分别比出发菌株提高了71.22%,但并未提及改组菌多糖产物的颜色。Kang等[18]通过基因组改组处理A.pullulansN3.387,其产物产量提高至20.7 g/L,相对于野生菌株提高了179.7%,同样的,该改组菌产生的多糖产物也含有黑色素成分。张晶[19]等通过GS,选育了2株改组菌,其多糖产量提高至42.38 g/L及42.6 g/L,同时,其发酵液OD654值比出发菌株分别降低了17.30%和20.57%,表明其产物黑色素成分含量有所降低。
基于目前尚未有适合工业化应用不积累黑色素的A.pullulans菌株,本研究拟以A.pullulansAs.40329和As.3#为出发菌,通过紫外诱变构建亲本突变库,选育性状优良的菌株进行全基因重组,以期获得一株高产无黑色素普鲁兰多糖的重组菌。
1 材料与方法
1.1材料与仪器
出芽短杆霉(A.pullulans)As.40329和(A.pullulans)As.3# 本研究室保藏;蔗糖、无水乙醇、Tris、氯化钠 均为常规分析纯,上海国药集团;溶菌酶 活性:>22800 U/mg,生工生物工程(上海)股份有限公司;普鲁兰标准品 Sigma公司;种子培养基(g/L) 磷酸氢二钾6,磷酸二氢钾2,硝酸钠1.54,氯化钠2,七水硫酸镁0.04,四水氯化锰0.006,六水氯化铁0.002,盐酸硫胺素0.004,葡萄糖30,酵母膏1;发酵培养基(g/L) 磷酸氢二钾7,硫酸铵0.4,氯化钠1,硫酸镁0.1,酵母膏1.5,蔗糖50;PDA马铃薯葡萄糖琼脂培养基(g/L) 马铃薯200,琼脂20,葡萄糖20;双层再生培养基 上层培养基(g/L):蔗糖60,磷酸氢二钾5,氯化钠1,硫酸镁0.2,硫酸铵0.6,酵母膏2.5,琼脂粉15;下层培养基琼脂粉23,其他成分与上层培养基相同;以上培养基均调节初始pH为5.8,121 ℃灭菌20 min;高渗缓冲液 25 mmol/L的Tris-HCl,含85.5 g/L蔗糖,pH6.0;酶缓冲液 2.365 g/L的KCl,25 mmol/L的Tris-HCl,pH5.0;预处理溶液 0.05 mol/Lβ-巯基乙醇,pH5.0。上述缓冲液均经无菌处理后备用。
YXQ-LS-18SI自动型手提灭菌器 上海博讯医疗生物仪器股份有限公司;BSD-YX(F)2600特大容量立式摇床 上海博讯医疗生物仪器股份有限公司;SHP-150恒温生化培养箱 上海智城分析仪器制造有限公司;VS-840K-U洁净工作台 苏净集团苏州安泰空气技术有限公司;5418R小型高速冷冻离心机 德国艾本德(Eppendorf)中国有限公司;Mettler Toledo AL204电子天平 梅特勒-托利多仪器(上海)有限公司;微孔滤膜针孔过滤器 德国MEMBRANA公司;OLYMPUS CX41-32C02奥林巴斯生物显微镜 上海普赫光电科技有限公司。
1.2实验方法
1.2.1 亲本突变库的构建 将A.pullulansAs.40329和A.pullulansAs.3#培养至对数期,分别收集菌体并用10 mL无菌ddH2O洗涤两次,然后重悬于10 mL的20 mmol/L Tris-HCl缓冲液(pH6.0)中。随后,取1 mL菌悬液稀释1000倍倒入无菌培养皿中,配合无菌搅拌子,放置于磁力搅拌器上,将培养皿置于紫外灯下(15 W)照射,照射距离为30 cm,照射时间为0、60、90、120、150、180、210、240、270、300 s,用移液枪吸取0.1 mL菌悬液于PDA琼脂培养基上涂布,每个处理使用三个平板,不进行照射(0 s)的菌悬液涂布作为空白对照;处理后立即用纸包裹,避光倒置,28 ℃下培养72 h。通过统计平板上菌落的数量,根据公式存活率(%)=Y/X×100,其中:X为对照组的菌落数平均值,Y为诱变处理组的菌落数平均值,计算诱变存活率,并确定最适诱变条件。同时,对出发菌及存活株进行多次诱变处理,利用显微镜观察诱变株的菌体形态。
1.2.2 GS的选育 GS的方法参照参考文献[20]。将在紫外诱变中筛选出的优良菌种As.302、As.406、As.401活化至对数期,向菌液中加入1%的预处理溶液摇床培养1 h,离心收集菌体并用高渗缓冲液洗涤两次,随后用等体积高渗缓冲液重悬,控制菌悬液菌体浓度在108cfu/mL左右。接下来向菌悬液中加入2 mg/mL的溶菌酶,28 ℃水浴酶解1~2 h,离心收集菌体,经高渗稳定液洗涤2次并重悬于高渗稳定液中。将上述原生质体悬浮液两两等量混合,55 ℃水浴热灭活处理120 min,在35%的PEG4000介导下进行全基因组随机改组。每一轮GS结束后,选择普鲁兰多糖产量增加最明显及产物较明亮的改组菌进行发酵,每株菌三个平行。根据发酵实验结果,筛选出性状优良的三株菌作为下一轮GS的出发菌株。
1.2.3 突变株的筛选
1.2.3.1 初筛 将未经诱变的菌体和突变株或融合株制成菌悬液,分两组,分别稀释到同样的倍数,涂布于含有0.05%曲利苯蓝的双层再生培养基,28 ℃倒置培养72 h,以未经诱变的一组为对照。挑取平板上菌落直径大,颜色深,表面湿润的变异株。
1.2.3.2 复筛 将初筛后的菌株接种到种子培养基并转接到发酵培养基中,28 ℃、200 r/min摇瓶发酵培养96 h,选出多糖含量明显提高且色素明显减少的1~2株。
1.2.4 普鲁兰多糖的测定 向15 mL发酵上清液中添加2倍体积的95%乙醇,4 ℃静置过夜,5000 r/min离心15 min,沉淀物用无水乙醇洗涤两次,将沉淀于70 ℃烘至恒重,称量记录[21]。多糖含量计算公式:
多糖含量(g/L)=(M实重-M空重)×1000/15
其中:M空重为烘至恒重称量瓶的重量(g),M实重为烘至恒重多糖和称量瓶的重量(g)。
1.2.5 红外光谱检测(FT-IR) 取普鲁兰多糖标准品与干燥的多糖沉淀样品1~2 mg分别置于玛瑙研磨体中,加入干燥的溴化钾粉末100~200 mg混合均匀,置于不锈钢磨具中抽真空后,用压片机进行压片处理,压好的薄片置于傅里叶红外光谱仪中进行红外扫描处理。随后,将得到的样品的红外光谱数据与普鲁兰多糖标准品进行比对,具体方法参照文献[22]。
1.3数据处理
数据采用Origin 8.6处理和Adobe Illustrator CS5作图。
2 结果与讨论
2.1亲本突变库的构建
为了达到更好的育种效果,研究者往往通过诱变处理出发菌株,并以筛选到的正突变株作为GS的出发菌株[23]。本研究以A.pullulansAs.40329和As.3#为出发菌株,采用紫外诱变处理以建立改良的亲本突变库。在存活率为20%~30%时,正突变几率更高[24],由紫外诱变存活率结果(图1)可知,As.40329选择紫外线诱变时间为180 s,此时存活率为28.4%,As.3#选择紫外诱变时间为150 s,存活率为19.7%。

图1 紫外诱变存活曲线
经初筛、复筛后,获得As. 301~As. 305,As. 401~As. 407共12株多糖产量较高且色素较少的亲本突变株。其中,以As. 3#为亲本得到的突变株As. 302的多糖产量为(14.28±0.36) g/L,以As. 40329为亲本获得的突变株As. 401和As. 406的多糖产量分别为(9.18±0.2) g/L和(19.57±0.42) g/L(图2)。进一步对As. 302、As. 401和As. 406三株菌的发酵产物及相应的菌体形态进行分析,结果如图3所示,As. 302产物黑色素含量低于As. 406,且与As. 406相比,As. 302产孢子能力较低。值得注意的是,As. 401多糖产物黑色素含量较低,菌体形态镜检结果显示,其呈现较明显的类酵母形态。这个结果可能与Li等[25]的报道类似,他们发现新分离的A.pullulansNG的细胞形态及产物普鲁兰多糖中是否含有黑色素,与培养基的pH及氮源含量不同所导致的细胞形态差异有关。综上,选择诱变株中两个多糖产量最高的As. 302和As. 406,以及多糖产物黑色素产量低的诱变株As. 401进行后续的GS。

图2 A. pullulans紫外诱变突变株发酵产多糖情况

图3 普鲁兰多糖(A)和出芽短梗霉细胞形态(B)
2.2A.pullulans的GS选育
将紫外诱变获得的As. 302、As. 406及As. 401进行首轮基因组改组。由于曲利苯蓝与多糖分子进行结合后会生成蓝色复合物,且其颜色的深浅与多糖含量呈现正相关关系[26]。因此,可以通过观察改组菌的菌落大小、颜色来衡量改组菌的多糖生产能力。本研究中,通过曲利苯蓝平板初筛,选出了7株原生质体较大且颜色较深的菌株,分别命名为F1-1~F1-7,并对这7株菌株进行发酵验证,结果见图4。其中,F1-2多糖产量达到(20.75±0.45) g/L,其多糖产物为墨绿色;F1-6所产多糖呈浅黄白色,产量为(16.75±0.41) g/L;F1-7所产多糖近乎为纯白色,产量达到(15.86±0.40) g/L。通过综合对比F1-1~F1-7的发酵性能及产物特征,选择F1-2、F1-6及F1-7作为下一轮GS的出发菌株。
通过新一轮的GS,利用与上轮相同的方法进行初筛,获得了F2-1~F2-7共7株改组菌。发酵结果表明,F2-6多糖产物为纯白色,多糖产量达到(19.53±0.39) g/L,相较于无色素出发菌As.401和浅色原始菌As.3#,其多糖产量分别提高了112.75%、119.69%(图4)。在接下来的研究中,又进行了多轮GS,但改组菌生产无黑色素多糖的能力并未超过F2-6。因此,确定F2-6为获得的目的菌株。
2.3F2-6的发酵验证
由图5可知,在2%的接种条件下,菌株F2-6在发酵培养基中的生长并未呈现明显的停滞,其生物量在0~60 h快速增长,60 h之后菌体进入稳定期,生物量最高为(20.42±0.69) g/L。在摇瓶培养的前60 h,多糖产量无明显增加,但在60~96 h内迅速上升,96 h时达到最高产量(19.55±0.79) g/L。由于OD654值通常用来评估发酵液的颜色变化,以空白发酵液为对照,用以表征发酵液中黑色素的积累[14]。在整个发酵过程中,发酵液的OD654值一直维持在0.02左右,表明发酵液中无明显黑色素积累。同时,根据菌体F2-6的生物量和普鲁兰多糖产量综合确定最适发酵时间为96 h。
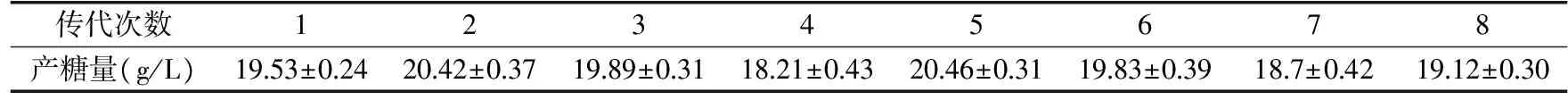
表1 菌株F2-6的遗传稳定性
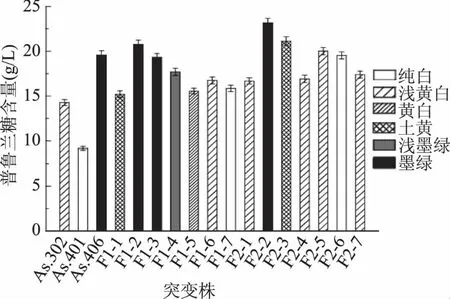
图4 A. pullulans的全基因重组后普鲁兰糖的产量
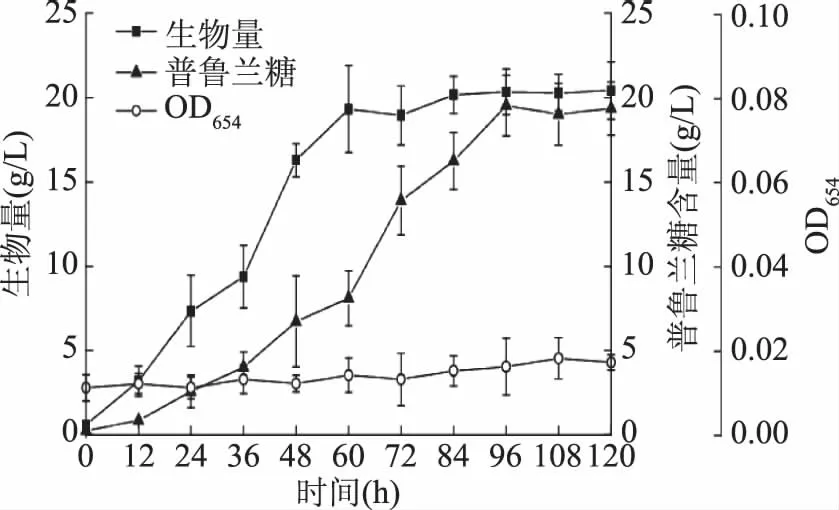
图5 出芽短梗霉F2-6的发酵实验结果
为考察改组菌的遗传稳定性,对获得的高产无色素普鲁兰多糖菌株F2-6进行传代分析,表1结果表明,经过8代多糖产量浮动较小,说明菌株F2-6的遗传性状较为稳定,并未出现大幅度降低。
2.4多糖产物的红外光谱分析
为考察产品是否为普鲁兰多糖,对普鲁兰多糖标准品和F2-6发酵提取的粗多糖进行了红外光谱分析,结果见图6。在普鲁兰多糖的特征吸收区域(1750~750 cm-1),二者显示出相似的吸收特征,表明F2-6发酵产生的多糖与标准品普鲁兰多糖呈现相同或相似的化学结构。其中,3500~3200 cm-1的吸收为O-H的伸缩振动,与样品的含水量有关[27]。
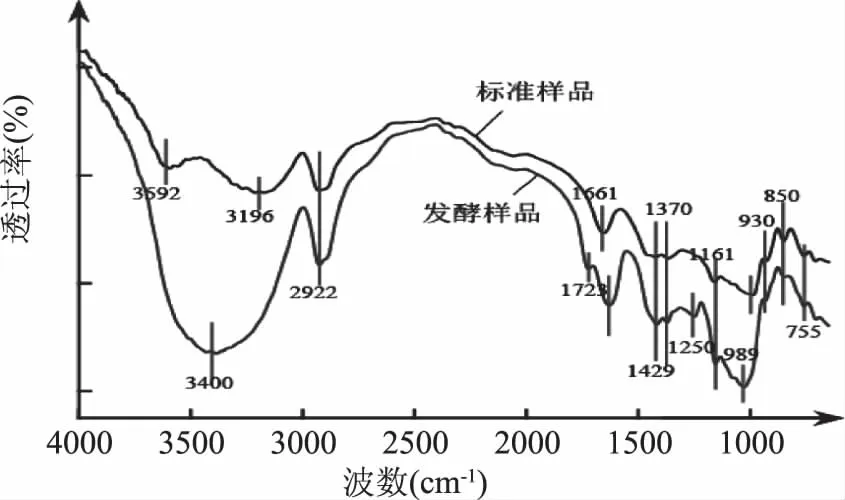
图6 普鲁兰多糖红外光谱图
3 结论与讨论
本文以A.pullulansAs.40329和A.pullulansAs.3#为出发菌株,获得了As. 302、As. 406及As. 401三株亲本正突变株。随后,对三株亲本制备原生质体并采用35% PEG4000介导进行了两轮全基因改组后,成功选育出一株高产普鲁兰糖且几乎不产黑色素的菌株F2-6。菌株F2-6能够较为稳定的遗传,在发酵培养基中发酵96 h后,普鲁兰多糖产量达到(19.53±0.39) g/L,比黑色素积累能力弱的原始菌As.3#提高了119.69%。与万翠香[14]等人的报导相比,菌株F2-6的普鲁兰多糖的产量相对偏低,但其OD654维持在0.02左右,低于报道值。本研究为高产无黑色素普鲁兰多糖的出芽短杆霉工业生产候选菌株的育种提供了一种快速可行的方式,也为其他工业生产菌株的育种提供借鉴。
随着A.pullulansAY4全基因组的公布[28],加强对其功能解析及操作系统构建方面的研究,进而从全细胞角度对A.pullulans进行无抗性代谢途径改造,将有助于提高A.pullulans的普鲁兰多糖产量。同时,利用转录组学、蛋白质组学及生物信息学等技术对比出发菌与无黑色素积累能力的改组菌之间的全细胞水平表达差异,将有助于从分子层面揭示黑色素在A.pullulans体内的形成机理。
[1]Xu F,Weng B,Gilkerson R,et al. Development of tannic acid/chitosan/pullulan composite nanofibers from aqueous solution for potential applications as wound dressing[J]. Carbohydrate Polymers,2015,115:16.
[2]Kanmani P,Lim S T. Synthesis and characterization of pullulan-mediated silver nanoparticles and its antimicrobial activities[J]. Carbohydrate Polymers,2013,97(2):421-428.
[3]Xiao Q,Tong Q. Thermodynamic properties of moisture sorption in pullulan-sodium alginate based edible films[J]. Food Research International,2013,54(2):1605-1612.
[4]Cheng K C,Demirci A,Catchmark J M. Pullulan:biosynthesis,production,and applications[J]. Applied Microbiology and Biotechnology,2011,92(1):29-44.
[5]Ma Z C,Fu W J,Liu G L,et al. High-level pullulan production byAureobasidiumpullulansvar. melanogenium P16 isolated from mangrove system[J]. Applied Microbiology and Biotechnology,2014,98(11):4865-4873.
[6]West T P,Strohfus B. Polysaccharide production by a reduced pigmentation mutant ofAureobasidiumpullulans,NYS-1[J]. Letters in Applied Microbiology,2001,33(2):169-172.
[7]Cheng K C,Demirci A,Catchmark J M. Evaluation of medium composition and fermentation parameters on pullulan production byAureobasidiumpullulans[J]. Food Science and Technology International,2011,17(2):99.
[8]Sharma N,Prasad G S,Choudhury A R. Utilization of corn steep liquor for biosynthesis of pullulan,an important exopolysaccharide[J]. Carbohydr Polym,2013,93(1):95-101.
[9]Sugumaran K R,Jothi P,Ponnusami V. Bioconversion of industrial solid waste-Cassava bagasse for pullulan production in solid state fermentation[J]. Carbohydrate Polymers,2014,99(1):22-30.
[10]韩鹏,周鹏,闫巧娟,等. 嗜热枯草芽孢杆菌普鲁兰酶基因的表达与重组酶的性质[J]. 微生物学通报,2011,38(12):1755-1761.
[11]Wang H K,Sun Y,Chen C,et al. Genome shuffling of Lactobacillus plantarum,for improving antifungal activity[J]. Food Control,2013,32(2):341-347.
[12]王雪松,王莹,于晓迪,等. 茁芽短梗霉原生质体激光诱变及高产菌株筛选[J]. 生物技术,2005,15(1):29-31.
[13]靳建忠,王慧娟,孔维甲,等. 紫外诱变选育出芽短梗霉高产普鲁兰糖白化突变菌株[J]. 食品科学,2011,32(11):187-191.
[14]万翠香,王贤卓,郭建军,等. 高产无色素普鲁兰糖突变菌株P1012的选育及发酵性能研究[J]. 现代食品科技,2015(1):101-106.
[15]Stephanopoulos G. Metabolic engineering by genome shuffling[J]. Nat Biotechnol,2002,20(7):666-668.
[16]Zhang Y X,Perry K,Vinci V A,et al. Genome shuffling leads to rapid phenotypic improvement in bacteria[J]. Nature,2002,415(6872):644.
[17]冯印,苏安祥,王玉华. 复合诱变选育茁霉多糖高产菌株[J]. 中国酿造,2011(8):84-86.
[18]Kang J X,Chen X J,Chen W R,et al. Enhanced production of pullulan inAureobasidiumpullulansby a new process of genome shuffling[J]. Process Biochemistry,2011,46(3):792-795.
[19]张晶,王丹,张静,等. 基因组改组选育低色素高产茁霉多糖生产菌株[J]. 食品科技,2012(7):16-21.
[20]Zeng W,Chen G,Wu H,et al. Improvement ofBacillussubtilisfor poly-γ-glutamic acid production by genome shuffling[J]. Microbial Biotechnology,2016,9(6):824-833.
[21]Tu G,Wang Y,Ji Y,et al. The effect of Tween 80 on the polymalic acid and pullulan production byAureobasidiumpullulansCCTCC M2012223[J]. World Journal of Microbiology and Biotechnology,2015,31(1):219.
[22]Chen Y,Guo J,Li F,et al. Production of pullulan from xylose and hemicellulose hydrolysate byAureobasidiumpullulans,AY82 with pH control and DL-dithiothreitol addition[J]. Biotechnology and Bioprocess Engineering,2014,19(2):282-288.
[23]Zhou Y P,Ren X D,Wang L,et al. Enhancement of ε-poly-lysine production in ε-poly-lysine-tolerant Streptomyces sp. by genome shuffling[J]. Bioprocess and Biosystems Engineering,2015,38(9):1705-1713.
[24]陈岩,吴天祥. 复合诱变红曲霉选育高产壳聚糖菌株及培养基优化[J]. 中国酿造,2009,28(3):43-46.
[25]Li B X,Zhang N,Peng Q,et al. Production of pigment-free pullulan by swollen cell inAureobasidiumpullulans,NG which cell differentiation was affected by pH and nutrition[J]. Applied Microbiology and Biotechnology,2009,84(2):293-300.
[26]马向东,柯涛,熊兰,等. 一种鉴定多糖水解酶类及其产生菌的新方法[J]. 微生物学报,2007,47(6):1102-1104.
[28]Chan G F,Bamadhaj H M,Han M G,et al. Genome sequence ofAureobasidiumpullulansAY4,an emerging opportunistic fungal pathogen with diverse biotechnological potential[J]. Eukaryotic Cell,2012,11(11):1419.
Breedingofapigment-freepullulanproductionmutantstrainofAureobasidiumpullulans
ZHANGRuo-xuan1,SUNShuai-nan1,SUNQin-ju1,LIUXin1,HANGFang-xue1,2,LIUJi-dong1,2,*
(1.Light Industry and Food Engineering Institute of Guangxi University,Nanning 530004,China;2.Guangxi Sugar Industry Collaborative Innovation Center,Nanning 530004,China)
To screen anAureobasidiumpullulansthat could be used for the production of pigment-free pullulan,A.pullulansAs.40329 andA.pullulansAs.3# were used as hosts in the present study. Three positive mutants were obtained as parents after ultraviolet(15 W)induced mutation of the two hosts,followed with genome shuffling(GS)that mediated by 35% PEG 4000,and a s
TableA.pullulansstrain F2-6 was obtained after parental inactivation. Nearly no pigment was detected in the culture ofA.pullulansF2-6,and pullulan production reached to(19.53±0.39) g/L,119.69% higher than that ofA.pullulansAs.3#. The results indicated thatA.pullulansF2-6 could be used as a potential strain in industrial production process.
Aureobasidiumpullulans;pullulan;genome shuffling;pigment
2017-04-25
张若璇(1993-),女,硕士研究生,研究方向:应用微生物学,E-mail:genus_rosa@163.com。
*
刘继栋(1980-),男,博士,讲师,研究方向:应用微生物学,E-mail:liujd@gxu.edu.cn。
国家自然科学基金(31460026);广西壮族自治区教育厅科研(重点)项目基金(ZD2014001)。
TS201.3
A
1002-0306(2017)22-0109-05
10.13386/j.issn1002-0306.2017.22.022

