夏黑葡萄附生酵母菌分离及多相分类鉴定
,,,,,
(南京农业大学食品科技学院,江苏南京 210095)
夏黑葡萄附生酵母菌分离及多相分类鉴定
杨雨蒙,徐敬国,胡伊旻,黄思琪,史雅凝,辛志宏*
(南京农业大学食品科技学院,江苏南京 210095)
葡萄野生酵母是酿造优质葡萄酒的重要菌种来源,为发现有价值的野生葡萄酵母,本研究以夏黑葡萄为研究对象,采用平板划线分离的方法得到3株葡萄野生酵母YYMPT-1、YYMPT-2和YYMPT-3,利用扫描电子显微镜(SEM)进行形态观察,PCR扩增26S核糖体DNA的D1/D2区(26S rDNA D1/D2)、核糖体内转录间隔区(ITS1-5.8S-ITS2)和肌动蛋白基因(Actin gene)区域,并构建系统发育树,将3株酵母菌分别鉴定为有孢汉逊酵母(Hanseniasporauvarum)、近玫色锁掷酵母(Sporidioboluspararoseus)和假丝酵母(Candidazemplinina)。本研究结果为优质葡萄酒酿造和改善葡萄酒风味提供了3株具有潜在工业化应用价值的资源菌。
酵母菌,形态学特征,系统发育树,多相鉴定
葡萄酒发酵是一个复杂的过程,在酿造期间需多种微生物的参与,其中天然酵母是最重要的发酵菌群。优良的酵母菌不仅可以提高葡萄酒的风味和品质,而且对葡萄酒特色的形成具有至关重要的作用[1-4]。夏黑葡萄是酿造红葡萄酒的优良品种,其果肉饱满、含糖量高、口感好、果汁呈紫红色、无核,是葡萄酒酿造过程中较为普遍使用的品种[5-6]。研究发现,葡萄表皮附生有丰富的野生酵母,对其进行分离鉴定,在酿造优质葡萄酒和改善酒的品质方面具有重要的实际应用价值。
酵母菌的鉴定包括表型鉴定和分子生物学鉴定两类方法[7]。表型鉴定是一种传统的菌种鉴定方法,一般通过单菌落的表型及显微形态观察判断菌株的种属,但该方法耗时、耗力、工作量大,需要专业的人员,且只能将酵母鉴定到属水平,不能反映与其它物种之间的亲缘关系[8]。
近年来,随着分子生物学的发展,通过PCR扩增酵母菌的保守基因序列并构建系统发育树从而确定酵母菌的种属地位,这为酵母菌的分类鉴定提供了准确有效的鉴定方法。研究表明,酵母菌的26S核糖体DNA的D1/D2区域具有较高的变异性,不同种菌株之间碱基差异较大,而同种的不同菌株之间碱基差异一般不超过1%,可作为将酵母鉴定至种级水平的靶点[9];核糖体内转录间隔区(ITS1-5.8S-ITS2)也具有较高的变异率,根据序列间的差异,可作为亲缘关系较近的酵母菌鉴定标准[10];肌动蛋白基因(Actin gene)区是普遍存在于真核细胞中的微丝构造蛋白,其核苷酸序列在种内具有高度保守性,广泛应用于酵母菌的鉴定[11]。然而单一分子靶点鉴定有时难以将相似度较高的种区分开来,大大限制了鉴定结果的准确性。如Scorzetti[12]等研究发现,C.magnus、F.magnus和F.floriforme的26S区基因序列完全相同,因此只通过26S序列分析无法区分这3个种,这时就需要其他的辅助鉴定方法。
多相分类鉴定是综合微生物表型特征和多个分子生物学特征对微生物进行分类的方法,可更加科学、准确地确定微生物的种属地位[13]。Janos等人[14]通过扩增ITS、β-tubulin和钙调蛋白基因序列并分别构建系统发育树,鉴定出了一株黑色曲霉新种——巴西曲霉(Aspergillusbrasiliensissp. nov.)。白飞荣等[15]通过形态学和ITS/β-tubulin分子序列系统发育分析,从香山黄栌枯萎病叶片中分离得到4种真菌:细极链格孢(Alternariatenuissima)、草酸青霉(Penicilliumoxalicum)、腊梅拟茎点霉(Phomopsischimonanthi)和葡萄茎枯病菌(Phomaglomerata),为香山红叶的枯萎病提供了有效的防治方法。刘洋等从诺尼果实中分离得到2株酵母菌,采用态学观察、生理生化特征以及ITS和26S序列分析,将这两株菌分别鉴定为Eremotheciumcoryli和Kodamaeaohmeri,为开发利用诺尼果实提供了有价值的资源菌[16]。
夏黑作为红葡萄酒酿造的优良品种,其附生酵母菌对酿造葡萄酒具有重要作用。本研究以夏黑为对象,采用平板划线法分离筛选葡萄附生酵母,利用扫描电子显微镜(SEM)进行形态观察,分别PCR扩增26S、ITS和Actin区域,经TA克隆测序后构建系统发育树,确定酵母菌的种属地位,以期为葡萄酒酿造和改善葡萄酒风味提供具有工业化应用价值的菌种资源。
1 材料与方法
1.1材料与仪器
夏黑葡萄 采自江苏省南京市葡萄采摘园、土豆采自卫岗苏果社区超市;葡萄糖、酵母粉、琼脂粉、NaCl、蛋白胨、KH2PO4、MgSO4·7H2O、孟加拉红、戊二醛、氨苄青霉素(Amp) 南京寿德试剂器材有限公司。
D3390-01E.Z.N.A真菌DNA微量提取试剂盒 美国Omega公司;2×Taq Master Mix PCR试剂 诺唯赞生物;DP1502多功能DNA纯化回收试剂盒 北京百泰克生物技术科技有限公司;pMDTM19-T Vector Cloning Kit 日本TaKaRa公司;DYCP-31DN电泳仪 北京市六一仪器厂;Microfuge 22R台式微量冷冻离心机 美国Beckman公司;TP600型梯度PCR仪 日本TaKaRa公司;JS-380C全自动数码凝胶成像分析仪 上海培清科技有限公司;S4800型扫描电镜 日本日立高新技术公司。
1.2酵母菌分离纯化培养基
PDA分离培养基(1 L):将土豆去皮并称取200 g切碎,自来水1 L煮沸约30 min,8层纱布过滤,滤汁定容至1 L,加入葡萄糖20.0 g、琼脂粉20.0 g、NaCl 30.0.0 g混匀,121 ℃、30 min高压灭菌备用。
孟加拉红培养基(1 L):加入蛋白胨5.0 g、葡萄糖10.0 g、KH2PO41.0 g、MgSO4·7H2O 0.5 g、琼脂粉20.0 g、1/3000孟加拉红水溶液100 mL、自来水900 mL混匀,121 ℃、30 min高压灭菌备用。
YPD培养基(1 L):加入葡萄糖20.0 g、酵母粉10.0 g、蛋白胨20.0 g、琼脂粉20.0 g,自来水定容至1 L溶解混匀,121 ℃、30 min高压灭菌备用。
1.3菌株分离
将剪刀、研钵、镊子紫外杀菌,在无菌条件下,用剪刀将葡萄剪碎置于研钵中研磨,然后将研磨物全部归入100 mL ddH2O,37 ℃、180 r/min摇床培养1 h,将葡萄混合物梯度稀释,涂板至以上3种培养基(添加氯霉素终浓度100 μg/mL),30 ℃培养2~3 d,待平板上长出单菌落,挑取单菌落划线纯化,并在相应培养基斜面试管中划线接种,置4 ℃保藏。
1.4形态学观察
挑取划线纯化的单菌落,经戊二醛固定、乙醇脱水、真空干燥进行电镜观察,观测参数为加速电压:15 kV,样品台:三轴马达台。
1.5基因组DNA的提取
从斜面保种中挑取单菌落至相应培养基划线活化,于30 ℃恒温培养箱中培养2~3 d。基因组DNA的提取严格按照真菌基因组试剂盒(Fungal DNA Kit 50)说明书操作。提取的基因组DNA在1%琼脂糖凝胶中电泳检测(110 V,40 min),溴化乙锭(EB)染色。4 ℃保存备用,或于-20 ℃中长期保存。
1.6基因片段PCR扩增
1.6.1 26S区域PCR扩增 26S区域扩增选择酵母菌通用扩增引物NL-1(5′-GCATATCAATAA GCGGAGGAAAAG-3′)/NL-4(5′-GGTCCGTGTTTC AAGACGG-3′),PCR反应条件为94 ℃预变性5 min,94 ℃变性1 min,52 ℃退火1 min,72 ℃延伸90 s,共36个循环,最后72 ℃延伸10 min[17]。
1.6.2 ITS区域PCR扩增 ITS区域的扩增选择真核生物ITS通用扩增引物ITS1(5′-TCCGTA GGTGAACCTGCGG-3′)/ITS4(5′-TCCTCCGCTTAT TGATATGC-3′)[18],PCR反应条件为94 ℃预变性2 min,94 ℃变性30 s,59 ℃退火30 s,72 ℃延伸90 s,共35个循环,最后72 ℃延伸7 min[19]。
1.6.3 Actin区域PCR扩增 Actin区域的扩增引物Act-HV-F(5′-TGGTGGAGCAATGATTTTGA-3′)/Act-HV-R(5′-GTTGTTGATGAAGCCCAATC-3′),PCR反应条件为94 ℃预变性5 min,94 ℃变性30 s,63 ℃退火30 s,72 ℃延伸2 min,共35个循环,最后72 ℃延伸7 min[20]。
PCR扩增反应均采用25 μL反应体系:ddH2O 9.5 μL、2×taq Mix 12.5 μL、10 μmol/L Primer-F 1 μL、10 μmol/L Primer-R 1 μL、DNA 1 μL。1%琼脂糖凝胶电泳检测PCR扩增产物,置于4 ℃保存备用。
1.7基因序列TA克隆
采用DP1502多功能DNA纯化回收试剂盒回收PCR产物,纯化的PCR产物与pMD19-T载体连接12 h,然后转化至-70 ℃保存的100 μL感受态细胞大肠杆菌DH5α中,冰中放置30 min,取出后42 ℃热激90 s,迅速加入预热的890 μL LB液体培养基,37 ℃、200 r/min振荡培养1 h。取适量菌液均匀涂布于含氨苄青霉素Amp(100 ng/mL)的LB固体培养基中,平板倒置过夜培养12~16 h,用灭菌牙签挑取白色单菌落于1 mL LB液体中37 ℃、200 r/min过夜培养。取2 μL菌液直接做PCR,引物为M13-47和M13-RV,1%琼脂糖凝胶电泳检测是否含有目的片段。PCR采用25 μL的反应体系:ddH2O 8.5 μL、2×taq Mix 12.5 μL、10 μmol/L Primer-F 1 μL、10 μmol/L Primer-R 1 μL、菌液2 μL[21]。
1.8测序及系统发育学分析
将含有目的条带的菌液送上海杰李生物科技有限公司测序。NCBI(https://blast.ncbi.nlm.nih.gov/Blast.cgi)BLAST进行同源性检索,下载与该序列相似性较高的核酸序列。使用Mega 6.0软件,采用邻接法(neighbor joining method)构建系统发育树。
2 结果与分析
2.1菌株表型特征鉴定
从以上三种培养基共分离得到10株酵母菌,其中孟加拉红培养基分离得到6株、PDA培养基分离得到2株、YPD培养基分离得到2株。但分子鉴定去除重复后,仅有3株菌株。扫描电镜结果(图1)显示:YYMPT-1酵母细胞呈圆形、腊肠形、皱缩扁长、多边芽殖,与鉴定手册[22-23]中Hanseniaspora属的描述特征基本一致,初步鉴定属于Hanseniaspora属。YYMPT-2呈豆形或肾形,与鉴定手册中Sporidiobolus属的描述特征一致,初步鉴定属于Sporidiobolus属。YYMPT-3呈椭圆型、卵型或长型,各细胞间仅以狭小的面积相连,为藕节状的假菌丝,与鉴定手册中Candida属的描述特征一致,初步鉴定为Candida属。

图1 3株分离酵母菌的扫描电子显微镜图片
2.2菌株分子生物学特征鉴定
2.2.1 菌株26S、ITS、Actin序列扩增 菌株经PCR扩增获得的26S序列全长572 bp,扩增ITS序列全长为500 bp左右,扩增Actin序列全长为800 bp左右(图2)。
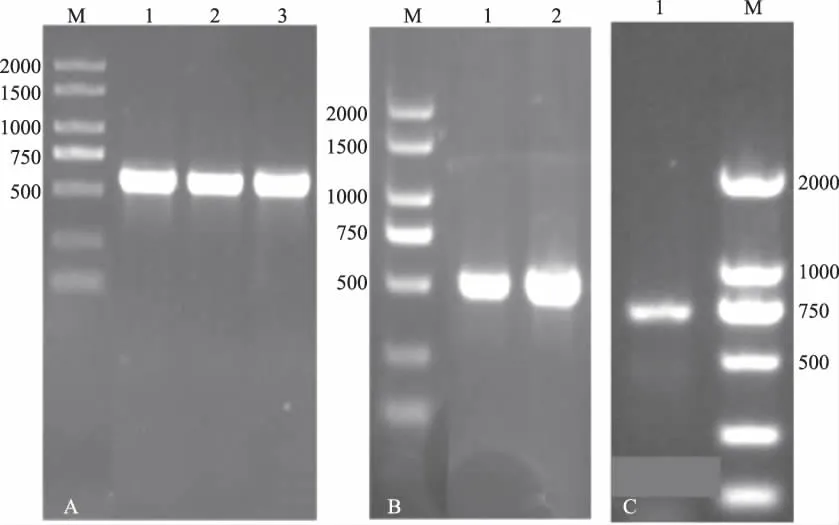
图2 26S rDNA、ITS、Actin基因片段扩增电泳图谱
2.2.2 菌株YYMPT系统发育学分析 将菌株YYMPT-1序列在NCBI中进行BLAST比对。结果显示其26S序列与H.uvarum的26S同源性最高,相似度达100%,选取其中同源性较高菌株的26S基因序列,使用MEGA 6.0软件构建系统发育树,从26S系统发育树(图3)中可以看出,菌株YYMPT-1(KY952908)与H.uvarum(U84229)聚为一枝,自展值为93,表现出相当近的亲缘关系;ITS序列与H.uvarum的ITS同源性最高,相似度达100%,选取其中同源性较高菌株的ITS基因序列,使用MEGA 6.0软件构建系统发育树,从ITS系统发育树(图4)中可以看出,菌株YYMPT-1(KY952911)与H.uvarum(AJ512432)聚为一枝,自展值为99,表现出相当近的亲缘关系;Actin序列与H.uvarum的Actin同源性最高,相似度达100%,选取其中同源性较高菌株的ITS基因序列,使用MEGA 6.0软件构建系统发育树,从Actin系统发育树(图5)中可以看出,菌株YYMPT-1(KY952913)与H.uvarum(AM039456)聚为一枝,自展值为100,表现出相当近的亲缘关系。
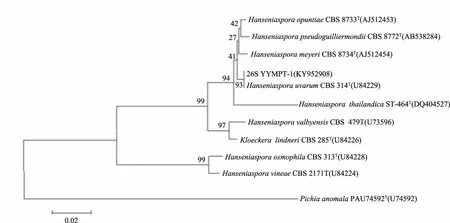
图3 YYMPT-1基于26S rDNA基因序列构建的系统发育树
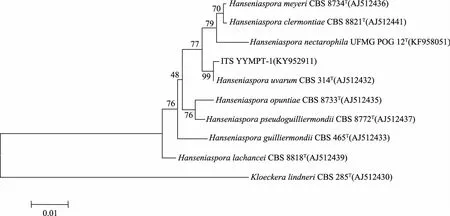
图4 YYMPT-1基于ITS rDNA基因序列构建的系统发育树
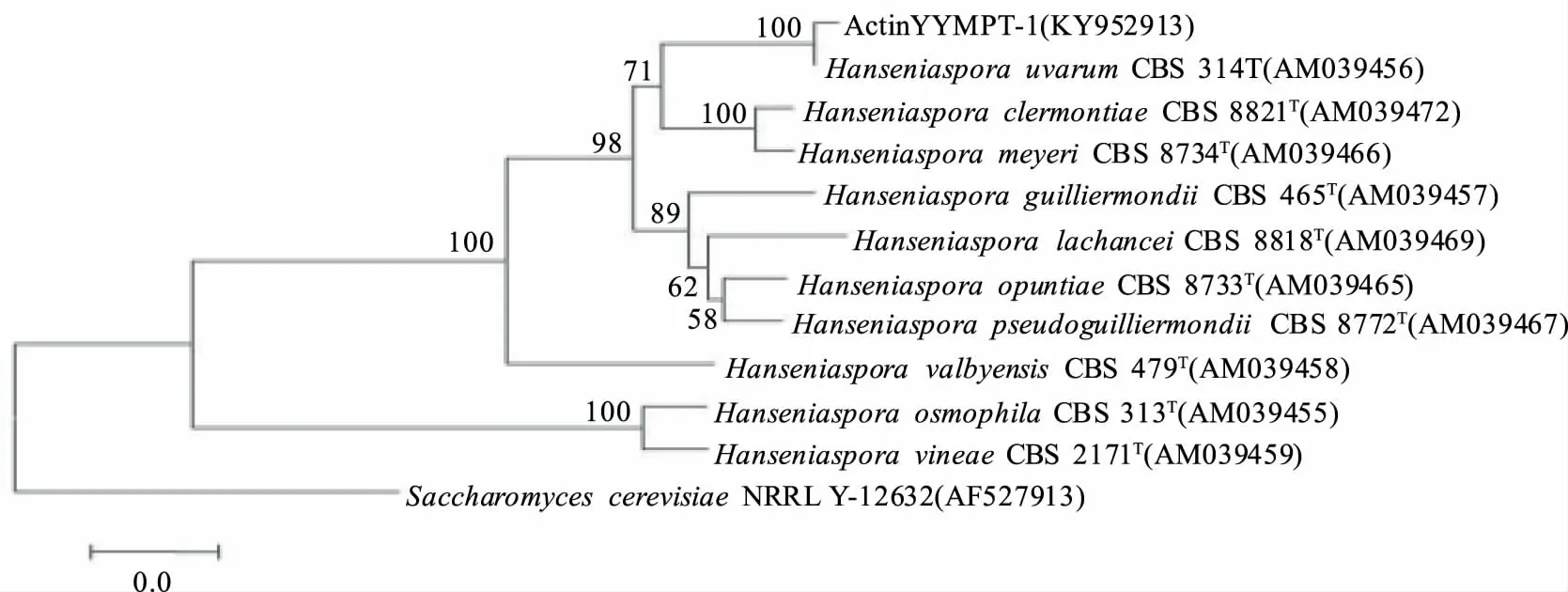
图5 YYMPT-1基于Actin基因rDNA基因序列构建的系统发育树
综合26S、ITS和Actin基因序列分析结果及菌落表型特征,且与酵母菌鉴定手册标准菌株对照后,将菌株YYMPT-1鉴定为葡萄有孢汉逊酵母(H.uvarum)。按照同样的方法,通过表型特征及分子生物学鉴定,将菌株YYMPT-2和YYMPT-3分别鉴定为近玫色锁掷酵母(S.pararoseus)和假丝酵母(C.zemplinina)。
3 讨论
传统的酵母菌鉴定方法主要依据形态学或生理生化分析,但由于培养时长及培养基和培养条件的改变,容易造成鉴定结果的不稳定或不确定性。相较于菌落表型观察,分子生物学研究酵母的基因型,以酵母菌26S、ITS、Actin基因保守序列为研究靶点,更能反映菌株的遗传本质,提供基因水平的鉴定信息,使鉴定结果更具准确性和遗传特异性。随着酵母数据库信息量的不断扩大与公开,分子生物学分析手段越来越成为酵母鉴定的常规工具。酵母菌26S rDNA位于核糖体大亚基5′端,其中D1/D2两个区域主要用于系统发育研究和菌种鉴定[24-25]。Kurtzman和Rohbnett 等[26]对子囊菌纲的假丝酵母26S区域进行测序,认为碱基差异在1%以上就为不同的种;核糖体内转录间隔区(ITS),是一段非编码区域,由位于18S rDNA和5.8S rDNA之间的ITS1区及5.8S rDNA和28S rDNA之间的ITS2区组成,该序列区种内高度保守,种间存在较大差异,为酵母菌鉴定提供丰富的遗传信息;Actin是普遍存在于真核细胞中的微丝构造蛋白,其核苷酸序列在种内也高度保守,广泛应用于酵母菌的鉴定。目前,26S、ITS及Actin区域序列分析已经成为最常用的DNA序列分析方法,其鉴定酵母菌快速准确,使酵母菌的分类鉴定从一般表型特征鉴定深化为分子生物学特征鉴定[27-28]。
本研究采用微生物表型观察和PCR扩增26S、ITS、Actin基因片段,将分离自夏黑葡萄表皮中的3株酵母菌分别鉴定为有孢汉逊酵母(H.uvarum)、近玫色锁掷酵母菌(S.pararoseus)和假丝酵母(C.zemplinina)。有孢汉逊酵母和假丝酵母在葡萄酒制备过程中,对葡萄酒的色泽、香味、口感等有重要影响,是最重要的微生物菌群。有孢汉逊酵母可发酵产生更高的乙酸酯类化合物,如乙酸苯乙酯和乙酸异戊酯,提高葡萄酒的香气[29]。假丝酵母可以产生大量的甘油、琥珀酸和醋酸,不仅赋予葡萄酒柔和性、圆润感和粘稠度,而且使葡萄酒具有强烈的蜂蜜、杏、和乙酸乙酯香[30]。
4 结论
本研究从夏黑葡萄中分离到3株葡萄野生酵母YYMPT-1、YYMPT-2和YYMPT-3,PCR扩增3株菌DNA的26S、ITS和Actin基因序列,构建系统发育树,结合形态学观察,将3株酵母菌分别鉴定为有孢汉逊酵母(H.uvarum)、近玫色锁掷酵母菌(S.pararoseus)和假丝酵母(C.zemplinina)。本研究结果为葡萄酒酿造和改善葡萄酒风味提供了3株具有潜在工业化应用价值的资源菌,今后将对3株菌的理化性质及其在葡萄酒酿造过程中的作用进行深入研究,为改善葡萄酒品质提供科学依据。
[1]谢俊云,姚笛,郭瑜,等. 贝达葡萄酒中酵母菌的分离鉴定[J]. 农产品加工,2016(1):19-21.
[2]李凤梅,谭婷婷,徐丽,等. 葡萄自然发酵过程中酵母菌和细菌的筛选、鉴定及系统发育分析[J]. 酿酒科技,2015(3):53-57.
[3]张春芝,莫寅斌. 宁夏产区酿酒葡萄酵母菌初步分类鉴定及多样性研究[J]. 中国酿造,2014(10):49-54.
[4]苏龙,刘树文,何玲,等. 东北山葡萄酒自然发酵酵母菌群的研究[J]. 食品与生物技术学报,2007,26(3):110-115.
[5]公维庶. 酿酒品种“夏黑”寒地生产技术[J]. 黑龙江生态工程职业学院学报,2013(3):23-24.
[6]鲁海东,倪天飞,杨义忠. 夏黑葡萄特征特性及栽培技术[J]. 现代农业科技,2011(9):120.
[7]杨静静,孟镇,钟其顶,等. 黄酒生产中酵母菌多相鉴定技术研究[J]. 中国酿造,2011(8):53-56.
[8]李丙超,胡卫东,唐文才,等. 传统发酵香肠中菌种的分子生物学鉴定[J]. 食品与机械,2015(3):20-22.
[9]卢君,李艳. 分子生物学技术在葡萄酒相关酵母菌分类鉴定中的应用及研究进展[J]. 酿酒科技,2009(6):92-94.
[10]王会会.烟台干红葡萄酒发酵过程酵母菌群研究[D]. 济南:山东轻工业学院,2011.
[11]范丙友,李芳,张文婷,等. 芍药肌动蛋白基因的克隆及表达分析[J]. 中草药,2013(15):2136-2142.
[12]Scorzetti G,Fell JW,Fonseca A,et al. Systematics of basidiomycetous yeasts:a comparison of large subunit D1/D2 and internal transcribed spacer rDNA regions[J]. FEMS Yeast Res,2002,4(2):495-517.
[13]张欣,刘勇,李金霞,等. 中性蛋白酶生产菌种AS1.398的多相复核鉴定[J]. 食品与发酵工业,2015(5):54-58.
[15]白飞荣,刘洋,李辉,等. 香山黄栌枯萎病叶片真菌的分离与鉴定[J]. 生物学通报,2014(5):51-53.
[16]刘洋,白飞荣,姚粟,等. 两株西沙群岛野生诺尼种子内生酵母CICC32991与CICC32993的多相分类鉴定[J]. 中国真菌学杂志,2014(4):199-202.
[17]Guo J,Wang H,Liu D,et al. Isolation ofCunninghamellabigeloviisp nov CGMCC 8094 as a new endophytic oleaginous fungus fromSalicorniabigelovii[J]. Mycological Progress,2015,14(113).
[18]McCullough MJ,Clemons KV,McCusker JH,et al. Intergenic transcribed spacer PCR ribotyping for differentiation ofSaccharomycesspeciesand interspecific hybrids[J]. Journal of Clinical Microbiology,1998,36(4):1035-1038.
[19]燕勇,李卫平,高雯洁,等. rDNA-ITS序列分析在真菌鉴定中的应用[J]. 中国卫生检验杂志,2008(10):1958-1961.
[20]Neza C,Peter R,Maudy T S. Phylogenetic placement of Hanseniaspora-Kloeckera species using multigene sequence analysis with taxonomic implications:descriptions ofHanseniasporapseudoguilliermondiisp. nov. andHanseniasporaoccidentalis var. citrica var. nov.[J]. International Journal of Systematic and Evolutionary Microbiology,2006,56:1157-1165.
[21]曹娜,湛东锐,李连强,等. 分子生物学与形态学相结合鉴定盐生海芦笋内生真菌Salicorn 15[J]. 食品科学,2012(23):180-183.
[22]KREGER-VAN R N J W. The yeasts:a taxonomic study[M]. Amsterdam:Elsevier Science Publishers BV,1984:130-137,585,766-768.
[23]孙万儒.酵母菌[J]. 生物学通报,2007(11):5-10.
[24]刘宁,刘延琳.核糖体RNA基因在酵母分类鉴定中的应用[J].中国农业科学,2010(22):4701-4708.
[25]杭姣,陈亚利,陈可泉,等. 酵母核酸常用的鉴定方法及其应用[J]. 食品科技,2014(12):2-7.
[26]Kurtzman CP,Robnett CJ. Identification and ascomycetous yeasts from analysis of nuclear large subunit(26S)ribosomal DNA partial sequences[J]. Antonie van Leeuwenhoek,1998,73:331-371.
[27]王凤梅,马利兵,潘建刚.分子生物学技术在酵母菌鉴定中的应用[J].综述与述评,2009(10):1-4.
[28]杨静静,孟镇,钟其顶,等.分子生物学技术在酵母菌多相分类鉴定中的应用[J].中国酿造,2011(4):16-20.
[29]郝瑞颖,王肇悦,张博润,等.葡萄酒中酿酒酵母产生的重要香气化合物及其代谢调控[J].中国食品学报,2012(11):121-127.
[30]李婧,罗苏苏,张晓旭.葡萄相关酵母多样性及其菌种鉴定的研究进展[J]. 食品工业科技,2016(24):391-394.
IsolationofepiphyticyeastsfromtheXiaheigrapeanditsidentificationbypolyphasicprocedure
YANGYu-meng,XUJing-guo,HUYi-min,HUANGSi-qi,SHIYa-ning,XINZhi-hong*
(College of Food Science and Technology,Nanjing Agricultural University,Nanjing 210095,China)
Wild yeast strains are important resources for brewing wine. In this study,in order to find valuable wild yeast strains,streak plate separation procedures were used and three strains,YYMPT-1,YYMPT-2 and YYMPT-3,were obtained using Xiahei grape as object. They were identified asHanseniasporauvarum,SporidioboluspararoseusandCandidazemplininaby amplifying D1/D2 domain of 26S ribosomal gene(26S rDNA),internal transcribed spacer sequence(ITS1-5.8S-ITS2)and actin gene by polymerase chain reaction(PCR),and established their phylogenetic tree,as well as observed their morphological features by scanning electron microscopy(SEM). The results from the current research provided 3 potential strains used for industrial applications for the production and improvement of wine quality with desirable flavor.
yeast;morphological features;phylogenetic tree;polyphasic identification
2017-05-18
杨雨蒙(1991-),女,硕士研究生,研究方向:食品营养与化学,E-mail:2015108059@njau.edu.cn。
*
辛志宏(1974-),男,博士,教授,研究方向:食品营养与化学,E-mail:xzhfood@njau.edu.cn。
2017年农产品质量安全风险评估项目(GJFP201701101);江苏省“青蓝工程”。
TS255.1
A
1002-0306(2017)22-0100-06
10.13386/j.issn1002-0306.2017.22.020

