MRI联合CT在诊断帕金森综合征中的应用价值分析
王慧芳, 田 娟
(陕西省榆林市第一医院 影像科, 陕西 榆林, 719000)
MRI联合CT在诊断帕金森综合征中的应用价值分析
王慧芳, 田 娟
(陕西省榆林市第一医院 影像科, 陕西 榆林, 719000)
磁共振; 磁敏感加权成像; 颅脑CT平扫; 血管性帕金森综合征; 帕金森病;
帕金森综合征(PD)是多种原因引起的肌强直,静止性震颤,运动迟缓综合征,与帕金森病同为老年人常见的运动障碍性疾病[1]。本研究通过比较分析VP与PD患者的SWI以及颅脑CT表现,探讨CT联合MRI对于帕金森综合征的诊断以及鉴别诊断的临床价值,现报告如下。
1 资料与方法
1.1 一般资料
收集2015年3月—2017年1月本院神经内科收治的帕金森病患者30例为PD组,血管性帕金森综合征患者28例为VP组,同期门诊行健康体检的老年人30例作为对照组。PD组纳入标准: 符合2005年中华医学会制定的原发性帕金森病诊断标准[2]。VP组纳入标准: 参考户村则照提出的VP诊断标准: ① 碎步前冲步态,动作迟缓,肌强直,伴或不伴静止性震颤; ② 不同程度智能障碍; ③ 锥体束征; ④ 既往高血压,动脉粥样硬化或脑卒中病史; ⑤ 发病年龄较晚,多巴胺治疗反应差或无反应; ⑥ 排除颅内感染、外伤、药物等其他原因引起的帕金森综合征。对照组纳入标准: ① 年龄>60岁; ② 既往无高血压、动脉硬化及脑卒中病史。VP组患者年龄在64~82岁,平均年龄(73.5±7.2)岁,男15例,女13例。平均病程(3.6±1.2)年。PD组患者年龄在60~81岁,平均年龄(70.5±6.8)岁,男16例,女14例,平均病程(3.2±1.5)年。对照组男16例,女14例,年龄在61~81岁,平均年龄(69.8±7.7)岁。3组性别、年龄、平均病程等一般资料比较,差异无统计学意义(P>0.05)。所有参与本次研究的患者及家属签署知情同意书。
1.2 影像学方法
1.2.1 颅脑CT平扫: 采用日立公司提供的PRATICOCFR型螺旋CT扫描仪,从眶耳线至颅顶逐层进行扫描,层厚为1 cm。对感兴趣区进一步加用HRCT扫描,层厚为5.0 mm。脑实质窗宽80~100 HU, 窗位35 HU, 颅骨窗宽取1 000~1 500 HU, 窗位250~350 HU。
1.2.2 磁敏感加权成像: 采用美国GE公司型号为1.5T HDxt MR进行SWI检查, SWI相关参数设置如下: TR 35.0 ms, TE 20.0 ms, 带宽41.67 Hz, 矩阵448×448, 层厚2.0 mm, 间距0,视野(FOV)24 mm, 激发角度15°。测定的椎体外系核团包括: 黑质致密带和网状带,苍白球,壳核,红核以及尾状核头的相位值。
1.3 结果判定
1.3.1 颅脑CT: 基底节改变: 基底节和/或半卵圆中心区圆形或卵圆形缺血灶,直径0.5~2 cm, 3处或以上; 皮质下白质改变: 靠近大脑皮质的白质区域弥漫性缺血改变,皮质白质界限模糊; 脑萎缩: 中至重度弥漫性脑萎缩,侧脑室扩大至正常的30%以上; 正常: 未见以上3种改变。出现除正常外以上任意一种改变判定为阳性; 未出现以上3种改变为阴性。
1.3.2 磁敏感加权成像: 黑质致密带,壳核,苍白球的任意一处相位值降低判定为阳性, 3处相位值均正常判定为阴性。
1.3.3 CT联合SWI: CT阳性且SWI阴性判定为联合实验阳性,CT阴性且SWI阳性判定为联合实验阴性。
1.4 统计学方法
采用SPSS 20.0对所有数据进行整合分析,计量资料采用均数+标准差表示,组间比较采用两独立样本t检验,计数资料用率表示,组间比较采用R×C列联表的χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组颅脑CT表现
颅脑CT显示, VP组基底节区腔隙性梗塞改变,皮质下白质缺血改变和中重度脑萎缩所占比例显著高于PD组和对照组(P<0.05)。见表1。
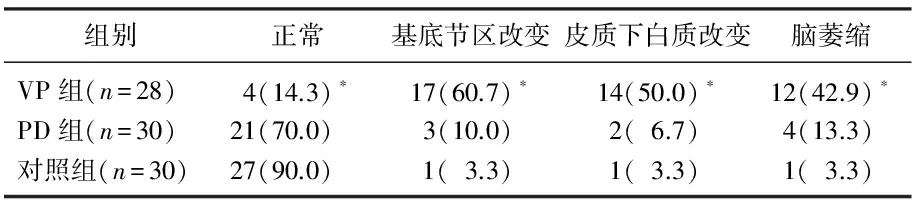
表1 3组颅脑CT平扫成像比较[n(%)]
与PD组和对照组比较, *P<0.05。
2.2 磁敏感加权成像表现
黑质致密带、壳核、苍白球的相位值比较, PD组显著小于VP组和对照组(P<0.05); VP组与对照组的差异无统计学意义(P>0.05)。黑质网状带、红核、尾状核头的相位值比较, 3组差异均无统计学意义(P>0.05)。见表2。

表2 3组磁敏感加权成像锥体外系相关核团相位值比较
与VP组和对照组比较, *P<0.05.
2.3 颅脑CT联合磁共振SWI序列对于VP诊断和鉴别诊断的临床价值
与单独CT或单独SWI相比, CT联合SWI对诊断VP的敏感度和特异度均增加,差异有统计学意义(P<0.05), 见表3。

与单独CT或单独SWI比较, *P<0.05。
3 讨 论
帕金森综合征是影响中老年人晚期生活质量的常见原因,血管源性占帕金森综合征的85%以上,大多数患者合并高血压,动脉粥样硬化以及脑卒中等病史[3-4]。对于血管性帕金森综合征(VP)的诊断,除了依靠患者的病史,病程,临床表现以及对多巴胺治疗的反应性,影像学检查也必不可少。以往VP的诊断标准中将CT或MRI的非特异性改变作为其中一项, Winikates 和 Jankovic对259例VP患者和PD患者的影像学改变进行分析,发现95.7%的VP患者存在不同程度的脑血管病变,包括多个供血区受累(92.4%), 皮质下白质(75.4%), 基底节(44.9%), 脑干(21.7%)以及不同程度的脑萎缩(63.4%), 而仅有22.6%的PD患者合并脑血管病变[5-6]。20世纪末,公认的VP诊断标准指出,急性卒中1个月内发生的类帕金森样症状伴有头CT多发性梗死证据可作为VP的临床诊断[7]。而VP的确诊则依靠尸检证实。本次研究显示, VP患者累及基底节、皮质下白质以及脑萎缩分别为60.7%, 50.0%和42.9%, 明显高于PD组及健康对照组, CT诊断VP的敏感度和特异度为69.4%和61.5%。
近年来,磁敏感加权成像(SWI)用于VP和PD的鉴别诊断有一定的临床应用价值。SWI根据中枢神经系统不同核团在磁场内的分布以及含量的不同,清晰的显示椎体外系与帕金森病相关的核团的内部结构,通过相位值表示[8-9]。帕金森病的发病机制为黑质致密带和苍白球处多巴胺神经元的不可逆性丢失,引起相应核团的相位值降低[10]。VP的发病机制不明,有学者认为可能是黑质-纹状体-皮质环路损害,而非多巴胺神经元丢失,因此VP患者SWI序列上黑质致密带和苍白球的相位值正常。根据SWI的这一表现,可以将VP和PD进行鉴别[11]。在本次研究中, PD患者黑质致密带,壳核和苍白球的相位值明显降低,而VP患者与对照组没有差别,证实了上述结论。
[1] 胡中华, 解渊, 范瑞敏, 等. 磁敏感加权成像再帕金森并及血管帕金森综合征诊断、鉴别诊断中的临床研究[J]. 中国CT和MRI杂志, 2015, 13(8): 8-10.
[2] 董玉茄, 王宏, 马毅, 等. 水成像在视神经磁共振扫描中的应用[J]. 中国CT和MRI杂志, 2015, 13(2): 15-17.
[3] 刘春岭. MRI磁敏感加权成像(SWI)在脑出血中的应用价值分析[J]. 中国CT和MRI杂志, 2015, 13(3): 13-15.
[4] 张洪业, 邓凯. MRI在侧脑室中枢神经细胞瘤诊断中的应用[J]. 中国CT和MRI杂志, 2015, 13(3): 10-12.
[5] 尚俊奎, 陈帅, 樊晓蕊, 等. 血管性帕金森综合征研究进展[J]. 国际神经内科学神经外科学杂志, 2013, 5(40): 470-473.
[6] 李政, 徐运. 帕金森病病因及发病机制的进展研究[J]. 国际神经病学神经外科学杂志, 2014, 41(4): 345-348.
[7] 李少华, 倪秀莹, 张玉虎, 等. 帕金森病痴呆的相关研究进展[J]. 中华老年心脑血管病杂志, 2015, 17(8): 892-894.
[8] 邢一兰, 陈俊抛, 苏欢欢. 磁共振弥漫张量成像再帕金森病早期诊断以及定量分析中的临床应用价值[J]. 中国现代医学杂志, 2015, 8(12): 02-04.
[9] 王铁铮, 林祥涛, 赵斌. 磁敏感加权成像对帕金森病脑核团的显示及其铁沉积差异测定[J]. 医学影像学杂志, 2013, 23(9): 1345-1349.
[10] Glass P G, Lees A J, Bacellar A, et al. The clinical features of pathologically confirmed vascular parkinsonism[J]. J Neurol Neurosurg Psych, 2014, 83(10): 1027- 1029.
[11] 刘放, 申宝忠, 王丹, 等. 应用磁敏感加权成像检测帕金森病患者脑铁含量变化的初步研究[J]. 现代生物医学进展, 2012, 12(30): 5845-5847.
2017-06-23
陕西省科学技术厅研究发展计划项目(2010K116-05-11)
田娟
R 445
A
1672-2353(2017)21-081-02
10.7619/jcmp.201721026

