摇蚊幼虫扰动对沉积物-水微界面氧化还原特征的影响
燕文明,麻 林,王 汗,杨家亮,杨艳青
(1.河海大学水文水资源与水利工程科学国家重点实验室,江苏 南京 210098; 2.湖南省水利厅,湖南 长沙 410007; 3.湖南省水利水电勘测设计研究院,湖南 长沙 410007)
摇蚊幼虫扰动对沉积物-水微界面氧化还原特征的影响
燕文明1,麻 林2,王 汗1,杨家亮3,杨艳青1
(1.河海大学水文水资源与水利工程科学国家重点实验室,江苏 南京 210098; 2.湖南省水利厅,湖南 长沙 410007; 3.湖南省水利水电勘测设计研究院,湖南 长沙 410007)
生物扰动是影响沉积物-水微界面反应的重要因素,为了明确生物扰动作用对沉积物-水微界面氧化还原特征的影响机制,从环境微界面角度出发,以摇蚊幼虫为例,借助高分辨率的微电极系统解析沉积物-水微界面O2、pH、氧化还原电位(Eh)的垂向分布特征。结果表明,摇蚊幼虫的生物扰动作用显著增加了沉积物-水微界面处的溶解氧浓度;降低了上覆水的pH值,提高了沉积物的pH值,且上覆水pH时空变化较大,沉积物pH值变化较小;廊道里O2增加,使Eh值也相应地提高,而没有生物扰动到的地方Eh值偏低。摇蚊幼虫通过呼吸和摄食作用将富含氧气的上覆水引进廊道,充入的氧气改变了微界面的氧化还原条件。
摇蚊幼虫;沉积物-水微界面;生物扰动;垂向分布
生物扰动是指底栖动物由于摄食、建管、筑穴、爬行、避敌、分泌、排泄和迁移等行为造成沉积物结构和性质的改变,进而影响到沉积物中颗粒态和溶解态物质迁移转化的过程。生物扰动能改变沉积物的结构和性质,因而对其中的污染物产生影响。Hughes等[1]发现大型底栖动物的筑穴行为增加了沉积物-水界面可交换态氮的交换通量。Welsh[2]的研究指出霍普水丝蚓扰动带动了其周围颗粒物质的迁移,增加了间隙水中氨氮。摇蚊属幼虫通过生物引灌、吸收、消化、排便、分泌等过程影响着湖泊沉积环境[3-5]。摇蚊幼虫把上覆水引灌入廊道获得食物和O2,同时间隙水中的溶解物质随着引灌作用被输出到上覆水中[6],摇蚊摄食浮游植物、沉积物微粒和细菌[7-8]吸收摄食微粒中的部分营养物质,其余部分被排泄出来[9],其栖息场所比较固定,主要集中在沉积物-水界面处[10],生存廊道只有2 mm直径[6]。
沉积物-水界面的O2控制着许多重要的生物地球化学过程,对沉积物-水界面生物群落的生物学特征与生态特性有着重要的影响。底栖动物利用富含O2的上覆水通风或引灌,以使得其通道或洞穴内保持较高的O2水平[11]。摇蚊幼虫大量存在于富营养化底泥U形廊道里,通过改变沉积物的氧化-还原条件来影响氨化速率、硝化速率。为测定U形廊道周边的环境,引入了微电极测量系统,其中,O2微电极的尖端直径只有10 μm[12-13],可在无损或微损的情况下检测微界面环境中O2。Finke等[14]利用微电极测定了墨西哥湾深海高盐地区光合作用过程中生物垫的O2,并进行了定量描述。Hulth等[15]采用pH微电极测定了海洋沉积物-水微界面pH值的分布。微电极的应用使对沉积物-水界面的研究尺度从常规尺度的厘米级减少为微观尺度的数十微米,可以大幅度提高微界面研究过程的微观性、多维性和准确性。本文通过采集表层沉积物收集摇蚊幼虫并进行室内培养,运用微电极技术,对沉积物-水微界面的O2、pH、氧化还原电位(Eh)进行测定,以期探明摇蚊幼虫扰动作用对沉积物-水微界面氧化还原特征的影响机制。
1 材料与方法
1.1 样品来源
在里下河的大纵湖湖心(31°30′31.1″N,120°10'31.0″E)采集6根沉积物柱样,沉积物深度不小于30 cm,同时采集湖心上覆水用于室内培养。本研究中采用的摇蚊幼虫,用彼得森采样器在采样点采集少量表层沉积物用于收集摇蚊幼虫,沉积物过2 mm筛获得4龄期幼虫,好氧5℃暂养[16-17]。所有样品采集后立即运回实验室。对于需要做实验室静态培养的部分采样点沉积柱则另取完整的沉积物柱(保留原位的上覆水,并在原采样点位置另取适量上覆水作为备用)直接运回实验室进行培养实验。
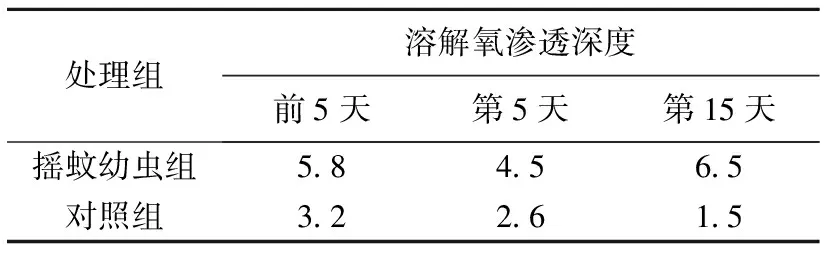
表1 不同处理组沉积物溶解氧渗透深度
1.2 实验方法
实验采用微电极技术测定沉积物-水微界面的DO、pH和Eh。构建实验系统,将培养管全部放入水槽恒温培养,并用微孔曝气头轻微曝气,温度控制在15±1°C,光照周期LD 12∶12,预培养16 d以使沉积物稳定。挑选过2 mm筛的4龄期摇蚊幼虫,计数、称重后引入到摇蚊幼虫组的6根预培养柱中(对照组每根柱子添加个数为零),10 min/h曝气培养,摇蚊幼虫密度1 887 ind/m2。进行微界面数据分析及相应的氧化还原指标测定,所使用的3种微电极尖端直径均为50 μm,电极使用前需要极化和校正。实验主要分为3个阶段,分别是加入摇蚊幼虫前5天,加入摇蚊幼虫后的第5天、第15天。
2 实验结果与分析
2.1 沉积物-水微界面DO垂向分布
由于沉积物中微生物的有氧呼吸作用以及从下层扩散而来还原物质的氧化,湖泊沉积物-水界面的O2渗透深度,一般仅有数毫米。在本研究中,对照组和摇蚊组的氧气渗透深度(OPD)如表1所示。
摇蚊组和对照组沉积物-水界面中DO的垂向剖面分布情况如图1所示,正值代表是上覆水,负值代表沉积物,下同。通过分析前5天和第5天发现,对照组和摇蚊组DO值无显著性差异(Pgt;0.05),摇蚊组在摇蚊幼虫刚加入时,对原沉积物环境产生较大扰动,呈不规则的波状变化,对照组DO值随时间变化不大;到了第15天,对照组和摇蚊组-3.3 mm以下DO值成显著性差异(Plt;0.05)。
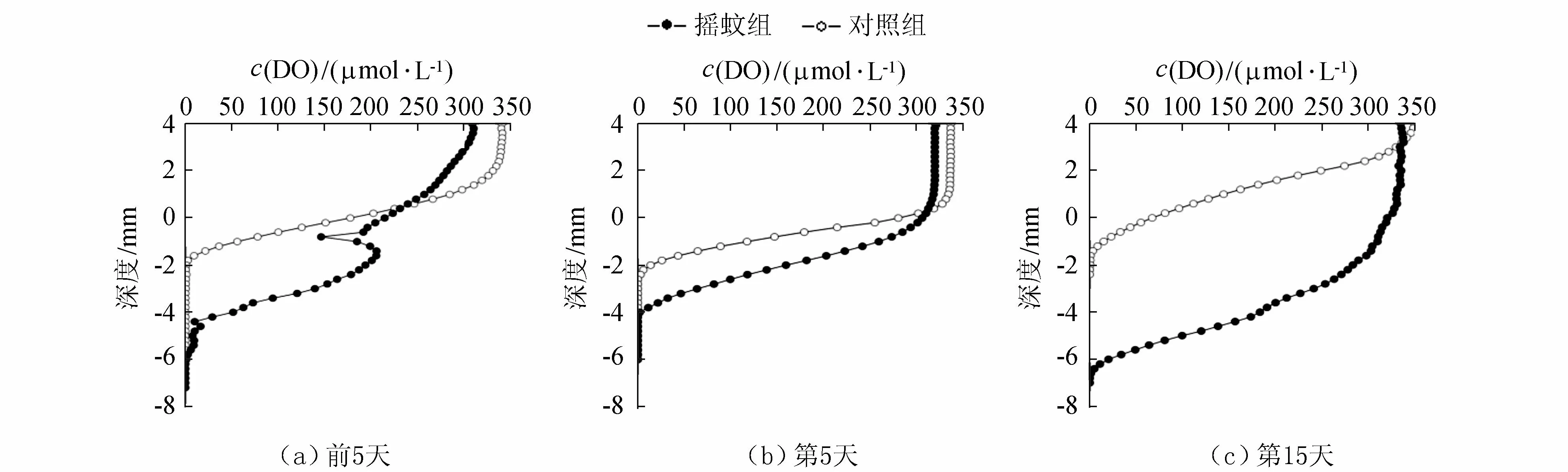
图1 不同处理组在不同时段DO垂直剖面分布Fig.1 The vertical distributions of DO values at different times for different treatments
从图1可以看出,摇蚊幼虫的扰动改变了间隙水DO的垂向分布,增加了O2在沉积物局部的渗透深度,摇蚊幼虫构筑的廊道中富含O2,同时,摇蚊幼虫的引灌作用增大了摇蚊组的OPD,使得摇蚊组沉积物OPD大于6 mm。有研究表明生物引灌不断将廊道中的水排出,同时引灌进来新鲜上覆水冲刷廊道管壁,使廊道内维持较高的DO水平[4,11,18]。Lagauzere等[19]利用平板氧电极的研究结果表明摇蚊幼虫没有显著增加沉积物OPD,与本文研究结果不同。这可能是因为,本文试验将摇蚊幼虫的活动通道作为DO测定的剖面,所测定的数据反映的是摇蚊幼虫所构建廊道里面的DO垂向分布情况,与平板氧电极的测定结果存在一定的差异。摇蚊幼虫的生物扰动作用显著增加了沉积物-水界面处的DO浓度,摇蚊幼虫特殊的生活廊道造成了沉积物内溶解氧分布的不均衡,随着洞穴的开拓,将上覆水引入管穴中,形成引灌效果,使表层沉积物间隙水中溶解氧增加。
虽然摇蚊幼虫的扰动作用能够增加沉积物中DO,但其生命活动也需要耗氧。摇蚊幼虫的引灌和筑穴行为增加了底层上覆水悬浮颗粒物的含量,还原态的沉积物颗粒以及附着的还原态离子被氧化,同时摇蚊幼虫的好氧呼吸作用也会消耗底层上覆水中的溶解氧,造成底层上覆水溶解氧浓度低于上层上覆水。本试验中,虽然柱状样受风浪扰动较小,但摇蚊幼虫的引灌和扰动作用明显促进了上覆水的富氧效果,上覆水中的DO增加后,通过扩散进入间隙水中的DO也会增加。对照组和摇蚊组间隙水中的DO在整个试验期间随深度的增加而降低,这是由于沉积物-水界面处的DO水平较高导致硝化作用强于反硝化作用,且氨氮的硝化作用消耗溶解性氧,使间隙水中的DO随深度增加而降低。
2.2 沉积物-水微界面pH垂向分布
摇蚊组和对照组沉积物-水界面中pH的分布情况如图2所示。可以看出,对照组和摇蚊组沉积物中pH值随深度的增加而减小,3个阶段表层沉积物-45 mm以上的pH值垂向变幅较大,-45 mm以下基本上稳定。在3个时段对照组的pH平均值为6.9、7.5、7.4,摇蚊组为6.8、7.7、7.5。加入摇蚊幼虫后的前5天,上覆水pH值无显著变化,沉积物0~-20 mm的pH值迅速减小,后变化趋势减弱,-25 mm处又开始缓慢回升;在加入摇蚊幼虫后的第5天,两组间隙水中的pH多分布在7.3~8.4之间;在加入摇蚊幼虫后的第15天,对照组0~-10 mm变幅较大,摇蚊组在0~-8 mm的pH随深度增加呈波状变化,且在-6~-12 mm处摇蚊组和对照组pH差值为0.3~0.5。从加入摇蚊幼虫的第5天到加入摇蚊幼虫的第15天,摇蚊扰动深度的逐渐加深,摇蚊组与对照组间隙水pH值的最大差异点也随之加深。
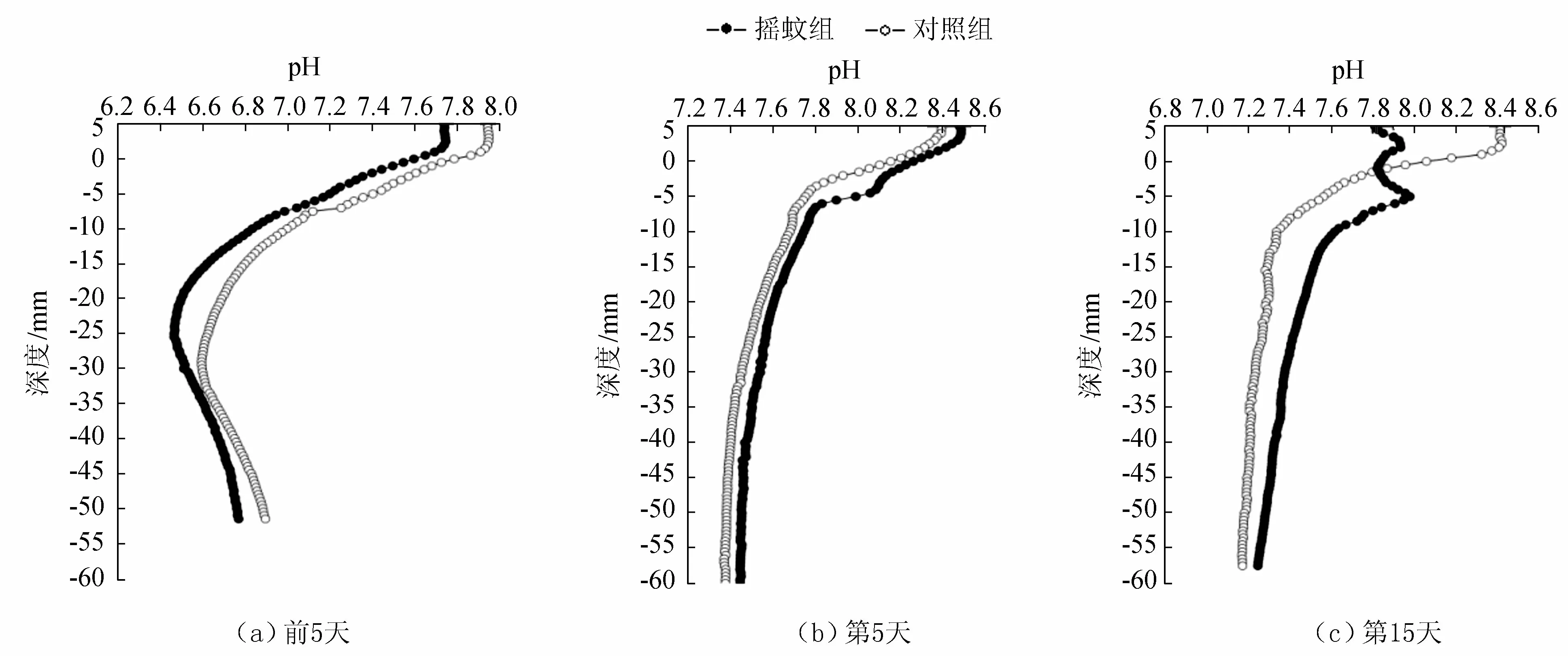
图2 不同处理组沉积物pH剖面分布Fig.2 The vertical distributions of pH values in sediments for different treatments
通过分析可知,在前两个阶段摇蚊组和对照组沉积物-水界面中pH值无显著变化(Plt;0.05),加入摇蚊幼虫后的第15天,摇蚊组上覆水中的pH值小于同期对照组,摇蚊组沉积物中的pH值大于同期对照组,均呈显著性差异(Pgt;0.05)。在加入摇蚊幼虫的第15天,摇蚊组上覆水pH值降低,可能是因为沉积物整体的pH值较低。pH的变化趋势可以在一定程度上反映水体碱度的变化趋势。在这3个阶段沉积物pH值呈现表层相对略高而下层略低的趋势,上覆水的pH较高而沉积物的pH较低,且上覆水pH的时空变化较大而沉积物pH的变化较小,这主要是由体系中的各种物理化学反应所引起的。
在加入摇蚊幼虫后的第5天,两组pH值随深度增加变化较小;在加入摇蚊幼虫的第15天,沉积物-水界面处的pH呈波动变化,这可能是因为此阶段摇蚊幼虫在沉积物中的引灌作用较强,且活动范围不固定,而沉积物-水界面和沉积物-40 mm以下,沉积物中pH的空间分布重新趋于均匀,这可能是因为摇蚊幼虫的扰动作用减少,垂向上的物质混合作用趋于平衡,这一结果与Anschutz等[20]对颤蚓的研究相似;在加入摇蚊幼虫的初期,上覆水中的pH值降低,沉积物表层的pH值增加。一方面,实验系统均是敞开体系,直接与空气接触,随着空气中的CO2进入上覆水并大量积累,上覆水中pH值降低,同时,氨氮的氧化的过程要消耗碱度降低系统的pH值,文献[21]指出每1 mg氨氮氧化为硝酸根需消耗7.1 mg的碱度;另一方面,摇蚊幼虫扰动加快了间隙水与上覆水的交换,摇蚊幼虫的呼吸作用及其带来的有机质促进反硝化作用的发生[22],使体系中的氮主要以氨的形式存在并释放到上覆水中,进而提高沉积物或上覆水的 pH。系统脱氮过程是消耗碱度的过程,导致了底层间隙水中的pH值下降。
2.3 沉积物-水微界面Eh垂向分布
沉积物-水界面Eh分布如图3所示。3个时段的对照组和摇蚊组上覆水均在350 mV以上,属于强氧化状态,但是随着沉积物深度的增加,Eh垂向剖面分布发生了明显的改变。
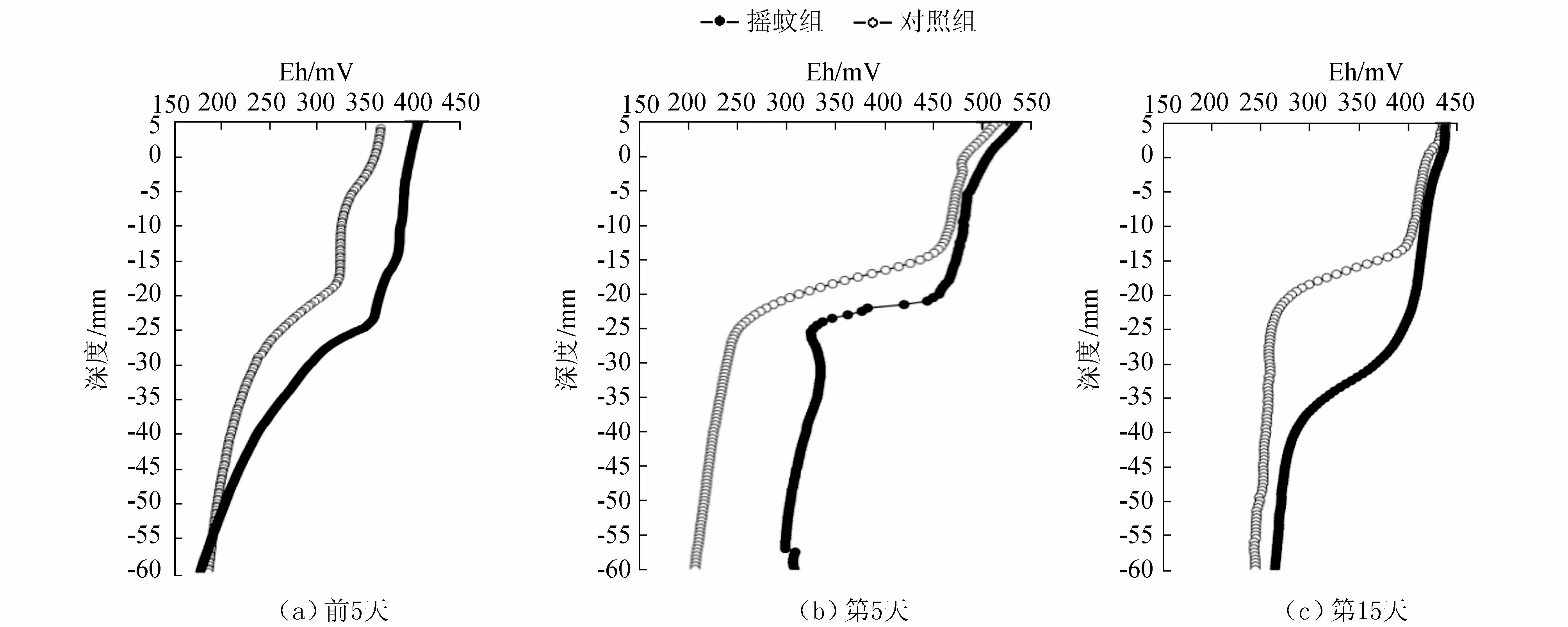
图3 不同处理组沉积物Eh剖面分布Fig.3 The vertical distributions of Eh values in sediments for different treatment groups
在加入摇蚊幼虫的前5天,对照组和摇蚊组沉积物中的Eh随着深度的增加而降低,分别在拐点-19 mm和-25 mm处迅速下降。在加入摇蚊幼虫后的第5天,对照组与摇蚊组0~-12 mm的沉积物同一分层处的Eh值较为接近,无显著性差异(Pgt;0.05);表层-12 mm以下同一分层处的Eh值呈显著性差异(Plt;0.05)。其中,摇蚊组在-20~-25 mm处Eh值迅速减小,而对照组在-13~-24 mm之间随深度增加急剧减小,在-25 mm以下,两组的Eh随深度小幅减小,并趋于稳定。在加入摇蚊幼虫后的第15天,摇蚊组沉积物的Eh值在-25~-37 mm处迅速减小,对照组沉积物的Eh值在-12~-20 mm处迅速减小,对照组与摇蚊组同一分层处的Eh值在-12~-40 mm差异性显著(Plt;0.05),其他深度摇蚊组的Eh值均小于同一分层处对照组的Eh值,且无显著性差异(Pgt;0.05)。可见,摇蚊幼虫的扰动作用改变了沉积物的Eh值。
在摇蚊扰动到的地方由于生物引灌作用,廊道里的O2增加,Eh也相应的增加,而没有生物扰动到的地方Eh偏低。沉积物中Eh的大小影响着沉积物中硝化和反硝化过程,侯红勋等[23]指出在完成同步硝化反硝化的氧化沟中,Eh在30 mV以上即可取得较好的硝化效果;Charpentier等[24]认为Eh=100 mV时硝化开始,200 mV时达到最佳。本试验中所测得的Eh值较大,沉积物中表层-60 mm以上的沉积物中Eh值均在150 mV以上,表层-20 mm以上的氧化还原电位均在400 mV左右,依据前人的研究结果,可知本试验中沉积物-水界面有硝化反应。在加入摇蚊幼虫后第15天,摇蚊幼虫的呼吸作用及其生命活动所带来的有机质改变了沉积物的氧化还原条件,降低沉积物的Eh。
3 结 论
摇蚊幼虫的扰动作用改变了沉积物-水界面处的溶解氧、酸碱度以及氧化还原条件。本文试验结果表明,摇蚊幼虫的引灌和扰动作用明显促进了上覆水的富氧效果,改变了间隙水DO的垂向分布,增加了O2在沉积物局部的渗透深度,使得摇蚊组沉积物OPD大于6 mm。摇蚊幼虫扰动初期沉积物-水界面处的pH呈波动变化,随后重新趋于稳定。摇蚊幼虫的扰动作用使得沉积物-水界面中Eh值的垂向分布发生了明显改变,由于生物引灌作用,廊道里的O2增加,Eh也相应增加。
[ 1 ] HUGHES D J, ATKINSON R, ANSELL A D.A field test of the effects of mega faunal burrows on benthic chamber measurements of sediment-water solute fluxes[J].Marine Ecology Progress Series,2000,195: 189-199.
[ 2 ] WELSH D T.It’s a dirty job but someone has to do it: the role of marine benthic macro fauna in organic matter turnover and nutrient recycling to the water column[J].Chemistry and Ecology,2003,19(5): 321-342.
[ 3 ] ALLER R C, ALLER J Y.The effect of biogenic irrigation intensity and solute exchange on digenetic reaction rates in marine sediments[J].Journal of Marine Research,1998,56(4): 905-936.
[ 4 ] LEWANDOWSKI J, HUPFER M.Effect of macrozoobenthos on two-dimensional small-scale heterogeneity of pore water phosphorus concentrations in lake sediments: a laboratory study[J].Limnology and Oceanography,2005,50(4): 1106-1118.
[ 5 ] LINDROTH A.Periodische ventilation bei der larvae von Chironomus plumosus[J].Zoologischer Anzeiger,1942,138: 244-247.
[ 6 ] WALSHE B M.Feeding mechanisms of Chironomus larvae[J].Nature,1947,160 (4066): 474.
[ 7 ] HYMEL S N, PLANTE C J.Fate of bacteria transiting the gut of the deposit feeder Abarenicola pacifica: influence of temperature and sediment food concentration[J].Aquatic Microbial Ecology,2000,22(1): 93-101.
[ 8 ] 王汗,燕文明,宋兰兰,等.摇蚊幼虫扰动对沉积物-水界面结构特征的影响[J].水资源保护, 2017,33(5):177-182.(WANG Han, YAN Wenming, SONG Lanlan, et al. Bioturbation effects of Chironomus plumosus on structural characteristics of sediment-water interface[J]. Water Resources Protection, 2017,33(5):177-182.(in Chinese))
[ 9 ] KRISTENSEN E, MIKKELSEN O L.Impact of the burrow-dwelling polychaete Nereis divers color on the degradation of fresh and aged macro algal detritus in coastal marine sediment[J].Marine Ecology Progress Series,2003,265: 141-153.
[10] AFFERY J M, KEMP W M.Influence of the submersed plant,potamogeton perfoliatus,on nitrogen cycling in estuarine sediments[J].Limnology and Oceanography,1992,37(7): 1483-1495.
[11] WANG F, TESSIER A, HARE L.Oxygen measurements in the burrows of freshwater insects[J].Freshwater Biology,2001,46(3): 317-327.
[12] REVSBECH N P.Analysis of microbial communities with electrochemical micro sensors and micro scale biosensors[J].Environmental Microbiology,2005,397: 147-166.
[13] REVSBECH N P, RISGAARD-PETERSEN N, SCHRAMM A,et al.Nitrogen transformations in stratified aquatic microbial ecosystems[J].Antonie Van Leeuwenhoek International Journal of General and Molecular Microbiology,2006,90(4): 361-375.
[14] FINKE N, HOEHLER T, POLERECKY M.Competition for inorganic carbon between oxygenic and an oxygenic prototroph’s in a hyper saline microbial mat,Guerrero Negro,Mexico[J].Environmental Microbiology,2013,15(5):1532-1550.
[15] HULTH S,ALLER R C,ENGSTROM P,et al.A pH plate fluorosensor (optode) forearly diagenetic studies of marine sediments[J].Limnology and Oceanography,2002,47(1): 212-220.
[16] 金相灿,王圣瑞,赵海超,等.五里湖和贡湖不同粒径沉积物吸附磷实验研究[J].环境科学研究,2004,17(增刊1):6-10.(JIN Xiangcan,WANG Shengrui,ZHAO Haichao,et al.Study on the phosphate sorption of the different particle size fractions in the sediments from Wuli Lake and Gonghu Lake[J].Research of Environmental Sciences,2004,17(Sup1):6-10.(in Chinese))
[17] 王昊天,刘凌,陈宁,等. 浮游植物对摇蚊幼虫扰动的响应研究[J].水资源保护, 2017,33(2):88-94.(WANG Haotian,LIU Ling,CHEN Ning, et al. Research on effect of Chironomid larvae bioturbation on phytoplankton[J]. Water Resources Protection, 2017,33(2):88-94. (in Chinese))
[18] 杨艳青,刘凌,陈沐松,等.摇蚊幼虫生物扰动对富营养化湖泊内源磷释放的影响[J].河海大学学报(自然科学版),2016,44(6):485-490.( YANG Yanqing,LIU Ling,CHEN Musong,et al. Effect of Chironomid larvae bioturbation on release of internal phosphorus in eutrophic lake[J].Journal of Hohai University(Natural Sciences), 2016,44(6):485-490.(in Chinese))
[19] LAGAUZERE S,BOYER P,STORA G.Effects of uranium-contaminated sediments onthe bioturbation activity of Chironomus riparius larvae (Insecta,Diptera) and Tubifex tubifex worms (Annelida,Tubificidae)[J].Chemosphere,2009,76(3): 324-334.
[20] ANSCHUTZ P, CIUTAT A, LECROART P,et al.Effects of tubificid worm bioturbation on freshwater sediment biogeochemistry[J].Aquatic Geochemistry,2012,18(6): 475-497.
[21] 孙亚东,李文奇,曾平.人工湿地处理污水技术[M].北京:中国水利水电出版社,2009.
[22] NIZZOLI D, BARTOLI M, COOPER M,et al.Implications for oxygen,nutrient fluxes and denitrification rates during the early stage of sediment colonization by the polychaete Nereis spp.in four estuaries[J].Estuarine Coastal and Shelf Science,2007,75(1-2): 125-134.
[23] 侯红勋,陈伦强,王淑莹,等.用ORP作为氧化沟同步硝化反硝化控制参数[J].北京工业大学学报,2006,32(12): 1093-1096.(HOU Hongxun,CHEN Lunqiang,WANG Shuying,et al.Use ORP to control simultaneous nitrification and denitrification in oxidation dirch process[J].Journal of Beijing University of Technology,2006,32(12):1093-1096.(in Chinese))
[24] CHARPENTIER H, MARTIN J.ORP regulation and acti-vated sludge: 15 years of experience[J].Water Science and Tech-nology,1998,38(3): 197-208.
·简讯·
第四批世界灌溉工程遗产公布
在墨西哥召开的国际灌排委员会第68届执行理事会,于当地时间2017年10月10日上午的全体会议上公布了2017年度的世界灌溉工程遗产名单。中国申报的宁夏引黄古灌区、陕西汉中三堰和福建黄鞠灌溉工程3个项目全部入选。
国际灌排委员会名誉主席高占义告诉记者,世界灌溉工程遗产的设立为水利遗产保护提供了一个良好的开端,使社会各界认知了独特的遗产类型,让人们走进灌溉工程遗产,从中了解区域历史、文化和水利,领略它的风采,感知它的博大。这些灌溉工程不仅是水利工程遗产,也是各国文化遗产体系的重要组成部分。世界灌溉工程遗产的评选,必将促进灌溉工程的保护和发展,同时也有利于传播、交流、弘扬水文化。
国际灌排委员会(ICID)成立于1950年,是以国际灌溉、排水及防洪前沿科技交流及应用推广为宗旨的专业类国际组织,目前有约100个会员国。
世界灌溉工程遗产名录是国际灌排委员会为保护、挖掘和推广具有历史价值的可持续灌溉工程及其科学经验而设立,自2014年开始在全球范围评选。每年由各国家委员会组织申报,经由国际专家组评审提出推荐名单,国际执行理事会投票通过后正式列入遗产名录。第四批入选遗产名录的工程还有其他4个国家的10个工程。
目前,我国陕西郑国渠、四川东风堰等10个已成功申报,加上此次成功申报的3个,我国已有13个世界灌溉工程遗产。
(本刊编辑部供稿)
EffectsoftheChironomusplumosusontheredoxcharacteristicsofSediment-watermicrointerface
YANWenming1,MALin2,WANGHan1,YANGJialiang3,YANGYanqing1
(1.StateKeyLaboratoryofHydrology-WaterResourcesandHydraulicEngineering,HohaiUniversity,Nanjing210098,China; 2.HunanProvincialDepartmentofWaterResources,Changsha410007,China; 3.HunanHydroamp;PowerDesignamp;ResearchInstitute,Changsha410007,China)
Bioturbation is one of the important influence factors in the sediment-water interface reaction. To identify the influence mechanism of bioturbation on redox characteristics in the sediment-water interface, Chironomus plumosus is selected to examine its effect on the vertical distribution characteristics of O2, pH and Eh using the high resolution microelectrode system. The result shows that the concentration of dissolved oxygen at the sediment-water interface is significantly increased, and the pH value of the overlying water is reduced together with increased pH value in the sediments. Moreover, due to the bioturbation of the Chironomus plumosus, the temporal and spatial variation of pH value in the overlying water becomes large, which is however less significant in the sediments. The Eh value appears to be significantly increased due to the increment of the Oxygen content in the corridor, which is low instead in the places without bioturbation. In general, the sediment-water micro interface is influenced by changing its redox conditions due to the oxygen, the latter is introduced into the corridor through breathing and ingestion of the Chironomus plumosus.
Chironomus plumosus; sediment-water micro interface; bioturbation; vertical distribution
10.3876/j.issn.1000-1980.2017.06.003
2016-10-12
国家自然科学基金(41301531); 湖南省水利基金(201524507)
燕文明(1982—),女,江苏沛县人,高级实验师,博士,主要从事环境水文及水环境保护研究。E-mail:ywm0815@163.com
麻林,博士。E-mail:155327259@qq.com
X171.1
A
1000-1980(2017)06-0489-06

