西南部分地区Ⅰ群禽腺病毒的分子流行病学调查及致病性研究
姚克昌,刘月月,游国进,李淑芸,夏 静,何 肖,李雯雯,杜莉静,韩新锋,黄 勇
(四川农业大学 动物医学院,四川 成都 611130)
西南部分地区Ⅰ群禽腺病毒的分子流行病学调查及致病性研究
姚克昌,刘月月,游国进,李淑芸,夏 静,何 肖,李雯雯,杜莉静,韩新锋,黄 勇*
(四川农业大学 动物医学院,四川 成都 611130)
2015—2016年,西南地区多个养鸡场发生疑似禽腺病毒感染病例。实验从发病鸡场采集肝组织,利用鸡胚肾细胞(CEK)进行病毒分离,共分离出16株Ⅰ群禽腺病毒(FAdV)。通过对hexon基因L1环临近的保守序列进行PCR扩增和序列测定,发现16株FAdV分属4个血清型,其中13株为FAdV-4型,FAdV-8a,FAdV-8b和FAdV-2型各占1株。选取不同血清型的4个代表毒株CH/SCDY/1604(FAdV-4)、CH/GZXF/1512(FAdV-2)、CH/CQBS/1504 (FAdV-8a)、CH/CQBS/1512(FAdV-8b)进行鸡的致病性实验,结果显示,感染CH/SCDY/1604(FAdV-4)的死亡率达80%,CH/CQBS/1504(FAdV-8a)感染组死亡率为20%,而CH/GZXF/1512(FAdV-2)和CH/CQBS/1512(FAdV-8b)组的鸡只有发病没有死亡。FAdV-4是西南地区流行的主要血清型且其致病性极高,其致病性主要表现为心包积液综合征(HPS)。试验结果可为西南地区Ⅰ群禽腺病毒感染的防治提供参考。
Ⅰ群禽腺病毒;心包积水综合征;流行病学调查;致病性
禽腺病毒(fowl aviadenoviruses,FAdVs)是无囊膜的双链DNA分子,属于腺病毒科,禽腺病毒属[1-3]。根据当前病毒分类系统,禽腺病毒可分为3个亚群,即Ⅰ、Ⅱ和Ⅲ群。Ⅰ群禽腺病毒根据限制性内切酶酶切分析可分为5个型即FAdV-A~FAdV-E,根据血清交叉中和实验可分为12个血清型即FAdV-1~FAdV-8a,FAdV-8b~FAdV-11。Ⅱ群禽腺病毒包括火鸡血性肠炎病毒(HEV)、大理石脾病毒和鸡大脾病毒。Ⅲ群禽腺病毒产蛋下降综合征病毒(EDSV)[4-7]。Ⅰ群禽腺病毒主要引起包涵体肝炎(inclusion body hepatitis,IBH)、心包积液综合征(the hydropericardium syndrome,HPS)和肌胃糜烂(gizzard erosions,GE)[8-11]。Ⅰ群禽腺病毒12个血清型都能引起鸡包涵体肝炎,典型的包涵体肝炎多发于3~10周龄肉鸡,以6周龄以前的鸡最常见,死亡率在10%左右,主要表现在肝脏坏死、肝细胞内含有嗜酸性和嗜碱性包涵体[12-13];大多数鸡的心包积液综合征的暴发是由FAdV-4型引起,其特征病变是心包充满透明的或淡黄色的液体,并伴有肾炎、肝炎,死亡率在30%~80%;引起肌胃糜烂的血清型有FAdV-1、FAdV-8,目前只有在白来航鸡上有较多报道[14-15]。近几年,世界各地都报道包涵体肝炎和心包积液综合征发生,给许多国家造成了巨大的经济损失,如美国[16]、印度[17]、南非[18]、加拿大[19]、韩国[10]、新西兰[20]、匈牙利[21]、波兰[22]、日本[23]、欧洲[24]等,在中国也有发生[9, 11, 25]。最近1~2年,疑似Ⅰ群禽腺病毒感染在西南地区部分养鸡场中发生,并且有很高的死亡率,给西南地区养禽业带来了重大的经济损失。本研究从西南地区发病鸡群中采集病料进行Ⅰ群禽腺病毒的分离、遗传进化分析和致病性测定,为西南地区该病的防治提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株、鸡胚及试验动物
E.coliDH5a,购自宝生物工程(大连)有限公司;SPF鸡胚购自北京梅里亚维通实验动物技术有限公司;1日龄商品代白羽肉鸡,购自四川省成都市温江正大集团,饲养至所需日龄。
1.1.2 主要试剂
pMD19-T、premix LATaq、限制性内切酶均购自宝生物工程(大连)有限公司;质粒提取试剂盒和胶回收试剂盒购自天根生化科技(北京)有限公司。
1.1.3 引物设计
根据GenBank上公布的FAdV-I 12个血清型的hexon基因L1环临近的保守序列,设计一对特异性PCR反应引物(F1: 5′-CAARTTCAGRCAGACGGT-3′和F2: 5′-TAGTGATGMCGSGACATCAT-3′),扩增片段的预计大小为897 bp。所设计的引物由上海生工生物工程有限公司合成。
1.2 方法
1.2.1 样本采集及处理
2015—2016年从四川、云南、重庆和贵州等西南地区的有疑似Ⅰ群禽腺病毒感染和致病鸡场中采集鸡肝脏组织52份,按1∶5的比例(m/V)加入灭菌PBS,磨碎制备组织悬液,6 000 r·min-1离心5 min,取上清液备用。
1.2.2 病料的PCR检测
采用苯酚/氯仿法提取样本中的DNA,然后通过PCR对样本中的Ⅰ群禽腺病毒特异性核酸进行检测。PCR反应总体系如下:DNA模板4 μL,10×ExTaqPCR MasterMix 25 μL,上、下游引物各2 μL,ddH2O 17 μL。PCR反应条件为:95 ℃预变性5 min;95 ℃变性45 s,55 ℃退火30 s,72 ℃延伸1 min,35个循环后;72 ℃延伸10 min。取6 μL PCR扩增产物用于电泳检测,于凝胶成像仪下观察并记录结果。
1.2.3 PCR产物的克隆测序
参照DNA胶回收试剂盒(TIANgel Midi purifieation Kit)的使用说明对PCR产物进行纯化,然后连接到pMD19-T载体上。连接产物转化到大肠埃希菌DH5a感受态细胞上,挑取阳性克隆接种于含有Amp的LB液体培养基中,37 ℃振荡培养10~12 h,收取菌液,按照E.Z.N.A.TM Plasmid Mini Kit I(200t)说明书提取质粒。用限制性内切酶EcoR Ⅰ和Hind Ⅲ对提取的质粒进行双酶切鉴定。将经过双酶切鉴定为阳性的质粒送上海生工生物工程有限公司进行测序。然后,通过NCBI的BLAST功能于基因库中的所有序列进行分析比对,再从国际基因库中选取下载不同国家或地区各个血清型的具有代表性的毒株序列,共16个序列(参考毒株的基本信息见表1),通过DNAstar软件中MegAlign程序中的clustal W法进行鉴定和同源性分析,并用MEGA6.0软件构建遗传进化树。
1.2.4 病毒分离
SPF鸡胚孵化至17~19日龄,按照常规方法制备鸡胚肾细胞(CEK)。将PCR反应鉴定为Ⅰ群腺病毒核酸阳性的病料上清液用0.22 μL滤膜过滤除菌,取0.2 mL接种于CEK单层6孔细胞上,于37 ℃ 5% CO2培养箱中吸附45 min,吸附完毕后将上清弃掉,加入维持液(含2%胎牛血清),同时设未接种的对照孔。37 ℃ 5%CO2培养箱继续培养,每隔12 h观察一次。在接毒后48~72 h收毒。通过PCR对收取的细胞液进行Ⅰ群腺病毒核酸的检测。检测结果为阴性的细胞培养物再盲传一代,如果盲传一代后Ⅰ群腺病毒核酸检测检测仍然为阴性,则丢弃。分离出的病毒-70 ℃保存备用。
1.2.5 Ⅰ群禽腺病毒的定量
选取不同血清型的4个分离株CH/SCDY/1604(FAdV-4)、CH/GZXF/1512(FAdV-2)、CH/CQBS/1504(FAdV-8a)和CH/CQBS/1512(FAdV-8b)的细胞液[以后简称CH/SCDY/1604(4)、CH/GZXF/1512(2)、CH/CQBS/1504(8a)和CH/CQBS/1512(8b)],按照10倍递进稀释至10-1~10-8。取10-3~10-8稀释度的病毒液,按照每孔0.2 mL接种于CEK单层24孔细胞培养板中,每个稀释度4个重复。于37 ℃ 5%CO2培养箱中吸附45 min,吸附完毕后将上清弃掉,加入维持液(含2%胎牛血清),同时设未接种的对照孔。37℃ 5%CO2培养箱继续培养,每隔12 h观察一次,观察5 d,按照Reed-Muench法计算TCID50。
1.2.6 Ⅰ群禽腺病毒对鸡的致病性试验
选取100只1周龄的商品肉鸡,饲养至28日龄。采集泄殖腔拭子,采用1.2.2节的方法进行禽腺病毒的检测,均为阴性。将鸡随机分成5个组(A、B、C、D、E),每组20只。A、B、C、D的鸡分别依次通过皮下接种CH/SCDY/1604(4)、CH/GZXF/1512(2)、CH/CQBS/1504(8a)和CH/CQBS/1512(8b) 4个毒株,每只鸡接种的剂量都为104TCID50。对照组皮下接种0.2 mL PBS。每个组隔离饲养14 d,每天观察两次,记录临床症状得分(0分表示正常,1分表示轻度沉郁;2分表示严重沉郁;3分表示麻痹,虚脱;4分表示死亡)。收集死亡鸡的心脏、肝脏、肾脏放于10%的福尔马林溶液中。14 d后所有未死亡的鸡进行安乐死,采集有疑似病变的组织,放于10%的福尔马林溶液中。按照常规方法制备组织切片,观察病理变化。
表1参考毒株的基本信息
Table1Information of the cited sequences

序号Number名称CaseID血清型Serotype分离地点IsolatedareaGenBank登录号Accessionnumber1CElOFAdV-1比利时BelgiumAF3399142VR827FAdV-2比利时BelgiumAF3399153SA55-08FAdV-2南非SouthAfricaHQ117900475FAdV-3北爱尔兰NorthernIrelandAF5089495PK-01FAdV-4印度IndiaEU9316936SDSXFAdV-4中国山东Shandong,ChinaKT8993257VR-829FAdV-4比利时BelgiumAF3399178TR22FAdV-5日本JapanAF5089539CR119FAdV-6日本JapanAF50895410YR36FAdV-7日本JapanAF5089551158FAdV-8北爱尔兰NorthernIrelandAF50895712764FAdV-8b加拿大CanadaJN11237313C-2BFAdV-10美国AmericaKT71788914C2BFAdV-11美国AmericaAF50895915QUFAdV-Ⅱ群中国山东Shandong,ChinaEF09350716EDSVFAdV-Ⅲ群德国GermanyY09598
2 结果与分析
2.1 Ⅰ群禽腺病毒的检测和分离结果
2.1.1 PCR鉴定结果
本文对52份有疑似Ⅰ群禽腺病毒感染的肝脏组织进行了PCR检测,结果有20份样品检测为Ⅰ群禽腺病毒特异性核酸阳性,PCR电泳结果见图1。
2.1.2 Ⅰ群禽腺病毒的分离结果
将20份阳性样本接种CEK细胞上进行病毒分离,结果分离出16株Ⅰ群禽腺病毒。各分离毒的背景资料见表2。
2.2 Ⅰ群禽腺病毒在细胞上致病性结果

Marker, DL2000; 1, 阴性; 2, 阳性; 3~22, PCR阳性结果Marker, DL2000; 1, Negative; 2, Positive; 3-22, Positive PCR product图1 引物F1和F2 PCR扩增产物Fig.1 The PCR product of primer F1 and F2
Ⅰ群禽腺病毒感染CEK细胞后24 h左右开始出现细胞病变,主要表现细胞变圆、聚集、折光性增强(图2-a)。对照组细胞一切正常,只有一些衰老的碎片(图2-b)。
2.3分离株的核酸序列分析结果
2.3.1 同源性分析结果
利用DNAStar软件Clustalw法,将测序所得到的hexon基因L1环基因序列与GenBank上发表的禽腺病毒不同血清型的参考株进行比较,比较的结果表明:16株分离株按照核酸序列同源性可归属为4个血清型即FAdV-2、FAdV-4、FAdV-8a和FAdV-8b,大部分毒株(13株)属于血清4型,且与Ⅰ群禽腺病毒血清型4型参考株的最高同源性为97.4%~99.8%;血清2、8a和8b各有1株,即CH/CQBS/1504(8a),CH/CQBS/1512(8b)和CH/GZXF/1512(2);16株分离株与Ⅱ群禽腺病毒火鸡出血性肠炎病毒(HEV)和Ⅲ群禽腺病毒鸡减蛋综合征病毒(EDSV)同源性比较低,具体结果见表3。
表2西南部分地区Ⅰ群禽腺病毒感染病料背景
Table2History of fowl adenovirus infection cases in chickens in southwestern China
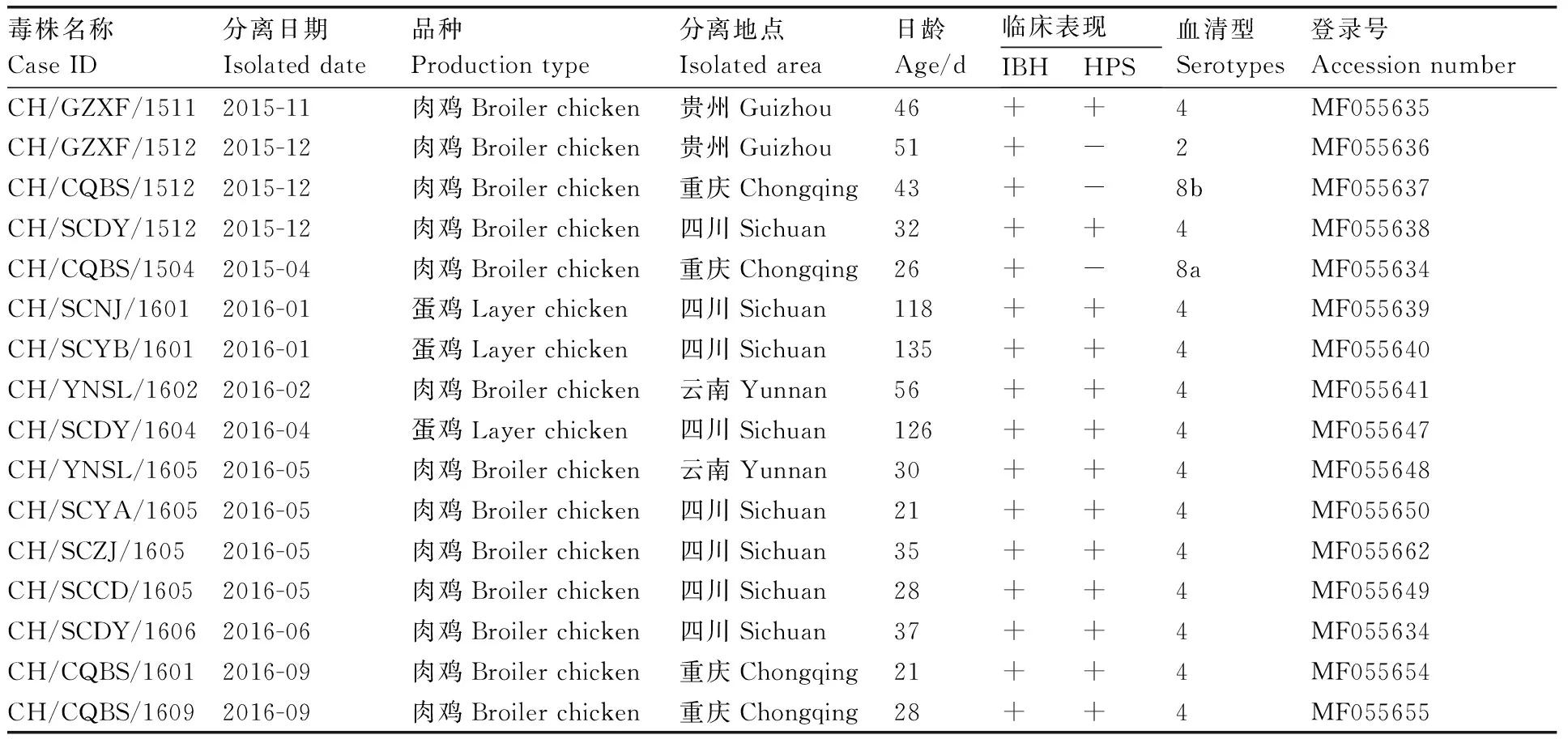
毒株名称CaseID分离日期Isolateddate品种Productiontype分离地点Isolatedarea日龄Age/d临床表现IBHHPS血清型Serotypes登录号AccessionnumberCH/GZXF/15112015-11肉鸡Broilerchicken贵州Guizhou46++4MF055635CH/GZXF/15122015-12肉鸡Broilerchicken贵州Guizhou51+-2MF055636CH/CQBS/15122015-12肉鸡Broilerchicken重庆Chongqing43+-8bMF055637CH/SCDY/15122015-12肉鸡Broilerchicken四川Sichuan32++4MF055638CH/CQBS/15042015-04肉鸡Broilerchicken重庆Chongqing26+-8aMF055634CH/SCNJ/16012016-01蛋鸡Layerchicken四川Sichuan118++4MF055639CH/SCYB/16012016-01蛋鸡Layerchicken四川Sichuan135++4MF055640CH/YNSL/16022016-02肉鸡Broilerchicken云南Yunnan56++4MF055641CH/SCDY/16042016-04蛋鸡Layerchicken四川Sichuan126++4MF055647CH/YNSL/16052016-05肉鸡Broilerchicken云南Yunnan30++4MF055648CH/SCYA/16052016-05肉鸡Broilerchicken四川Sichuan21++4MF055650CH/SCZJ/16052016-05肉鸡Broilerchicken四川Sichuan35++4MF055662CH/SCCD/16052016-05肉鸡Broilerchicken四川Sichuan28++4MF055649CH/SCDY/16062016-06肉鸡Broilerchicken四川Sichuan37++4MF055634CH/CQBS/16012016-09肉鸡Broilerchicken重庆Chongqing21++4MF055654CH/CQBS/16092016-09肉鸡Broilerchicken重庆Chongqing28++4MF055655
1IBH = 包涵体肝炎; HPS = 心包积水综合症; “+”表示有相应的临床表现; “-”表示无相应的临床表现;死亡率(%)=根据提交的诊断日期记录死亡率。
IBH = inclusion body hepatitis; HPS = hydropericardium; “+”means having positive clinical sign; “-”means having negative clinical sign; Mortality was recorded based on the date submitted for diagnosis.

图2 Ⅰ群禽腺病毒(A)和对照组(B)感染CEK细胞的致病性结果Fig.2 Cytopathogenic effect by FAdV in CEK cells(A) and normal CEK cells(B)
2.3.2 核酸序列遗传进化
根据序列比较结果绘制遗传进化树(图3)。进化分析表明,CH/CQBS/1504(8a)与欧洲分离株58在同一支上,CH/CQBS/1512(8b)与加拿大分离株764在同一分支上,且都属于FAdV-E;CH/GZXF/1512(2)和南非分离株SA55-08及欧洲分离株VR-827在同一分支上属于FAdV-D;有13株和中国山东分离株SDSX,印度分离株PK-01以及欧洲分离株VR-829在同一分支上,属于FAdV-C;所有序列与Ⅱ群禽腺病毒DUADV-1 QU株和Ⅲ群禽腺病毒EDSV不在同一个大的分支上。
2.3 临床症状和剖检病变
接种CH/SCDY/1604(4)、CH/GZXF/1512(2)、CH/CQBS/1504(8a)、CH/CQBS/1512(8b) 4个毒株的鸡在2~9 d出现精神沉郁、卧地不起等症状,CH/SCDY/1604(4)和 CH/CQBS/1504(8a)在第4天和第7天出现死亡。图4显示本次实验中各组不同的临床症状得分和死亡率。临床得分图显示在第3~7天各组鸡的临床症状最严重,且CH/SCDY/1604(4)组临床症状比CH/GZXF/1512(2)、CH/CQBS/1504(8a)、CH/CQBS/1512(8b)组严重。存活率图显示CH/SCDY/1604(4)和CH/CQBS/1504(8a)的死亡率为80%和20%,而CH/GZXF/1512(2)、CH/CQBS/1512(8b)和对照组都没有死亡。剖检结果显示(图5),4组鸡都有明显的肝脏肿大,肾脏肿大、苍白色,小肠出血,其中CH/SCDY/1604(4)组鸡心包还有大量淡黄色的液体,对照组鸡剖检一切正常。
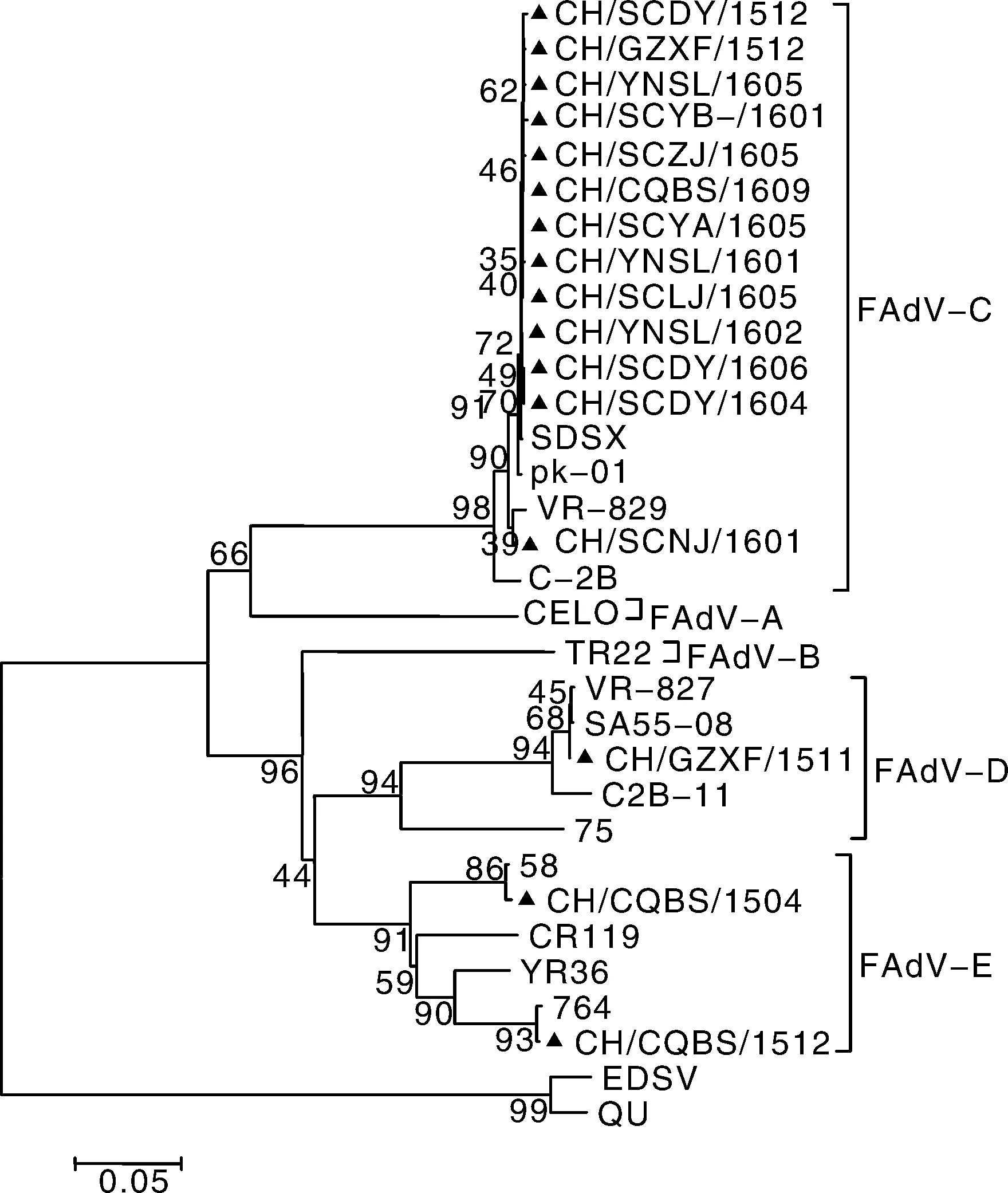
▲表示本试验分离株的序列,其他序列为GenBank中下载的序列▲ means the sequence from isolates in this research, other reference sequences were retrieved from GenBank图3 分离株hexon基因L1环扩增片段的遗传发育树Fig.3 Phylogentic tree based on L1 loop sequences of hexon gene
2.4 病理组织学观察结果
(1)心脏。感染分离株CH/SCDY/1604(4)组(图6-Ⅰ)显示,心外膜增厚,鸡心肌细胞坏死和无序排列,中度嗜中性粒细胞和单核细胞浸润,图6-Ⅳ代表对照组的鸡的心肌细胞正常,心内膜紧贴心肌细胞。
(2)肝脏。肝脏的病变主要出现严重的脂肪变性,炎性细胞浸润、淤血、坏死的肝细胞有散在的分布,同时可见嗜酸性或碱性包涵体;感染4个分离株的鸡肝脏都出现不同程度的病变,其中CH/SCDY/1604(4)组病变最严重,对照组的鸡肝脏显示正常。

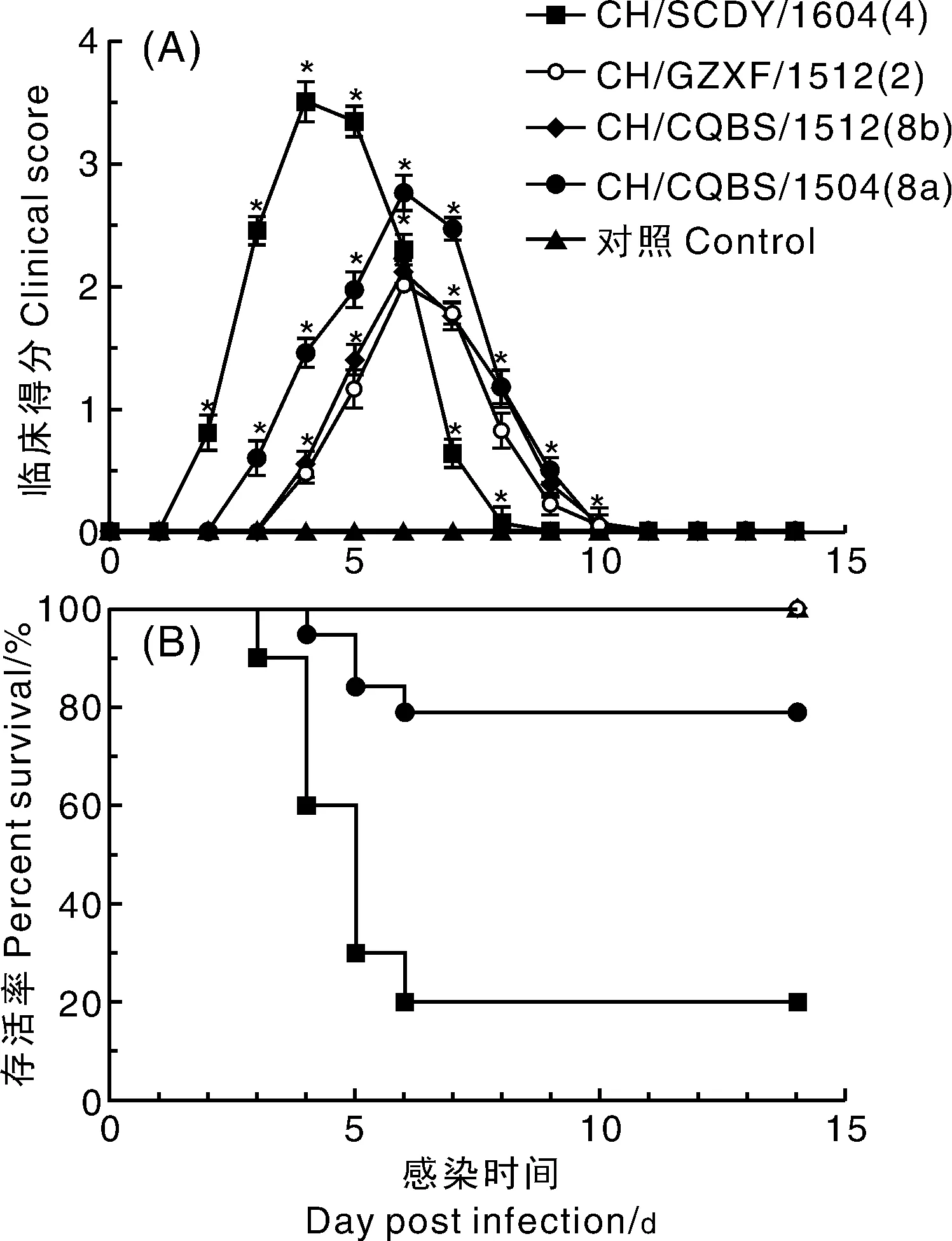
0分为正常; 1分为轻度抑郁; 2分严重抑郁; 3分瘫痪、虚脱; 4死亡。临床得分为明日每个组的平均得分。误差是标准差(*)表示实验组的每天临床得分与对照组之间有显著差异(P<0.05)0, Normal; 1, Mild depression; 2, Severe depressed; 3, Paralysis/prostration; 4, Death. The mean scores per group per day are shown. The error bars indicate standard deviations. Asterisks (*) mark the days in which the clinical scores were significantly different between infected group and control group (P <0.05)图4 接种 CH/SCDY/1604(4)、CH/GZXF/1512(2)、CH/CQBS/1504 (8a)和CH/CQBS/1512(8b) 4个毒株临床得分(A)和存活率(B)Fig.4 Clinical scores (A) and survival rates (B) of chickens after inoculation with CH/SCDY/1604(4), CH/GZXF/1512(2), CH/CQBS/1504(8a) and CH/CQBS/1512(8b)
(3)肾脏。肾脏的变化主要是肾小管上皮细胞出现严重大小不等的空泡,大量的炎性细胞浸润,肾细胞,上皮细胞坏死呈散在的分布。感染4个分离株的鸡肾脏都出现不同程度的病变,其中CH/SCDY/1604(4)组病变最严重,对照组鸡的肾脏只有一些散在的出血(可能是采取组织不小心划破血管所致)。
2.5 病理组织学变化评分
病理评分图(图7)显示,感染分离株CH/SCDY/1604株鸡肝脏和肾脏的病变最严重,感染CH/CQBS/1504组的鸡次之,感染CH/GZXF/1512和CH/CQBS/1512组的鸡组织病理学变化最轻,通过显著性分析显示CH/SCDY/1604与CH/CQBS/1504与各组之间都差异显著(P<0.05),CH/GZXF/1512和CH/CQBS/1512两组病理学变化不显著(P<0.05),与其他组组织病理学变化差异显著(P<0.05),所有实验组与对照组相比都差异都显著(P<0.05)。

a、d,对照组;b,心包积液,肝脏严重发黄肿大;c,肝脏边缘发黄、肿大;e,肾脏肿大;f,肾脏肿大变苍白色a and d, The control group; b, Pericardial effusion, severe yellowing of the liver; c, Yellowing of the liver, swelling; e, Kidney enlargement; f, Kidney enlargement becomes pale图5 感染FAdV后心脏、肝脏、肾脏的剖检病变Fig.5 Gross lesions in liver, heart and kindey from the chicken after infected with FAdV
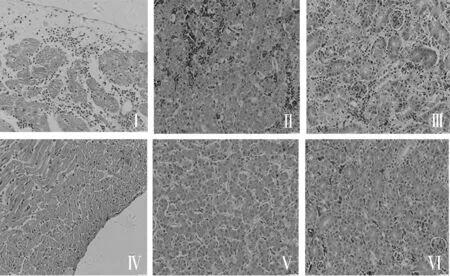
Ⅰ,心外膜增厚,炎性细胞增多(黑色箭头部位);Ⅱ,肝脏脂肪变性(红色箭头部位),淤血(蓝色箭头部位)、包涵体(黄色箭头部位);Ⅱ,肾脏肾细胞坏死,核溶解(绿色箭头部位);Ⅳ、Ⅴ、Ⅵ分别表示正常的心脏、肝脏、肾脏组织细胞形态Ⅰ: Epicardial thickening, inflammatory cells increased(black arrow); Ⅱ: Liver steatosis(red arrow), congestion(blue arrow), inclusion body(yellow arrow); Ⅲ: Kidney cell necrosis, nuclear dissolution(green arrow); Ⅳ, Ⅴ, Ⅵ: The heart, liver, kidney respectively.图6 感染FAdV后心脏、肝脏和肾脏组织病理切片(H.E×400)Fig.6 Histopathology in the heart, liver, kidney after infected with FAdV(H.E×400)

0分表示没有损失,1~2分表示轻微的损失,3~4分表示中等的损伤,5~6表示严重的损伤。误差条表示标准偏差。 星号(*)标记组之间的显着差异(P<0.05)Lesion score: 0 for no lesions, 1-2 for mild lesions, 3-4 for morderate lesions and 5-6 for severe lesions. Asterisks (*) mark significant differences between groups (P<0.05)图7 感染FAdV的鸡第5天肝脏和肾脏组织病理学评分图(每组5只)Fig.7 Scores of histopathological lesions in liver and kidney tissues of chickens at 5 day after infected with FAdV (n=5 per group)
3 讨论
最近几年,在很多国家报道由Ⅰ群禽腺病毒引起的心包积液综合征、包涵体肝炎和肌胃糜烂(目前只在白来航鸡发现)的发生呈上升趋势[22, 26-27]。其中一些高致病性毒株给养禽业带来了相当大的经济损失[11, 17, 28-29]。自2010年以来,Ⅰ群禽腺病毒的暴发在中国呈上升趋势。2010—2014,刘东[30]从黑、吉、京、鲁、苏、豫、沪、粤9省市收集355份疑似Ⅰ群禽腺病毒感染的样品进行检测,结果显示,Ⅰ群禽腺病毒的感染率由30%升至70%,且主要流行的血清型为FAdV-8a/b型和FAdV-4型。李敏等[31]调查研究中发现,在我国目前流行的禽腺病毒中存在两种基因型的病毒,FAdV-C型的病毒主要引起禽的心包积液综合征;而FAdV-E的病原主要引起禽的包涵体肝炎。本研究通过采集西南不同地区疑似Ⅰ群禽腺病毒感染鸡的肝脏,分离出16株Ⅰ群禽腺病毒,通过遗传进化分析16株中1 CH/GZXF/1512株与FAdV-2型,CH/CQBS/1504株与FAdV-8a型以及CH/CQBS/1512株与FAdV-8b型分别具有很高的同源性;其余13株与FAdV-4型具有很高的同源性。本研究发现目前在西南地区主要流行的Ⅰ群禽腺病毒是4型。
Ⅰ群禽腺病毒有12个血清型(FAdV-1~FAdV-8a和FAdV-8b~FAdV-11)不同的血清型的致病性存在很大的差异。目前在全国多个地区均有发生,该病感染1~6周龄任何品种鸡,发病日程短的4~8 d逐渐恢复,一般7~10 d,也有少数持续2~3周;发病鸡群死亡高峰期4~8 d,病程持续8~15 d,死亡率10%~60%不等[31]。本研究通过观察鸡的临床症状、剖检病变和组织病理学变化来确定不同血清型4个毒株CH/SCDY/1604(4)、CH/GZXF/1512(2)、CH/CQBS/1504(8a)、CH/CQBS/1512(8b)的致病性,结果显示Ⅰ群禽腺病毒血清4型毒株CH/SCDY/1604和8a型毒株CH/CQBS/1504分别引起80%和20%的死亡率,而Ⅰ群禽腺病毒血清2型毒株CH/GZXF/1512和8b型毒株CH/CQBS/1512没有死亡。临床和组织病理学得分显示Ⅰ群禽腺病毒血清4型毒株CH/SCDY/1604(4)的致病性高于毒株CH/GZXF/1512(2)、CH/CQBS/1504(8a)、CH/CQBS/1512(8b)。Ⅰ群禽腺病毒不同的血清型对鸡的敏感程度的不同,引起的发病和死亡率也不相同。本研究结果与先前几个研究一致,血清4型(FAdV-C)部分毒株能够引起的很高的死亡率[5, 9, 32]。
对于禽腺病毒感染的预防,消灭传染源是重中之重。腺病毒既可水平传播,也可垂直传播,控制腺病毒要从种鸡开始。目前我国种鸡场还未开展禽腺病毒的净化工作,净化技术和方案也不成熟,需要加强这方面的研究。腺病毒是无囊膜的病毒,具有较强的抵抗力,通过消毒的方法可以杀灭密闭环境中的腺病毒。传染性法氏囊病病毒(IBDV)和鸡传染性贫血病毒(CIAV)等一些能引起免疫抑制病的病毒都能够强化禽腺病毒的致病性[10, 33-34],生产中也要做好这两种病原的控制。在禽腺病毒感染流行的地区,除了以上措施外,疫苗的使用也非常有效。在一些国家,灭活的油乳疫苗对IBH和HPS有很好的保护效果[35-36]。对于腺病毒感染的治疗,高免卵黄抗体具有较好的效果。我国市场上高免卵黄抗体的质量参差不齐,有的携带有垂直传播性病原,高免卵黄抗体最好不要用于发病种鸡场。
本研究结果表明在中国西南地区暴发的Ⅰ群腺病毒感染由FAdV-4、FAdV-2、FAdV-8a、FAdV-8b引起,其中主要是FAdV-4。今后应继续加强Ⅰ群腺病毒感染的分子流行病学调查,掌握流行的Ⅰ群腺病毒的血清型、致病性和遗传特点。同时应该加强Ⅰ群腺病毒疫苗的研发,制定有效的生物安全措施,为生产上控制甚至净化该病打下基础。
[1] HARRACH B, BENKÖ M, BOTH G W, et al. FamilyAdenoviridae[M]//KING A M Q, ADAMS M J, CARSTENS E B,et al. Virus taxonomy: classification and nomenclature of viruses. Ninth report of the international committee on taxonomy of viruses. New York: Elsevier; 2011: 125-141.
[2] MCFERRAN J B, SMYTH J A. Avian adenoviruses[J].RevueScientifiqueEtTechnique, 2000,19(2):589-601.
[3] SAIF Y M, 苏敬良, 高福, 等. 禽病学[M]. 11版. 北京: 中国农业出版社,2005.
[4] HESS M. Detection and differentiation of avian adenoviruses: a review[J].AvianPathology, 2000, 29(3):195-206.
[5] ZHAO J, ZHONG Q, ZHAO Y, et al. Pathogenicity and complete genome characterization of fowl adenoviruses isolated from chickens associated with inclusion body hepatitis and hydropericardium syndrome in China[J].PLoSOne, 2015, 10(7):e0133073.
[6] 徐辉, LOHR J E. 检测鸡产蛋下降综合症抗体的ELISA法在田间应用的可行性研究[J]. 浙江农业学报, 1996,8(4):232-235.
XU H, LOHR J E. On study of application feasibility of the enzyme-linked immunosorbent assay for the detecting of antibody to egg drop syndrome virus in the field[J].ActaAgriculturaeZhejiangensis, 1996,8(4):232-235.(in Chinese with English abstract)
[7] 何永强, 杜青云, 盛祖恬, 等. 一种非EDSV引起的鸭传染性减蛋症[J]. 浙江农业学报, 2001, 13(3):125-126.
HE Y Q, DU Q Y, SHENG Z T, et al. A virus different from EDSV cause duck infectious egg drop disease[J].ActaAgriculturaeZhejiangensis, 2001, 13(3):125-126.(in Chinese with English abstract)
[8] GJEVRE A G, KALDHUSDAL M, ERIKSEN G S. Gizzard erosion and ulceration syndrome in chickens and turkeys: a review of causal or predisposing factors[J].AvianPathology, 2013, 42(4):297-303.
[9] CHEN H, DOU Y, ZHENG X, et al. Hydropericardium hepatitis syndrome emerged in cherry valley ducks in China[J].TransboundaryandEmergingDiseases, 2017,64(4):1262-1267.
[10] CHOI K S, KYE S J, KIM J Y, et al. Epidemiological investigation of outbreaks of fowl adenovirus infection in commercial chickens in Korea[J].PoultryScience, 2012, 91(10):2502-2506.
[11] YE J, LIANG G, ZHANG J, et al. Outbreaks of serotype 4 fowl adenovirus with novel genotype, China[J].EmergingMicrobes&Infection, 2016 (5):e50.
[12] MATOS M, GRAFL B, LIEBHART D, et al. Selected clinical chemistry analytes correlate with the pathogenesis of inclusion body hepatitis (IBH) experimentally induced by fowl aviadenoviruses (FAdVs)[J].AvianPathology, 2016,45(5):520-529.
[13] JOUBERT H W, AITCHISON H, MAARTENS L H, et al. Molecular differentiation and pathogenicity of Aviadenoviruses isolated during an outbreak of inclusion body hepatitis in South Africa[J].JournalofSouthAfricanVeterinaryAssociation, 2014, 85(1):1058.
[14] OKUDA Y, ONO M, SHIBATA I, et al. Pathogenicity of serotype 8 fowl adenovirus isolated from gizzard erosions of slaughtered broiler chickens[J].JournalofVeterinaryMedicalScience, 2004, 66(12):1561-1566.
[15] MASE M, NAKAMURA K. Phylogenetic analysis of fowl adenoviruses isolated from chickens with gizzard erosion in Japan[J].JournalofVeterinaryMedicalScience, 2014, 76(11):1535-1538.
[16] MENDELSON C, NOTHELFER H B, MONREAL G. Identification and characterization of an avian adenovirus isolated from a ′spiking mortality syndrome’ field outbreak in broilers on the Delmarva Peninsula, USA[J].AvianPathology, 1995, 24(4):693-706.
[17] DAHIYA S, SRIVASTAVA R N, HESS M, et al. Fowl adenovirus serotype 4 associated with outbreaks of infectious hydropericardium in Haryana, India[J].AvianDiseases, 2002, 46(1):230-233.
[18] JOUBERT H W, AITCHISON H, MAARTENS L H, et al. Molecular differentiation and pathogenicity of Aviadenoviruses isolated during an outbreak of inclusion body hepatitis in South Africa[J].JournaloftheSouthAfricanVeterinaryAssociation, 2014, 85(1):1058.
[19] GOMIS S, GOODHOPE R, OJKIC D, et al. Inclusion body hepatitis as a primary disease in broilers in Saskatchewan, Canada[J].AvianDiseases, 2006, 50(4):550-555.
[20] SAIFUDDIN M, WILKS C R. Reproduction of inclusion body hepatitis in conventionally raised chickens inoculated with a New Zealand isolate of avian adenovirus[J].NewZealandVeterinaryJournal, 1990, 38(2):62-65.
[22] NICZYPORUK J S. Phylogenetic and geographic analysis of fowl adenovirus field strains isolated from poultry in Poland[J].ArchivesofVirology, 2016, 161(1):33-42.
[23] MASE M, NAKAMURA K, MINAMI F. Fowl adenoviruses isolated from chickens with inclusion body hepatitis in Japan, 2009-2010[J].JournalofVeterinaryMedicalScience, 2012, 74(8):1087-1089.
[24] SCHACHNER A, MAREK A, GRAFL B, et al. Detailed molecular analyses of the hexon loop-1 and fibers of fowl aviadenoviruses reveal new insights into the antigenic relationship and confirm that specific genotypes are involved in field outbreaks of inclusion body hepatitis[J].VeterinaryMicrobiology, 2016, 186: 13-20.
[25] 国纪垒, 刁有祥. Ⅰ群禽腺病毒山东株的分离鉴定及hexon基因的克隆与分析[C]//中国畜牧兽医学会2011学术年会, 成都, 2011.
[26] METTIFOGO E, NUEZ L F N, SANTANDER PARRA S H, et al. Fowl adenovirus Group I as a causal agent of inclusion body hepatitis/hydropericardium syndrome (IBH/HPS) outbreak in brazilian broiler flocks[J].PesquisaVeterinriaBrasileira, 2014, 34(8):733-737.
[27] LIM T H, KIM B Y, KIM M S, et al. Outbreak of gizzard erosion associated with fowl adenovirus infection in Korea[J].PoultryScience, 2012, 91(5):1113-1117.
[28] STEER P A, SANDY J R, O’ROURKE D, et al. Chronological analysis of gross and histological lesions induced by field strains of fowl adenovirus serotypes 1, 8b and 11 in one-day-old chickens[J].AvianPathology, 2015, 44 (2):106-113.
[29] OAKS J L, SCHRENZEL M, RIDEOUT B, et al. Isolation and epidemiology of falcon adenovirus[J].JournalofClinicalMicrobiology, 2005, 43(7):3414-3420.
[30] 刘东, 刘红祥, 于静, 等. Ⅰ亚群腺病毒在我国鸡群的流行病学调查[J]. 中国家禽, 2015, 37(15):70-73.
LIU D, LIU H X, YU J, et al. Epidemiological investigation of avian influenza adenovirus subgroup Ⅰ in China[J].ChinaPoultry, 2015, 37(15):70-73. (in Chinese)
[31] 李敏, 马玉峰, 杨振. Ⅰ型禽腺病毒在我国鸡群中的流行情况和防控措施[J]. 兽医导刊, 2017 (1):30-32.
LI M, MA Y F, YANG Z. Epidemic situation and control measures of avian influenza type A virus in chicken flocks in China[J].VeterinaryOrientation, 2017 (1):30-32. (in Chinese)
[32] SCHONEWILLE E, SINGH A, GÖBEL T W, et al. Fowl adenovirus (FAdV) serotype 4 causes depletion of B and T cells in lymphoid organs in specific pathogen-free chickens following experimental infection[J].VeterinaryImmunology&Immunopathology, 2008, 121(1/2):130-139.
[33] KAURI S, DEKA D, DWIVEDI P, et al. Studies on the association of hydropericardium syndrome with infectious bursal disease under field conditions[J].IndianJournalofPoultryScience, 2011, 46(2):220-225.
[34] LEE J Y, KWON M S, CHU K S, et al. Outbreak of inclusion body hepatitis (IBH) and infectious bursal disease (IBD) in broilers, case[J].KoreanJournalofVeterinaryService, 2007, 30(3):321-327.
[35] SHAH M S, ASHRAF A, RAHMAN M, et al. A subunit vaccine against hydropericardium syndrome using adenovirus penton capsid protein[J].Vaccine, 2012, 30(50):7153-7156.
[36] KIM M S, LIM T H, LEE D H, et al. An inactivated oil-emulsion fowl Adenovirus serotype 4 vaccine provides broad cross-protection against various serotypes of fowl Adenovirus[J].Vaccine, 2014, 32(28):3564-3568.
(责任编辑张 韵)
PathogenicityandepidemiologicalinvestigationofoutbreaksoffowladenovirussubpopulationⅠinfectioninchickensinpartsofsouthwesternChina
YAO Kechang, LIU Yueyue, YOU Guojin, LI Shuyun, XIA Jing, HE Xiao, LI Wenwen, DU Lijing, HAN Xinfeng, HUANG Yong*
(CollegeofVeterinaryMedicine,SichuanAgriculturalUniversity,Chengdu611130,China)
In 2015-2016, suspected fowl adenoviruses infections were observed in many chicken farms in southwestern China. The liver samples were collected from diseased chickens and inoculated into chicken embryo kidney cells (CEK) cultures for virus isolation, and 16 fowl adenoviruses (FAdV) strains were isolated. After PCR amplificating, sequencing and comparing the conserved sequences located in the pedestal regions adjacent to the L1 loop of thehexongenes of FAdV, all of the 16 stains could be grouped into four serotypes including FAdV-4(13/16), FAdV-8a (1/16), FAdV-8 (1/16) and FAdV-2 (1/16). Then, the delegate strains from those four different serotypes were selected to infect chickens to observe its pathogenicity to chickens, the results showed that the mortality of chickens infected with CH/SCDY/1604(FAdV-4) and CH/CQBS/1504 (FAdV-8a) was 80% and 20%, respectively, while no death of chicken was observed in chickens infected by CH/GZXF/1512(FAdV-2)and CH/CQBS/1512(FAdV-8b). It was concluded that the FAdV-4 was the predominant serotype and was highly pathogenic to chickens, and hydropericardium syndrome (HPS) was the main clinical manifestation. This results could provide reference for the epidemiological investigation and prevention of FAdVⅠinfection in southwestern China.
fowl adenovirus; hydropericardium syndrome; epidemiological investigation; pathogenicity
姚克昌,刘月月,游国进,等. 西南部分地区Ⅰ群禽腺病毒的分子流行病学调查及致病性研究[J].浙江农业学报,2017,29(11): 1809-1818.
10.3969/j.issn.1004-1524.2017.11.06
2017-05-12
姚克昌(1989—),男,河南商丘人,硕士研究生,主要从事家禽传染病的研究。E-mail: qingbuykc@163.com
*通信作者,黄勇,E-mail:hyong601@163.com
S852.65+7
A
1004-1524(2017)11-1809-10

