Wip1基因重组慢病毒表达载体的构建及其对乳腺癌MCF-7细胞生物学行为的影响研究
李宗涛,顾笑梅,孙国贵,李 娟,张 浩
(1.河北省唐山市工人医院乳腺外科 063000;2.河北省唐山市妇幼保健院妇产科 063000;3.河北省唐山市人民医院放化疗科 063000)
·论著·
Wip1基因重组慢病毒表达载体的构建及其对乳腺癌MCF-7细胞生物学行为的影响研究
李宗涛1,顾笑梅2,孙国贵3,李 娟2,张 浩2
(1.河北省唐山市工人医院乳腺外科 063000;2.河北省唐山市妇幼保健院妇产科 063000;3.河北省唐山市人民医院放化疗科 063000)
目的构建Wip1基因重组慢病毒表达载体,研究其对乳腺癌细胞生物学行为的影响。方法以慢病毒感染方法将Wip 1的短发夹状RNA(shRNA)转入乳腺癌MCF-7细胞。采用qRT-PCR和蛋白质印迹法(Western blot)检测转染前后细胞Wip1 mRNA、蛋白的表达,MTT法、流式细胞术及Transwell侵袭实验检测Wip1-shRNA对MCF-7细胞增殖、凋亡、周期及侵袭转移的影响。筛选具有抑制 p53基因表达的干扰RNA分子p53dsRNA,并分析其干扰后对乳腺癌MCF-7细胞侵袭转移的影响。结果转染48 h后,Wip1-shRNA组细胞荧光较强,NC-shRNA组较弱。Wip1-shRNA组细胞Wip1 mRNA和蛋白的表达分别为0.291±0.025、0.203±0.021与NC-shRNA组0.954±0.090、0.963±0.092比较,差异有统计学意义(Plt;0.05)。两组各时间点细胞存活率比较,差异有统计学意义(Plt;0.05)。NC-shRNA组早期与晚期细胞的凋亡数少于Wip1-shRNA组,差异有统计学意义(Plt;0.05)。NC-shRNA组细胞G0+G1期、S期细胞数分别为53.5±3.6、27.3±1.5,Wip1-shRNA组分别为72.3±5.2、14.6±0.8,差异有统计学意义(Plt;0.05)。Transwell侵袭转移结果表明,NC-shRNA组细胞的穿膜数均多于Wip1-shRNA组(Plt;0.05)。对照组细胞中p53 mRNA的表达、细胞侵袭转移的穿膜数与p53dsRNA组比较,差异有统计学意义(Plt;0.05)。结论RNA干扰可有效抑制乳腺癌MCF-7细胞Wip1表达,Wip1可能通过调控蛋白表达影响乳腺癌细胞增殖、凋亡、周期与侵袭转移,p53dsRNA干扰p53 基因下调后增加乳腺癌MCF-7细胞侵袭转移的能力。
Wip1;乳腺肿瘤;细胞凋亡;基因转染
慢病毒属逆转录病毒科,是以HIV-1为基础发展起来的基因治疗载体。其能够在人和动物的细胞系或原代细胞中高效地导入目的基因或者RNA干扰,效果维系时间长并且很稳定,可以在宿主细胞中成功整合目的基因,目的基因随着机体细胞进行分裂增殖,还可以对非分裂的细胞进行整合。
全球每年新增乳腺癌患者120万,每年死亡人数约50万人,我国主要城市近10来发病率增长了37%。目前,乳腺癌目前已成为严重威胁妇女健康的第一大杀手,其早期诊断、恶性程度分析及预后判断是当今研究的热点。
本文采用慢病毒感染方法将Wip1的短发夹状RNA(shRNA)转入乳腺癌MCF-7细胞,采用qRT-PCR和蛋白质印迹法(Western blot)检测转染前后细胞Wip1 mRNA、蛋白的表达,MTT法、流式细胞术及Transwell侵袭实验检测Wip1-shRNA对MCF-7细胞增殖、凋亡、周期及侵袭转移的影响,给临床治疗乳腺癌及预后的判断带来新的可能。
1 材料与方法
1.1材料与试剂 乳腺癌MCF-7细胞购自中科院肿瘤医院细胞库;以pLenti.puro-shWip1-eGFP为质粒和载体,针对Wip1对shRNA干扰的慢病毒重组质粒予以构建,并实现Wip1-shRNA及阴性对照shRNA(NC-shRNA)慢病毒的包装;病毒载体购自广州赛业生物科技有限公司,引物设计及合成由上海生工生物工程技术服务有限公司提供。qRT-PCR试剂盒购自北京索来宝公司;兔抗人单克隆抗体Wip1、p53购自美国Abcam公司;p53dsRNA合成由广州锐博生物有限公司提供。
1.2方法
1.2.1细胞培养与慢病毒感染 感染前1 d将乳腺癌MCF-7细胞以每孔105个接种于24孔板中,待细胞生长达80%范围时把慢病毒稀释液(含NC-shRNA或Wip1-shRNA质粒)1 mL加入。在感染病毒12 h之后,把病毒液吸去并将DMEM培养基1 mL加入予以继续培养。感染病毒48 h之后,对带有绿色荧光的细胞在荧光显微镜下加以挑取,从而克隆扩大培养。实验分为空转染组(NC-shRNA组)、转染组(Wip1-shRNA组)。
1.2.2RNA提取与qRT-PCR Wip1按Trizol试剂说明提取细胞总RNA,根据qRT-PCR试剂盒说明逆转录成cDNA,进行PCR扩增。Wip1上游引物:5′-TTC CCC ATG TTC TAC ACC ACC AG-3′,下游引物:5′-TGA GGG TAT GAC TAC ACC TTG GAC-3′;GAPDH上游引物:5′-GTC TCC TCT GAC TTC AAC AGC G-3′,下游引物:5′-ACC ACC CTG TTG CTG TAG CC-3′。 PCR反应条件:95 ℃预变性60 s,95 ℃变性15 s,60 ℃退火60 s,72 ℃延伸45 s,40个循环。利用琼脂糖凝胶电泳成像系统成像,表达量以Wip1和GAPDH电泳条带灰度比值表示。
1.2.3Western blot 提取转染前后细胞总蛋白,BCA法测定蛋白质浓度。10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳实现蛋白的分离,进行固相支持体(聚偏氟乙烯膜)室温封闭蛋白质1 h,分别与Wip1抗体、p53抗体和GAPDH抗体 (稀释均为1∶500) 反应过夜(4 ℃),荧光二抗(稀释1∶2 000)进行1 h室温孵育。扫描显像由红外激光成像系统实现,表达量通过目的条带与GAPDH条带灰度比值表示。
1.2.4MTT法 取处于对数生长期接种密度70%~80% NC-shRNA组、Wip1-shRNA组细胞按每孔5 000个细胞、每孔体积200 μL在96孔培养板内予以接种。终止培养时间为24、48、72、96 h。5 mg/mL MTT溶液20 μL在培养终止前4 h加入,继续培养4 h,除去培养基,每孔加入200 μL DMSO,予以振荡直到结晶溶解为止。利用全自动酶标仪检测各孔吸光度(A)值,490 nm为其检测波长,620 nm为其参考波长。细胞存活率(%)=实验组A值/对照组A值×100%。
1.2.5细胞凋亡、周期实验 细胞凋亡:选择对数生长期接种密度70%~80% NC-shRNA组、Wip1-shRNA组细胞。 把细胞消化、收集,用预冷的4 ℃磷酸盐缓冲液(PBS)冲洗2次,以1 mL结合缓冲液将细胞重新悬浮,浓度每毫升1×106,在5 mL流式管中加入100 μL细胞悬液,每管加入10 μL碘化丙啶,并进行15 min的均匀避光。细胞周期:取处于对数生长期接种密度70%~80%NC-shRNA组、Wip1-shRNA组细胞。将细胞消化、收集,用预冷的4 ℃ PBS冲洗2次,使其浓度为每毫升1×106,在5 mL流式管中加入195 μL的细胞悬液,每管加入Annexin V-FITC 5 μL和PI 的10 μL碘化丙啶,并进行15 min的均匀避光。采用流式细胞仪上机检测。
1.2.6Transwell侵袭实验 聚碳酸脂微孔滤膜上铺Matrigel凝胶(8.4 g/L) 50 μL或无Matrigel凝胶聚碳酸脂微孔滤膜,NC-shRNA组、Wip1-shRNA组细胞均以无血清培养基制成细胞悬液(每毫升1×106个);各取50 μL 在小室进行移入,800 μL 10% DMEM完全培养基在下室加入;培养18 h后,用棉签把滤膜上室面的细胞刮除,在下室面的细胞实现侵袭并黏附,使用4%多聚甲醛固定,进行20 min 0.1%结晶紫的染色。每张膜中央部分和周围部分各随机取5个视野,计数每个视野内的穿过8 μm微孔的细胞数。肿瘤细胞的侵袭能力用每个视野的平均数表示。
1.2.7p53dsRNA沉默效应的鉴定 在 p53dsRNA 中筛选出能够沉默基因且效应最强的一个siRNA序列用于之后共转染的实验。将p53dsRNA稀释后与 Lipofectamine2000试剂混合,形成siRNA/Lipofectamine2000复合物,再将转染复合物加入到乳腺癌MCF-7细胞与Opi-MEM培养液的培养板中,siRNA浓度为50 nmol,总体积为2 mL。6 h后换含10% 胎牛血清的RPMI 1640 培养液继续培养,48 h后提取总RNA,行qRT-PCR 观察p53沉默效应。
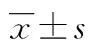
2 结 果
2.1慢病毒感染筛选稳定表达细胞株及其对细胞Wip1 mRNA和蛋白的表达影响 转染48 h后,Wip1-shRNA组细胞转染率都在85%以上,荧光较强;NC-shRNA组细胞转染率只有20%左右,荧光较弱,见图1。Wip1-shRNA组细胞Wip1 mRNA和蛋白表达分别为0.291±0.025、0.203±0.021与NC-shRNA组0.954±0.090、 0.963±0.092比较,差异有统计学意义(Plt;0.05)。
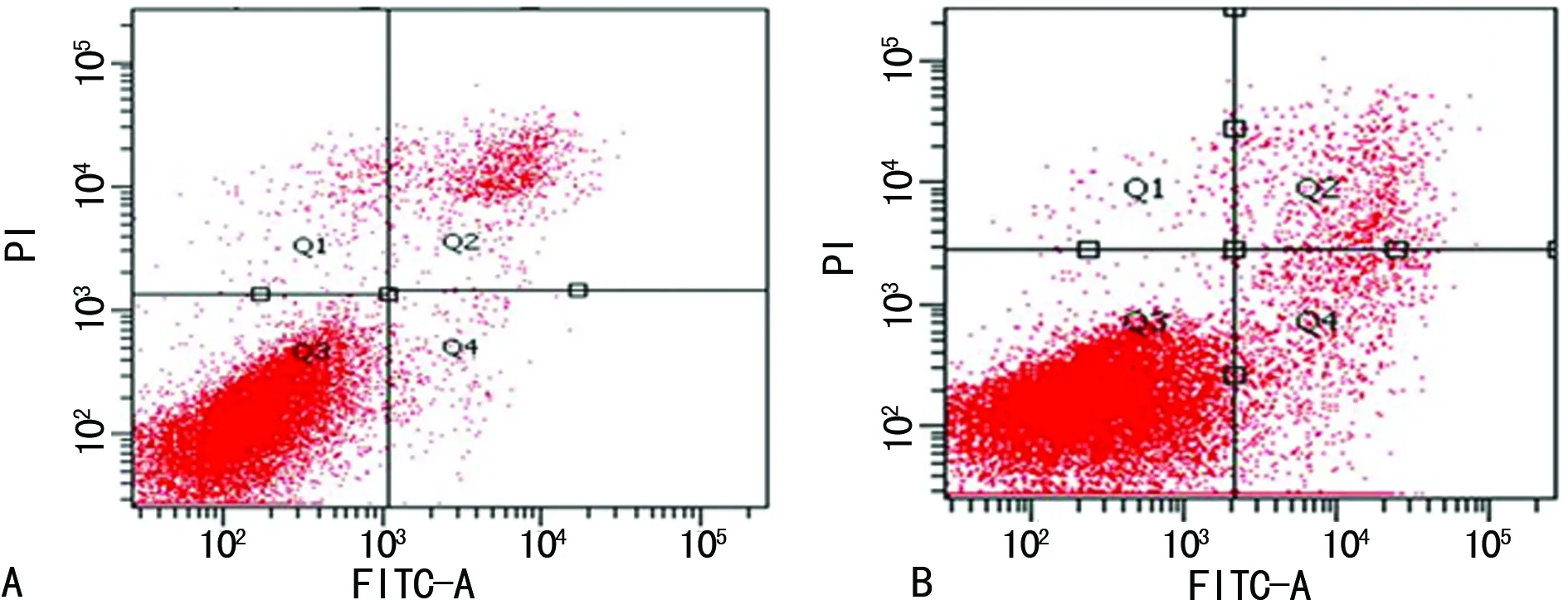
2.2Wip1-shRNA对乳腺癌MCF-7细胞增殖、凋亡、周期、侵袭转移的影响 两组各时间点细胞存活率比较,差异有统计学意义(Plt;0.05),见图2。NC-shRNA组早期与晚期细胞的凋亡数为(5.4±0.6)%,Wip1-shRNA组为(17.6±0.9)%,差异有统计学意义(Plt;0.05),见图3。NC-shRNA组细胞G0+G1期、S期细胞数分别为53.5±3.6、27.3±1.5,Wip1-shRNA组分别为72.3±5.2、14.6±0.8,差异有统计学意义(Plt;0.05),见图4。Transwell侵袭结果表明,NC-shRNA组细胞的穿膜数为106.0±11.0,Wip1-shRNA组为49.0±6.0,差异有统计学意义(Plt;0.05);Transwell转移结果表明,NC-shRNA组细胞的穿膜数为96.0±9.0,Wip1-shRNA组为42.0±4.01,差异有统计学意义(Plt;0.05),见图5。

A:NC-shRNA组;B:Wip1-shRNA组
图1两组转染情况(荧光×100)

图2 Wip1-shRNA对乳腺癌MCF-7细胞存活率的影响
A:NC-shRNA组;B:Wip1-shRNA组
图3流式细胞术检测乳腺癌MCF-7细胞凋亡情况
A:NC-shRNA组;B:Wip1-shRNA组
图4流式细胞术检测乳腺癌MCF-7细胞周期情况
2.3Wip1-shRNA对乳腺癌MCF-7细胞p53蛋白的表达影响 NC-shRNA组细胞中p53蛋白表达的相对表达量为0.765±0.067,Wip1-shRNA组为0.315±0.033,差异有统计学意义(Plt;0.05)。见图6。
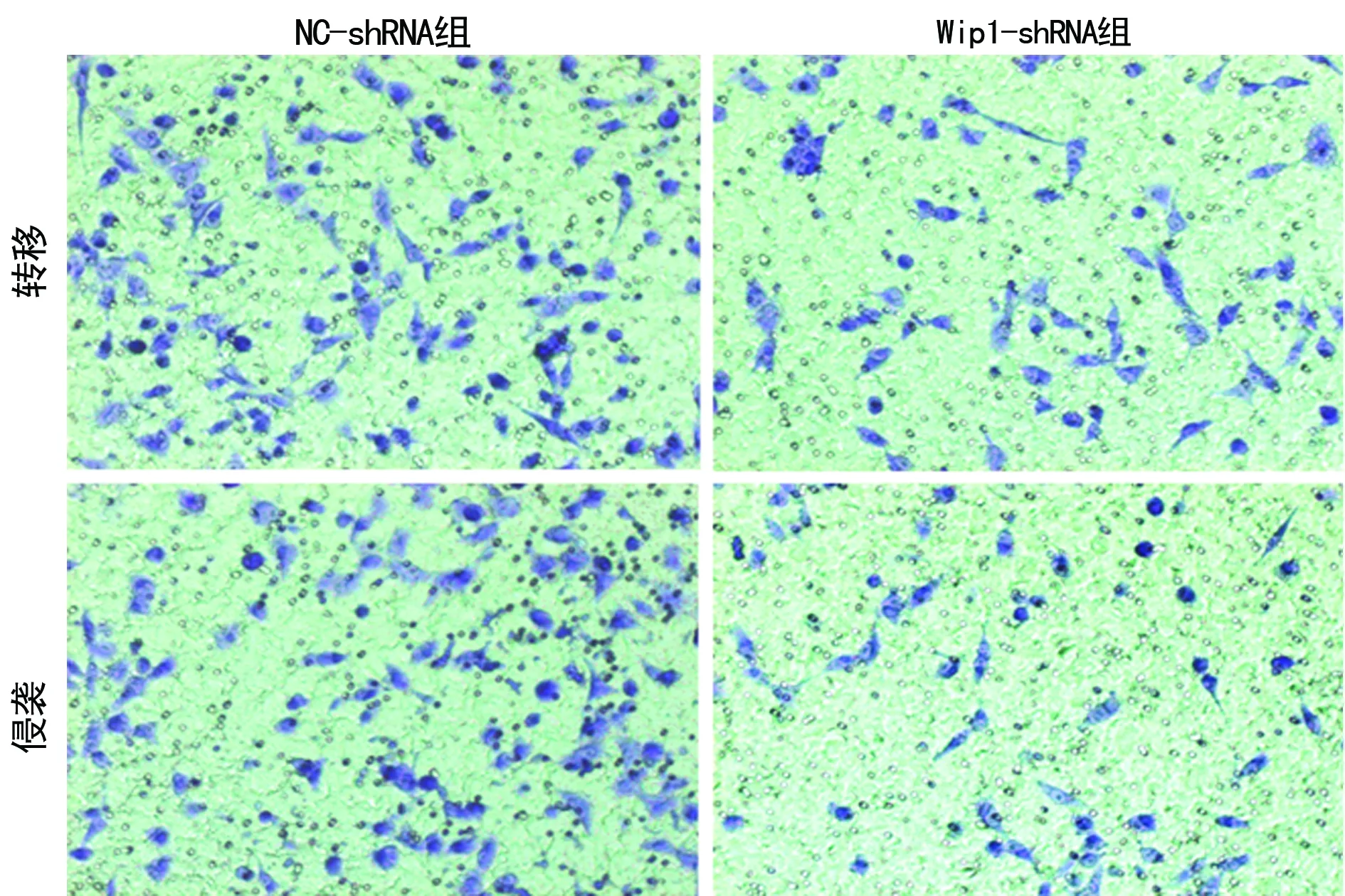
图5 Transwell检测乳腺癌MCF-7细胞侵袭转移情况(×100)

图6 Western blot检测乳腺癌MCF-7细胞 p53蛋白的表达

图7 p53dsRNA对乳腺癌MCF-7细胞侵袭转移的影响(×200)
2.4p53dsRNA对乳腺癌MCF-7细胞p53mRNA表达及侵袭转移的影响 对照组、p53dsRNA组细胞p53 mRNA的相对表达量分别为0.663±0.047、0.190±0.013,差异有统计学意义(Plt;0.05);对照组细胞侵袭转移的穿膜数分别为135.0±14.0、104.0±9.0,p53dsRNA组分别为155.0±16.0、108.0±7.0,差异有统计学意义(Plt;0.05)。见图7。
3 讨 论
Wip1与Wild-type-53密切相关,受到Wild-p53的诱导,参与到DNA的损伤修复过程中,并发挥重要的作用[1]。Wip1在人类卵巢癌、乳腺癌、髓母细胞瘤和神经母细胞瘤中都有较高的表达水平[2]。主要定位于17号染色体,参与肿瘤细胞增殖、分化、抗凋亡等过程。对于Wip1来说,它能够实现抑癌基因的抑制,导致癌症的发生,并和多种原癌基因具有协同作用[3]。有研究显示,Wip1能够脱磷酸化H2AX并使检测点修复得到促进,加大肿瘤细胞的增殖速度[4]。除此之外,从某种程度来说肿瘤发生、发展受到Wip1同NF-κB、BRCA1-IRIS[5]基因相互作用,并且在各种肿瘤中Wip1的高表达,对p53起负回馈调控作用可以通过p38MAPK/p53信号通路来实现[6],同时具备诱导p53突变等特点[7]。以Wip1为靶点的基因治疗研究开始列入人们的计划,利用RNA基因干扰技术沉默髓母细胞瘤D283细胞实现Wip1的高表达,增高了p53的表达水平,使肿瘤细胞凋亡得到诱导[2]。对于其介导的基因来说,其表达作用具备持续且稳定的特点,在宿主细胞基因组中目的基因能实现整合,同时它的分裂随细胞基因组的分裂同时进行[8]。
对于慢病毒来说,它属于逆转录病毒科亚科的一种,属于RNA病毒的范畴,逆转录病毒的特性明显,基因组在经逆转录后可以在宿主DNA上整合,其增殖随宿主细胞的增殖而进行,另外具备使非分裂细胞感染、转移基因片段容量大、持续性强目的基因表达、宿主免疫反应不易诱发等优点[9]。目前,在真核系统基因转移慢病毒载体方面,它作为工具已经备受青睐[9]。跟传统的逆转录病毒载体相比,慢性病毒载体具有整合基因不发生重排及高感染率等优点[1],另外其高效转录、宿主范围广、高效表达及高效整合的特点也值得关注。它不仅可以对分裂和非分裂细胞感染,同时对于静止细胞还能够实现感染[10]。在进行改构之后,寄主细胞的死亡或者在宿主内增殖的情况都不会出现,细胞在感染和转化后可以实现传代增殖[11]。因此利用慢病毒作载体,将动物细胞的基因型改变,并遗传到子代,成为生物领域干预基因实验的重要方法[12]。
本研究显示,慢病毒载体可以对Wip1 mRNA、蛋白的表达起到有效地抑制,同时可以使细胞周期的变化得到明显改变,细胞生长也会因此受到抑制。且p53dsRNA对MCF-7细胞p53 mRNA表达及侵袭转移也能产生影响。相关研究显示:对于Wip1 shRNA慢病毒载体来说,它对于MCF-7细胞内Wip1的表达水平可以做到有效沉默,同时也会抑制乳腺癌细胞恶性增殖的特性[13]。有研究显示,Wip1的基因沉默明显抑制了乳腺癌细胞的迁移及侵袭能力,进一步为Wip1在乳腺癌组织中表达规律及其是否参与乳腺癌的发生、发展均有积极的指导作用,为肿瘤新的靶向治疗提供了理论依据。Parssinen等[11]研究中曾有相关报道。
Wip1 shRNA慢病毒载体可以做到有效沉默,同时在抑制细胞恶性增殖方面效果明显。在恶性肿瘤的研究中,Wip1 RNA干预技术是乳腺癌靶向治疗的新技术,是肿瘤治疗方面研究的重点。
[1]Rossi M,Demidov ON,Anderson CW,et al.Induction of PPM1D following DNA-damaging treatments through a conserved p53 response element coincides with a shift in the use of transcription initiation sites[J].Nucleic Acids Res,2008,36(22):7168-7180.
[2]Moon SH,Lin L,Zhang X,et al.Wild-type p53 induced phosphatase1 dephosphorylates histone variant gamma-H2AX and suppresses DNA double strand break repair[J].J Biol Chem,2010,285(17):12935-12947.
[3]Yu E,Ahn YS,Jang SJ,et al.Overexpression of the Wip1 gene abrogates the p38 MAPK/p53/Wip1 pathway and silences p16 expression in human breast cancers[J].Breast Cancer Res Treat,2007,101(3):269-278.
[4]Castellino RC,De Bortoli M,Lu X,et al.Medulloblastomas overexpress the p53-inactivating oncogene WIP1/PPM1D[J].J Neurooncol,2008,86(3):245-256.
[5]Lu X,Nguyen TA,Moon SH,et al.The type 2C phosphatase Wip1:an oncogenic regulator of tumor suppressor and DNA damage response pathways[J].Cancer Metastasis Rev,2008,27(2):123-135.
[6]Cha H,Lowe JM,Li H,et al.Wip1 directly dephosphorylates gamma-H2AX and attenuates the DNA damage response[J].Cancer Res,2010,70(10):4112-4122.
[7]Macurek L,Lindqvist A,Voets O,et al.Wip1 phosphatase is associated with chromatin and dephosphorylates gammaH2AX to promote checkp-oint inhibition[J].Oncogene,2010,29(15):2281-2291.
[8]Chew J,Biswas S,Shreeram S,et al.WIP1 phosphatase is a negative regulator of NF-kappaB signalling[J].Nat Cell Biol,2009,11(5):659-666.
[9]Chock K,Allison JM,Elshamy WM.BRCA1-IRIS overexpression abrogates UV-induced p38MAPK/p53 and promotes proliferation of damaged cells[J].Oncogene,2010,29(38):5274-5285.
[10]Baxter EW,Milner J.p53 regulates LIF expression in human medulloblastoma cells[J].J Neuro Oncol,2009,97(3):373-382.
[11]Parssinen J,Alarmo EL,Karhu R,et al.PPMID silencing by RNA interference inhibits Proliferation and induces apoptosis in breast cancer cell lines with wild-type P53[J].Cancer Genet Cytogenet,2008,182(1):33-39.
[12]Liu T,Xu F,Du X,et al.Establishment and characterization of multi-drug resistance prostate carcinoma-initiationg stem-like cells from human prostate cancer cell lines 22RV1[J].Mol Cell Biochem,2010,10(5):425-426.
[13]Maddalena B,Armando F,Massimo R,et al.Reducing the risk of overdiagnosis in lung cancer:A support from molecular biology[J].Cell Physiol,2011,226(9):2213-2214.
ConstructionofWip1generecombinantlentiviralexpressionvectoranditseffectsonbreastcancerMCF-7cellbiologicalbehavior*
LiZongtao1,GuXiaomei2,SunGuogui3,LiJuan2,ZhangHao2
(1.DepartmentofBreastSurgery,TangshanMunicipalWorker′sHospital,Tangshan,Hebei063000,China;2.DepartmentofGynecologyandObstetrics,TangshanMunicipalMaternalandChildHealthCareHospital,Tangshan,Hebei063000,China;3.TangshanMunicipalPeople′sHospital,Tangshan,Hebei063000,China)
ObjectiveTo construct the Wip1 gene recombinant lentiviral expression vector and to investigate its effects on breast cancer cell biological behaviors.MethodsWip1 gene short hairpin RNAs (shRNA) was transfected into breast cancer MCF-7 cells through lentiviral infection method.Wip1 mRNA and protein expressions before and after transfection were detected by using qRT-PCR and Western blotting.The effects of Wip1-shRNA on the proliferation,apoptosis,cell cycle,invasion and metastasis in MCF-7 cells were determined by using the MTT assay,flow cytometry and transwell invasion test.Interfering RNA molecule p53dsRNA inhibiting p53 gene expression (p53 dsRNA) was screened,and the effect of p53 inhibition on MCF-7 cells invasion and metastasis was analyzed.ResultsAfter transfection for 48 h,the cellular fluorescence in the Wip1-shRNA group was stronger,while which in the NC-shRNA group was weaker.Cellular Wip1 mRNA and protein expressions in the Wip1 shRNA group were 0.291±0.025 and 0.203±0.021 respectively,which in the NC-shRNA group were 0.954±0.090 and 0.963±0.092 respectively,the difference between the two groups was statistically significant(Plt;0.05).The cellular survival rate at various time points had statistical difference between the two groups(Plt;0.05).The early and late cell apoptosis number in the NC-shRNA group was less than that in the Wip1-shRNA group,the difference was statistically significant(Plt;0.05).The cells numbers at phase G0+G1and phase S in the NC-shRNA group were 53.5±3.6 and 27.3±1.5 respectively,which in the Wip-shRNA group were 72.3±5.2 and 14.6±0.8 respectively,the difference was statistically significant(Plt;0.05).The Transwell invasion and metastasis results showed that the cell transmembrane number in the NC-shRNA group was more than that in the Wip1-shRNA group(Plt;0.05).The cellular p53 mRNA and protein expression had statistical difference between the control group and p53dsRNA group(Plt;0.05).ConclusionRNA interference can effectively suppress Wip1 expression in MCF-7 cells.Wip1 may affect the proliferation,apoptosis,cell cycle,invasion and metastasis of breast cancer cells by modulating protein expression.p53dsRNA increases the invasion and metastasis ability of breast cancer MCF-7 cells by interfering p53 gene down-regulation.
Wip1;breast neoplasms;apoptosis;gene silencing
10.3969/j.issn.1671-8348.2017.33.001
2015年度河北省医学科研重点课题计划(20150953)。
李宗涛(1978-),副主任医师,博士,主要从事乳腺癌及各种乳腺良性疾病的诊断、治疗研究。
R73
A
1671-8348(2017)33-4609-04
2017-05-18
2017-07-26)

