高敏感度酶联免疫吸附测定法检测分泌蛋白MPB64对于活动性肺结核诊断的价值
赵冰 侯萍 黄静 贺文从 欧喜超 刘东鑫 赵雁林
·论著
高敏感度酶联免疫吸附测定法检测分泌蛋白
MPB64对于活动性肺结核诊断的价值
赵冰 侯萍 黄静 贺文从 欧喜超 刘东鑫 赵雁林
目的评价以结核分枝杆菌(MTB)分泌蛋白MPB64为检测抗原的高敏感度酶联免疫吸附测定法(high sensitivityenzyme-linked immunosorbent assay,HI-ELISA)用于检测痰液中MTB的价值。方法选取97份储存的疑似肺结核患者的痰标本,分别进行BACTEC MGIT 960液体培养(简称“MGIT 960培养”)、MTB/利福平耐药实时荧光定量核酸扩增检测系统(Gene Xpert MTB/RIF,简称“Xpert检测”)和HI-ELISA检测,通过与MGIT 960培养比较来评价HI-ELISA的诊断效能。结果本研究97份痰标本中,MGIT 960培养、HI-ELISA检测MTB的阳性率分别为36.08%(35/97)、32.99%(32/97);与MGIT 960培养比较,HI-ELISA的检测敏感度、特异度、总体符合率分别为88.57%(31/35)、98.39%(61/62)、94.85%(92/97)。在Xpert检测阳性的66份痰标本中,MGIT 960培养、HI-ELISA检测MTB的阳性率分别为51.51%(34/66)、48.48%(32/66);与MGIT 960培养相比,HI-ELISA 的检测敏感度、特异度、总体符合率分别为91.18%(31/34)、96.88%(31/32)、93.93%(62/66)。Xpert检测MTB为阴性的31份痰标本中,仅有1份标本的MGIT 960培养阳性而HI-ELISA未能检测到MTB,其他30份标本检测结果全部相符,符合率为96.77%(30/31)。结论HI-ELISA可以特异性检测MTB活菌,对活动性肺结核的诊断及治疗评价有很高的应用价值。
分枝杆菌,结核; 分泌蛋白,MPB64; 酶联免疫吸附测定; 敏感性与特异性; 诊断
结核病(tuberculosis, TB)是一种严重危害人类健康的呼吸道传染性疾病。据世界卫生组织报道仅2015年全球就有1040万例新发肺结核患者,180万例因肺结核死亡[1]。结核病的发病率一直呈现上升态势,已成为一个严重的全球性公共卫生问题。快速而准确地检测患者体内的结核分枝杆菌(MTB),对于结核病的防控、降低肺结核的发病率和死亡率有着重大意义。
目前,临床诊断结核病主要依靠痰涂片、抗酸染色镜检及液体培养的方法,而上述方法存在敏感度低或耗时长等缺陷,不利于结核病的快速诊断和治疗[2-4]。MTB分泌蛋白MPB64是结核分枝杆菌复合群中致病菌(结核分枝杆菌、牛分枝杆菌、非洲分枝杆菌)所分泌的特异性蛋白,能够用来区分结核分枝杆菌复合群和非结核分枝杆菌[5]。以MPB64为检测抗原的高敏感度酶联免疫吸附测定法(high sensitivityenzyme-linked immunosorbent assay,HI-ELISA)是由TAUNS公司(日本)开发,无需培养,通过酶循环反应来积累大量的被检测物质硫代烟酰胺腺嘌呤二核苷酸 (thio-nicotinamide adenine dinucleotide,Thio-NADH),最终可以高效检测结核分枝杆菌复合群,诊断结核感染,对结核病的快速诊断具有一定的意义。本研究通过对国家参比实验室储存的97份疑似肺结核患者痰标本进行BACTEC MGIT 960液体培养(简称“MGIT 960培养”)、MTB/利福平耐药实时荧光定量核酸扩增检测系统(GeneXpert MTB/RIF,简称“Xpert检测”)和HI-ELISA实验,来评价HI-ELISA方法诊断活动性肺结核的效能。
材料和方法
一、研究材料
1.标本来源:97份储存痰标本来自2015年4月在首都医科大学附属北京胸科医院就诊的部分疑似肺结核患者,且所有患者均签署知情同意书。
2. 试剂:用于痰液处理的NaOH和枸橼酸钠均购自国药集团化学试剂有限公司,N-乙酸-L-半胱氨酸(N-acetyl L-cysteine,NALC)购自美国Sigma公司;Xpert检测试剂盒购自美国Cepheid公司;HI-ELISA试剂盒由日本TAUNS公司赠送。
3.引物:用于菌种鉴定的正向引物5′-GGCCTAACCCTCGGGAGGGAG-3′和反向引物5′-CCCGAGGCATATCGCAGCCTC-3′由北京擎科生物科技公司合成。
二、研究方法
将储存的所有痰标本在室温下放置至充分融化后取3 ml痰标本,然后平均分为3份,进行以下3种检测。
1. MGIT 960培养检测:MGIT 960培养操作按《结核病诊断实验室检验规程》[6]进行。将标本经过NALC-4%NaOH处理后,静置15 min,然后加入0.067 mol/L pH 6.8的磷酸盐缓冲液(PBS)行3000×g低温离心15 min,弃上清。最后将所得菌悬液加入到BACTEC MGIT 960培养管中进行培养,孵育42 d,实时监测并读取结果。
2. Xpert检测:具体实验操作按照《现代结核病诊断技术》[7]进行。将Xpert试剂盒配套的处理液加入含有标本的离心管中,震荡后静置15 min,将处理后样品由加样孔缓慢加入到反应盒内。然后上机,反应2 h后读取结果。
3.HI-ELISA检测:具体实验操作按照HI-ELISA试剂盒说明书进行,检测实验的操作程序见图1。
4.菌种鉴定:采用16S~23S rDNA间隔区序列分析来鉴定菌株是否为MTB[8]。将MGIT 960培养阳性的菌株离心收集,100 ℃加热20 min后提取DNA,以提取的细菌DNA作为模板,按照如下配制50 μl反应体系:5 μl 10×PCR缓冲液、200 μmol dNTP、上下游引物(0.2 μmol)各1 μl,1 U HotStarTaq DNA聚合酶(Qiagen),适量模板DNA,去离子水补齐反应体系。将配置好的体系置于PCR仪,扩增条件:94 ℃预变性5 min;94 ℃变性1 min,58 ℃复性1 min,72 ℃延伸2 min,35个循环;最后72 ℃延伸10 min。扩增产物送上海生工生物技术有限公司测序,测序结果与美国国立生物技术信息中心(NCBI)中的序列进行比对,进行菌种鉴定。
三、结果判定
1. MGIT 960培养结果判定:判断标准参考《结核病实验室检验规程》[9]。根据仪器报告结果及菌种鉴定结果来判定。当仪器报告有阳性结果并且菌种鉴定为MTB,则该标本为阳性。当第42 天培养结果仪器报告培养管为阴性结果或报告为阳性结果而菌种鉴定不是MTB时,则该份标本为阴性。

图1 HI-ELISA操作程序
2. Xpert检测结果判定:判断标准参照Xpert MTB/RIF试剂盒说明书[10]。根据仪器报告结果,当结果显示为MTB检出(检出量高、中、低、极低均视为检出),则认为该份标本为阳性;当结果显示为MTB未检出,则该份标本为阴性。
3. HI-ELISA结果判定:判断标准参照HI-ELISA试剂盒说明书。与空白对照相比,待测样本与空白对照吸光度的差≥0.05A(吸光度值),即为阳性,否则为阴性。
四、统计学分析
采用SPSS 18.0软件对结果数据进行统计学处理,采用四格表的形式计算敏感度、特异度和符合率。经配对卡方检验(McNemar test),比较HI-ELISA与MGIT 960培养(金标准)MTB阳性检出率差异。采用Excel 2010绘制Venn Diagram(韦恩图)。敏感度=真阳性数/(真阳性数+假阴性数)×100%;特异度=真阴性数/(真阴性数+假阳性数)×100%;阳性预测值=真阳性数/(真阳性数+假阳性数)×100%;阴性预测值=真阴性数/(真阴性数+假阴性数)×100%;阳性似然比=敏感度/(1-特异度);阴性似然比=(1-敏感度)/特异度;符合率=(真阳性数+真阴性数)/所有检测患者例数。
结 果
1.MGIT 960培养及菌种鉴定:97份痰标本经MGIT 960培养,有36份(37.11%)标本阳性,将培养阳性菌株提取核酸后进行16S~23S rDNA间隔区序列分析;除1株为非结核分枝杆菌(NTM)外,其余35株为MTB,阳性检出率为36.08%(35/97)。
2.HI-ELISA的检测结果:97份痰标本经HI-ELISA 检测,有32份标本为阳性,阳性率为32.99%(32/97),65份标本为阴性。HI-ELISA和MGIT 960培养(金标准)检测MTB的阳性检出率差异无统计学意义(χ2=0.80,P=0.375)。与MGIT 960培养结果相比,HI-ELISA的敏感度为88.57%(31/35),特异度为98.39%(61/62),符合率达94.85%(92/97)(表1)。
3.Xpert检测结果:经Xpert检测,97份标本中有66份标本MTB检测结果为阳性,根据Xpert结果,检出含有MTB的痰标本66份,但仅有34份标本培养阳性,阳性检出率为51.51%(34/66)。在66份阳性标本中,经HI-ELISA检测有32份阳性,阳性检出率为48.48%(32/66),HI-ELISA和MGIT 960培养(金标准)检测MTB的阳性检出率差异未见统计学意义(χ2=0.25,P=0.625);与MGIT 960培养相比较,HI-ELISA的敏感度是91.18%(31/34),特异度是96.88%(31/32),符合率达到93.93%(62/66)(表2)。Xpert未检出MTB的31份标本中,仅有1份标本MGIT 960培养阳性而HI-ELISA未能检出MTB,其他30份标本检测结果全部相符,符合率高达96.77%(30/31)(表3)。在GeneXpert检测阴性的31份痰标本中,由于四格表2项结果为0,敏感度、特异度结果不可信。
4.Xpert和HI-ELISA检测结果均为阳性的31例样本的检测情况:韦恩图比较直观地显示出Xpert和HI-ELISA共同检测的31例阳性样本中,MGIT 960培养也是阳性,详见图2。
讨 论
自1976年Naussau建立了以ELISA方法检测结核病患者血清中抗结核分枝杆菌抗体的方法以来[11],ELISA方法在诊断结核病方面得到了越来越多的应用,但是目前诸如结核分枝杆菌抗体快速免疫色谱检测法(rapid immunochromatographic assay of TB,ICT-TB),以及常规ELISA等方法大多是血清学检测,不能直接检测痰液中MTB抗原,且敏感度

表1 HI-ELISA检测97份痰标本的结果
注敏感度=真阳性数/(真阳性数+假阴性数)×100%,即a/(a+c)×100%;特异度=真阴性数/(真阴性数+假阳性数)×100%,即d/(b+d)×100%;符合率=(真阳性数+真阴性数)/(真阳性数+真阴性数+假阳性数+假阴性数),即(a+d)/(a+b+c+d);阳性预测值=真阳性数/(真阳性数+假阳性数)×100%,即a/(a+b)×100%;阴性预测值=真阴性数/(真阴性数+假阴性数)×100%,即d/(c+d)×100%;阳性似然比=敏感度/(1-特异度);阴性似然比=(1-敏感度)/特异度

表2 66例Xpert检测阳性标本的HI-ELISA与MGIT 960培养的检测结果
注敏感度=真阳性数/(真阳性数+假阴性数)×100%,即a/(a+c)×100%;特异度=真阴性数/(真阴性数+假阳性数)×100%,即d/(b+d)×100%;符合率=(真阳性数+真阴性数)/(真阳性数+真阴性数+假阳性数+假阴性数),即(a+d)/(a+b+c+d);阳性预测值=真阳性数/(真阳性数+假阳性数)×100%,即a/(a+b)×100%;阴性预测值=真阴性数/(真阴性数+假阴性数)×100%,即d/(c+d)×100%;阳性似然比=敏感度/(1-特异度);阴性似然比=(1-敏感度)/特异度和特异度均不理想[12],在临床检测中存在一定的局限性。贾文青和刘莹[13]以及张梅等[14]研究表明,在免疫力低下且并发结核性胸膜炎的患者中结核感染T细胞斑点试验(T-SPOT.TB)检测的敏感度只有79.63%;李伟霞等[15]研究表明,MTB抗体快速免疫色谱检测法和常规ELISA检测法的敏感度分别为51.14%和70.45%,由此可见血清学检测方法的敏感度较低。
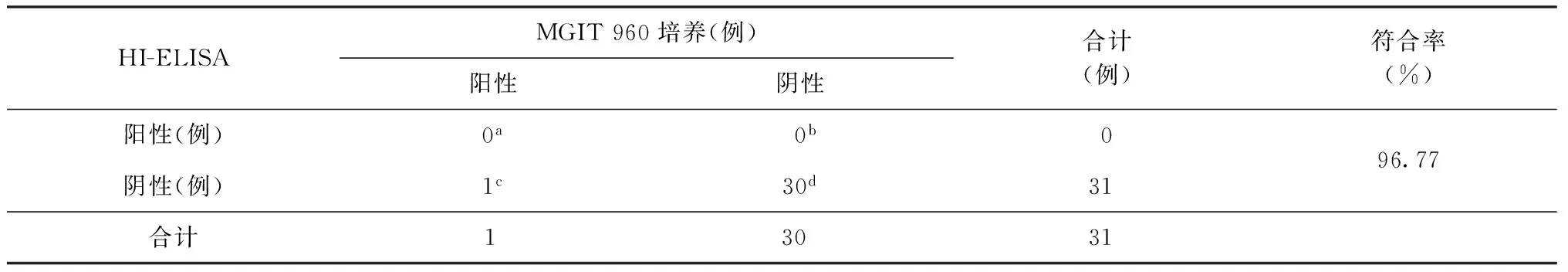
表3 HI-ELISA检测与MGIT 960培养在Xpert检测阴性结果标本中的符合情况
注符合率=(真阳性数+真阴性数)/(真阳性数+真阴性数+假阳性数+假阴性数)×100%,即 (a+d)/(a+b+c+d)×100%

31a表示67份标本中,有31份标本仅Gene Xpert检测结果为阳性,而HI-ELISA与MGIT 960培养检测结果为阴性;1b表示有1份标本GeneXpert和HI-ELISA检测结果为阳性,MGIT 960培养检测结果为阴性;3c表示3份标本GeneXpert和MGIT 960培养检测结果为阳性,而HI-ELISA检测结果为阴性;31d表示31份标本以上3种检测方法检测结果均为阳性;0e表示GeneXpert或MGIT 960培养结果为阳性的标本,其HI-ELISA检测结果也为阳性;0f表示HI-ELISA或MGIT 960培养检测结果为阳性的标本,其GeneXpert检测结果也为阳性;1g表示仅1份标本MGIT 960培养检测结果为阳性,而GeneXpert和HI-ELISA检测的结果为阴性图2 3种检测方法检测结果的韦恩图
MPB64是MTB早期分泌蛋白的主要成分,由Rv1980c基因编码,含有228个氨基酸,是结核分枝杆菌复合群中结核分枝杆菌、牛分枝杆菌和非洲分枝杆菌特有的分泌蛋白[16-17]。本研究中采用TAUNS公司自主研发的高敏感度ELISA试剂盒,以检测疑似肺结核患者痰液中MTB分泌的MPB64蛋白为基础,无需培养,通过高敏感度的酶循环显色试剂进行显色反应,根据反应孔中吸光度值来判断标本中是否存在活的MTB,从而达到快速诊断活动性肺结核的目的。但因HI-ELISA为新研制用于快速诊断结核的试剂盒,并没有对其进行相应研究和评估的相关文献可供参考。本研究结果显示,与MGIT 960培养相比较,HI-ELISA操作简单、耗时短,对MTB的检出率差异未见统计学意义(P=0.375),且检测MTB的敏感度为88.57%(31/35),特异度为98.39%(61/62),与MGIT 960培养的总体符合率为94.85%(92/97),说明HI-ELISA具有快速准确诊断结核病的效能;且敏感度明显高于痰涂片(20%~60%)[18],分析原因一方面可能与痰涂片抗酸染色镜检原理和MTB排出规律有关:一般来说,痰液中至少含有5000个细菌/ml才得出阳性结果,同时MTB属于间歇性排菌,从而导致痰涂片检测的敏感度低[19];另一方面可能受周围环境和操作人员水平的影响,导致痰涂片检测的敏感度明显低于HI-ELISA。
Xpert检测是世界卫生组织推荐的MTB的分子学检测方法。有大量研究表明,Xpert检测可以非常准确地高敏感度地检测出标本中是否存在MTB[20],但Xpert检测技术仅能检测MTB的DNA,不能区分样本中所含MTB是死菌还是活菌。本研究引入Xpert检测方法的主要目的是根据Xpert检测及液体培养结果将样本分为死菌(Xpert检测阳性,培养阴性结果)和活菌(Xpert检测阳性,培养阳性结果)两类,然后采用HI-ELISA检测两类样本,检测结果与MGIT 960培养结果比较,意在说明HI-ELISA不仅对于不含MTB的样本呈现阴性结果,对于含有MTB但为死菌的样本也会呈现阴性结果,充分体现了HI-ELISA只可以检测活的MTB的优势。本研究Xpert检测出66份痰标本为阳性,可认为这66份标本都含有MTB,但仅有34份标本的MGIT 960培养结果为阳性,提示34份标本含有可培养的活菌。32份标本培养阴性的原因可能一是样本中含有死菌或者培养管中的一些物质抑制了细菌的生长,但本研究由于所用的BACTEC MGIT 960液体培养管为同一批次,保证了样本处理和培养条件完全相同,且观察时间均定为42 d,即使细菌代谢缓慢也足以达到可检测的水平,可排除抑菌物质的影响;其二是Xpert检测的下限为131菌落形成单位(CFU)/ml,而MGIT 960培养的检测下限为10~100 CFU/ml,理论上如果Xpert检测结果为阳性,则液体培养的检测结果也必为阳性,由此判定32份阴性标本中MTB为死菌。在这66份标本中HI-ELSIA检测结果与MGIT 960培养相比,敏感度、特异度、符合率分别为91.18%(31/34)、96.88%(31/32)、93.93%(62/66),说明HI-ELISA可以有效地区分MTB是死菌还是活菌,可有效评价患者的治疗效果。此外有1份痰标本MGIT 960培养阳性但菌种鉴定结果为非结核分枝杆菌,经HI-ELISA检测结果为阴性;由于本研究中仅分离到1株非结核分枝杆菌菌株,对于确定HI-ELISA检测是否可以区分非结核分枝杆菌还是MTB,以及是否对非结核分枝杆菌具有诊断效果,还需要更大量含有非结核分枝杆菌的样本来验证。
总之,基于检测分泌型蛋白MPB64和酶循环反应的HI-ELISA是一种敏感度能够与MGIT 960培养法相媲美的快速诊断活动性肺结核的方法,将HI-ELISA应用于肺结核的临床检测,不仅可以对活动性肺结核的诊断有帮助,更对肺结核治疗方法及其疗效的评价有着重要意义。
[1] World Health Organization. Global tuberculosis report 2016. Geneva:World Health Organization,2016.
[2] Gelaw B, Shiferaw Y, Alemayehu M, et al. Comparison of loop-mediated isothermal amplification assay and smear microscopy with culture for the diagnostic accuracy of tuberculosis. BMC Infect Dis,2017,17(1):79.
[3] Chandra TJ, Selvaraj R, Sharma YV. Same day sputum smear microscopy for the diagnosis of pulmonary tuberculosis: Ziehl-Neelsen versus fluorescent staining.J Family Med Prim Care,2015, 4(4):525-528.
[4] Rochefort C, Behr MA. Assessment of microbiological diagnosis of active pulmonary tuberculosis: culture on liquid medium with or without solid medium. J Clin Microbiol,2016,54(12):3064.
[5] Simar J, Belkhir L, Tombal B, et al. Ruptured aortic aneurysm due toMycobacteriumbovisBCG with a delayed bacteriological diagnosis due to false negative result of the MPB 64 immunochromatographic assay. BMC Res Notes, 2017, 10(1):64.
[6] 赵雁林, 刘志敏.结核病诊断实验室检验规程. 北京: 中国教育文化出版社,2005.
[7] 张贺秋, 赵雁林.现代结核病诊断技术. 北京:人民卫生出版社,2013.
[8] Ou X, Song Y, Zhao B, et al. A multicenter study of cross-priming amplification for tuberculosis diagnosis at peripheral level in China. Tuberculosis(Edinb),2014, 94(4):428-433.
[9] 赵雁林, 逄宇.结核病实验室检验规程. 北京: 人民卫生出版社, 2015.
[10] Blakemore R, Story E, Helb D, et al.Evaluation of the analytical performance of the Xpert MTB/RIF assay. J Clin Microbiol,2010,48(7):2495-2501.
[11] Nassau E, Parsons ER, Johnson GD.The detection of antibo-dies toMycobacteriumtuberculosisby microplate enzyme-linked immunosorbent assay (ELISA). Tubercle, 1976, 57(1):67-70.
[12] 孟苏凯, 吴振萍, 张玉华,等. 血清结核抗体检测在结核病临床诊断中的价值. 中国卫生检验杂志, 2015, 25(22):3858-3860.
[13] 贾文青, 刘莹.T-SPOT.TB对免疫低下合并结核性胸膜炎患者的诊断价值. 实用医学杂志, 2016,32(18):3023-3026.
[14] 张梅.痰涂片和TB-DNA及血清抗PPD-IgG在肺结核感染诊断中的联合应用. 国际检验医学杂志,2016,37(4):504-505.
[15] 李伟霞, 刘金伟, 匡铁吉, 等.三种血清学方法检测抗结核抗体对肺结核诊断价值的评估. 临床肺科杂志,1998,3(5):15-16.
[16] Roche PW, Feng CG, Britton WJ. Human T-cell epitopes on theMycobacteriumtuberculosissecreted protein MPT64. Scand J Immunol,1996, 43(6):662-670.
[17] Abe C, Hirano K, Tomiyama T. Simple and rapid identification of theMycobacteriumtuberculosiscomplex by immunochromatographic assay using anti-MPB64 monoclonal antibodies. J Clin Microbiol, 1999, 37(11):3693-3697.
[18] 郑志远.实时荧光定量PCR检测TB-DNA与痰涂片在肺结核诊断中的比较研究. 首都食品与医药, 2015,(8月下半刊):122-124.
[19] 马维兰, 王发秀.结核抗体与痰涂片检验对活动性肺结核的诊断价值. 中外医学研究, 2017, 15(21):58-59.
[20] Kim CH, Hyun IG, Hwang YI, et al. Identification ofMycobacteriumtuberculosisand rifampin resistance in clinical specimens using the Xpert MTB/RIF assay. Ann Clin Lab Sci,2015, 45(1):32-38.
2017-08-02)
(本文编辑:孟莉 薛爱华)
Diagnosticvalueofhigh-sensitivityELISAinactivetuberculosisthroughdetectingthesecretionproteinMPB64
ZHAOBing*,HOUPing,HUANGJing,HEWen-cong,OUXi-chao,LIUDong-xin,ZHAOYan-lin.
*NationalTuberculosisReferenceLaboratory,ChineseCenterforDiseaseControlandPrevention,Beijing102206,China
ZHAOYan-lin,Email:zhaoyanlin@chinatb.org
ObjectiveThe aim of this study was to evaluate the value of high-sensitivity-ELISA test (HI-ELISA) in detectingMycobacteriumtuberculosis(MTB) in sputum, which is based on detecting the secretory protein MPB64.MethodsNinety-seven stored sputum specimens from suspected tuberculosis patients were subjected to cultivation in BACTEC MGIT 960 tubes, Xpert MTB/RIF test and HI-ELISA test, respectively, the results of HI-ELISA test and 960-liquid-culture test were compared to evaluate the diagnostic efficacy of HI-ELISA method.ResultsAmong the 97 sputum specimens collected in this study, the positive rates of detecting MTB of 960-liquid-culture method and HI-ELISA method were 36.08% (35/97) and 32.99% (32/97) respectively. When compared with liquid-culture, the sensitivity of HI-ELISA was 88.57% (31/35), the specificity of HI-ELISA was 98.39% (61/62) and the overall coincidence rate was 94.85% (92/97). Of the 66 positives putum specimens using Xpert MTB/RIF, the positive rate of 960-liquid-culture method and HI-ELISA method in detecting MTB were 51.51% (34/66) and 48.48% (32/66), respectively; furthermore, compared with 960-liquid-culture,the sensitivity of HI-ELISA was 91.18% (31/34), the specificity was 96.88% (31/32) and the coincidence rate was 93.93% (62/66). Among the 31 negative sample stested by Xpert MTB/RIF, MTB was detected in only one sample by 960-liquid-culture method but HI-ELISA method failed to detect it, however, in the other 30 sputum samples, the results of HI-ELISA method were entirely consistent with the results of 960-liquid-culture method and the coincidence rate was 96.77% (30/31).ConclusionHI-ELISA assay was able to detecting viable MTB with high sensitivity and specificity, it was of high evaluate in diagnosis and treatment of active tuberculosis.
Mycobacteriumtuberculosis; Secretory protein, MPB64; Enzyme-linked immunosorbentassay; Sensitivity and specificity; Diagnosis
10.3969/j.issn.1000-6621.2017.12.010
国家科技重大专项(2014ZX10003002)
102206 北京,中国疾病预防控制中心国家结核病参比实验室(赵冰、欧喜超、赵雁林);哈尔滨市结核病防治所检验科(侯萍);新疆生产建设兵团第八师152团医院(黄静);中国疾病预防控制中心传染病预防控制所结核室(贺文从、刘东鑫)
赵雁林,Email:zhaoyanlin@chinatb.org
注:赵冰和侯萍对本研究具有同等贡献,为并列第一作者

