干酪乳杆菌SY13在BALB/c小鼠肠道粘附属性研究
贾子阳,马长路,贾震虎,逄晓阳,孙剑锋,*,吕加平,*
(1.河北农业大学食品科技学院,河北保定071001;2.北京农业职业学院,北京102442;3.中国农业科学院农产品加工研究所,北京100193)
干酪乳杆菌SY13在BALB/c小鼠肠道粘附属性研究
贾子阳1,马长路2,3,贾震虎3,逄晓阳3,孙剑锋1,*,吕加平3,*
(1.河北农业大学食品科技学院,河北保定071001;2.北京农业职业学院,北京102442;3.中国农业科学院农产品加工研究所,北京100193)
干酪乳杆菌具有良好的益生功能,在乳制品研究与开发中广泛应用。利用荧光定量PCR测定外源性干酪乳杆菌SY13在BALB/c小鼠肠道内的分布及其在肠道内的保留时间。并从灌胃时间和益生元作用两个方面评价了对粘附能力的影响。结果表明:灌胃的干酪乳杆菌SY13多分布于宿主的盲肠和结肠中;灌胃时间和益生元均对干酪乳杆菌SY13在小鼠肠道内的粘附属性有影响。为干酪乳杆菌SY13在功能性食品的研究与开发中提供部分的理论依据。
干酪乳杆菌SY13;BALB/c小鼠;灌胃时间;益生元;粘附
干酪乳杆菌属于益生菌的一种。能够耐受人体口腔中的酶,低pH值的胃液,小肠中碱性肠液和胆盐,进而在人体肠道内定植,发挥良好的益生功能[1-4]。干酪乳杆菌在制作功能性酸乳[5],发酵豆乳[6-7],干酪[8]和功能性乳酸菌饮料[9]当中广泛应用。由于干酪乳杆菌优良的发酵风味和良好的功能性,其在食品研究与开发中占有重要地位。
益生元是一种膳食补充剂,通过选择性的刺激一种或少数种菌落中的细菌的生长与活性而对寄主产生有益的影响从而改善寄主健康的不可被消化的食品成分。研究表明益生元还具有促进神经树突发育,减少焦虑,刺激免疫,影响矿质代谢,提高食物消化率,抗氧化,对抗肿瘤等作用[10-17]。益生元不但在营养方面表现出众,而且价格相对较低,在功能性食品当中广泛应用。
干酪乳杆菌SY13分离自传统乳制品。经研究表明,干酪乳杆菌SY13具有良好的抗氧化功能。益生菌的粘附能力是益生菌功能性评价的一个重要方面。益生菌在人体肠道粘附定植是其进一步发挥益生功能的前提。本研究筛选出了2种有益于干酪乳杆菌SY13生长的益生元。并对有无益生元干预下BALB/c小鼠空肠、回肠、盲肠和结肠进行了干酪乳杆菌SY13的检测。对比分析了益生元对干酪乳杆菌SY13在BALB/c小鼠肠道粘附能力的影响。为干酪乳杆菌SY13在功能性食品的开发提供部分的理论支持。
1 材料与方法
1.1 仪器与试剂
多功能酶标仪(SPARK2M):瑞士帝肯商贸有限公司;荧光定量PCR仪(ABI 7500):美国应用生物系统中国公司;超纯水:美国Millipore Milli-Q超纯水系统;TaqMan®Universal PCR Master Mix(4304437):美国应用生物系统中国公司;粪便基因组DNA提取试剂盒(DP328):天根生化科技有限公司。标准质粒pMD19-T-CS:由中国农业科学院农产品加工所吕加平课题组实验室合成。上游引物引物,06232F:TCAACCGTGACTGGCAAGT;下游引物,06232R:AGCGGCTTGTCGAACTGA;探针,06232P:FAM-CTCAAAAATGGATCTTG-MGB。
1.2 试验菌种与动物
干酪乳杆菌SY13:由中国农业科学院吕加平课题组分离自传统乳制品;MRS培养基37℃静置培养;大肠杆菌DH5α:天根生化科技有限公司;LB培养基(1%胰蛋白胨,0.5%酵母浸粉,1%NaCl,pH7.4),200 μg/mL氨苄青霉素,37℃200 r/min摇床培养;BALB/c小鼠(SPF,维通利华),饲养于中国农业大学实验动物管理平台。
1.3 试验方法
1.3.1 益生元筛选
以MRS培养基(蛋白胨1%,牛肉粉1%,酵母粉0.5%,葡萄糖2%,硫酸镁0.01%,醋酸钠0.5%,柠檬酸氨0.02%,磷酸氢二钾0.02%,硫酸锰0.005%,吐温80 0.1%)为基础,用乳果糖、棉籽糖、低聚甘露糖、新琼寡糖、低聚龙胆糖、大豆多糖、枸杞多糖、黄芪多糖、香菇多糖、低聚果糖、低聚半乳糖、低聚异麦芽糖、β葡聚糖和水苏糖分别替换葡萄糖,作为碳源,配制相应的筛选培养基。将干酪乳杆菌以1%的接种量分别接种于MRS和不同的筛选培养基中,取800 μL于24孔板中,进行干酪乳杆菌SY13培养。以相应空白培养基为对照,多功能酶标仪测定OD600,绘制生长曲线。多功能酶标仪试验条件:温度37℃;OD600测定,静置培养58 min,200 r/min震荡培养2 min,23个循环,测定OD600。
1.3.2 BALB/c小鼠试验
96只6周~8周SPF级BALB/c雄性小鼠用于本试验。小鼠自由采食与饮水,饲料与饮水均经灭菌处理。给予7 d时间以适应新环境后,相应的随机平均分组。分组及灌胃情况见表1。灌胃试验完成后分别于第1、3、5、7 天处死小鼠,每次每组 3 只,取小鼠空肠、回肠、盲肠和结肠,液氮保存。

表1 BALB/c小鼠分组及灌胃项Table 1 Details of groups of BALB/c mice and gavage items
1.3.3 基因提取
分别取小鼠1 cm空肠、回肠、盲肠和结肠的内容物,用粪便基因组DNA提取试剂盒提取基因组,提取方法参考说明书,洗脱体积是80 μL。标准质粒的提取应用TIANprep Mini Plasmid Kit(DP103,TIANGEN),提取方法参考说明书,洗脱体积50 μL。
1.3.4 荧光定量PCR反应条件
实时荧光定量PCR反应体系总体积20 μL,包括1 μL06232F(10 μmol/L),1 μL06232R(10 μmol/L),1 μL06232P(10 μmol/L),1 μL 模板 DNA,10 μL Taq-Man®Universal PCR Master Mix,6 μL 灭菌超纯水。荧光定量PCR反应条件包括:50℃酶激活2 min;95℃预变性10 min;循环阶段,95℃变性15 s,58℃退火和延伸60 s,共40个循环;荧光检测设定在退火和延伸阶段。
1.3.5 数据分析
试验的数据分析采用SPSS20,绘图软件采用Origin8.0。
2 试验结果
2.1 益生元筛选
本研究以14种益生元为碳源进行了干酪乳杆菌SY13生长试验。低聚果糖和乳果糖作为碳源时生长状况最优,被选为后续研究对象。生长曲线见图1。
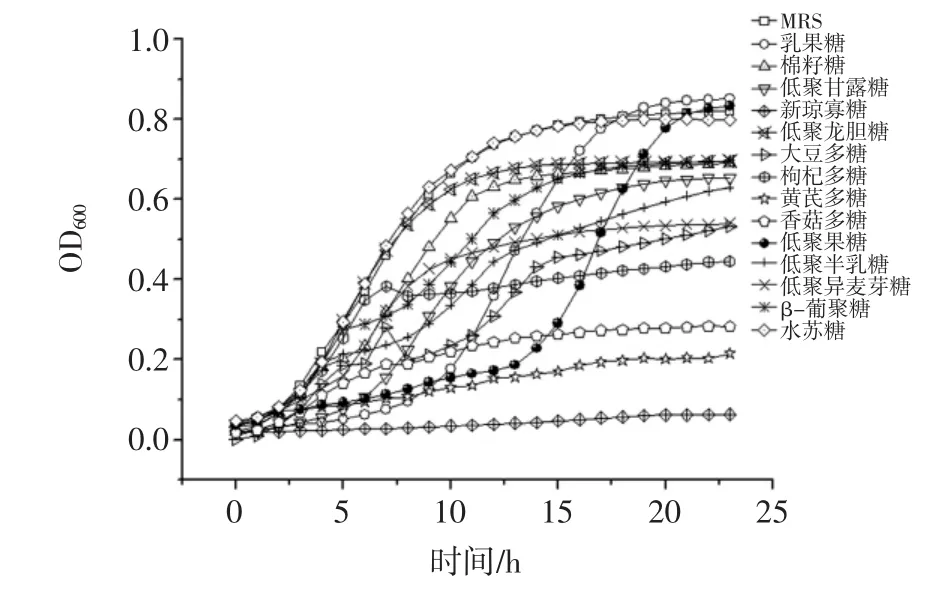
图1 SY13分别以14种益生元为碳源的生长曲线图Fig.1 Growth curve of SY13 used 14 kinds of prebiotics as carbon source
2.2 外源性干酪乳杆菌SY13在小鼠肠道分布分析
取AP1与AP2组第一天处死小鼠进行荧光定量检测,对比分析空肠、回肠、盲肠和结肠内目标菌的数量,试验详细结果见表2。

表2 单次灌胃下SY13在青年小鼠肠道分布Table 2 Regularities of distribution of SY13 with single oral administration in young mice
由表2可得出目标菌在单次灌胃下,在肠道内的分布规律。干酪乳杆菌SY13在盲肠和结肠中分布较多,空肠较少,回肠中未检测到。其中盲肠比结肠更多一些,但是统计结果显示差异性并不显著。这与干酪乳杆菌ATCC393在肠道内的分布相似[18]。
2.3 灌胃时间对SY13粘附力影响
取AP1与AP2、BP1与BP2组第一次处死小鼠进行荧光定量检测,分析空肠、回肠、盲肠和结肠内目标菌的数量,得出目标菌在不同灌胃时间下,在肠道内的分布规律。结果见表3。试验结果表明,在青年小鼠中,灌胃时间对干酪乳杆菌在小鼠肠道内的粘附能力有影响。随着灌胃的进行,一个月后,干酪乳杆菌SY13在小鼠回肠和盲肠内的检出数量显著提高。空肠有所提高,但是统计学分析结果表明并不显著。这可能是干酪乳杆菌SY13长时间地入侵肠道,使肠道的微环境向有利于干酪乳杆菌SY13生长转变。

表3 不同灌胃时间下SY13在青年小鼠肠道分布Table 3 Distribution of SY13 in intestinal tract with different gavage time to young mice
2.4 干酪乳杆菌SY13在小鼠肠道保留时间分析
2.4.1 单次灌胃的干酪乳杆菌SY13在小鼠肠道保留时间测定
取AP1与AP2组小鼠盲肠进行荧光定量检测,对比分析灌胃1、3、5 d和7 d的盲肠内目标菌的数量,得出目标菌在单次灌胃下,在肠道内的保留时间。试验结果见图2。

图2 单次灌胃下的SY13在青年小鼠肠道内的保留时间Fig.2 Retention time in intestinal tract of SY13 with single oral administration
由图2可知,单次灌胃下,干酪乳杆菌SY13在小鼠肠道内仅能保留3 d。原因为干酪乳杆菌SY13与宿主BALB/c小鼠并非同源。非同源的宿主与益生菌并不容易发生粘附定植。
2.4.2 长时间灌胃的干酪乳杆菌SY13在小鼠肠道保留时间测定
取BP1与BP2组小鼠盲肠进行荧光定量检测,对比分析灌胃1、3、5 d和7 d的盲肠内目标菌的数量,得出目标菌在长时间灌胃下,在肠道内的保留时间。试验结果见图3。
由图3可知,长时间灌胃下,干酪乳杆菌SY13在小鼠肠道内能至少保留7 d,但是其在小鼠肠道内没有定植趋势。随着灌胃时间的推移,相对目标菌在肠道内的数量逐渐降低。这与单次灌胃下的试验结论相一致:干酪乳杆菌SY13并不能在BALB/c小鼠肠道内发生定植。但是保留时间的延长说明了干酪乳杆菌SY13对于宿主微生态产生了影响。

图3 长时间灌胃下的SY13在青年小鼠肠道内的保留时间Fig.3 Retention time in intestinal tract of SY13 in young mice with long time oral administration
2.5 益生元对SY13粘附属性影响
2.5.1 益生元对SY13在BALB/c小鼠肠道粘附能力影响
取AP1、AP2、AP3和AP4组第1天处死小鼠进行荧光定量检测,试验结果见表4。

表4 益生元作用下SY13在青年小鼠肠道分布Table 4 Distribution of SY13 gavage with prebiotics in intestinal tract of young mice
对比分析空肠、回肠、盲肠和结肠内目标菌的数量,得出目标菌在单次灌胃下,在益生元作用下,肠道内的分布规律。在益生元作用下,回肠明显检测到了目标菌,但是其他肠段均无显著性差异。单次灌胃下,益生元对SY13在BALB/c小鼠肠道粘附能力影响不大。
2.5.2 长期灌胃下益生元对干酪乳杆菌SY13在青年小鼠肠道粘附能力影响
取BP1、BP2、BP3和BP4组第一天处死小鼠进行荧光定量检测,对比分析空肠、回肠、盲肠和结肠内目标菌的数量,试验结果见表5。

表5 益生元作用下长期灌胃的SY13在青年小鼠肠道分布Table 5 Distribution of SY13 long-term gavage with prebiotics in intestinal tract of young mice
由表5可得出目标菌在长期灌胃后,在益生元作用下,在肠道内的分布规律。试验发现,在益生元作用下,干酪乳杆菌SY13在盲肠和结肠中的数量有所降低。空肠没有明显规律。干酪乳杆菌SY13在肠道内的分布可能受肠道内的流体基质有关。在小肠中,其内容物水分含量相对大肠较高,其流动性强于大肠肠内容物。内容物的流动性越强,则目标菌越不容易在该肠段定植分布。低聚果糖和乳果糖在分子式中,都含有果糖。果糖能够促进宿主的肠道蠕动,利于宿主的粪便排除[19-22]。以至于虽然益生元有利于干酪乳杆菌生长,但短期内并不利于其在宿主肠道内定植。
2.5.3 单次灌胃下益生元对SY13在BALB/c小鼠肠道保留时间测定
取AP1、AP2、AP3和AP4组小鼠盲肠进行荧光定量检测,对比分析灌胃1、3、5 d和7 d的盲肠内目标菌的数量,得出在益生元作用下,目标菌在单次灌胃时,在青年小鼠肠道内的保留时间。试验结果见图4。

图4 单次灌胃益生元和SY13下SY13在青年小鼠肠道保留时间Fig.4 Retention time of SY13 in young mice with single gavage with prebiotics
由图4可知,单次灌胃下,无论有无益生元作用,干酪乳杆菌SY13在青年小鼠肠道内仅能保留3 d。
2.5.4 长时间灌胃下益生元对SY13在BALB/c小鼠肠道保留时间测定
取BP1、BP2、BP3和BP4组小鼠盲肠进行荧光定量检测,对比分析灌胃1、3、5 d和7 d的盲肠内目标菌的数量,得出在益生元作用下,目标菌在长期灌胃后,在青年小鼠肠道内的保留时间。试验结果见图5。

图5 长期灌胃益生元和SY13下SY13在青年小鼠肠道保留时间Fig.5 Retention time of SY13 in young mice with long-term gavage with prebiotics
由图5可知,长期灌胃下,无论有无益生元作用,干酪乳杆菌SY13在青年小鼠肠道内至少能保留7 d。并且由图可知,低聚果糖曲线相对较陡,乳果糖曲线最为平缓,可得出结论:在青年小鼠肠道中,低聚果糖可能降低目标菌的保留时间;乳果糖可能可以延长了目标菌的保留时间。
3 结论
干酪乳杆菌SY13在BALB/c小鼠肠道中,主要分布于盲肠和结肠。宿主的年龄会影响其在肠道内的定植,集中体现在回肠。随着灌胃时间延长,灌胃次数的增多干酪乳杆菌SY13在肠道内的数量会显著增多。低聚果糖和乳果糖并不能够在短期内对干酪乳杆菌SY13在小鼠肠道内的数量有影响;长期作用下,会略微降低目标菌在肠段内的数量,但可能会延长目标菌在肠道内的保留时间。本试验的研究内容为干酪乳杆菌SY13在功能性食品的研究与开发中提供了部分的理论依据。
[1]Prashant Babaji,Kiran Keswani,Himani Lau,et al.Role of probiotics in oral health:A review of the literature[J].Journal of Education and Ethics in Dentistry,2012,2(2):52
[2]J R Broadbent,R L Larsen,V Deibel,et al.Physiological and transcriptional response of Lactobacillus casei ATCC 334 to acid stress[J].J Bacteriol,2010,192(9):2445-2458
[3]Chun-Feng Guo,Jing-Yan Li.A combination of Tween 80 with CaCl2enhances the hypocholesterolemic activity of bile salt hydrolase-active Lactobacillus casei F0422 in rats fed a cholesterol-rich diet[J].Journal of Functional Foods,2014,9:131-140
[4]M.Sidira,G.Saxami,D.Dimitrellou,et al.Monitoring survival of Lactobacillus casei ATCC 393 in probiotic yogurts using an efficient molecular tool[J].J Dairy Sci,2013,96(5):3369-3377
[5]卜永士,郭本恒.一株干酪乳杆菌的生物学特性研究[J].乳业科学与技术,2004(2):49-51,69
[6]贺志华.干酪乳杆菌与瑞士乳杆菌发酵绿豆乳工艺研究[D].保定:河北农业大学,2012
[7]王佳.鼠李糖乳杆菌与干酪乳杆菌发酵大豆乳工艺研究[D].保定:河北农业大学,2009
[8]王静波,任发政,郑丽敏,等.含有干酪乳杆菌的再制干酪的特性分析[J].食品科技,2009(12):71-75
[9]郑欣.荔枝汁乳酸菌发酵饮料的工艺研究[D].南昌:江西农业大学,2014
[10]Mohammad Bodrul Munir,Roshada Hashim,Yam Hok Chai,et al.Dietary prebiotics and probiotics influence growth performance,nutrient digestibility and the expression of immune regulatory genes in snakehead(Channa striata)fingerlings[J].Aquaculture,2016,460:59-68
[11]Sadeq Hasan Al-Sheraji,Amin Ismail,Mohd Yazid Manap,et al.Prebiotics as functional foods:A review[J].Journal of Functional Foods,2013,5(4):1542-1553
[12]L Moreno-Vilet,M H Garcia-Hernandez,R.E.Delgado-Portales,et al.In vitro assessment of agave fructans(Agave salmiana)as prebiotics and immune system activators[J].Int J Biol Macromol,2014,63:181-187
[13]D E Serban.Gastrointestinal cancers:influence of gut microbiota,probiotics and prebiotics[J].Cancer Lett,2014,345(2):258-270
[14]R V Waworuntu,T Hanania,S R Boikess,et al.Early life diet containing prebiotics and bioactive whey protein fractions increased dendritic spine density of rat hippocampal neurons[J].Int J Dev Neurosci,2016,55:28-33
[15]L F de Cossio,C Fourrier,J Sauvant,et al.Impact of prebiotics on metabolic and behavioral alterations in a mouse model of metabolic syndrome[J].Brain Behav Immun,2016,60:33-49
[16]D Carbone,C Faggio.Importance of prebiotics in aquaculture as immunostimulants.Effects on immune system of Sparus aurata and Dicentrarchus labrax[J].Fish Shellfish Immunol,2016,54:172-178
[17]Oluwakemi Obasola Adebola,Olivia Corcoran,Winston A Morgan.Synbiotics:the impact of potential prebiotics inulin,lactulose and lactobionic acid on the survival and growth of lactobacilli probiotics[J].Journal of Functional Foods,2014,10(3):75-84
[18]G Saxami,P Ypsilantis,M Sidira,et al.Distinct adhesion of probiotic strain Lactobacillus casei ATCC 393 to rat intestinal mucosa[J].Anaerobe,2012,18(4):417-420
[19]褚慰,付小林,樊智慧,等.低聚果糖对便秘模型小鼠的通便功能的研究[J].中国药物与临床,2010(10):1135-1136
[20]刘晓梅,彭芝榕,倪学勤,等.低聚果糖、乳酸杆菌对便秘模型大鼠的通便功能影响[J].食品科学,2013(11):296-299
[21]刘协,胡启之,李小宁,等.低聚果糖的润肠通便功能研究[J].江苏预防医学,2002(1):62-63
[22]张俊黎,王宇,于红霞,等.低聚果糖对动物通便功能研究[J].预防医学情报杂志,2007(5):534-536
Adherence Property Resarch of Lactobacillus casei SY13 in Intestinal Tract of BALB/c Mice
JIA Zi-yang1,MA Chang-lu2,3,JIA Zhen-hu3,PANG Xiao-yang3,SUN Jian-feng1,*,LÜ Jia-ping3,*
(1.College of Food Science and Technology,Agricultural University of Hebei,Baoding 071001,Heibei,China;2.Beijing Vocational College of Agrichuture,Beijing 102442,China;3.Institute of Food Science and Technology CAAS,Beijing 100193,China)
Lactobacillus casei possesses excellent beneficial function,and it is widely used in dairy products research and develop.This assay used real-time PCR to detect exogenous Lactobacillus casei SY13 in BALB/c mice,and assessed the distribution in intestinal tract and retention time.Time of gavage and prebiotics were explored the affect on adherence of Lactobacillus casei SY13.The experiment result indicated that gavaged Lactobacillus casei SY13 mainly distributed in cecum and colon;Aspects of gavage time and prebiotics both had effect on adherence of Lactobacillus casei SY13 in intestinal tract of BALB/c mice.
Lactobacillus casei SY13;BALB/c mice;gavage time;prebiotics;adherence
10.3969/j.issn.1005-6521.2017.23.031
国家自然科学基金(31471603);北京农业职业学院科研项目(XY-YF-16-29)
贾子阳(1990—),男(汉),硕士,研究方向:乳酸杆菌益生作用。
*通信作者
2017-05-03

