酶解异育银鲫制备不同分子量段抗氧化肽的研究
史文军,万夕和,黎慧,沈辉,王李宝,乔毅,孙瑞健
(江苏省海洋水产研究所,江苏南通226007)
酶解异育银鲫制备不同分子量段抗氧化肽的研究
史文军,万夕和*,黎慧,沈辉,王李宝,乔毅,孙瑞健
(江苏省海洋水产研究所,江苏南通226007)
以异育银鲫(Carassius auratus gibelio)蛋白为原料,以酶解产物的DPPH自由基清除率为评价指标,从酸性蛋白酶、中性蛋白酶、碱性蛋白酶、木瓜蛋白酶、菠萝蛋白酶、风味蛋白酶、胃蛋白酶和胰蛋白酶8种蛋白酶中筛选出风味蛋白酶作为最佳酶解用酶,并通过单因素试验和正交试验确定风味蛋白酶酶解的最佳工艺条件为:加酶量3 000 U/g、底物浓度7%、酶解pH 7.5、酶解温度55℃、酶解时间4 h。在该条件下对异育银鲫的水解度为46.78%,酶解产物的DPPH自由基清除率为90.12%、羟自由基清除率为82.31%、超氧阴离子自由基清除率为79.45%;在此基础上对酶解液进行硫酸铵盐析、活性炭脱腥、超滤膜分段、透析脱盐、浓缩和干燥,得到不同分子量段酶解产物。
异育银鲫;酶解;自由基;抗氧化肽
异育银鲫(Carassius auratus gibelio)是中国科学院水生生物研究所的鱼类育种专家于二十世纪七八十年代研制成功的一种鲫鱼养殖新品种,然而,随着异育银鲫养殖业的不断发展,病害导致异育银鲫死亡的数量逐渐增加,特别是近些年,由于“鳃出血”病的影响,江苏沿海,特别是盐城地区养殖损失惨重。另一方面,由于技术和人为忽视的原因,死亡的异育银鲫没有得到很好的利用,这不仅造成资源的浪费,而且造成严重的环境污染。在鱼体组织中,蛋白质是最主要的有机组分,经测定,异育银鲫的含肉率在48.18%~54.19%之间,肌肉蛋白质含量在17.58%~18.03%,氨基酸构成中,谷氨酸含量为最高,其次为天冬氨酸、亮氨酸和赖氨酸[1-2]。
人体代谢过程中会不断产生自由基,当自由基的产生和清除动态平衡失调时,机体内一些正常生理生化反应就会发生紊乱,引起机体的组织和细胞的损伤,进而引发慢性疾病及衰老效应,如癌症、心血管病和炎症等[3]。而抗氧化肽可以清除体内多余的自由基,增加机体免疫力,延缓衰老,从而实现机体的自我保护。抗氧化肽是一种以休眠形式存在于母蛋白质序列中的特异性蛋白质片段,当水解释放后才能表现出强烈的抗氧化活性[4]。与酸法和碱法水解相比,酶法水解蛋白水解效率高,反应条件温和,产生毒性物质的可能性小,同时随着酶解反应的进行,蛋白质的相对分子质量变小,转化为小分子肽或者游离氨基酸,更易于人体消化吸收和利用[5]。不同分子量的酶解产物,其吸收能力和生物活性差异较大,目前多是使用超滤法对酶解产物进行分子量大小分段的[6]。如郝更新[7]等通过超滤工艺从牡蛎贝肉蛋白酶解液中分离富集抗氧化活性肽;林慧敏[8]等采用超滤膜对带鱼蛋白酶解液进行分级分离获得了高抗菌、抗氧化活性的带鱼蛋白亚铁螯合肽(Fe-HPH);Mohamed Beva Kelfala Foh[9]等研究了超滤对罗非鱼蛋白水解物抗氧化活性的影响。
本文以异育银鲫蛋白为原料,选择体外DPPH自由基清除率为评价指标,从8种蛋白酶中筛选出最适制备异育银鲫抗氧化肽的蛋白水解酶,并通过正交试验优化酶解工艺,确定合适的加酶量、底物浓度、酶解温度、酶解pH值和酶解时间,并通过超滤分段的方法将其分成不同分子量段的抗氧化肽,以期为发病异育银鲫的综合开发及利用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
异育银鲫:取自江苏省盐城市大丰区养殖塘口,低温运至江苏省海洋水产研究所海洋生物技术试验室,-20℃保存,使用时室温解冻。
酸性蛋白酶、中性蛋白酶、碱性蛋白酶、木瓜蛋白酶、菠萝蛋白酶、风味蛋白酶、胃蛋白酶和胰蛋白酶(均为食品级):天津市诺奥科技发展有限公司;试验所使用的硫酸、盐酸、氯化钠等各类试剂均为分析纯。所用蛋白酶的各项参数见表1。

表1 8种蛋白酶的特征性参数值Table 1 Feature values of eight enzymes
1.2 主要仪器设备
PHS-2F pH酸度计:上海仪电科学仪器股份有限公司;DL-I-15台式封闭电炉:江阴市保利科研器械有限公司;UV-2450紫外分光光度计:岛津国际贸易(上海)有限公司;DK-S26水浴锅:海精宏试验设备有限公司:SHY-2A恒温水浴振荡器;常州麦科诺仪器有限公司;AB54-S电子分析天平:梅特勒-托利多常州公司;蠕动泵:上海沪西有限公司;超滤板:美国颇尔公司;旋转蒸发仪:瑞士步琦有限公司。
2 方法
2.1 样品预处理
将-20℃保存的异育银鲫,于室温下放置解冻,去除鱼鳞和内脏后,将鱼肉分成2 cm~3 cm每段;按1∶5(g/mL)加入无乙醇,脱脂 2 h,期间每 1 h更换一次液体;然后用自来水冲洗干净,纯水浸泡一次;50℃烘干5 h;用组织粉碎机将其粉碎,放置于干燥器里贮藏备用。
2.2 蛋白质含量的测定
参照GB/T5009.5-2010《食品中蛋白质的测定》中的凯氏定氮法。
2.3 甘氨酸标准曲线的绘制
准确称取预先于105℃烘箱干燥至恒重的甘氨酸0.100 0 g(准确至0.000 1 g),用蒸馏水定容至100 mL,取2.0 mL用蒸馏水定容至100 mL,即得20 μg/mL标准液;用蒸馏水分别稀释至 2、4、6、8、10、14、16 μg/mL和20 μg/mL 8个梯度,分别取上述溶液2.0 mL至具塞试管中,并以蒸馏水作为空白组,各加1.00 mL茚三酮显色剂,混匀后置于沸水浴中加热15 min,立即冷水中冷却,加入5.00 mL 40%乙醇溶液,剧烈震荡数分钟至棕红色退去,室温静置15 min,用紫外分光光度计测570 nm处吸光值,以吸光值A为纵坐标,甘氨酸浓度C为横坐标,绘制甘氨酸标准曲线。
2.4 水解度的测定
茚三酮比色法[10],具体是将蛋白水解上清液稀释至合适倍数,取2.00 mL稀释液于试管并加入1.00 mL茚三酮显色剂混匀后沸水浴加热15 min。同时作空白试验,以后操作同标准曲线绘制过程。利用标准曲线计算水解蛋白液中-NH4的含量,水解度计算公式如下:

式中:DH为水解度,%;h为水解后每克蛋白质被裂解的肽键数,mmol;htot为每克原料蛋白质的肽键毫摩尔数,本试验取7.4mmol/g;水解液-NH4的含量:由标准曲线求得;N为凯氏定氮测定的氮的浓度,mg/mL。
2.5 酶解试验
准确称取一定量的异育银鲫干粉,加入适当比例的超纯水,用2 mol/L氢氧化钠或盐酸调节体系pH值至试验用酶最适pH值,加入适量的水解用蛋白酶,在给定的反应温度下进行反应,酶解至设定时间后,将酶解液置于沸水中灭酶活10 min,10 000 r/min离心15 min,将所得酶解产物(上清)置于冰箱4℃短期保存待用。
2.6 酶解产物抗氧化能力的测定
2.6.1 DPPH自由基清除活性的测定
参照李云涛等[11]的方法,略作改动,取1.5 mL待测液与1.5 mL 0.02 mmol/L的DPPH溶液,混匀,室温黑暗下放置30 min,以1.5 mL 99.5%乙醇和1.5 mL纯水的混合液调零,测定其在517 nm波长下的吸光值,计算公式如下:

式中:Ai为1.5 mL待测液与1.5 mL 0.02 mmol/L的DPPH溶液的吸光值;A1为1.5 mL99.5%乙醇与1.5 mL0.02mmol/L的DPPH溶液的吸光值;A2为1.5mL DPPH溶液与1.5 mL99.5%乙醇的吸光值。
2.6.2 羟自由基清除活性的测定
参照文献中的方法[12],在10 mL具塞比色管依次加入0.8 mL的pH5.0HAc-NaAc缓冲液,1.0 mL1×10-4mol/L的孔雀石绿溶液,2.2 mL2×10-2mol/L的EDTA-Fe2+溶液,1.4 mL0.3%的H2O2溶液,用纯水稀释至10 mL,摇匀,放置45 min后在617 nm波长处测定吸光值A0,同时测定不加H2O2时的吸光值A1,同时测得在加H2O2前加入1 mL所测酶解液,此时的吸光值计作Ai,计算公式如下:
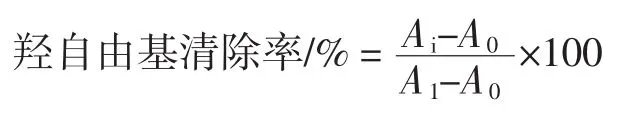
2.6.3 超氧阴离子清除活性的测定
参照张照昱等[13]的方法,取0.05 mol/LpH8.2的Tris-HCl缓冲液2.4 mL,25℃水浴加热20 min,加入0.3 mL提前预热过的4 mmol/L的邻苯三酚溶液和

式中:A0为不加待测酶解液的吸光值;A1为加待测酶解液的吸光值;A2为不加邻苯三酚时溶液的吸光值。
2.7 最适酶的筛选
在加酶量为2 000 U/g,底物浓度为10%,酶解时间为2 h的相同条件下,选择各酶最适pH值和最适温度,分别测定酸性蛋白酶、中性蛋白酶、碱性蛋白酶、木瓜蛋白酶、菠萝蛋白酶、风味蛋白酶、胃蛋白酶和胰蛋白酶水解异育银鲫的水解度及相对应酶解产物的DPPH自由基清除率,最终筛选出最佳水解蛋白酶[14-16]。
2.8 单因素试验
在最适pH值和温度的条件下,分别以不同加酶量(500、1 000、1 500、2 000、2 500 U/g 和 3 000 U/g),不同底物浓度(4、6、8、10、12 g/100 mL 和 14 g/100 mL),反应时间(1、1.5、2、2.5、3、3.5 h 和 4 h)为单因素,考察各单因素水平对异育银鲫蛋白水解度及水解产物抗氧化性的影响。
2.9 正交试验
根据单因素试验结果和风味蛋白酶最适pH值及温度条件,运用正交试验设计软件,研究加酶量、底物浓度、pH值、温度和反应时间对风味蛋白酶酶解异育银鲫蛋白制备抗氧化肽的影响,并优化出各因素的最佳组合。
2.10 不同分子量段抗氧化肽的制备
硫酸铵盐析:在以上所选最佳酶解工艺条件下进行异育银鲫蛋白质酶解,将灭酶后的酶解上清液,在冰水浴条件下加硫酸铵至一定饱和度,然后4℃过夜盐析,离心收集沉淀;
生理盐水复溶:复溶沉淀用10 mmol/L磷酸盐缓冲液(pH7.0含0.15 mol/L氯化钠)复溶,然后用活性炭(浓度2%~4%,温度40℃~50℃)脱腥2 h后,离心收集上清液;
超滤分段:用截留分子量不同的超滤板将其分离为 Mr>10kDa、10kDa>Mr>5kDa、5kDa>Mr>3kDa 及3kDa>Mr 4个分子量段的抗氧化肽;
透析脱盐:将各段酶解液分别装于截留分子量3 kDa的透析袋中,于纯水中脱盐24 h,期间每8 h替换一次纯水;
浓缩和干燥:将脱盐后的各段酶解液通过旋转蒸0.3 mL的待测酶解液,摇匀,25℃反应4 min,加一滴10 mmol/L的HCl以终止反应,325 nm波长处测定吸光值,计算公式如下:发浓缩进行浓缩;然后进行冷冻干燥。
2.11 数据处理
采用Origin和Spass软件对数据进行分析,所有数据均采用±S表示。
3 结果及分析
3.1 酶解用酶的筛选
在底物浓度10%,加酶量2 000 U/g,酶解时间2 h的相同条件下,在各蛋白酶自身最适pH值和温度条件下,分别测得8种蛋白酶酶解异育银鲫的水解度和相对应酶解产物的DPPH自由基清除率结果见图1。

图1 不同蛋白酶酶解液的DPPH自由基清除率Fig.1 DPPH scavenging activity of the enzymatic hydrolysates by different proteinases
由图1可知,其水解度大小顺序为胰蛋白酶>菠萝蛋白酶>风味蛋白酶>木瓜蛋白酶>碱性蛋白酶>中性蛋白酶>酸性蛋白酶>胃蛋白酶,其中胰蛋白酶水解度最高,可以达到22.94%,而最低的胃蛋白酶,只能达到7.66%;测得各蛋白酶所对应的酶解产物DPPH自由基清除率大小顺序为风味蛋白酶>菠萝蛋白酶>胰蛋白酶>木瓜蛋白酶>碱性蛋白酶>酸性蛋白酶>胃蛋白酶>中性蛋白酶,其中,最高的风味蛋白酶酶解液对DPPH自由基清除率达68.26%,而最低的中性蛋白酶酶解液对DPPH自由基清除率只能达到16.02%。因此,选择风味蛋白酶作为本试验制备抗氧化肽的酶解用酶,其水解异育银鲫的水解度19.03%。
3.2 加酶量对酶解液DPPH自由基清除率的影响
在底物浓度为10%,pH值为6.5,反应温度为50℃,酶解时间为2 h的相同条件下,研究风味蛋白酶的(500 U/g~3 000 U/g)加酶量对酶解液DPPH自由基清除率和水解度的影响,结果如图2所示。
由图2可知,在加酶量达到2 500 U/g前,随着加酶量的增加,水解度及酶解液DPPH自由基清除率均成呈上升趋势,但当加酶量达2 500 U/g后,继续增加蛋白酶加入量,水解度变化不明显,而酶解液DPPH自由基清除率却呈现下降趋势。所以选择2 500 U/g作为风味蛋白酶的最适加酶量。

图2 加酶量对酶解液DPPH自由基清除率的影响Fig.2 DPPH scavenging activity of the enzymatic hydrolysates by different proteinas’concentration
3.3 底物浓度对酶解液DPPH自由基清除率的影响
在加酶量为2 500 U/g,pH值为6.5,反应温度为50℃,酶解2 h的相同条件下,研究(4%~14%)底物浓度对酶解液DPPH自由基清除率和水解度的影响,结果如图3所示。
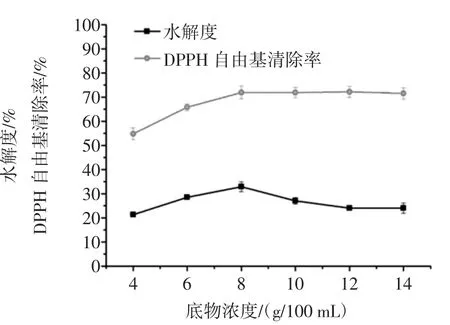
图3 底物浓度对酶解液DPPH自由基清除率的影响Fig.3 DPPH scavenging activity of the enzymatic hydrolysates by different substrates’concentration
由图3可知,在底物浓度达到8%之前,随着底物浓度的增加,水解率和酶解液DPPH自由基清除率均呈上升趋势,但当底物浓度达8%后,继续增加底物浓度,酶解液DPPH自由基清除率趋于平稳,而水解度呈下降趋势。综合考虑选择8%作为风味蛋白酶最适反应底物浓度。
3.4 酶解时间对酶解液DPPH自由基清除率的影响
在加酶量为2 500 U/g,pH值为6.5,反应温度为50℃,底物浓度为10%的相同条件下,研究(1 h~4 h)酶解时间分别对酶解液DPPH自由基清除率和水解度的影响,结果如图4所示。
由图4可知,前3 h内,随酶解时间的延长,水解度和酶解液DPPH自由基清除率均呈上升趋势;但酶解3 h后,继续延长酶解时间,水解度上升趋势不明显,酶解液DPPH自由基清除率却有下降趋势。综合考虑选择3 h作为最适酶解时间。

图4 酶解时间对酶解液DPPH自由基清除率的影响Fig.4 DPPH scavenging activity of the enzymatic hydrolysates by different hydrolysis time
3.5 正交试验设计及结果分析
最适加酶量为2 500 U/g,最适底物浓度为8%,最适酶解时间为3 h,结合风味蛋白酶最适pH6.5和最适反应温度为50℃。在上述最适单因素的基础得出正交试验试验水平因素设计表,见表2。

表2 正交试验水平因素设计表Table 2 Factors and levels in the orthogonal array design
以异育银鲫酶解液DPPH自由基清除率评价为指标,采用正交试验确定风味蛋白酶酶解的最适反应组合条件。正交试验结果及分析见表3,方差分析表见表4。

表3 风味蛋白酶酶解条件正交试验方案及结果分析Table 3 The design and results of orthogonal test

续表3 风味蛋白酶酶解条件正交试验方案及结果分析Continue table 3 The design and results of orthogonal test

表4 方差分析表Table 4 Variance analysis
由表3可知,用风味蛋白酶酶解异育银鲫制备抗氧化肽时,以DPPH自由基清除率为评价指标,对正交试验结果进行极差分析,发现各单因素的影响程度依次为加酶量>pH值>反应温度>酶解时间>底物浓度;最佳试验组合为A3B1C3D3E3,即加酶量为3 000 U/g,底物浓度为7%,pH值为7.5,反应温度为55℃,酶解时间为4 h。由表4可以看出加酶量、pH值和温度水平之间存在显著差异;而底物浓度和反应时间水平之间没有显著性差异。
3.6 验证试验
为了检验正交试验优化出的最佳酶解条件的准确性,在此最优条件(A3B1C3D3E3)下,进行异育银鲫酶解试验,此时水解度为46.78%,对应酶解液DPPH自由基清除率为90.12%,结果大于正交13号试验组,所以此次正交试验优化出的最佳酶解条件是准确的,可以用于酶解。同时测定此时酶解液羟自由基清除率为82.31%、超氧阴离子自由基清除率为79.45%。
3.7 不同饱和度硫酸铵盐析效果
加入硫酸铵至不同的饱和度,其盐析效果是不同的,如图5所示。

图5 不同饱和度硫酸铵盐析效果Fig.5 The results of ammonium sulfate precipitation
由图5可知,随着硫酸铵饱和度的不断增加,上清液中蛋白质的含量在逐渐降低,即越来越多的蛋白从溶液中析出,当硫酸铵饱和度达到90%时,几乎所有的蛋白从溶液中析出。
3.8 不同分子量段抗氧肽的得率
将干燥后的各段抗氧化肽进行称量,与加入底物的量进行比较,计算出各段的得率,如表5所示,可见分子量大于10 kDa的抗氧化肽产率是最高的,而分子量小于3 kDa的抗氧化肽产率最低。

表5 不同分子量段抗氧化肽的产率Table 5 Pproduction rate of different molecular weight antioxidant peptides
3.9 不同分子量段抗氧化肽的抗氧化性
将不同分子量段的抗氧化肽粉充分溶于纯水中,浓度均为2.0 mg/mL,然后用0.45 μm的滤膜过滤,检测各段的体外抗氧化性,结果见图6。
由图6可知,相同浓度下,随着分子量的降低,其抗氧化活性不断升高。
4 小结
1)通过对8种酶水解度和酶解产物自由基清除率的分析,综合考虑各方面因素,筛选出风味蛋白酶作为试验用最佳蛋白水解酶;

图6 不同分子量段多肽抗氧化效果Fig.6 The antioxidant effect of different molecular weight
2)通过正交优化试验可得,风味蛋白酶水解异育银鲫蛋白的最佳水解条件是:
加酶量3 000 U/g,底物浓度7%,pH7.5、反应温度为55℃和酶解时间4 h。在此最优条件下,进行异育银鲫酶解试验,测得水解度为46.78%,对应酶解液DPPH自由基清除率为90.12%,同时测定此时酶解液羟自由基清除率为82.31%、超氧阴离子自由基清除率为79.45%;
3)通过硫酸铵盐析、活性炭脱腥和超滤膜分段,将异育银鲫酶解液按分子量大小分离为Mr>10kDa、10kDa>Mr>5kDa、5kDa>Mr>3kDa及 3kDa>Mr 4个分子量段的抗氧化肽;其中,3kDa>#分子量段的抗氧化肽抗氧化效果最好,2.0 mg/mL时其DPPH自由基清除率为90.82%。
[1]李育培,盛晓洒,权恒.蛋白质和氨基酸营养水平对异育银鲫的影响研究[J].饲料博览,2008(1):41-43
[2]严安生,熊传喜,周志军,等.异育银鲫的含肉率及营养评价[J].水利渔业,1998,97(3):16-19
[3]陆向英.银杏叶提取物对老年性疾病的治疗作用分析[J].中外医学研究,2011,9(24):140
[4]SARMADI B H,ISMAIL A.Antioxidative peptides from food proteins:a review[J].Peptides,2010,31(10):1949-1956
[5]ARAI S,YAMASHITA M,KATO H,et al.Applying proteolytic enzymes on soybean[J].Agric Biol Chem,1970,34(5):729-738
[6]任海伟,王常青.超滤法分离黑豆抗氧化活性肽[J].食品科学,2009,30(12):123-126
[7]郝更新,曹文红,郝记明,等.超滤法浓缩富集牡蛎蛋白抗氧化活性肽[J].食品工业科技,2013,34(11):77-80
[8]林慧敏,邓尚贵,庞杰.张宾超滤法制备高抗菌抗氧化活性带鱼蛋白亚铁螯合肽(Fe-HPH)的工艺研究[J].中国食品学报,2012,12(6):16-21
[9]Mohamed Beva Kelfala Foh,J Qixing,I Amadou,et al.Influence of Ultrafiltration on Antioxidant Activity of Tilapia(Oreochromis niloticus)Protein Hydrolysate[J].Advance Journal of Food Science and Technology,2010,2(5):227-235
[10]赵新淮,冯志彪.蛋白质水解物水解度的测定[J].食品科学,1994,15(11):65-67
[11]李云涛,陈博,马剑茵.虾蛄肉酶法制备抗氧化肽的工艺优化和活性研究[J].海洋与湖沼,2014,45(2):336-339
[12]张照昱,邢俊德,张朝峰,等.孔雀绿褪色光度法检测Fenton反应产生的羟自由基[J].太原理工大学学报,2009,40(2):113-116
[13]刘媛,王健,牟建楼,等.扇贝贝肉抗氧化肽制备及体外抗氧化试验研究[J].食品工业科技,2014,35(8):206-209
[14]王水霞,王珊珊.青蛤碱性蛋白酶水解物的抗氧化活性试验[J].药物与人,2014,27(5):42-43
[15]吴林泽,李从发.罗非鱼下脚料酶解产物中抗菌肽的初步研究[J].科技信息,2007(17):289
[16]付学军,金海珠.酶解时间对海参肽抗氧化活性影响的研究[J].食品科技,2013,38(9):193-196
Study on the Preparation of Antioxidant Peptide with Different Molecular Weights from Crucian Carp(Carassius auratus gibelio)Meat Enzymolysis
SHI Wen-jun,WAN Xi-he*,LI Hui,SHEN Hui,WANG Li-bao,QIAO Yi,SUN Rui-jian
(Institute of Oceanology&Marine Fisheries of Jiangsu,Nantong 226007,Jiangsu,China)
Gibel carp (Carassius auratus gibelio)protein was chosed as the raw material.It was independently hydrolyzed by trypsin,pepsin,flavourzyme,neutrase,alcalase,papain,bromelain and acid protease.The antioxidant capability was evaluated by the DPPH free radicals clearance rate.The results showed that the flavourzyme was the best proteolytic enzyme.The single factor and orthogonal experiment showed that the best hydrolysis conditions of the flavourzyme were:enzyme amount 3 000 U/g,substrate concentration 7%,pH=7.5,T=55℃,reaction time 4 h.Under these conditions,the degree of hydrolysis(DH)was 46.78%,the DPPH free radicals clearance rate could achieve to 90.12%,the scavenging rate of hydroxyl radical was 82.31%and the clearance rate of superoxide anion radical was 79.45%.The enzymatic hydrolysates were processed with ammonium sulfate salting-out,active carbon,ultrafiltration,dialysis,concentration and lyophilization,then antioxidant peptide with different molecular weights were got.
Carassius auratus gibelio;enzymatic hydrolysis;free redicals;antioxidant peptide
10.3969/j.issn.1005-6521.2017.23.011
异育银鲫重大疾病防控技术体系研究与示范(D2015-12)作者简介:史文军(1987—),男(汉),工程师,硕士,研究方向:海洋生物技术。
*通信作者:万夕和(1971—),男(汉),研究员,博士,研究方向:海洋生物。
2017-03-13

