苦荞发芽期不同部位的活性成分含量变化
胡俊君,仪鑫,李红梅,何永吉,边俊生,李云龙
(山西省农业科学院农产品加工研究所,山西太原030031)
苦荞发芽期不同部位的活性成分含量变化
胡俊君,仪鑫,李红梅,何永吉,边俊生,李云龙*
(山西省农业科学院农产品加工研究所,山西太原030031)
苦荞发芽后,将其分为芽及去除芽后的籽粒两部分,在发芽期间,对芽和籽粒中的总黄酮、芦丁、槲皮素及D-CI含量变化进行研究。发芽第二天开始,随着发芽时间延长,芽粉中总黄酮、芦丁、D-CI含量呈下降趋势,槲皮素含量缓慢上升;发芽第二天,芽粉中D-CI含量高达18.38 mg/g,未萌动的苦荞全粉中D-CI含量为0.32 mg/g。随发芽时间延长,全粉中总黄酮、芦丁含量呈先上升后下降趋势,在发芽萌动第七天总黄酮含量达到最大值,为27.92 mg/g,第六天芦丁含量达到最大,为23.13 mg/g;槲皮素含量变化呈上升趋势,在发芽中后期含量上升迅速,发芽第八天其含量为6.85 mg/g;D-CI含量变化呈缓慢上升趋势,第一天其含量为1.07 mg/g,第六天其含量为1.51 mg/g。芽粉中总黄酮、芦丁、D-CI在发芽初期含量较高;全粉中D-CI的合成也主要发生在发芽初期,芦丁、槲皮素的合成主要在发芽中后期。
苦荞;发芽;芽粉;全粉;活性成分
苦荞是蓼科(polygonaceae)荞麦属(Fagopyrum escuentum Moench)一年生草本双子叶植物,含有丰富的生物活性物质。徐宝才等[1]通过液质联用技术发现苦荞中黄酮类化合物主要是芦丁、槲皮素、山奈酚等物质。现代药理学实验和临床试验表明苦荞黄酮类化合物具有较明显的降血糖、降血脂、清除自由基、增强免疫等功能[2-5]。同时荞麦也是为数不多的天然肌醇的生物载体。D-手性肌醇(D-chiro-inostiol,D-CI)是肌醇的立体异构体,具有旋光性,存在于荞麦和大豆等植物和部分昆虫中。研究发现D-CI具有调节胰岛素活性和促进肝脏脂肪代谢功能,能够明显降低血糖含量[6-10]。萌动是生命发展的最初阶段,也是生物中最有活力的阶段[11]。谷物种子萌发可以提高营养物质含量[12-13],降低或消除有毒或抗营养物质含量[14-15]。因此,可通过发芽萌动的方法,为提高苦荞中生物活性物质含量提供一定的依据。目前,对苦荞萌发活性物质含量变化的研究,主要集中在其发芽后整体籽粒中总黄酮物质的变化[16-18];少数学者对萌动前后荞麦整籽粒中手性肌醇物质变化进行研究。周小理等[19]发现苦荞总黄酮随发芽天数的增加而增加;唐宇等[20]发现,苦荞萌发后芦丁含量是萌发前的35倍;石磊等[21]发现荞麦萌动后提高了黄酮类成分,萌发7天苦荞中芦丁含量提高了66.64%,槲皮素含量由8.93 mg/g上升为11.90 mg/g。宋雨等[22]对苦荞萌发过程中D-CI含量变化进行了研究,发现萌发第9天D-CI含量最高,达2.55 mg/g,说明萌发可明显提高苦荞种子中D-CI含量。学者对萌动苦荞中活性成分变化主要集中在整体籽粒上,对萌动前后荞麦不同部位生物活性物质变化少见报道。本试验对萌动后苦荞芽粉和去除芽粉后的全粉中黄酮类物质及D-CI含量进行研究,探究不同部位黄酮类物质、D-CI含量的变化趋势,为萌动后苦荞不同部位的加工应用提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
苦荞(黑丰一号):山西省农科院右玉试验站;芦丁(纯度92.5%)、槲皮素(纯度92.5%):中国药品生物制品检定所;D-手性肌醇(纯度≥98%):美国Sigma公司;乙腈(色谱纯):美国 Fisher Chemical;氯化铝,醋酸钾,苯甲酰氯,吡啶,氯仿等均为分析纯。
1.2 仪器与设备
BSC-250恒温恒湿培养箱:上海博迅实业有限公司医疗设备厂;Agilent 1100型高效液相色谱仪:美国Agilent公司;A380型紫外/可见分光光度计:上海翰艺仪器有限公司;DZF-6050型真空干燥箱:上海博迅实业有限公司医疗设备厂;DZKW-4电子恒温水浴锅:北京中兴伟业仪器有限公司。
1.3 试验方法
1.3.1 苦荞萌发
挑选颗粒大小均匀,成熟饱满无虫害的苦荞种子,用1%次氯酸钠溶液消毒浸泡15 min,清水洗至中性,分别均匀置于铺有滤纸的发芽盘中,种子上下均放置一层滤纸,于25℃,湿度95%条件下萌发,每晚补充适量水分[23]。每天同一时间取苦荞芽全株,量其芽长,计量其发芽率后,于60℃真空干燥,将苦荞芽与籽粒分离,籽粒经脱壳后磨粉,称为去芽后苦荞全粉;苦荞芽经磨粉,称为苦荞芽粉。对不同萌发时间的苦荞芽粉及去芽后苦荞全粉的成分进行分析。
1.3.2 样液制备
精确称取样品,70%甲醇,料液比 1 ∶25(g/mL)于70℃下提取3 h,得到样液。
1.3.3 基本成分分析
灰分:GB 5009.4-2010《食品安全国家标准食品中灰分的测定》
碳水化合物:酸水解法[24]
粗脂肪:GB 5009.6-2003《食品安全国家标准食品中脂肪的测定》
粗蛋白:GB 5009.5-2010《食品安全国家标准食品中蛋白质的测定》
可溶糖:蒽酮比色法[25]
粗淀粉:GB 5009.9-2008《食品安全国家标准食品中淀粉的测定》
1.3.4 总黄酮含量测定
采用铝盐法[26]。精确称取0.5 g样品按照方法1.3.2制备样液,准确吸取1 mL样液于10 mL具塞比色管中,先加2 mL 0.1 mol/L AlCl3溶液,再加3 mL 1mol/L CH3COOK溶液,用70%甲醇定容至10 mL,摇匀后静置30 min,于420 nm测定吸光度。
标准曲线绘制:分别精确吸取0.05 mg/mL芦丁标准溶液 0、0.5、1、2、3、4 mL 于 10 mL 具塞比色管中,按上述方法进行显色并测定吸光度,以芦丁质量为横坐标,吸光度为纵坐标绘制标准曲线,得到方程为y=3.679x-0.001,R2=0.999。
1.3.5 芦丁、槲皮素含量测定
采用高效液相色谱法。精确称取2g样品按照方法1.3.2制备样液,样液过0.45μm滤膜,进样1μL。色谱柱为 C18,250 mm×4.6 mm,柱温30℃,检测波长360 nm,流动相如表1所示。
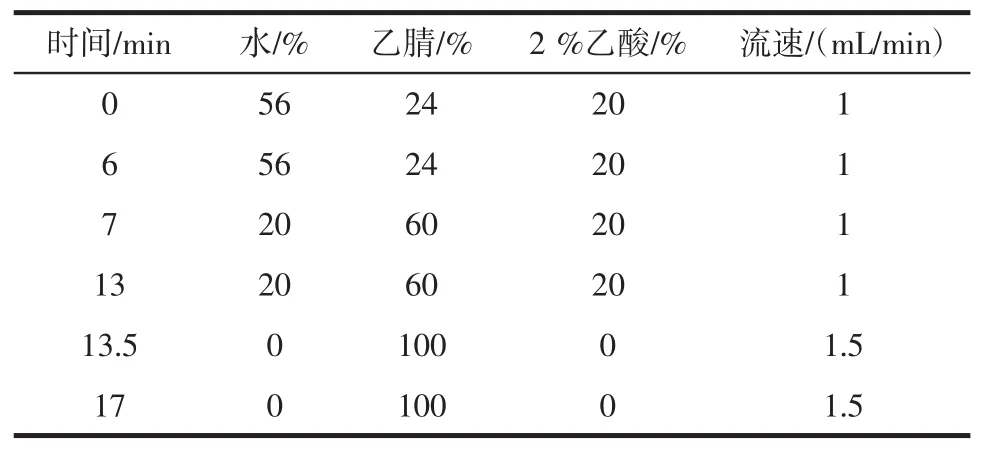
表1 高相液相色谱法流动相Table 1 Mobile phase of high performance liquid chrommatography
0.2 mg/mL芦丁标准标准液经0.45 μm滤膜过滤后,分别进样 1、2、3、4、5、6 μL,以进样体积为横纵标,面积为纵坐标作图,得到标准曲线方程为y=308.9x-0.26,R2=1.0.05 mg/mL槲皮素标准标准液经0.45 μm滤膜过滤后,分别进样 1、2、3、4、5 μL,以进样体积为横纵标,面积为纵坐标作图,得到标准曲线方程为y=117.4x-2.867,R2=0.999。
1.3.6 D-CI含量测定
采用柱前衍生化高效液相色谱法。
1.3.6.1 衍生化方法
量取一定样液或标准液于5 mL试管,烘干后加吡啶 0.4 mL,苯甲酰氯 0.1 mL,氯仿0.1 mL,60℃反应30 min,冷却后,用氯仿与甲醇混合液(1∶3 v/v)稀释至刻度,摇匀即为衍生化储备液[27]。
1.3.6.2 D-CI含量测定
芽粉精确称取0.5 g,全粉精确称取2 g,按照方法1.3.2制备样液。分别量取1 mL样液按照方法1.3.6.1制备衍生化储备液。衍生化储备液经0.45 μm滤膜过滤后,进样5μL。色谱柱为SDSHYPERSILC18,250mm×4.6 mm,柱温30℃,检测波长为230 nm,流动相为乙腈和水,0 min~16 min:80%乙腈,20%水,流速 1 mL/min,16.5 min~21 min:100%乙腈,流速 1.5 mL/min[28]。
0.2 mg/mL D-CI标准液分别量取 0.1、0.2、0.4、0.8、1 mL,按照方法1.3.6.1制备衍生化储备液,经0.45 μm滤膜过滤后进样2 μL。以进样质量为横坐标,面积为纵坐标,得到标准曲线方程y=20 310x-18.14,R2=0.999。
2 结果与分析
2.1 苦荞发芽萌动生长趋势
苦荞发芽萌动生长趋势如图1所示。

图1 苦荞发芽生长趋势Fig.1 Germination growth trend of tartary buckwheat
随着发芽萌动时间的延长,苦荞发芽率及芽长随之增加,发芽萌动第1天,苦荞发芽率为37.27%,苦荞仅露白,芽长1.17 mm;第2天苦荞发芽率增至90.60%,随后发芽率缓慢上升,第6天苦荞发芽率达99.33%。随发芽萌动时间延长,苦荞芽长呈上升趋势,发芽第8天芽长达66.87 mm。在发芽萌动期间,芽粉比重逐渐增大,发芽第2天,芽粉比重为2.15%,发芽第8天,芽粉比重增至23.01%。
2.2 苦荞全粉发芽萌动过程中基本成分变化趋势
苦荞全粉发芽萌动过程基本成分变化趋势如图2所示。
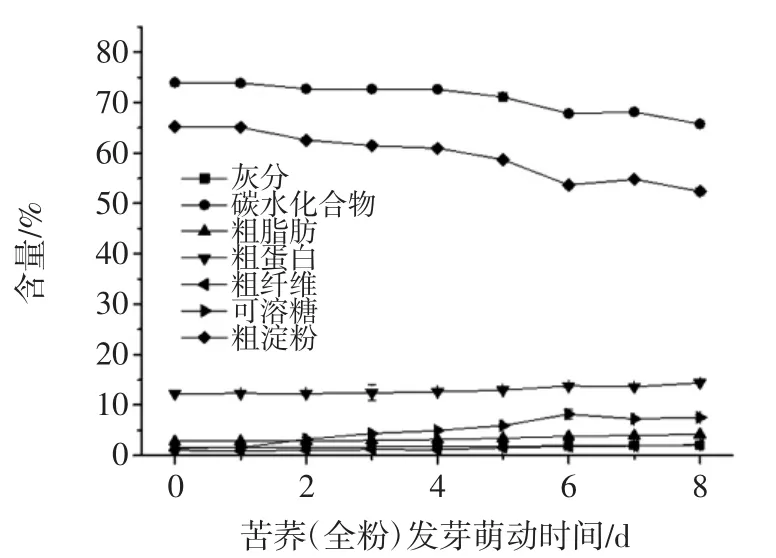
图2 苦荞全粉发芽过程基本成分变化趋势Fig.2 Change trend of basic components on buckwheat whole powder during germination
随发芽时间延长,碳水化合物、粗淀粉的含量呈下降的趋势,可溶糖的含量呈上升趋势,碳水化合物由73.96%降至65.76%,粗淀粉由65.23%降至62.39%,可溶糖由1.48%升至7.55%。脂肪、蛋白质、粗纤维、灰分含量随发芽萌动时间延长略微上升。
2.3 苦荞全粉发芽萌动过程中活性成分变化趋势
苦荞全粉发芽萌动过程中,活性成分变化趋势如图3所示。
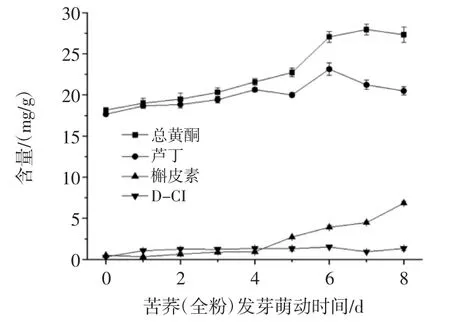
图3 苦荞全粉发芽过程活性成分变化趋势Fig.3 Change trend of bioactive substance of buckwheat whole powder during germination
苦荞全粉中总黄酮与芦丁含量呈先上升后下降趋势,槲皮素含量为上升趋势。芦丁含量在第6天达到最大值为23.13 mg/g,总黄酮含量在第7天达到最大值为27.92 mg/g;随后芦丁含量开始下降,说明芦丁开始发生降解。在发芽萌动前4天槲皮素含量呈缓慢上升趋势,继续萌发,其含量明显上升,发芽第八天其含量为6.85 mg/g。D-CI在苦荞发芽萌动第1天,其含量由0.32 mg/g迅速增长为1.07 mg/g,发芽萌动第2天D-CI含量为1.27 mg/g,发芽萌动第6天,其含量达到最大值1.51 mg/g。在苦荞发芽萌动前2天中,D-CI含量增加了3倍左右,说明D-CI是在发芽萌动初期迅速合成。
2.4 苦荞芽粉发芽萌动过程中活性成分变化趋势
苦荞芽粉发芽萌动过程活性成分变化趋势如图4所示。

图4 苦荞芽粉发芽过程活性成分变化趋势Fig.4 Change trend of bioactive substance of buckwheat malt powder during germination
由于发芽萌动第1天,苦荞芽仅露白,无法进行其成分测定,故从发芽萌动第2天开始对其功能成分进行测定。苦荞发芽萌动过程中,芽粉的总黄酮、芦丁、D-CI含量呈下降趋势,槲皮素呈缓慢上升趋势。说明在芽粉中,功能成分的合成积累主要发生在苦荞萌动初期。值得一提的是,在发芽萌动第2天苦荞芽粉中DCI含量高达18.38 mg/g,是未萌动苦荞全粉0.32 mg/g的57倍左右。
2.5 苦荞总粉、全粉及芽粉发芽萌动过程中功能成分的变化
苦荞发芽萌动过程中总黄酮、芦丁、槲皮素及DCI含量变化趋势如图5~图8所示。
总粉为苦荞全粉与芽粉的总和。由图5~图8可知,发芽第2天,芽粉中的总黄酮、槲皮素、D-CI含量均高于全粉中其含量,特别是D-CI的含量(18.38 mg/g)是此时全粉中D-CI含量(1.27 mg/g)的14倍左右;芦丁含量与全粉中芦丁含量相差不多。此后,芽粉中总黄酮、芦丁、D-CI含量随发芽萌动时间延长而减少,表明芽粉中功能成分的合成积累主要发生在发芽萌动初期。
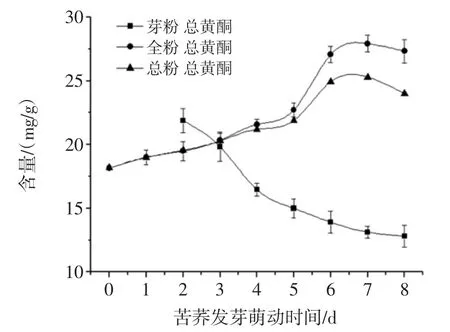
图5 苦荞发芽中总黄酮含量变化趋势Fig.5 Total flavonoids content change of buckwheat during germination
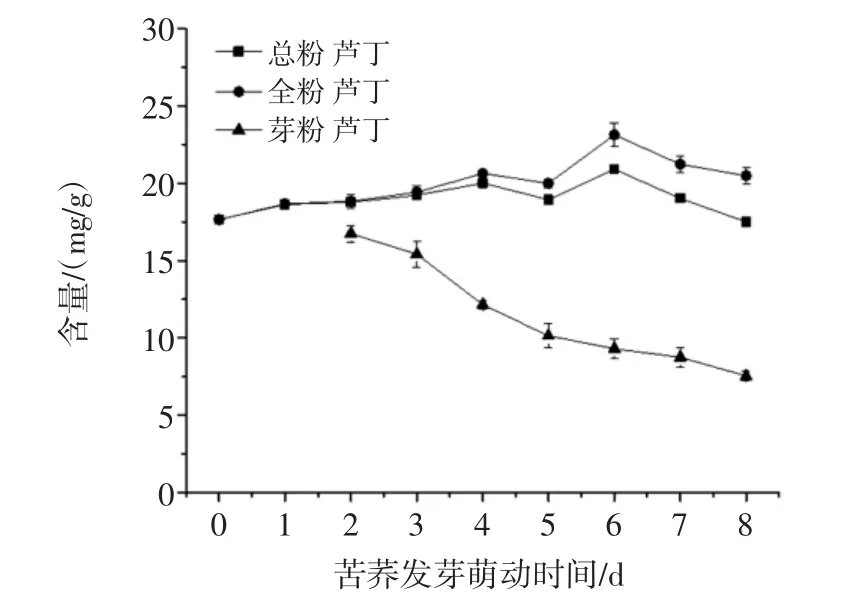
图6 苦荞发芽中芦丁含量变化趋势Fig.6 Rutin content change of buckwheat during germination

图7 苦荞发芽中槲皮素含量变化趋势Fig.7 Quercetin content change of buckwheat during germination
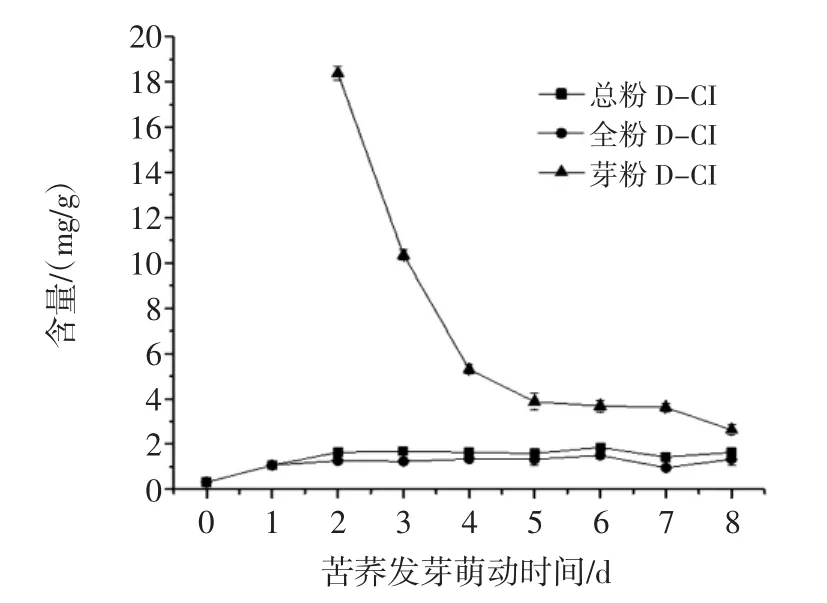
图8 苦荞发芽中D-CI变化趋势Fig.8 D-CI content change of buckwheat during germination
由于全粉在总粉中所占比重较大(由图1可知),苦荞总粉中总黄酮、芦丁、槲皮素及D-CI含量变化趋势与苦荞全粉中其变化趋势保持一致,均呈不同程度上升趋势。全粉与总粉中活性成分的合成积累可能发生在发芽萌动的整个过程中,在发芽萌动第6天,全粉与总粉中芦丁含量最高。
3 讨论
3.1 苦荞发芽萌动生长趋势及基本成分变化
随着苦荞发芽萌动时间延长,苦荞发芽率芽长及其比重随之增长。在发芽萌动第2天,苦荞发芽率增至90.60%,芽粉比重为2.15%,发芽第6天,苦荞发芽率达99.33%,芽粉比重16.10%,第8天芽粉所占比重为23.01%,表明苦荞的发芽主要发生在前期,发芽后期主要是芽体的生长。
苦荞发芽萌动过程,主要是碳水化合物含量由73.96%下降至65.76%,碳水化合物的水解可为苦荞发芽萌动提供能量物质及物质转化的中间体物质。凌孟硕等[29]在发现苦荞在萌发过程中,总淀粉含量呈直线下降的趋势,淀粉降解可为苦荞萌发提供能量物质,这与本研究结果一致。苦荞萌发中其他营养物质蛋白质、脂肪、粗纤维及灰分的含量略微上升。而张美莉[30]对萌发前后苦荞中脂肪及矿物质元素含量分析,发现萌发前后其含量无明显变化;这可能是本研究中的苦荞全粉是去除苦荞芽后制备,导致其相对含量略微升高。
3.2 苦荞发芽萌动过程中黄酮类物质及D-CI含量变化
发芽萌动第2天,苦荞芽粉中总黄酮含量为21.87 mg/g,芦丁 16.74 mg/g,槲皮素 0.995 mg/g,D-CI含量高达18.38 mg/g;随着发芽时间延长,芽粉中总黄酮、芦丁、D-CI含量均呈不同程度下降趋势,表明芽粉中活性成分的合成积累主要发生在发芽初期。
苦荞全粉中活性成分随发芽时间的适当延长而增加,在发芽第6天,全粉中芦丁含量达到最高,为23.13 mg/g,继续进行萌发,芦丁含量会降低。王青[31]在对苦荞萌发过程中,发现第六天时其芦丁含量最高,与本研究中芦丁变化趋势相一致。Suzuki等[32]发现苦荞萌发过程中,芦丁含量在增加,而黄酮醇-3-糖苷酶(可降解芦丁)含量及活性均在下降,说明在苦荞发芽过程中,芦丁处于合成积累的阶段。D-CI在苦荞发芽萌动第1天,其含量由0.32 mg/g迅速增长为1.07 mg/g,发芽萌动第2天D-CI含量为1.27 mg/g,发芽萌动第6天,其含量达到最大值1.51 mg/g。苦荞全粉中DCI的合成主要发生在萌动发芽初期,中后期D-CI的合成缓慢。
苦荞发芽后可分为芽粉及全粉。苦荞总粉为芽粉与全粉的总和。在萌动初期,苦荞芽粉中D-CI含量明显高于苦荞全粉中D-CI的含量,总黄酮、槲皮素含量也稍高于全粉中其含量。由于芽粉所占比重较小,且芽粉中活性成分物质随发芽时间延长呈下降趋势,而全粉所占重相对较大,且其功能成分含量总体呈上升趋势,总粉中功能成分含量的变化与苦荞全粉中其变化趋势一致。
4 结论
随着苦荞发芽时间延长,苦荞发芽率芽长及其比重随之增长。试验结果表明苦荞的发芽主要发生在前期,发芽后期主要是芽体的生长。芽粉中总黄酮、芦丁、D-CI在发芽初期含量较高;全粉中D-CI的合成也主要发生在发芽初期,芦丁、槲皮素的合成主要在发芽中后期。
对苦荞发芽不同时期不同部位活性物质的含量变化有了一定了解后,人们可根据自己需要,选择苦荞发芽萌动时间及确定不同部位产品的用途,从而更合理的利用苦荞,提高其经济价值。
[1]徐宝才,肖钢,丁霄霖,等.液质联用分析测定苦荞黄酮[J].食品科学,2003,24(6):113-117
[2]赵刚,陕方.中国苦荞[M].北京:科学出版社,2008
[3]臧志和,曹丽萍,钟玲.芦丁的药理作用及制剂的研究进展[J].医药导报,2007,26(7):758-760
[4]马溶,庞广昌.芦丁对现代文明病的作用[J].食品科学,2013,34(7):307-311
[5]赵钢,唐宇,王安虎.荞麦的成分功能研究与开发应用[J].四川农业大学学报,2001,19(4):355-358
[6]张泽生,裴雅,高云峰,等.D-手性肌醇的研究和开发[J].中国食品添加剂,2013(3):77-82
[7]陕方,李文德,林汝法,等.苦荞提取物对糖尿病模型大鼠血糖的影响[J].中国食品学报,2006,6(1):208-211
[8]曹文明,张燕群,苏勇.荞麦手性肌醇提取及其降糖功能研究[J].粮食与油脂,2006(1):22-24
[9]Larner J.D-chiro-inositolits functional role in insulin and its deficit in insulin resistance[J].International Journal of Experimental Diabetes Research,2002,3(1):47-60
[10]Ortmeyer H K,Lamer J,Hansen B C.Effects of D-chiro-inositol Added to a Meal on Plasma Glucose and Insulin in Hyperinsulinemic Rhesus Monkey[J].Obesity Research,1995,3(SuPP14):6055-6085[11]周小理,宋鑫莉.萌动对植物籽粒营养成分的影响及荞麦萌动食品的研究[J].上海应用技术学院学报(自然科学版),2009,9(3):171-174
[12]蔡马.萌发对荞麦营养成分的影响研究[J].西北农业学报,2004,13(3):18-21
[13]Zhou Yiming,Wang Hong,Cui Linlin,et al.Evolution of nutrient ingredients in tartary buckwheat seeds during germination[J].Food Chemistry,2015,33(8):271-273
[14]Bau H M,Villaume C,Nicolas J P,et al.Effect of germination on chemical composition,biochemical constituents and antiutritional factors of soyabean(Glycine max)seed[J].Agricultural science,1997,73:177-182
[15]郭鸰,霍贵成,贾振宝,等.大豆发芽过程中抗营养因子的变化[J].食品与发酵工业,2008,34(3):20-24
[16]侯建霞.苦荞活性成分分析及其在萌发过程中的变化研究[D].硕士学位论文,江南大学,2007
[17]王学辉,薛风照.苦荞麦萌发过程中营养物质的变化及分布研究[J].农业机械-粮油加工,2013(4):63-66
[18]刘金福,李晓雁,孟蕊.苦荞发芽过程中促进黄酮合成的因素初探[J].食品工业科技,2006(10):106-108
[19]周小理,宋鑫莉,周一鸣,等.苦荞萌发期抗氧化活性规律的研究[J].上海应用技术学院学报(自然科学版),2009,30(5):9-11
[20]唐宇,赵钢,任建川.荞麦中总黄酮和芦丁含量的变化[J].植物生理学通讯,1989(1):33-35
[21]石磊,刘超,梁霞,等.萌发荞麦中芦丁和槲皮素含量变化的研究[J].食品研究与开发,2016,37(15):30-33
[22]宋雨,邹亮,赵江林,等.苦荞萌发过程中D-手性肌醇含量变化的探究[J].食品科技,2016,41(2):80-83
[23]李红梅,胡俊君,李云龙,等.苦荞米及萌动苦荞米加工工艺研究[J].食品工业科技,2011,32(12):362-364
[24]中国预防医学科学院标准处.食品卫生国家标准汇编[M].中国标准出版社,1999
[25]位杰,吴翠云,蒋媛,等.蒽酮法测定红枣可溶性糖含量条件的优化[J].食品科学,2014,35(24):136-140
[26]周一鸣.苦荞麸皮中黄酮类化合物的提取、分离及其抗氧化性活性的研究[D].硕士学位论文,陕西师范大学,2008
[27]王咏梅,金晓英,袁东星,等.高效液相色谱法直接测定肌醇样品中肌醇的含量[J].食品科学,2001,22(8):71-72
[28]胡俊君,蒋梅峰,林勤保,等.苦荞麸皮中D-手性肌醇的分离纯化[J].食品工业科技,2009,30(4):197-199
[29]凌孟硕,唐年初,赵晨伟,等.苦荞麦萌发过程中营养物质的变化分布及磨浆提取工艺[J].食品科学,2013,34(22):92-96
[30]张美莉.萌发荞麦种子内黄酮与蛋白质的动态变及抗氧化性研究[D].博士学位论文,中国农业大学,2004
[31]王青.苦荞萌发物中营养成分提取测定及黄酮类化合物抗肿瘤活性的研究[D].硕士学位论文,上海海洋大学,2009
[32]Suzuki T,Honda Y,Funatsuki W,et al.Purification and characterization of flavonol 3-glucosidase,and its activity during ripening in tartary buckwheat seeds[J].Plant Science,2002,163(3):417-423
Content Changes of Active Components in Different Parts of Buckwheat during Germination
HU Jun-jun,YI Xin,LI Hong-mei,HE Yong-ji,BIAN Jun-sheng,LI Yun-long*
(Institute of Agricultural Products Processing of Shanxi Academy of Agricultural Sciences,Taiyuan 030031,Shanxi,China)
After germination,the tartary buckwheat was divided into two parts:malt and kernel.The contents changes of total flavonoids,rutin,quercetin and D-CI of malt powder and whole powder was studied in the different germination.The results showed that the content of total flavonoids,rutin and D-CI decreased gradually and the content of quercetin increased slowly from second day of germination later in the malt powder.The D-CI content of malt powder was as high as 18.38 mg/g in the second day of germination,however the D-CI content was only 0.32 mg/g of whole buckwheat powder without germination.With the germination,the content of total flavonoids and rutin of the whole powder increasd firstly and then decreased.The content of total flavonoids reached the maximum at 27.92 mg/g on the seventh day of germination,and the content of rutin reached the maxmum at 23.13 mg/g on the sixth day of germination.The content of quercetin of whole powder increased with germination.The quercetin content increased rapidly in the mid-anaphasc germination,and the content was 6.85 mg/g on the eighth of germination.The D-CI content was increasing slowly that the content was 1.07 mg/g on the first day and 1.51 mg/g on the sixth day of germination.The content of total flavonoid,rutin,D-CI of malt powder was higher in the early germination.The synthesis of D-CI of whole powder was also occurred in the early germination;and the synthesis of rutin and quercetin was mainly occurred in the mid-anaphasc germination.
tartary buckwheat;germination;malt powder;whole powder;bioactive substance
10.3969/j.issn.1005-6521.2017.23.003
国家现代农业(燕麦荞麦)产业技术体系项目(CARS-08-D-2);山西省科技攻关项目(20150311021-1)
胡俊君(1980—),男(汉),助理研究员,本科,研究方向:农产品深加工。
*通信作者:李云龙(1979—),男(汉),副研究员,研究方向:杂粮深加工。
2017-05-03

