小剂量环孢素联合小剂量激素治疗膜性肾病的疗效观察
张健 李冀军 宋岩
·论著·
小剂量环孢素联合小剂量激素治疗膜性肾病的疗效观察
张健 李冀军 宋岩
目的观察小剂量环孢素联合小剂量激素治疗特发性膜性肾病(idiopathic membranous nephropathy,IMN)的临床疗效以及不良反应,以探讨更加安全有效的治疗方案。方法选择37例解放军总医院第一附属医院收治的IMN患者,予以小剂量环孢素(1.5~3.0 mg·kg-1·d-1)联合小剂量糖皮质激素(泼尼松0.2~0.4 mg·kg-1·d-1),治疗时间12~24个月,随访时间12~24个月。观察临床疗效、不良反应及并发症发生情况。将37例IMN患者以第12个月随访疗效结果分为2组,完全或部分缓解的为有效组,未缓解的患者为无效组,采用单因素分析影响预后的相关因素。结果37例患者治疗12个月后完全缓解23例(62.2%),部分缓解10例(27.0%),未缓解4例(11%);其中8例应用环孢素+激素4周内起效,4例在停药或减量过程中复发。单因素分析显示治疗有效组和无效组中患者的性别构成无统计学意义(Pgt;0.05)。无效组患者的年龄、病理分期III、IV期构成比例明显高于有效组,治疗前高血压、镜下血尿构成比例高于有效组,差异均有统计学意义(Plt;0.05)。结论小剂量环孢素联合小剂量激素治疗IMN是有效的,治疗后患者的尿酸水平会明显升高,需要引起重视;尿酸的升高可能与环孢素造成的肾小管损伤有关。患者的年龄、病理分期、高血压、镜下血尿均影响治疗的效果。
特发性膜性肾病;糖皮质激素;环孢素
膜性肾病是成人肾病综合征中常见的病理类型,根据其病因的不同,可以分为特发性膜性肾病(idiopathic membranous nephropathy,IMN)和继发性膜性肾病。IMN的临床表现轻重不一,个体预后差别也较大。根据国外资料报道,大约10%~30%的患者可出现自发缓解,大约10%~40%的患者最终会进入尿毒症期[1-2]。2012年改善肾脏病全球预后组织(Kidney Disease:Improving Global Outcomes, KDIGO)发布的指南推荐:对于临床表现为肾病综合征的IMN患者,初始的治疗建议是糖皮质激素联合使用烷化剂或钙调磷酸酶抑制剂。环孢素A(cyclosporin A,CsA)作为钙调磷酸酶抑制剂的一种,近年来被广泛应用于IMN的治疗中,并且取得了满意的疗效[3]。但是根据2012年KIDGO指南的推荐,对IMN患者需要给予CsA 3.5~5.0 mg·kg-1·d-1,分两次口服,1次/12h,加用泼尼松0.15 mg·kg-1·d-1联合治疗6个月[4]。我们认为这个剂量对中国人来说偏大,很容易出现牙龈增生、高尿酸血症、肝功能损伤,甚至出现肾间质小管损伤等不良反应,而且也有研究表明CsA的肾毒性是呈现剂量依赖性的[5]。对此国内外近年来也进行了一些小剂量环孢素治疗膜性肾病的研究,Hassan K等[6]使用了3.5 mg·kg-1·d-1环孢素治疗膜性肾病,取得了良好的效果,但服药疗程达5.5年,远远长于国内的常规治疗方案。同样,国内学者也对小剂量环孢素的应用进行了一些研究,环孢素的剂量在2~3 mg·kg-1·d-1,明显低于KIDGO指南的推荐剂量,但其合并使用的激素剂量均偏大,0.5~0.8 mg·kg-1·d-1,明显高于KIDGO指南的推荐剂量,而激素同样为具有免疫抑制作用,也面临一系列不良反应[7-9]。因此本研究尝试使用小剂量环孢素加小剂量激素治疗IMN,观察该方案的疗效、不良反应以及疗效的影响因素。
资料与方法
一、研究对象
选择解放军总医院第一附属医院肾内科2013年1月至2015年12月收治的37例IMN患者,其中男27例,女10例,年龄17~73岁,平均年龄(43.9+15.6)岁。纳入标准:经肾活检病理确诊为膜性肾病且肝肾功能正常的患者。排除标准:排除继发因素(自身免疫性疾病,乙型肝炎、丙型肝炎病毒感染、肿瘤、有机溶剂、药物等)及合并糖尿病。本研究经解放军总医院第一附属医院伦理委员会批准,所有患者均签署知情同意书。
二、方法
1.治疗方法 37例IMN患者中有31例是初治患者,直接给予小剂量CsA+小剂量激素治疗,另外6例为激素治疗无效后更改为小剂量CsA+小剂量激素治疗。具体治疗方案:口服CsA(新赛斯平,杭州中美华东制药有限公司),前24周给予1.5~3 mg·kg-1·d-1,分2次口服,监测CsA血药浓度谷值维持在100~150 mg/L,激素减量后缓慢减量为1~2 mg·kg-1·d-1,共服18~24个月;泼尼松给予0.2~0.4 mg·kg-1·d-1开始,8周后每2周逐渐减量至0.1~0.2 mg·kg-1·d-1维持,总疗程9个月。其余治疗:如利尿、抗凝等根据病情进行选择联合用药方案。
2.病理分期标准 参照Ehrenreich标准[10]:Ⅰ期为基底膜基本正常,沿基底膜上皮侧可见分散的较小电子致密物呈不规则分布;Ⅱ期为钉突形成,沉积物数目增加,广泛的上皮细胞足突消失;III期为沉积物由均匀分布变成不规则分布,呈虫烛状,钉突融合;IV期为沉积物的电子密度降低,基底膜不规则且明显增厚。肾穿刺组织进行免疫荧光、光镜和电镜检查,若光镜和电镜分期结果不统一,则以电镜结果为最终分期。
3.观察指标 随访12个月以上,前4周治疗期间每2周监测1次,以后每月1次监测治疗反应,内容包括血常规、尿常规、尿蛋白定量、肝肾功能、血脂、电解质、CsA血药浓度,同时观察尿量、水肿情况以及可能出现的药物不良反应。
4.疗效评定 治疗1、3、6、9、12个月的时候进行疗效评估。治疗的效果包括完全缓解,部分缓解及未缓解三类。完全缓解是指治疗后尿蛋白定量lt;0.3 g/d,血清白蛋白gt;35 g/L;部分缓解指尿蛋白定量下降大于基础值50%,且定量≤3.5 g/d,肾功能稳定;未缓解指尿蛋白下降小于基础值50%,或定量gt;3.5 g/d。
三、统计学处理
应用SPSS 18.0软件进行统计分析。计量资料以均数±标准差表示,治疗前后数值的比较采用配对样本t检验,Plt;0.05表示差异有统计学意义。
结 果
一、疗效
37例患者治疗12个月后完全缓解23例(62%),部分缓解10例(27%),未缓解4例(11%),其中8例应用环孢素+激素4周内起效,4例在停药或减量过程中复发。大部分患者在治疗3个月内起效。(表1)
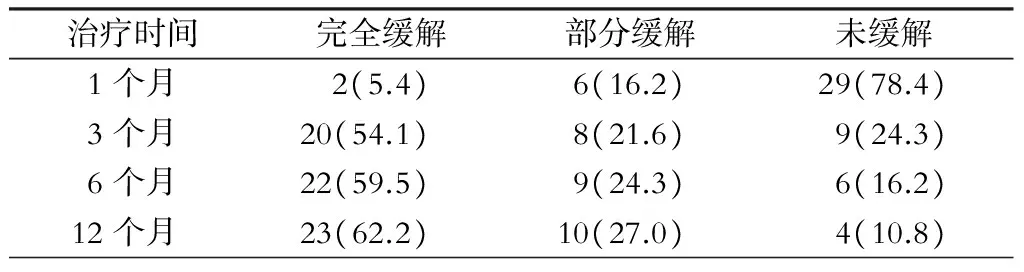
表1 37例IMN患者疗效分析[例(%)]
二、不良反应
主要不良反应有多毛症、胃肠道不适及牙龈增生。其中2例患者用药过程中出现重症肺炎,查血常规提示CD4+细胞绝对值下降,治愈后继续使用激素+环孢素治疗有效;1例青年男性患者在出现发热过程中使用赖氨匹林后出现急性肾衰竭,停药后血肌酐逐渐下降,病情平稳后再次使用激素+环孢素治疗,血肌酐未再出现升高。但整组患者在用药3个月后查血尿酸基线值明显升高[用药前(347.84±94.22) μmol/L,用药后(426.16±108.03) μmol/L,Plt;0.01]。
三、危险因素分析
根据治疗12个月后的疗效评判,将全部患者分为有效组(完全缓解和部分缓解)和无效组(未缓解),对患者的年龄、性别、免疫抑制剂治疗情况、病理分期、合并基础疾病情况、实验室相关检查等资料分别进行单因素分析。2组患者的性别无统计学意义(Pgt;0.05);无效组患者的年龄、病理分期III、IV期构成比例明显高于有效组,治疗前高血压、镜下血尿构成比例高于有效组,差异均有统计学意义(Plt;0.05)。
讨 论
IMN是成人肾病综合征的常见病因,约占我国肾活检诊断的原发性肾炎的10%[11]。IMN自然预后差异很大,大约20%~30%的患者可出现自发缓解,一部分患者表现为持续蛋白尿,但肾功能下降缓慢,而一部分患者则最终进入尿毒症。作为免疫系统介导的慢性肾小球疾病,起初临床上大多单独使用糖皮质激素来治疗,但随着对膜性肾病研究的深入,免疫抑制剂联合激素的治疗方案被证实更为有效。2012年KDIGO临床实践指南推荐糖皮质激素联合环磷酰胺作为首要方案对该病进行治疗,但由于该病的高复发性,造成糖皮质激素与环磷酰胺累计剂量较大,潜在一定的药物毒性作用,并可一定概率引发糖尿病,因此存在一定的局限性[12]
CsA是由11个氨基酸组成的环形多肽,来源于土壤霉菌,属于钙调神经酶抑制剂的一种,从1979年开始被发现,其后因疗效显著,被广泛的应用于器官移植和自身免疫性疾病的治疗,近年来也被应用于难治性肾病综合征和其他肾脏疾病的治疗,且对IMN临床疗效较好,2012年KDIGO临床实践指南将钙调神经酶抑制剂类药物推荐为IMN的初始治疗替代方案[4]。虽然CsA的临床疗效是十分肯定的,但是仍然被用作替代药物,部分原因就是在于其不良反应,尤其是肝肾毒性。CsA的治疗效果、不良反应与给药剂量和血药浓度相关,安全的血药范围较窄。临床治疗中,成人CsA的给药剂量若达到5 mg·kg-1·d-1,即使血药浓度低于治疗窗,也会增加CsA的毒性[13]。而且Feutren等[14]研究发现,环孢素的初始剂量为环孢素肾毒性发生的独立危险因素,CsA肾毒性的出现与CsA血药浓度不相关,在出现不良反应后停药或者减量,血肌酐可逐渐下降。因此Fujiwara等[15]研究发现使用小剂量环孢素(2~3 mg·kg-1·d-1)+甲泼尼龙(30 mg/d),治疗微小病变性肾病9个月,并没有出现肾毒性,因此认为小剂量环孢素治疗微小病变性肾病是安全的。Cattran等[16]探讨用CsA治疗IMN中建议小剂量,每天3~4 mg/kg,维持6个月以上,小剂量通常不会造成高血压,但可以出现肾功能不全,合并肾功能不全的患者停药后肾功能可恢复。我们认为目前研究中采用的3~4 mg·kg-1·d-1环孢素剂量对于中国人来说仍偏大,因此,我们尝试使用更低剂量的CsA来治疗膜性肾病,对此国内学者进行了大量研究。邱波等[7]对29例膜性肾病患者给予醋酸泼尼松(0.5 mg·kg-1·d-1)、环孢素(2~3 mg·kg-1·d-1)、雷公藤多苷(60 mg/d)的联合治疗12个月,最终12例(41.4%)完全缓解,12例部分缓解(41.4%),证实了小剂量环孢素+小剂量激素治疗膜性肾病是有效的。黄志辉[8]对21例膜性肾病患者采用了糖皮质激素+环孢霉素+来氟米特的治疗方案,具体方案为醋酸强的松(0.5 mg·kg-1·d-1)+环孢霉素(2~3 mg·kg-1·d-1)+来氟米特(20 mg/d),连续治疗12个月,最终完全缓解率42.86%,部分缓解率33.33%。以上研究均联合应用了其他免疫抑制剂,目前指南并不推荐来氟米特和雷公藤用于膜性肾病的治疗,且增加了其他免疫抑制剂,就增加了患者出现过敏以及其他不良反应的风险。对此,刘继承等[17]使用了小剂量环孢素+激素的治疗方案,入组了22例膜性肾病患者,使用了CsA起始剂量2~3 mg·kg-1·d-1,泼尼松起始剂量0.5 mg·kg-1·d-1,治疗6个月后完全缓解7例(31.82%),部分缓解6例(27.27%)。刘艾芹等[18]对24例膜性肾病患者使用了小剂量环孢素+激素的方案,以环孢素2.5~3.5 mg·kg-1·d-1作为起始剂量,以泼尼松0.5~1 mg·kg-1·d-1作为起始剂量,治疗3个月后6例(25%)完全缓解,10例(41.7%)部分缓解;以上研究虽然环孢素的剂量在2~3 mg·kg-1·d-1,明显低于KIDGO指南的推荐剂量,但合并使用的激素剂量均偏大,明显高于KIDGO指南的推荐剂量,而激素同样为具有免疫抑制作用,也面临一系列不良反应。因此,本研究尝试使用更低剂量的激素, CsA(1.5~3 mg·kg-1·d-1)联合泼尼松(0.2~0.4 mg·kg-1·d-1)治疗,12个月后完全缓解率可达到62.2%,部分缓解27.0%,完全缓解率和部分缓解率与其他研究相仿,证实了更小剂量CSA联合小剂量激素治疗IMN是有效的。同时本研究发现了,在如此低的剂量下,患者治疗后的尿酸水平仍然明显升高;而Kengne-Wafo等[19]也在研究中发现了使用低剂量环孢素会导致尿酸升高,并认为这种尿酸升高与环孢素造成的肾小管损伤是相关的。因此,可以肯定使用小剂量 CsA加小剂量激素治疗IMN是有效的,而且不良反应少,但仍会出现血尿酸升高的不良反应。当然,本文观察例数仍较少,有待于进一步大样本观察总结,以及进一步观察更低剂量的环孢素治疗是不是更安全和有效的。
目前国内外针对IMN患者预后影响因素的研究较多。日本的一项研究发现起病时的年龄,男性和发病时的血肌酐是影响IMN患者预后的危险因素[20]。后续研究多认为肾小管间质损伤是IMN肾功能恶化进展的重要预测因子。Wehrmann等[21]对334例IMN患者随访5.2年,认为肾小管间质病变程度是唯一与预后相关的因素。Zuo等[22]观察217例IMN患者发现,肾小管间质慢性病变加重是其进展至终末期肾病的高危因素。秦丽丽等[23]对137名IMN患者资料分析发现年龄≥60岁是IMN患者进展至eGFRlt;30 ml/min的独立危险因素;一项来自日本的大规模回顾性研究也认为年龄大于59岁是膜性肾病发生终末期肾病的独立危险因素[24]。但针对影响免疫抑制剂治疗特发性膜性肾病患者预后的相关因素的研究很少,国内高世平等[25]对149例IMN患者进行了12~60个月的观察,结果显示持续高尿蛋白、高血压,镜下血尿、高SCr水平是影响IMN患者免疫抑制剂治疗预后的主要影响因素,而年龄对预后并无影响。在本研究中发现无效组患者的年龄、病理分期III、IV期构成比例明显高于有效组,治疗前高血压、镜下血尿构成比例高于有效组,结果大致与国内的研究结果一致。高血压可引起肾小球硬化,导致肾脏高滤过,而环孢素可引起肾脏血管收缩,加重肾脏缺血,从而影响治疗预后;镜下血尿影响预后的原因可能是镜下血尿患者可能存在肾静脉血栓,影响肾脏的血液循环,给予免疫抑制剂治疗时,到达病变肾脏组织局部的药物浓度有限,而且还可能出现顽固性激素抵抗,因此对于疗效不佳的镜下血尿患者,应考虑肾静脉血栓的可能性,进一步检查明确诊断,适当抗凝治疗,以提高疗效。但关于年龄的问题主要考虑为本研究纳入的病例数较少,无效组病例数更少所致,可能结果存在一定偏差,因此年龄对IMN患者免疫抑制剂治疗预后的影响尚不得而知,需进一步大样本观察总结。
[1] Wasserstein AG. Membranous glomerulonephritis[J]. J Am Soc Nephrol, 1997, 8(4): 664-674.
[2] Donadio JV Jr, Torres VE, Velosa JA, et al. Idiopathic membranous nephropathy: the natural history of untreated patients[J]. Kidney Int, 1988, 33(3): 708-715.
[3] Ponticelli C, Glassock R. Glomerular disease: membranous nephropathy-a modern view[J]. Clin J Am Soc Nephrol, 2014, 9(3): 609-616.
[4] Kidney Disease: Improving Global Outcomes (KDIGO)Glomerulonephritis Work Group. KDIGO Clinical practice guideline for glomerulonephritis[J]. Kidney Int, 2012, (Suppl 2): 143-153.
[5] Etienne I, Toupance O, Bénichou J, et al. A 50% reduction in cyclosporine exposure in stable renal transplant recipients: renal function benefits[J]. Nephrol Dial Transplant, 2010, 25(9): 3096-3106.
[6] Hassan K, Kristal B. Improving long-term outcomes in idiopathic membranous nephropathy using a distinctive cyclosporine regimen[J]. Minerva Urol Nefrol, 2016, 68(3): 293-301.
[7] 邱波, 梁卫东, 袁良东. 小剂量激素、环孢素A、雷公藤多苷联合治疗特发性膜性肾病的临床观察[J]. 实用药物与临床, 2014, 17(11): 1427-1430.
[8] 黄志辉. 小剂量糖皮质激素联合环孢霉素和来氟米特对原发性膜性肾病疗效观察[J]. 中医临床研究, 2016, 8(1): 136-138.
[9] 崔琳琳, 叶朝阳. 钙调神经磷酸酶抑制剂治疗特发性膜性肾病的回顾性研究[J]. 临床肾脏病杂志, 2015, 15(7): 27-432.
[10] T Ehrenreich, J Churg. Pathology of memboranous nephropathy[J]. Pathology, 1968, 3:145-186.
[11] Li LS, Liu ZH. Epidemiologic data of renal diseases from a single unit in China: analysis based on 13, 519 renal biopsies[J]. Kidney Int, 2004, 66(3): 920-923.
[12] 刘芳, 付淑丽. 不同剂量激素联合环孢素治疗特发性膜性肾病的临床研究[J]. 中华肾脏病杂志, 2016, 32(12): 905-912.
[13] 环孢素A在肾内科应用专家协作组. 环孢素 A 治疗肾小球疾病的应用共识[J]. 中国血液净化, 2007, 6(7): 393-395.
[14] Feutren G, Mihatsch MJ. Risk factors for cyclosporine-induced nephropathy in patients with autoimmune diseases. International Kidney Biopsy Registry of Cyclosporine in Autoimmune Diseases[J]. N Engl J Med, 1992, 326(25): 1654-1660.
[15] Fujiwara A, Hirawa N, Kobayashi Y, et al. Efficacy of cyclosporine combination therapy for new-onset minimal change nephrotic syndrome in adults[J]. Clin Exp Nephrol, 2015, 19(2): 240-246.
[16] Cattran D. Management of membranous nephropathy: when and what for treatment[J]. J Am Soc Nephrol, 2005, 16(5): 1188-1194.
[17] 刘继承, 安自民, 张立存. 环孢素A联合激素治疗膜性肾病的疗效观察[J]. 齐齐哈尔医学院学报, 2013, 34(13): 1910-1912.
[18] 刘艾芹, 刘国平, 于磊. 环孢素A治疗特发性膜性肾病临床研究[J]. 内蒙古医学杂志, 2016, 48(12): 1505-1506.
[19] Kengne-Wafo S, Massella L, Diomedi-Camassei F, et al. Risk factors for cyclosporin A nephrotoxicity in children with steroid-dependant nephrotic syndrome[J]. Clin J Am Soc Nephrol, 2009, 4(9): 1409-1416.
[20] Reichert LJ, Koene RA, Wetzels JF. Prognostic factors in idiopathic membranous nephropathy[J]. Am J Kidney Dis, 1998, 31(1): 1-11.
[21] Wehrmann M, Bohle A, Bogenschutz O, et al. Long-term prognosis of chronic idiopathic membranous glomerulonephritis. Ananalysis of 334 cases with particular regard to tubule-interstitial changes[J]. Clinical Nephrology, 1989, 31(2): 67-76.
[22] Zuo K, Wu Y, Li SJ, et al. Long-term outcome and prognostic factors of idiopathic membranous nephropathy in the Chinese population[J]. Clinical nephrology, 2013, 79(6): 445-453.
[23] 秦丽丽, 王艳秋, 杨旭. 特发性膜性肾病患者预后的危险因素分析[J]. 中国综合临床, 2014, 30(3): 263-268.
[24] Shiiki H, Saito T, Nishitani Y, et al. Prognosis and risk factors for idiopathic membranous nephropathy with nephrotic syndrome in Japan[J]. Kidney Int, 2004, 65(4): 1400-1407.
[25] 高世平, 王莉, 姚恬. 特发性膜性肾病患者免疫抑制剂治疗效果的影响因素[J]. 海南医学, 2017, 27(8): 1230-1232.
Clinicalobservationoflow-dosecyclosporineAcombinedwithsmalldoseofhormoneinthetreatmentofidiopathicmembranousnephropathy
ZHANGJian,LIJi-jun,SONGYan.
DepartmentofNephrology,theFirstAffiliatedHospitalofPLAGeneralHospital,Beijing100039,China
ObjectiveTo observe the clinical effect and adverse reactions of low dose of cyclosporine A combined with small dose of hormone in the treatment of idiopathic membranous nephropathy, and to explore the safe and effective treatment strategy.MethodsThirty-seven cases of idiopathic membranous nephropathy admitted at the Department of Nephrology, the First Affiliated Hosital of PLA General Hospital were given low-dose cyclosporine A (1.5~3.0 mg/kg every day) combined with small dose of glucocorticoid (prednisone 0.2~0.4 mg/kg every day). The treatment course was 12~24 months, and the follow-up period was 12-24 months. The clinical efficacy, adverse reactions and complications were observed. At 12th month during the follow-up period, the patients were divided into effective group (complete or partial remission) and ineffective group (no remission). The single factor analysis was used to analyze the prognostic factors.ResultsIn 37 cases, 23 cases (62%) achieved complete remission, 10 cases (27%) partial remission, and 4 cases (11%) no remission. Eight cases had the effect of cyclosporine A within 4 weeks, and 4 cases relapsed in stopping drug or reducing process. Univariate analysis showed no statistically significant difference in gender between the effective and ineffective groups (Pgt;0.05). The proportion of the patients in the ineffective group in age, and pathological stage III and IV was significantly higher than that in the effective group, and the proportion of hypertension and microscopic hematuria before treatment in the ineffective group was significantly higher than that in the effective group (Plt;0.05).ConclusionsLow dose of cyclosporine A combined with low dose of prednisone in the treatment of idiopathic membranous nephropathy is effective. But even such a low dose, after treatment the uric acid level is still significantly increased, because of renal tubular injury caused by cyclosporine A. The patient's age, pathological stage, hypertension and microscopic hematuria all affect the effectiveness of treatment.
Idiopathic membranous nephropathy; Glucocorticoid; Cyclosporine A
10.3969/j.issn.1671-2390.2017.11.007
首都卫生发展科研专项项目(No.2011-5002-04)
100039 北京,解放军总医院第一附属医院肾内科
2017-02-12
2017-08-25)

