LC-MS-MS法测定葡萄中的脱落酸含量
孙 震,任 瑞,李增良,毕 波
(河北省林果桑花质量监督检验管理中心,河北石家庄 050081)
LC-MS-MS法测定葡萄中的脱落酸含量
孙 震,任 瑞,李增良,毕 波
(河北省林果桑花质量监督检验管理中心,河北石家庄 050081)
葡萄中含有较多的糖类、色素和果胶,干扰项较多,对微量脱落酸进行定量分析较为困难。针对此问题,建立了高效测定葡萄中脱落酸含量的LC-MS-MS方法,对提取剂、提取方式、富集净化、色谱条件和质谱条件多个关键环节进行了研究。将葡萄样品粉碎匀浆制成待测样,以甲醇+甲酸(二者体积比为99.5∶0.5)作为提取剂,振荡提取30 min,将提取液经MAX Cartridge SPE柱富集净化后进行分析。当上样溶剂为20%~50%(质量分数)的甲醇时,净化洗脱效率较好,能有效去除杂质。色谱条件为ODS2色谱柱(2.1 mm×150 mm,5 μm),乙腈为A相、质量分数为0.1%的甲酸作为B相流动相,流量为0.2 mL/min,梯度洗脱。在负离子监测模式下,选择263.1~153.2作为定性定量离子对,采用标准物质的保留时间和SRM图谱,对照2种方式对样品进行准确定性,外标法以峰面积计算进行定量。结果表明,在19.05~381.00 ng/mL范围内线性关系良好,回收率为92.2%~110.4%,RSD值<8.1%,可为高效、快速、准确测定葡萄中的脱落酸含量提供有价值的分析方法。
食品检验学;LC-MS-MS法;测定;葡萄;脱落酸含量
脱落酸又叫S-诱抗素,具有促进植物平衡吸收水肥和协调体内代谢的能力,对葡萄的抗逆性和果实品质均有一定的影响。在实际生产中施用适当浓度的脱落酸可以提高葡萄的抗逆性和商品价值,减少农药和其他化学药品的施用量[1]。葡萄中含有较多的糖类、色素和果胶,干扰项较多,对微量脱落酸进行定量分析较为困难。目前,脱落酸的测定方法主要有液相色谱法[2-7]、气质联用法[8-9]、酶联免疫法[10-11]、液相色谱质谱法[12-17]等。液相色谱法具有较高的准确性,但易受到基体杂质干扰的影响,糖类、果胶等复杂基质条件下的应用研究少有报道。气质联用法利用了质谱检测的高灵敏度,但通常需要进行柱前衍生来提高植物激素的挥发性,而且气相色谱入口处和色谱柱所处的高温可能会使植物激素分解,影响检测结果的准确性。酶联免疫法具有较高的特异性,作为一种快速筛选方法,具有较大的应用潜力,但由于易出现交叉反应,因此在适用范围、灵敏度、准确性等方面都受到一定的限制。本研究建立的色谱质谱联用方法,兼具色谱的高分离能力和质谱的强鉴别能力,对复杂基质有良好的灵敏度,无需衍生化,前处理程序简化,具有前处理操作简单、线性范围宽、灵敏度高的优点,可以缩短检测时间,减少误判,提高准确度,对提高葡萄中脱落酸的检测效率、保障葡萄果品质量安全具有积极的现实意义。
1 材料与方法
1.1仪器设备与试剂材料
LC-MS-MS,UltiMate 3000+TSQ Quantum Access Max,Thermo SCIENTIFIC公司提供;3K30高速冷冻离心机,SiGMA公司提供;SD超声波清洗器,北京中晟铭科技有限公司提供;MS3 basic涡旋振荡器,IKA公司提供;N-EVAP氮吹仪,Organomation公司提供;Nylon针式滤膜0.22 μm,DiKMA公司提供;电子天平,梅特勒公司提供;MAX SPE固相萃取柱,Waters公司提供;甲醇、乙腈,残留级,Fisher Scientific公司提供;甲酸、脱落酸(98.5%),SiGMA-ALDRRICH公司提供;葡萄为市场购买。
1.2试验方法
1.2.1 样品制备
将新鲜的葡萄去梗,放入食品加工器粉碎匀浆,制成待测样后放入分装容器中,于-20~-16 ℃条件下保存,备用。
1.2.2 试样提取剂前处理
称取匀浆试样10.0 g(精确至0.1 g),置于50 mL具塞聚丙烯试管中(用于回收试验的样品,加入一定量的标准溶液并匀浆),加入20.0 mL提取剂(甲醇+甲酸,二者体积比为99.5∶0.5),于涡旋振荡器中混合1 min,超声提取30 min,然后以5 000 r/min转速离心8 min,将上清液转移至50 mL比色管中。将残渣加入5 mL提取剂,在涡旋振荡器上充分混合2 min,再以5 000 r/min的转速离心8 min,合并上清液。再重复1次,合并上清液,用水定容至50 mL。
将固相萃取柱经5 mL甲醇平衡,用5 mL水淋洗。取上清液5 mL,过萃取柱,用 5 mL甲醇洗脱,洗脱液氮吹,用甲醇定容至5 mL,过0.22 μm滤膜,上机测定。
1.2.3 色谱条件
采用Inertsil ODS2(2.1 mm×150 mm,5 μm)色谱柱(日本GL Science公司提供);流动相:A相为乙腈,B相为0.1%(体积分数,下同)甲酸水溶液,流速为0.2 mL/min。梯度洗脱:0~3 min,3%A;3~8 min,3%~50%A;8~10 min,50%~70%A;10~15 min,70%~80%A;15~25 min,80%A;25~27 min,80%~3%A;27~30 min,3%A。流速为0.2 mL/min,进样10.0 μL。
1.2.4 质谱条件
采用电喷雾离子源(ESI),负离子模式采集;喷雾电压为3 000 V;辅助气流量,N25 arb;鞘气压力,N25 psi;碰撞气压力,Ar 1.0 mTorr;毛细管温度为275.0 ℃;蒸气温度为180.0 ℃;选择SRM监测模式。定性定量离子对为263.1~153.2。其他质谱参数见表1。

表1 质谱参数
1.2.5 定性与定量
采用标准物质的保留时间和SRM图谱对照2种方式对样品进行准确定性,采用外标法以峰面积计算进行定量。依次配置不同质量浓度的标准溶液进行分析,以质量浓度为横坐标,定量离子峰面积为纵坐标绘制标准曲线。
2 结果与分析
2.1提取条件的选择
2.1.1 提取剂和提取方式
分别以甲醇、80%甲醇、90%甲醇、甲醇+甲酸(二者体积比为99.5∶0.5)、甲醇+水+甲酸(三者体积比90∶9.5∶0.5)、乙腈、80%乙腈作为提取剂,按照“试样前处理”称样、加标和定容。对第1组采用振荡提取方式提取60 min,对第2组采用超声提取的方式提取30 min,对比各提取剂在不同提取方式下的提取效率,结果见表2。
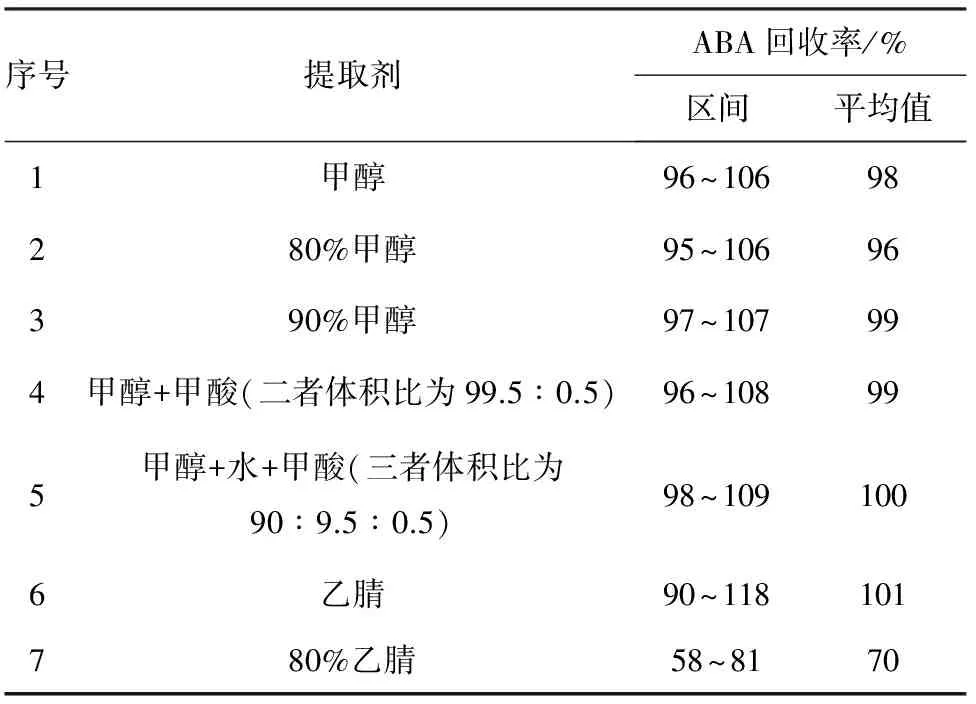
表2 提取效率比较
由表2可以看出:1)超声提取方式的提取效率显著高于振荡提取方式,7种溶剂采用振荡提取、超声波提取方式,脱落酸回收率分别为30%~65%和95%~108%;2)在超声波提取方式下,除80%乙腈外,其他6种提取剂的提取效率没有显著差别,同时,酸性环境下可以抑制目标物质的离子化,以获得对称的色谱峰型。因此,综合考虑提取效率和提取剂的毒性,确定甲醇+甲酸(二者体积比为99.5∶0.5)为目标物提取剂。
2.1.2 提取时间
以甲醇+甲酸(二者体积比为99.5∶0.5)作为提取剂,超声波提取时间分别定在15,30,45,60 min,选择较高效率、满足回收率要求的提取时间。结果见图1。结果表明:超声提取30 min时,提取效率满足要求。
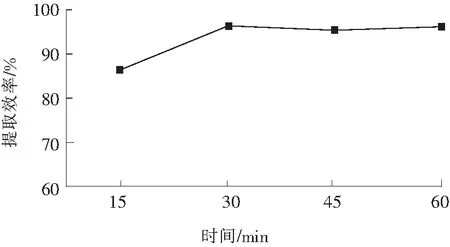
图1 提取时间的选择Fig.1 Extraction time selection
2.2富集净化条件的选择
综合时间成本和工作效率,采用了固相萃取法(SPE)。实验对1# StrataTMX patent pending (Phenomenex, 60 mg/3 mL),2# AccuBOND ODS-C18(Agilent Tech., 500 mg/6 mL),3# Cleanert NH2(Agela Tech.,500 mg/6 mL),4# MAX Cartridge (Waters OASIS,500 mg/6 mL) 等固相萃取柱进行了测试,分别考察上样溶剂为20%甲醇、50%甲醇和100%甲醇时,4种SPE柱的吸附洗脱效率。实验步骤如下:1)SPE平衡,先用5 mL甲醇淋洗,再用5 mL水淋洗;2)上样,取脱落酸储备液0.1 mL,加入到10 mL的容量瓶中,临用时分别配制成溶解介质为20%甲醇、50%甲醇和100%甲醇的标准混合工作溶液,取上述工作溶液1.0 mL加到SPE柱上;3)洗脱,用5.0 mL甲醇洗脱,收集洗脱液并定容至5.0 mL,摇匀,此洗脱液过0.22 μm滤膜,上机测定。结果表明:脱落酸在4# MAX Cartridge SPE柱的吸附洗脱效率较好,能有效去除杂质,当上样溶剂为20%~50%甲醇时效果较佳。
2.3色谱条件的选择
色谱柱 脱落酸与葡萄常用植物激素赤霉素的极性差异相对较小,通过调节洗脱梯度可以分离。结果表明,Spursil(思博尔)C18-EP,Inertsil(日本GL)ODS2均能够满足要求。
流动相及梯度 由于乙腈黏度较低,且使用乙腈时离子化效率优于甲醇,因此优先选用乙腈作为流动相A相,甲酸水溶液(0.1%甲酸)作为B相。洗脱梯度见表3。
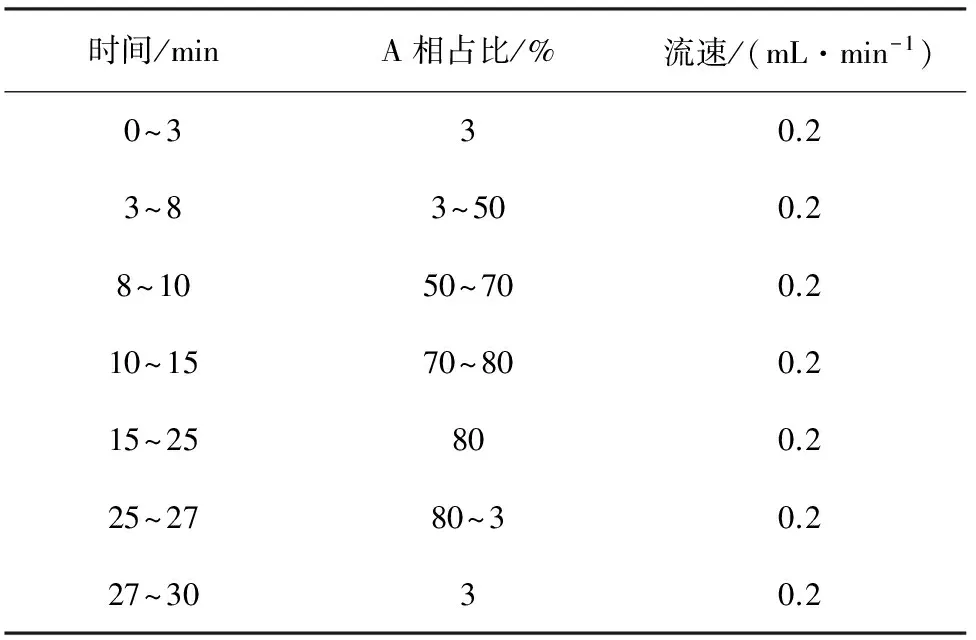
表3 洗脱梯度
离子监测模式 采用电喷雾质谱(ESI源),总离子监测方式,单标进样,分别在正离子、负离子监测模式下,对质谱测定参数进行优化,比较总离子流的丰度和稳定性。结果表明,负离子模式下总离子流的丰度和稳定性更佳。
定量离子对 MS/MS+MS方式下,单标进样进一步优化毛细管电压、锥孔电压、碰撞能量,筛选特征母离子下的子离子,优选离子流稳定、丰度高的母离子-子离子作为定性定量离子对。脱落酸MS/MS+MS图见图2。结果表明,263.1~153.2适宜作为定性定量离子对。

图2 脱落酸MS/MS+MS图Fig.2 Abscisic acid MS/MS+MS chart
2.4质谱条件的选择
在选择反应监测SRM模式下,分别优化离子对的质谱参数,确定最佳碰撞能量,作为定量测定条件。在Chrom Filter Peak Width为10 s,Collision Gas Pressure为1.0 m Torr,Q1 Peak Width(FWHM)为0.40,Cycle Time为5 s的条件下,碰撞能量为14 V、锥孔电压(Tube Lens)为-53 V较为适宜。
2.5方法评价
2.5.1 线性关系
配置脱落酸系列标准溶液,质量浓度依次为19.05,38.10,95.25,190.50,381.00 ng/mL。按照上述方法进行LC-MS-MS分析,建立标准曲线。以峰面积y对质量浓度x(ng/mL)进行线性回归分析,y=320.12x+555.54,R2=0.999,满足农药残留分析要求。进一步试验发现,在9.53~952.50 ng/mL范围内也呈现较好的线性关系。
2.5.2 检出限
以低含量标准物作为样品,按上述方法平行测定20次,以测定值的3倍标准偏差/标准曲线斜率方法,计算方法的检出限为0.06 mg/kg。
2.5.3 回收率和精密度
以葡萄作为基质,按0.238,0.476,1.905 mg/kg 3个水平加入标准溶液,每个水平平行测定5次。添加回收率及相对标准偏差见表4。结果表明,方法的平均回收率为92.2%~110.4%,RSD值<8.1%。
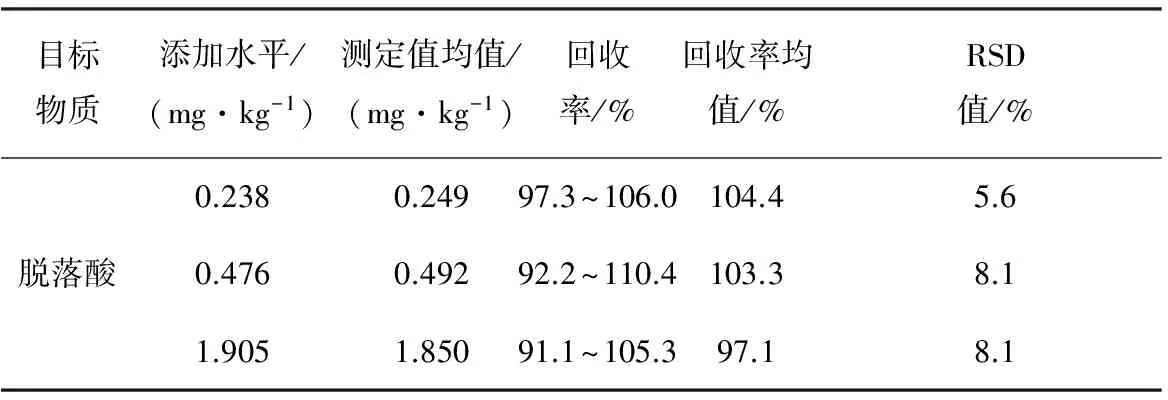
表4 添加回收率及相对标准偏差
2.5.4 测量不确定度评定
以实验室内添加8次平行检测结果作为数据来源,建立方法测量不确定度评定数学模型,识别不确定度来源,量化、计算不确定度分量,测算合成标准不确定度和扩展不确定度。结果得知:在包含因子k=2(95%置信度)的情况下,试样品中脱落酸的含量为(0.39±0.08)mg/kg,扩展不确定度U=0.08 mg/kg。
3 讨 论
提取液富集净化过程中,上样溶剂的含水率对SPE柱的洗脱效率具有较大影响。试验发现,当上样溶剂含水率低于50%时,目标物质的回收率不能满足定量测定要求。经实验测定,大部分葡萄品种水分含量为76.8%~86.6%。综合以上因素确定称样量和提取剂的用量,以保证将最终上样溶剂的含水率控制在可接受的范围内。
适合的流动相能够改善色谱峰型。在流动相中加入适当的甲酸(或乙酸、三氯乙酸、磷酸等),可以抑制目标物质的离子化,以获得对称的色谱峰型。实验中选择0.05%,0.1%,0.2%,0.5%的甲酸水溶液作为B相流动相,比较流动相对目标物质分离效果的影响。结果表明,低于0.2%的甲酸水溶液对目标物质的分离效果影响不显著,对目标物质离子化效率的影响相对较低。同时,综合考虑流动相酸性对色谱柱的长期影响,测定方法中选用0.1%的甲酸。
离子监测模式是目标物质定性和定量的决定性因素之一。结果表明,正离子模式下,脱落酸易解离成为2个峰,由于同时产生[M+H]+和[M+H2O]+等多种类型子离子,单特征离子丰度和稳定性均不够理想。因此,应选用更为稳定的负离子模式。
4 结 论
通过对提取条件、富集净化条件、色谱条件、质谱条件的研究,建立了葡萄中脱落酸的LC-MS-MS定量测定方法,得到了较好的分离方法和检测技术条件。本方法操作简便,线性范围宽,回收率、精密度、检出限满足农药残留定量检测要求,适合批量样品的定量测定,对其他植物激素的测定方法研究具有一定的借鉴意义。目前,为缩短检测时长,提高检测效率,在色谱梯度方面仍有进一步改进提升的空间。随着液相色谱串联质谱仪的应用越来越普及,本方法在葡萄中脱落酸含量的检测方面会具有广泛的应用前景。
/
[1] 何昊.脱落酸对葡萄抗逆性和果实品质的影响研究[D]. 成都:四川农业大学,2013.
HE Hao. Effect of ABA on Stress Resistance and Fruit Quality of Grape[D]. Chengdu: Sichuan Agricultural University,2013.
[2] 孙崇臻,王超,蔡子哲,等. 高效液相色谱测定蜂蜜中的脱落酸、黄酮和酚酸[J].食品科学,2013,34(10): 281-285.
SUN Chongzhen, WANG Chao, CAI Zizhe, et al. Determination of flavonoids, phenolic acids and abscisic acid in honeys of different floral origins by HPLC[J]. Food Science, 2013, 34(10): 281-285.
[3] 王水良,王平,王珍义. 固相萃取-高效液相色谱法测定马尾松组织中内源激素[J]. 分析科学学报,2010,26(5):547-550.
WANG Shuiliang, WANG Ping, WANG Zhenyi. Determination of endogenous hormones in (PinusmassonianaLamb) using solid phaseextraction-high performance liquid chromatography[J]. Journal of Analytical Science, 2010, 26(5): 547-550.
[4] 陈亚玲,江阳,李永新,等.高效液相色谱法同时测定瓜果中6种植物生长调节剂[J].现代预防医学,2016,43(5):891-895.
CHEN Yaling, JIANG Yang, LI Yongxin, et al. Simultaneous determination of six plant growth regulators in melon andfruit by high-performance liquid chromatography[J]. Modern Preventive Medicine, 2016, 43(5): 891-895.
[5] 马宏棋, 陈敏氡, 朱海生, 等. 草莓 ABA 的快速提取方法及超高效液相色谱分析[J]. 园艺学报, 2014, 41(3): 577-584.
MA Hongqi, CHEN Mindong, ZHU Haisheng, et al. Rapid method for the extraction of abscisic acid from strawberry and analysis by ultra-high performance liquid chromatography[J].Acta Horticulturae Sinica, 2014, 41(3): 577-584.
[6] 胡西洲,彭西甜,余琼卫,等.固相萃取-分散液液微萃取-高效液相色谱测定椰子汁中酸性植物激素[J].分析科学学报,2013,29(5):593-598.
HU Xizhou, PENG Xitian, YU Qiongwei, et al. Determination of acidic phytohormones in natural coconut juice by combining solid-phase extraction and molecular conlex-base dispersive liquid-liquid microextraction with high performance liquid chromatograph[J]. Journal of Analytical Science, 2013, 29(5): 593-598.
[7] 杨杨,范蓓,生吉萍,等.高效液相色谱测定芒果皮中脱落酸的含量[J].食品工业科技,2014,35(2):76-79.
YANG Yang, FAN Bei, SHENG Jiping, et al. Analysis of abscisic acid content in peel of mango by HPLC[J]. Science and Technology of Food Industry, 2014, 35(2): 76-79.
[9] 李莉,田士林. 酶联免疫(ELISA)分析晋麦叶片中脱落酸的含量[J].安徽农业科学,2007, 35(23): 7098-7099.
LI Li, TIAN Shilin. ELISA analysis on the ABA content of Jinmai leaves[J]. Journal of Anhui Agri Sci,2007, 35(23) : 7098-7099.
[10] FERNANDEZ B, CENTENO M L, FEITO I, et al. Simultaneous analysis of cytokinins, auxins and abscisic acid by combined immunoaffinity chromatography, high performance liquid chromatography and immunoassay [J].Phytochem Analysis, 1995, 6: 49-54.
[11] 李金克,陈华君,陈少良. GC-MS 内标法定量分析植物组织中的JA,IAA 和ABA[J]. 北京林业大学学报,2010,32(5): 143-148.
LI Jinke, CHEN Huajun, CHEN Shaoliang. Quantitative analysis of jasmonic acids,indole-3-acetic acid and abscisic acid in plant tissues by GC-MS[J]. Journal of Beijing Forestry University, 2010, 32(5): 143-148.
[12] 侯升杰,朱江,丁明玉,等.液相色谱-电喷雾串联质谱法测定冬青芽中的脱落酸[J].分析试验室,2009,28(3): 96-98.
HOU Shengjie, ZHU Jiang, DING Mingyu, et al. Determination of abscisic acid in holly buds by liquid chromatography-electrospray tandem mass spectrometry[J].Chinese Journal of Analysis Laboratory, 2009, 28(3): 96-98.
[13] 徐生坚,曹慧,陈小珍. 超高效液相色谱-串联质谱法测定粮谷中6种植物生长调节剂残留[J].食品科学,2013,34(18): 218-223.
XU Shengjian, CAO Hui, CHEN Xiaozhen. Determination of plant growth regulator residues in grains by ultra performance liquid chromatography-tandem mass spectrometry[J]. Food Science, 2013, 34(18): 218-223.
[14] 张慧,吴颖,路勇,等. 超高效液相色谱-串联质谱法测定苹果中的赤霉素、脱落酸、甲萘威、多效唑和烯效唑的残留量[J]. 食品工业科技,2010,31(10): 383-385.
ZHANG Hui, WU Ying, LU Yong, et al. Determination of gibberellin,abscisic acid, carbaryl, paclobutrazol and uniconazole in apples by ultra performance liuid chromatography-tandem mass spectrometry[J]. Science and Technolgy of Food Industry, 2010, 31(10): 383-385.
[15] 潘星燕,陆云霞,姚军.高效液相色谱法测定芒柄花素磺酸钠相关物质[J].河北科技大学学报,2017,38(1):32-38.
PAN Xingyan,LU Yunxia,YAO Jun. Related substance determination of formononetin by HPLC[J]. Journal of Hebei University of Science and Technology,2017,38(1):32-38.
[16] 易勇,唐旭,林锡煌,等.超高效液相色谱串联质谱法同时测定马尾藻中4种内源性植物激素[J].分析化学,2016,44(1):124-130.
YI Yong, TANG Xu, LIN Xihuang, et al. Simultaneous determination of 4 kind of plant hormones in sargassum by ultra performance liquid chromatography tandem mass spectrometry [J]. Chinese Journal of Analytical Chemistry, 2016, 44(1): 124-130.
[17] 龚明霞,王日升,何龙飞,等.超高效液相色谱-三重四级杆串联质谱法同时测定植物组织中多种激素[J].分析科学学报,2016,32(6): 789-794.
GONG Mingxia, WANG Risheng, HE Longfei, et al. Simultaneous determination of multiple phytohormones in plant tissues by ultra-high performance liquid chromatography-triple quadrupole tandem mass spectrometry[J]. Journal of Analytical Science, 2016, 32(6): 789-794.
Analysis of abscisic acid content in grape by LC-MS-MS
SUN Zhen,REN Rui,LI Zengliang,BI Bo
(Hebei Provincial Center for Quality Supervision and Test of Forestry Fruit, Mulberry and Flower, Shijiazhuang,Hebei 050081,China)
Grape contains much sugar, pigment and pectin, which has interference and makes it difficult for quantitative analysis of trace abscisic acid. To solve this problem, LC-MS-MS method for the determination of abscisic acid in grape is established. Several key aspects including extractant, extract methods, enrichment, chromatographic conditions and mass spectrometry are studied. The test sample is prepared through pulverization and homogenate of grape sample, and analyzed with methanol + formic acid (V/V=99.5/0.5) as the extractant, after oscillation extraction for 30 min, and with MAX Cartridge SPE as the enrichment and purification extractant. The research shows that the elution efficiency is better and the impurities can be removed effectively when the solvent is methanol of 20%~50%(mass fraction); the chromatographic condition is of ODS2(2.1 mm×150 mm,5 μm)column, acetonitrile as the phase A, 0.1% formic acid as mobile phase B, flow rate at 0.2 mL/min, and gradient elution is performed; 263.1~153.2 is used as the qualitative-quantitative ion pair in the negative ion monitoring mode, the samples are characterized by the retention time and the SRM atlas, and the external standard method is quantified by the peak area. The method has a calibration curves of good linearity over the range from 19.05 to 381.00 ng/mL. The recovery rate is 92.2%~110.4%, and RSD is less than 8.1%. This research provides an efficient and accurate method for the determination of abscisic acid in grapes.
food inspection; LC-MS-MS; analysis; grape; ABA(abscisic acid) content
1008-1534(2017)06-0428-06
S379.1
A
10.7535/hbgykj.2017yx06007
2017-08-14;
2017-09-26;责任编辑:张士莹
河北省科技计划项目(14225503D)
孙 震(1970—),男,河北清苑人,高级工程师,主要从事林果质量安全方面的研究。
任 瑞正高级工程师。 E-mail:1608887877@qq.com
孙 震,任 瑞,李增良,等. LC-MS-MS法测定葡萄中的脱落酸含量[J].河北工业科技,2017,34(6):428-433.
SUN Zhen, REN Rui, LI Zengliang,et al . Analysis of abscisic acid content in grape by LC-MS-MS[J].Hebei Journal of Industrial Science and Technology,2017,34(6):428-433.

