细鳞鱼杀鲑气单胞菌杀鲑亚种的分离鉴定
单晓枫 , 康元环 , 吴同垒 , 孙武文 , 张冬星 , 贾俊鹏 , 刘艳辉 , 钱爱东
(1.吉林农业大学动物科学技术学院 , 吉林 长春 130118 ; 2.河北科技师范学院 河北省预防兽医学重点试验室 , 河北 秦皇岛 066004 ; 3.吉林省水产科学研究院 , 吉林 长春 130000)
细鳞鱼杀鲑气单胞菌杀鲑亚种的分离鉴定
单晓枫1, 康元环1, 吴同垒2, 孙武文1, 张冬星1, 贾俊鹏1, 刘艳辉3, 钱爱东1
(1.吉林农业大学动物科学技术学院 , 吉林 长春 130118 ; 2.河北科技师范学院 河北省预防兽医学重点试验室 , 河北 秦皇岛 066004 ; 3.吉林省水产科学研究院 , 吉林 长春 130000)
为确定吉林省某渔场细鳞鱼发病死亡的病因,本研究由濒死的细鳞鱼体内分离出一株优势菌,经动物回归试验,该菌株对细鳞鱼具有致病性,将其命名为BRL-15。经菌体、菌落形态,理化特性,16S rRNA基因序列分析,鉴定菌株BRL-15为杀鲑气单胞菌杀鲑亚种。药敏试验结果显示,该菌株对所选抗菌药物中绝大多数高度敏感。试验结果为细鳞鱼杀鲑气单胞菌病的防治提供一定理论依据。
细鳞鱼 ; 杀鲑气单胞菌杀鲑亚种 ; 分离鉴定 ; 药敏试验
细鳞鱼隶属于鲑形目、鲑科、细鳞鱼属,其生活在亚洲东北部,是一种冷水性鱼类。我国只有一属一种,主要分布在西北、东北和华北的某些河流中[1]。细鳞鱼是国家二级保护水生野生动物,在鱼类学与动物地理学上具有重要学术研究价值。此外,细鳞鱼营养价值较高,还具有可以防止血栓生成、加快伤口愈合等药用功能,而受到人们喜爱[2]。但是,由于人类活动范围扩大、捕捞过度等原因,该鱼已处于濒临灭绝的状态。为了保护这一名贵的鱼类资源,我国已在吉林省图们江流域、黑龙江省牡丹江流域、陕西省秦岭地区等地建立了细鳞鱼自然保护区,并进行人工的规模化养殖[3]。
随着细鳞鱼驯养繁殖过程的深入,出现了各种疫病,制约了其发展。目前,已有报道的细鳞鱼疾病包括肠炎病、烂鳃病、水霉病、三代虫病等多种。2016年6月,吉林省延边朝鲜族自治州某养殖场的细鳞鱼体侧及尾部出现脓肿,甚至形成溃疡,并有部分死亡现象。试验室从濒死鱼体内分离出1株优势菌株,经动物回归试验证实其有致病性,通过理化鉴定、16S rRNA基因序列分析确定其种属,并对菌株进行了药敏试验。研究结果细鳞鱼溃疡病的防治提供了理论依据。
1 材料与方法
1.1 试验材料 患病细鳞鱼、健康细鳞鱼,均取自吉林省延边朝鲜族自治州某渔场;RS培养基,购自北京陆桥生物技术有限公司;TaqDNA聚合酶、dNTP、DL-2 000 Marker,购自TaKaRa公司;微量生化反应管、药敏纸片,购自杭州微生物试剂有限公司;其余均为国产或进口分析纯。
1.2 病原菌的分离纯化 无菌操作,取濒死细鳞鱼的肝脏、心脏等组织,划线接种于RS琼脂平板,28 ℃培养24 h,挑取形态一致的优势菌落,再次划线培养24 h,挑取单个菌落进行纯培养,并对纯化的细菌进行革兰染色,观察菌体形态。
1.3 动物回归试验 将纯化的细菌用无菌PBS稀释至1.55×108CFU/mL,以每尾0.2 mL的剂量腹腔注射感染健康细鳞鱼,同时设置对照组,腹腔注射0.2 mL的无菌PBS,每组感染10尾。饲养水温保持在20 ℃、并保证溶氧充足。持续观察7 d,记录细鳞鱼发病死亡情况,并对病死鱼进行细菌分离培养。
此外,采集自然发病的濒死鱼心脏、肝脏等组织,5倍量添加无菌PBS(1g∶5 mL),进行组织研磨且反复冻融,12 000 r/min离心15 min取上清,上清液用0.22 μm滤膜过滤,滤液经无菌检验后接种健康细鳞鱼,感染剂量、方法与鱼尾数同上。
1.4 生理生化鉴定 挑取分离株纯培养物,接种于微量生化反应管中,具体操作及结果判定标准见微量生化反应管说明书。
1.5 16S rRNA基因扩增及系统发育分析 热裂解法提取病原菌分离株的基因组,并以此为模板,扩增16S rRNA基因序列,引物为16S rRNA通用引物:P1:5′-AGAGTTTGATCATGGCTCA-3′、P2:5′- GTGTGACGGGCGGTGTGTA-3′,由吉林省库美生物科技有限公司合成。PCR反应条件为:95 ℃预变性5 min,94 ℃变性1 min、55 ℃退火1 min、72 ℃延伸1.5 min、30个循环,最后72 ℃延伸10 min。PCR产物经1.0%琼脂糖凝胶电泳检测,纯化回收后由吉林省库美生物科技有限公司测序。
测序结果经NCBI数据库BLSAT比对相似性,并用MEGA6.0软件构建系统发育树进行比较分析。
1.6 药敏试验 药敏试验采用K-B纸片法,将病原菌活菌扩增,并将菌浓度调成1.5×107CFU/mL。取0.1 mL菌液涂布于TSA琼脂平板,选取20种药敏纸片,贴于上述平板,28 ℃培养24 h,测量抑菌圈直径,依据CLSI标准,对药敏结果进行判定。
2 结果
2.1 细菌的分离及菌落菌体形态 从患病濒死细鳞鱼体内分离出1株优势菌,命名为BRL-15。该菌在RS培养基上为圆形、边缘整齐的黄色菌落。革兰染色为革兰阴性短杆菌、两端钝圆、单在或双在(见中插彩版图1)。
2.2 动物回归试验 将菌株BRL-15腹腔接种细鳞鱼,在4 d内全部发病死亡,对照组无异常。剖检病死鱼,其病理变化与自然病死鱼相同,从其体内也分离出与BRL-15菌落、菌体、理化特性相同的细菌。
将组织滤液接种细鳞鱼,并未出现发病等现象,说明这次引起细鳞鱼死亡的病原是细菌感染而非病毒。
2.3 理化鉴定结果 菌株BRL-15葡萄糖、麦芽糖、甘露醇、甘露糖、蔗糖、半乳糖、ONPG、胆汁七叶苷、鸟氨酸脱羧酶、赖氨酸脱羧酶、精氨酸脱羧酶、精氨酸双水解酶、硝酸盐还原、氰化钾生长等结果阳性;乳糖、阿拉伯糖、阿拉伯醇、木糖、山梨醇、肌醇、尿素、靛基质、硫化氢、枸橼酸盐、运动性等结果为阴性;与《伯杰氏细菌鉴定手册》比对,基本符合杀鲑气单胞菌特性,初步判定其为杀鲑气单胞菌。
2.4 16S rRNA基因序列与系统发育分析 PCR扩增菌株BRL-15的16S rRNA基因片段经电泳检测约1 400 bp(图2),测序结果显示,该片段长1 403 bp,将基因序列进行同源性检索,同时选取不同气单胞菌种属代表株及BRL-15菌株的16S rRNA基因序列构建系统发育树(图3),结果显示,菌株BRL-15 16S rRNA基因序列与杀鲑气单胞菌杀鲑亚种同源性达99%以上。
综合菌体、菌落形态,理化特性与16S rRNA基因序列分析结果显示,菌株BRL-15为杀鲑气单胞菌杀鲑亚种。

图2 菌株BRL-15 16S rRNA PCR扩增结果

图3 分离菌株BRL-15 16S rRNA基因序列发育进化树
2.5 药敏试验 菌株对20种抗菌药物的敏感性试验结果表明,该菌株除对强力霉素、多黏霉素B中度敏感外,其余18种抗菌药物均高度敏感(表1)。
3 讨论
杀鲑气单胞菌隶属于气单胞菌科气单胞菌属,其下有5个亚种,分别是杀鲑亚种、无色亚种、杀日本鲑亚种、史氏亚种和溶果胶亚种[4]。该菌分布广泛,可以引发多种水生动物发病,尤其是鲑科鱼类更易感染,感染鱼体会出现皮肤溃疡等症状,严重者会引起死亡[5]。本研究从患溃疡细鳞鱼体内分离出一株细菌即是杀鲑气单胞菌杀鲑亚种,该菌经动物回归试验显示,对细鳞鱼具有致病性,并与自然发病者症状一致。此外,本研究对病鱼组织进行了研磨、离心、取上清,并用此上清进行了攻毒试验,结果显示,细鳞鱼并未发病。综合以上试验证明,此次细鳞鱼溃疡病的病原为杀鲑气单胞菌杀鲑亚种。而究其感染原因可能是发病前期当地气温发生骤变、加上部分鱼体受伤,致使鱼机体免疫力下降,其自身携带的细菌感染导致发病,并迅速传染同池细鳞鱼,致使疾病暴发。
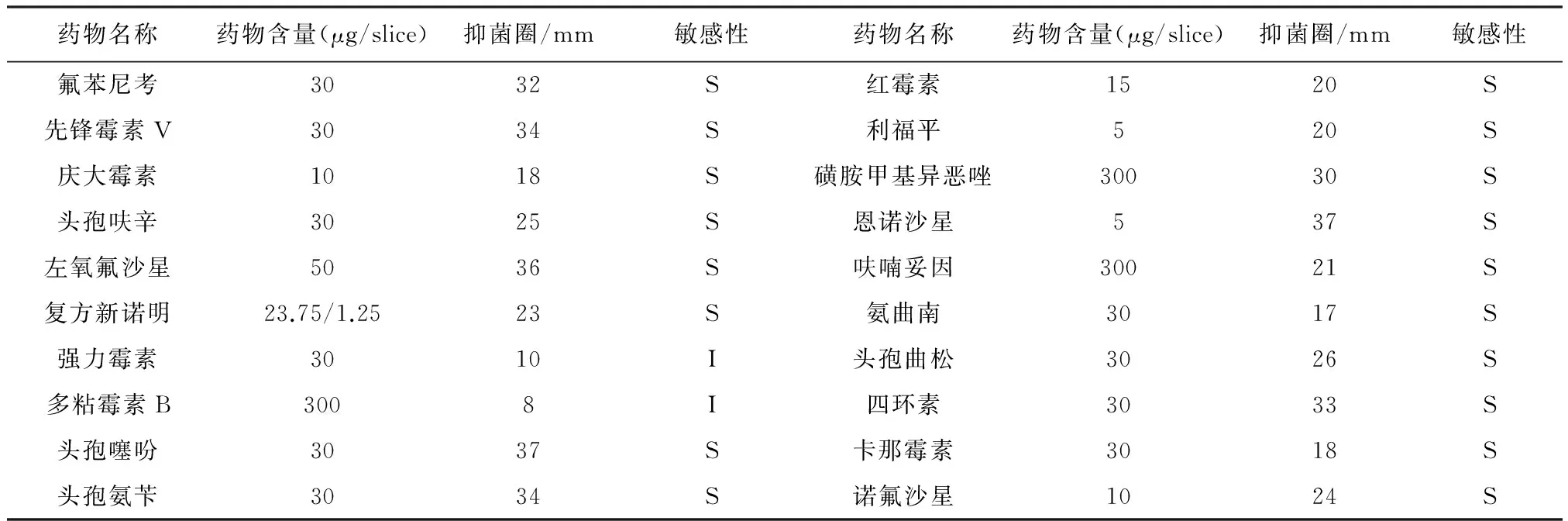
表1 分离菌株BRL-15的药敏试验结果
S:高度敏感;I:中度敏感
杀鲑气单胞菌的5个亚种之间的理化特性区别不大[6],为更准确的鉴定,本试验通过PCR扩增出菌株BRL-15的16S rRNA基因序列,通过BLSAT的比对以及系统发育树分析:其与GenBank上公布的杀鲑气单胞菌杀鲑亚种16S rRNA基因序列的同源性在99%以上,且系统发育树显示,菌株BRL-15与杀鲑气单胞菌杀鲑亚种聚为一支。综合菌落菌体形态、理化特性、16S rRNA基因序列分析,菌株BRL-15最终确定为杀鲑气单胞菌杀鲑亚种。
目前,国内鱼类大部分细菌病的治疗仍以抗生素为主,因此,为筛选合适的抗生素治疗该病,本研究对菌株BRL-15进行了药敏试验。令人欣慰的是:菌株BRL-15对试验所选的绝大部分药物均比较敏感,这与异育银鲫源、鲤鱼源杀鲑气单胞菌杀鲑亚种的耐药性有一定区别[7-8],与同样为细鳞鱼的病原菌杀鲑气单胞菌无色亚种的耐药谱也区别较大[1]。这可能与菌种不同、菌株来源地点不同有一定关联。此外,本试验所用细鳞鱼所属的养殖场为山泉流水养殖,水环境优良、受到抗生素的污染较少,鱼的抵抗力相对较强,而此次发病,如上所讨论,可能是气温变化较为剧烈,加上换池导致的鱼体受伤所致。因此,菌株BRL-15的药敏试验结果是对试验所选绝大多数药物敏感。
为防治细鳞鱼溃疡病的发生,除加强日常管理、尽量避免鱼体受伤外,如果研制其病原的灭活疫苗或其他优质疫苗,则可以更好预防该病的发生,还可以减少抗生素的使用,进而降低耐药菌株出现的风险,减少食品中药物残留的危害。
[1] 刘宁,时晓,杜迎春,等.患病细鳞鱼杀鲑气单胞菌的分离与鉴定[J].淡水渔业,2015,45(1):88-92.
[2] 李永发,张永泉,刘洋,等. 黑龙江两种生态类型水域细鳞鱼肌肉营养成分的比较分析[J].东北农业大学学报,2011,42(9):97-103.
[3] 白亚荣,武二栓,宗振东,等. 细鳞鱼人工繁育及大型水域放流增殖技术[J].内蒙古农业科技, 2015,43(5):101-103.
[4] Nash J H E, Findlay W A, Luebbert C C,etal. Comparative genomics profiling of clinical isolates ofAeromonassalmonicidausing DNA microarrays [J].BMCGenomics, 2006,7: 43
[5] Cipriano R C. Furunculosis and other Diseases Caused byAeromonassalmonicida. Fish Disease Leaflet 66 [M].UnitedStatesDepartmentoftheInterior, 2001: 1-4.
[6] Pavan M E, Abbott S L, Zorzópulos J,etal.Aeromonassalmonicidasubsp.pectinolyticasubsp. nov., a new pectinase positive subspecies isolated from a heavily polluted river [J].InternationalJournalofSystematicBacteriology. 2000, 50:1 119-1 124.
[7] 王亚冰,梁利国,高金伟,等. 异育银鲫源杀鲑气单胞菌杀鲑亚种的分离鉴定[J].微生物学通报, 2016,43(7):1 532-1 539.
[8] 王海娟,王利. 鲤鱼杀鲑气单胞菌的分离鉴定及耐药性分析[J]. 中国畜牧兽医,2015,42(1):192-196.
IsolationandidentificationofAeromonassalmonicidasubspSalmonicidafromBrachymystaxlenok
SHAN Xiao-feng1, KANG Yuan-huan1, WU Tong-lei2, SUN Wu-wen1, ZHANG Dong-xing1, JIA Jun-peng1, LIU Yan-hui3, QIAN Ai-dong1
(1.College of Animal Science and Technology, Jilin Agricultural University, Changchun 130118,China;2.Hebei Normal University of Science amp; Technology, Hebei Province Key laboratory of Veterinary Proventive Medicine, Qinhuangdao 066004,China; 3.Jilin Province Research Institute of fisheries science,Changchun 130000,China)
To identify the cause of disease from theBrachymystaxlenokin Jilin Province,the pathogenic strain was isolated from moribundBrachymystaxLenok. A purely cultured strain (BRL-15) causedBrachymystaxlenokinfected. It was identified asAeromonassalmonicidasubsp.salmonicidaaccording to its morphological, and physiobiochemical characteristics, and 16SrRNA sequencing. The result of drug susceptibility test showed that the isolatesensitive was to most antibiotics. These results provide a scientific basis for treatment ofBrachymystaxLenokinfected withAeromonassalmonicida.
BrachymystaxLenok;Aeromonassalmonicidasubsp ;Salmonicida; isolation and identification ; Drug resistance
s: QIAN Ai-dong ; LIU Yan-hui
S943.121
A
0529-6005(2017)10-0091-03
2017-03-04
国家自然科学基金项目(31201927);吉林省重点科技攻关项目(20150204065NY);吉林省科技厅自然基金项目(20170101016JC)
单晓枫(1977-),男,副教授,博士,从事动物细菌学方面的研究,E-mail: sxf1997@163.com
钱爱东,E-mail: qianaidong0115@163.com;刘艳辉,E-mail: liuyanhui9@163. com
——和田盘羊

