脑脊液中CD4+ CD25+ Treg、sICAM-1及BAFF与动脉瘤蛛网膜下腔出血的相关性研究
李淑雯 吕亮亮
脑脊液中CD4+CD25+Treg、sICAM-1及BAFF与动脉瘤蛛网膜下腔出血的相关性研究
李淑雯 吕亮亮
目的探讨脑脊液中CD4+CD25+调节性T细胞(Treg)、可溶性细胞间黏附分子(sICAM-1)及B细胞活化因子(BAFF)与动脉瘤蛛网膜下腔出血(SAH)的相关性。方法随机选择内蒙古医科大学附属医院神经外科2015年3月至2016年12月120例SAH患者作为观察组,选择同期健康体检人群40例作为对照组,均行脑脊液CD4+CD25+Treg、sICAM-1及BAFF水平检测,组间比较采用t检验,并采用Pearson参数法分析其与疾病严重程度(Hunt-Hess分级法)的相关性。结果观察组CD4+CD25+Treg水平(2.52±0.73)﹪低于对照组(4.52±1.08)﹪,差异有统计学意义(t=-12.563,P<0.01);sICAM-1(853.25±155.36)pg/ml及 BAFF(586.23±163.73)pg/ml水平高于对照组 sICAM-1(315.65±132.58)pg/ml,(t=-19.569,P<0.01)及 BAFF(272.66 ± 142.58)pg/ml,(t=-11.426,P<0.01);随着Hunt-Hess分级的增加,SAH患者CD4+CD25+Treg水平呈逐渐降低趋势(3.12 ± 0.82)﹪、(2.42 ± 1.05) ﹪、(1.28 ± 0.61) ﹪,sICAM-1(627.21 ± 152.56)pg/ml、(794.78 ± 106.36)pg/ml、(896.56 ± 110.52)pg/ml 及 BAFF(395.32 ± 162.53)pg/ml、(589.62 ± 170.43)pg/ml、(789.61 ± 173.52)pg/ml水平呈逐渐上升趋势,3组比较差异有统计学意义(F=7.214,12.372,11.581,P均<0.01);CD4+CD25+Treg 与 SAH 病情程度呈负相关(r=-0.824,P<0.01)、sICAM-1、BAFF水平与病情程度成正相关(r=0.922,0.472,P均<0.01)。结论CD4+CD25+Treg是颅内动脉瘤患者的一种保护因素,其水平的含量降低,动脉瘤破裂后SAH的风险程度增加,sICAM-1、BAFF参与SAH的发生,其水平增高可加重动脉瘤SAH的炎症反应。
CD4; CD25; 调节性T细胞; 可溶性; 细胞间黏附分子; B细胞活化因子; 动脉瘤; 蛛网膜下腔出血
动脉瘤所致蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是临床神经外科常见的急重症之一,致死率和致残率均较高[1-2]。随着国内外学者对动脉瘤SAH的研究机制不断深入,越来越多的研究显示,机体免疫功能与动脉瘤SAH的病理生理机制密切相关[3-4]。其中调节性T细胞(regulatory cell,Treg)是调节机体自身免疫功能的一类T细胞亚群[5],B细胞活化因子(B cell-activating factor of the TNF family,BAFF)是一种调控机体免疫应答的B淋巴细胞的共刺激因子[6],可溶性细胞间黏附分子(soluble intercellular adhesion molecule,sICAM-1)是动脉瘤SAH后脑血管痉挛与炎性反应中的一类细胞炎性因子[7]。但目前临床上对三者与动脉瘤SAH病情发生发展的相关性研究较少,现将本研究结果报告如下。
资料与方法
一、临床资料
选择内蒙古医科大学附属医院神经外科2015年3月至2016年12月120例动脉瘤SAH患者作为观察组研究对象。120例SAH患者中,男69例,女 51 例,年龄 21~72 岁,平均年龄(56±11)岁 ;选择同期健康体检人群40例作为对照组,其中男23例,女 17 例,年龄 26~64 岁,平均年龄(53±12)岁。本研究经本院医院伦理委员会批准,并由研究对象签署知情同意书。两组患者年龄、性别比例等一般资料比较差异无统计学意义。
入选标准:(1)经影像学检查证实SAH,并伴有剧烈的头痛;(2)有腰穿刺和脑脊液检查适应证;(3)经DSA及MRI造影确诊为动脉瘤;(4)发病3 d内入院,并接受相关治疗;(5)可较好的配合检查,并签署知情同意书。排除标准:(1)出血日不明确或入院前已经出血超过3 d;(2)病情严重,预计可能在72 h内死亡者;(3)排除外伤性、高血压性SAH及合并有颅内出血、颅内感染、颅内肿瘤及其他颅内病变者;(4)合并有严重的心、肺、肝、肾功能障碍者;(5)合并有凝血障碍、恶性肿瘤及精神病者。
二、方法
1.检测方法 :分别在患者发病后 3、5、7、10 和14 d内应用常规腰椎穿刺抽取脑脊液3 ml,离心半径10 cm,3000 r/min,离心机离心10 min,取上清液装试管,低温保存,集中检测,取3组平均值比较。流体细胞仪检测方法:CD4-PE及CD25-FITC抗体购自南京建城生物工程研究所,腰椎穿刺采集研究对象脑脊液标本,抗凝后采用流式细胞仪器(德国产Beckman Counlter色流式细胞仪)检测CD4+CD25+Treg水平。使用酶联免疫吸附法(ELISA)检测白细胞介素10(IL-10),白细胞介素6,转化生长因子β(TGF-β)、sICAM-1及BAFF水平。试剂盒均采购于江莱生物科技有限公司,严格按试剂盒内的说明书操作。
2.评价方法:按照Hunt-Hess五级分类法对本研究动脉瘤SAH患者进行分级。Ⅰ级:无症状或者仅有轻微头痛,脑膜刺激征轻;Ⅱ级:少量出血,中-重度头痛,脑膜刺激征明显,但无重要神经功能障碍;Ⅲ级:出血量中等,昏睡继而根据对照组重新统计了原始数据资料出血量中等以上,木僵,中或重度偏侧不全麻痹,可能有早期的去脑强直及自主神经功能障碍;Ⅴ级:出血严重,深昏迷,去大脑皮质强直,对刺激反应消失,病例呼吸循环等。以上120例SAH患者含Ⅰ级25例,Ⅱ级46例,Ⅲ级25例,Ⅳ级18例,Ⅴ级6例。并以此作为判断评价SAH病情严重程度的标准,作为应变量进行相关性分析。
三、统计学分析方法
使用SPSS 19.0统计学软件进行数据分析,脑脊液CD4+CD25+Treg、sICAM-1及BAFF水平以± s表示,两组间 CD4+CD25+Treg、sICAM-1及BAFF比较采用t检验,三组不同病情程度SAH患者Treg、sICAM-1及BAFF水平比较采用One Way ANOVA检验,CD4+CD25+Treg与SAH病情程度、sICAM-1、BAFF相关性分析采用Pearson参数法,以P<0.05为差异有统计学意义。
结 果
一、两组脑脊液CD4+ CD25+ Treg、sICAM-1及BAFF水平比较
结果显示,观察组CD4+CD25+Treg水平显著低于对照组,差异有统计学意义(P<0.05);sICAM-1及BAFF水平高于对照组,差异有统计学意义(P<0.05,表 1)
二、不同病情程度SAH患者CD4+ CD25+Treg、sICAM-1及BAFF水平比较
结果显示,随着Hunt-Hess分级的增加,SAH患者CD4+CD25+Treg水平呈逐渐降低趋势,sICAM-1及BAFF水平呈逐渐上升趋势,3组比较有统计学差异(P<0.05,表 2)
三、Pearson相关性分析
结果显示,CD4+CD25+Treg与SAH病情程度呈负相关(r=-0.824,P<0.05)、sICAM-1、BAFF 水平与病情程度成正相关(r=0.922,0.472,P<0.05)。
讨 论
临床上SAH分为自发性蛛网膜下腔出血和外伤性蛛网膜出血两类,其中自发性蛛网膜下腔出血最常见的病因是颅内动脉瘤,约占50﹪~85﹪[8-9]。颅内动脉瘤是由于脑动脉管壁的先天性缺陷以及血管腔内压力增高所致囊性膨出,多在患者咳嗽过猛、情绪激动时发病[10-11]。目前对于动脉瘤的病因尚不清楚。近年来,随着对动脉瘤的研究深入,发现免疫和炎症因素是颅内动脉瘤的重要致病因素,参与了动脉瘤发生发展的病理过程[12-14]。此过程中,CD4+CD25+Treg可由CD4和CD25细胞分泌TGF-β及IL-10作为特征性细胞因子,而TGF-β及IL-10是实现免疫调节功能的重要因子,是作为调节性T细胞执行免疫功能的物质基础[15]。研究证实,TGF-β是一种血管生长因子,其水平降低可导致血管内皮损伤,是血管内膜稳定性降低,进而引起机体过度的炎症反应,导致动脉瘤破裂发生SAH,且出血发生后仍然参与继发性免疫反应,是脑血管痉挛的重要炎性介质之一[16]。ICAM-1是白细胞功能相关抗原配子,在血管内皮反应和血栓形成过程中含量最高,可介导白细胞与血管内皮细胞的黏附,其水平的升高是白细胞和内皮细胞损害或启动的标志[17]。另外BAFF是一种促炎细胞因子,被认为是一种类似C反应蛋白的物质,可反应机体的炎症水平[18]。
表1 两组脑脊液CD4+ CD25+ Treg、sICAM-1及BAFF水平比较(± s)
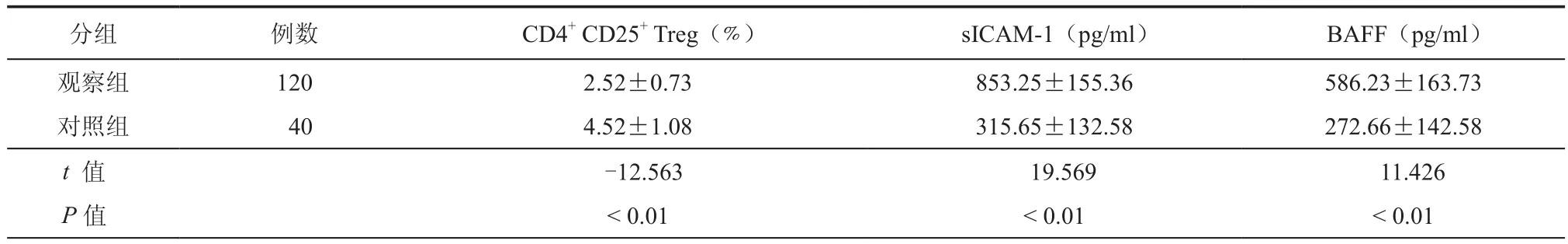
表1 两组脑脊液CD4+ CD25+ Treg、sICAM-1及BAFF水平比较(± s)
分组 例数 CD4+ CD25+ Treg(﹪) sICAM-1(pg/ml) BAFF(pg/ml)观察组 120 2.52±0.73 853.25±155.36 586.23±163.73对照组 40 4.52±1.08 315.65±132.58 272.66±142.58 t 值 -12.563 19.569 11.426 P值 <0.01 <0.01 <0.01
表2 不同病情程度SAH患者CD4+ CD25+ Treg、sICAM-1及BAFF水平比较(± s)

表2 不同病情程度SAH患者CD4+ CD25+ Treg、sICAM-1及BAFF水平比较(± s)
分组 例数 CD4+ CD25+ Treg(﹪) sICAM-1(pg/ml) BAFF(pg/ml)Ⅰ~Ⅱ级 71 3.12±0.82 627.21±152.56 395.32±162.53Ⅲ级 25 2.42±1.05 794.78±106.36 589.62±170.43Ⅳ~Ⅴ级 24 1.28±0.61 896.56±110.52 789.61±173.52 F值 7.214 12.372 11.581 P值 <0.01 <0.01 <0.01
本研究对CD4+CD25+Treg、sICAM-1及BAFF在SAH发生发展中的作用进行探讨,结果显示,SAH患者CD4+CD25+Treg水平较健康体检人群降低,而sICAM-1及BAFF水平则增高。Hunt-Hess分级越高,SAH患者CD4+CD25+Treg水平越低,sICAM-1及BAFF则越高。提示CD4+CD25+Treg、sICAM-1及BAFF与动脉瘤SAH患者的严重程度存在一定的相关性。相关性检验结果提示,CD4+CD25+Treg与SAH病情程度呈负相关(P<0.05)、sICAM-1、BAFF 水平与病情程度成正相关(P<0.05)。这为动脉瘤SAH免疫-临床之间的联系提供了一定的数据支持。笔者认为,颅内动脉瘤是一种免疫炎性反应,从病理学研究来看,动脉瘤瘤壁纤维组织大量增生,组织平滑肌细胞显著降低,管壁内外膜可见大量炎性细胞。这些大量聚集的炎性细胞可促使一系列的炎性物质如氧自由基、白细胞介素、肿瘤坏死因子以及血管内皮生长因子等过度表达,从而引起单核细胞聚集并黏附血管壁发挥致炎作用。炎性物质可持续激活脑内的小胶质细胞、巨噬细胞、内皮细胞等保持炎性反应,进一步对SAH区域和周边组织造成持续的损害[19-20]。本组实验研究结果中sICAM-1、BAFF水平越高,则提示SAH的预后越差。而CD4+CD25+Treg的数量减少,则可导致患者免疫抑制功能受损,加重颅内动脉管壁持续性损伤。
综上所述,CD4+CD25+Treg是颅内动脉瘤患者的一种保护因素,其水平的含量降低,动脉瘤破裂后SAH的风险程度增加,sICAM-1、BAFF参与SAH的发生,其水平增高可加重SAH的炎症反应。血管痉挛和再破裂是动脉瘤破裂后的SAH预后和风险的主要方面,本研究中CD4+CD25+Treg、sICAM-1及BAFF这三类免疫因子均与SAH病情严重程度有关,因此通过对这三类免疫细胞因子的检测,可以掌握SAH的患者病情状况,预测患者血管痉挛和再出血的风险,为及时的调整治疗方案提供依据。但是本研究仍有一定的局限性,一是病例较少,研究时间仍然较短,对后期Treg、sICAM-1、BAFF动态改变没有进行研究。另外本研究仅对Hunt-Hess分级的相关性研究,对血管痉挛、GCS评分、NIHSS及VAS疼痛评分的相关性缺乏探讨。
1 Chen S, Luo J, Reis C, et al. Hydrocephalus after subarachnoid hemorrhage: pathophysiology, diagnosis, and treatment[J]. Biomed Res Int, 2017, 11(1):858-858.
2 孔祥溢, 关健, 李军, 等. 氧化应激促发颅内动脉瘤的研究进展[J]. 基础医学与临床, 2015, 35(4):558-562.
3 何安邦, 周奋, 潘德岳,等. 免疫炎症反应在颅内动脉瘤形成中的作用[J]. 国际脑血管病杂志, 2015, 23(2):107-109, 110.
4 Moraes L, Grille S, Morelli P, et al. Immune cells subpopulations in cerebrospinal fl uid and peripheral blood of patients with aneurysmal subarachnoid hemorrhage[J]. Springerplus, 2015, 4(1):195.
5 Biswas M, Sarkar D, Kumar SR, et al. Synergy between rapamycin and FLT3 ligand enhances plasmacytoid dendritic cell-dependent induction of CD4+CD25+FoxP3+Treg[J]. Blood, 2015, 125(19):2937-2947.
6 Fanny M, Gombault A, Francois F, et al. B-cell activating factor regulates IL-1β-and IL-17A-mediated pulmonary fi brosis in mice[J].Rev Mal Respir, 2015, 32(3):311-311.
7 杨福义, 高涵, 赵梓涵. TNF-α和sICAM-1在颅内动脉瘤的表达[J].黑龙江医药科学, 2016, 39(3):53-54.
8 陈佳琦, 陈慧敏. 颅内动脉瘤诊疗的研究现状和进展[J]. 临床荟萃,2014, 12(5):589-592.
9 马恒飞, 朱洁, 李灵军, 等. 脑脊液中CD4+CD25+Tr细胞和sICAM-1与蛛网膜下腔出血相关性研究[J]. 介入放射学杂志, 2015, 24(11):939-942.
10 丛大伟, 张雪峰, 王束玫. 动脉瘤性蛛网膜下腔出血后脑血管痉挛的防治探讨[J]. 滨州医学院学报, 2017, 40(1):36-38.
11 姚亮, 曹永胜. 复杂颅内动脉瘤的血管内治疗现状与进展[J]. 安徽医学, 2015 (1): 118-121, 122.
12 梁仔, 罗赛华. 自发性蛛网膜下腔出血患者CD4+CD25+调节性T细胞变化特点与意义[J]. 南方医科大学学报, 2013, 33(8):1213-1216.
13 罗赛华, 戴世学, 梁仔, 等. 颅内动脉瘤破裂与CD8+CD28-调节性T细胞的关系[J]. 中国神经精神疾病杂志, 2012, 38(7):425-427.
14 姚鹏飞, 程刚, 高晨, 等. 炎症在颅内动脉瘤形成和破裂中的作用和机制[J]. 国际脑血管病杂志, 2016, 24(3):275-278.
15 刘小飞, 段永红, 廖勇仕, 等. 破裂颅内动脉瘤患者动脉瘤壁AIF-1, MMP-9和COX-2表达上调[J]. 国际脑血管病杂志, 2016,24(9):833-838.
16 Schoenhoff FS. Increased TGF-β signaling precedes aneurysm formation in SMAD3 deficient mice[J]. EBioMedicine, 2016,9(12):26-27.
17 Fan XJ, Zhao HD, Yu G, et al. Role of in fl ammatory responses in the pathogenesis of human cerebral aneurysm[J]. Genet Mol Res, 2015,14(3):9062-9070.
18 邱友燕. 1型糖尿病患者血清B细胞活化因子水平改变及临床意义初探[D]. 广州医科大学, 2014.
19 Mcbride OM, Joshi NV, Robson JM, et al. Positron emission tomography and magnetic resonance imaging of cellular in fl ammation in patients with abdominal aortic aneurysms[J]. Eur J Vasc Endovasc Surg, 2016, 51(4):518-526.
20 Motoki T, Kurobe H, Hirata Y, et al. PPAR-γ agonist attenuates in fl ammation in aortic aneurysm patients[J]. Gen Thorac Cardiovasc Surg, 2015, 63(10):565-571.
2017-04-25)
(本文编辑:李少婷)
李淑雯,吕亮亮.脑脊液中CD4+CD25+Treg、sICAM-1及BAFF与动脉瘤蛛网膜下腔出血相关性研究[J/CD].中华细胞与干细胞杂志(电子版),2017,7(5):287-290.
Correlation of CD4+CD25+Treg, sICAM-1 and BAFF in cerebrospinal fluid with aneurysmal subarachnoid hemorrhage
Li Shuwen, Lyu Liangliang. Department of Neurosurgery, the Affiliated Hospital of Inner Mongolia Medical University, Hohhot 010050, China
Lyu Liangliang, Email: kittdoc@163.com
ObjectiveTo investigate the correlation of CD4+CD25+Treg, sICAM-1 and BAFF in cerebrospinal fluid (CSF) with aneurysmal subarachnoid hemorrhage.Methods120 theaneurysmal subarachnoid hemorrhage (SAH) patients treated in the Department of Neurosurgery,the Affiliated Hospital of Inner Mongolia Medical University from March 2015 to December 2016 were randomly selected as an observation group, and 40 healthy people we selected as a control group at the same period. CD4+CD25+Treg, sICAM-1 and BAFF in cerebrospinal fluid in both groups were detected.Ttest was used to compare among groups and Pearson parameter method was used to analyze the correlation with disease severity (Hunt-Hess classification method).ResultsThe CD4+CD25+Treg of the observation group (2.52±0.73)﹪ was significantly lower than that of the control group (4.52 ± 1.08)﹪ , which was statistically different (t=-12.563,P<0.01); sICAM-1(853.25 ±155.36) pg/ml and BAFF (586.23 ± 163.73) pg/ml levels in the observation group were significantly higher than those of the control group sICAM-1:(315.65±132.58) pg/ml, (t=-19.569,P<0.01) and BAFF:(272.66±142.58) pg/ml (t=-11.426, P<0.01), which were statistically different (P<0.05); with the increase of Hunt-Hess grade, CD4+CD25+Treg level in SAH patients was gradually decreased:(3.12 ± 0.82)﹪ and(2.42 ± 1.05)﹪ and(1.28 ± 0.61), sICAM-1(627.21±152.56) pg/ml, (794.78 ± 106.36) pg/ml, (896.56 ± 110.52) pg/ml and BAFF (395.32 ± 162.53)pg/ml, (589.62 ± 170.43) pg/ml, (789.61 ± 173.52) pg/ml levels were increased gradually, which were statistically different between 3 groups (F=7.214, 12.372, 11.581,P<0.01); CD4+CD25+Treg and SAH severity was negatively correlated (r=-0.824,P<0.01), sICAM-1 and BAFF levels and the severity of disease were negatively correlated (r=0.922, 0.472,P<0.01).ConclusionCD4+CD25+Treg is a protective factor for patients with intracranial aneurysms. Decrease of CD4+CD25+Treg increases the risk of SAH after aneurysm rupture. sICAM-1, BAFF are involved in SAH, the increase of which can increase the level of inflammation aneurysmal SAH.
CD4; CD25; Regulatory T cells; soluble; Cell adhesion molecules;B-cell activating factor; Aneurysm; Subarachnoid hemorrhage
10.3877/cma.j.issn.2095-1221.2017.05.006
010050 呼和浩特,内蒙古医科大学附属医院神经外科
吕亮亮,Email:kittdoc@163.com

