脐带血非造血性功能定向干(祖)细胞研究进展
徐峰波 崔光晶 曹光鑫 综述 沈柏均 校审
·综述·
脐带血非造血性功能定向干(祖)细胞研究进展
徐峰波1崔光晶1曹光鑫1综述 沈柏均2校审
脐带血非造血干细胞(UCB-nHSC)种类多样,近年来在越来越多的领域凸显其作用。本文归纳了脐带血中发现的胚胎样干细胞、非限制性体干细胞、多系性祖细胞及多潜能祖细胞、神经祖细胞的非造血干细胞的特性,指出目前研究应用领域及存在的问题,讨论与其他细胞相比在应用方面的优缺点,并在此基础上对UCB-nHSC的研究及应用前景做了展望。
脐带血非造血干细胞; 极小胚胎样干细胞; 非限制性体干细胞; 多系性祖细胞; 神经祖细胞
脐带血中含有丰富的干细胞,包括造血干细胞和非造血干细胞[1]。造血干细胞研究较多,已在临床中广泛应用。非造血类干细胞报道相对较少,但随着相关研究的加深,非造血类干细胞已成为干细胞研究的新热点。实际上非造血类干细胞包括多种种类,从原始的胚胎样干细胞到相对成熟的神经祖细胞和内皮祖细胞等[2],近年来已成为新的研究热点。与其他来源的干细胞相比,脐带血非造血干细胞(non-hematopoietic stem cells in umbilical cord blood,UCB-nHSC)具有取材方便、功能丰富、应用广泛等优点,文中对UCB-nHSC中胚胎样干细胞、非限制性体干细胞、多向分化祖细胞以及神经祖细胞的重要特性及研究应用现状进行综述,旨在探讨UCB-nHSC研究和应用前景,为再生医学提供重要的干细胞资源。
一、极小胚胎样干细胞(very small embryonic-like stem cells,VSELs)
VSELs以其体积小命名,且细胞数量很少,近年来研究逐渐增加。2006年3月Kucia等[3]从成年的小鼠骨髓Sca-1+Lin-CD45-细胞中分离趋化因子受体4阳性细胞时,发现一种同时表达胚胎干细胞、外胚层干细胞和原始生殖细胞标志分子(SSEA-1,Oct-4,Nanog和Rex-1)的特殊干细胞,该细胞数量很少,只占骨髓(mononuclear cell,MNC)的0.02﹪,细胞体积极小,只有2~4 μm,因此命名。同年,伊利诺伊大学的Zhao等[4]报道一种在脐带血中发现的命名为脐带血干细胞(cord blood stem cells,CB-SC)的多分化潜能异质细胞,CB-SC同时具有胚胎干细胞和造血干细胞相关分子标志的特征,体外诱导可分化为内皮和神经细胞,体内可分化为分泌胰岛素的细胞,这是首次从脐带血中发现胚胎样、可跨胚层分化的多能干细胞报道。Halasa等[5]也获得人脐带血VSELs,并证实脐带血VSELs的多能干细胞特征,该团队还通过对新生儿VSELs的研究,提出脐带血中VSELs与胎儿的发育密切相关。Shaikh等[6]从人脐带血分离得到的VSELs表达Lin-CD45-CD34+CD133+,并表达多能干细胞标志Oct4A,Oct4,SSEA4,SOX2,Nanog和 Rex-1以及原始生殖细胞标志STELLA,FRAGILIS。人脐带血VSELs细胞直径比鼠来源的稍大,约4~6 μm。人VSELs体积比红细胞小,但胞内内容物密度大,梯度密度离心分离时与红细胞而不是白细胞一起被分离。另外,也可采用流式细胞仪经过特异性标记分选得到。
VSELs是最原始的静息多能干细胞,成年组织器官中的其他干细胞可能是其定向分化的结果。VSELs作为最原始、体型小的静息干细胞,其活化可生成形体较大,兼有多向重叠分化潜能的干细胞,很可能是真正发挥器官修复作用的生命机制[7]。Ratajczak等[8]用从脐带血分离来的VSELs与OP9共培养获得的造血细胞,可使致死剂量照射的非肥胖型糖尿病免疫缺陷小鼠重建造血功能,并且移植这些造血细胞后小鼠的造血功能可持续4~6周,因此研究者推测,VSELs可能是脐带血中最原始的造血干细胞。Ratajczak等研究认为,脐带血VSELs为新生儿提供用于修复分娩中损伤组织的干细胞,由此认为,VSELs具有可长期再植造血干细胞(long-term repopulating hematopoietic stem cells,LTHSCs)特性,可作为再生医学中多能干细胞的重要来源。因此,VSELs具有原始性、体积小、分化能力强的特点,使其在新生儿干细胞修复方面作用较大,随着研究的深入,将在越来越多的领域发挥作用。
二、非限制性体干细胞(unrestricted somatic stem cells,USSCs)
2004年,Kögler等[9]报道一种从脐带血中发现的多能干细胞,称之为USSCs。USSCs从脐带血MNC中分离得到,但在脐带血中含量极低。该细胞类似间充质干细胞(mesenchymal stem cells,MSCs),可黏附生长,细胞形态呈梭型,具有高增殖活性。USSCs表面抗原表达情况与MSCs类似,阳性标志分子有:CD13/CD29/CD44/CD90/CD105,但不表达CD14/CD34/CD45。两者的不同在于,USSCs不表达CD50/CD62L/CD106和HAS1,而MSCs呈阳性表达。USSCs在体内外都可以分化成3个不同胚层的细胞,包括成骨细胞、成软骨细胞、脂肪细胞、造血细胞和神经胶质细胞。研究发现,将USSCs移植到无创羊胚胎,可得到USSCs来源的造血细胞、心肌细胞以及可产生白蛋白的干细胞。此外,脐带血USSCs可以在支持MSCs生长的培养基中扩增,同时具备造血支持基质的活性和体内增强脐带血CD34+细胞归巢的能力,而且USSCs的这种造血支持活性和相关细胞因子表达水平高于骨髓MSCs。以此推断USSCs是比MSCs更原始的干细胞,是促进脐带血造血和加快血象恢复的重要因素。
近来研究发现,β-磷酸三钙-藻酸盐-明胶(beta tricalcium phosphate alginate gelatin,BTAG)3D支架可促进人脐带血来源的USSCs向软骨细胞分化[10]。研究中实验组的USSCs被包裹在BTAG的支架中诱导培养,对照组在无支架的诱导培养体系中。免疫组化检测表明,含支架组在培养21 d后细胞外基质中强烈表达USSCs来源的Ⅱ型胶原蛋白,可观察到未完全分化的细胞(图1a),但在无支架培养体系未检测到粘多糖的表达(图1b)。PCR检测表明,实验组中软骨特异性标记物、蛋白聚糖聚合物、Ⅰ型和Ⅱ型胶原蛋白以及骨形成蛋白(BMP-6)的mRNA表达水平高于对照组。可见,BTAG可为USSCs向软骨分化提供合适的生长环境,这为USSCs的临床应用提供研究方向。
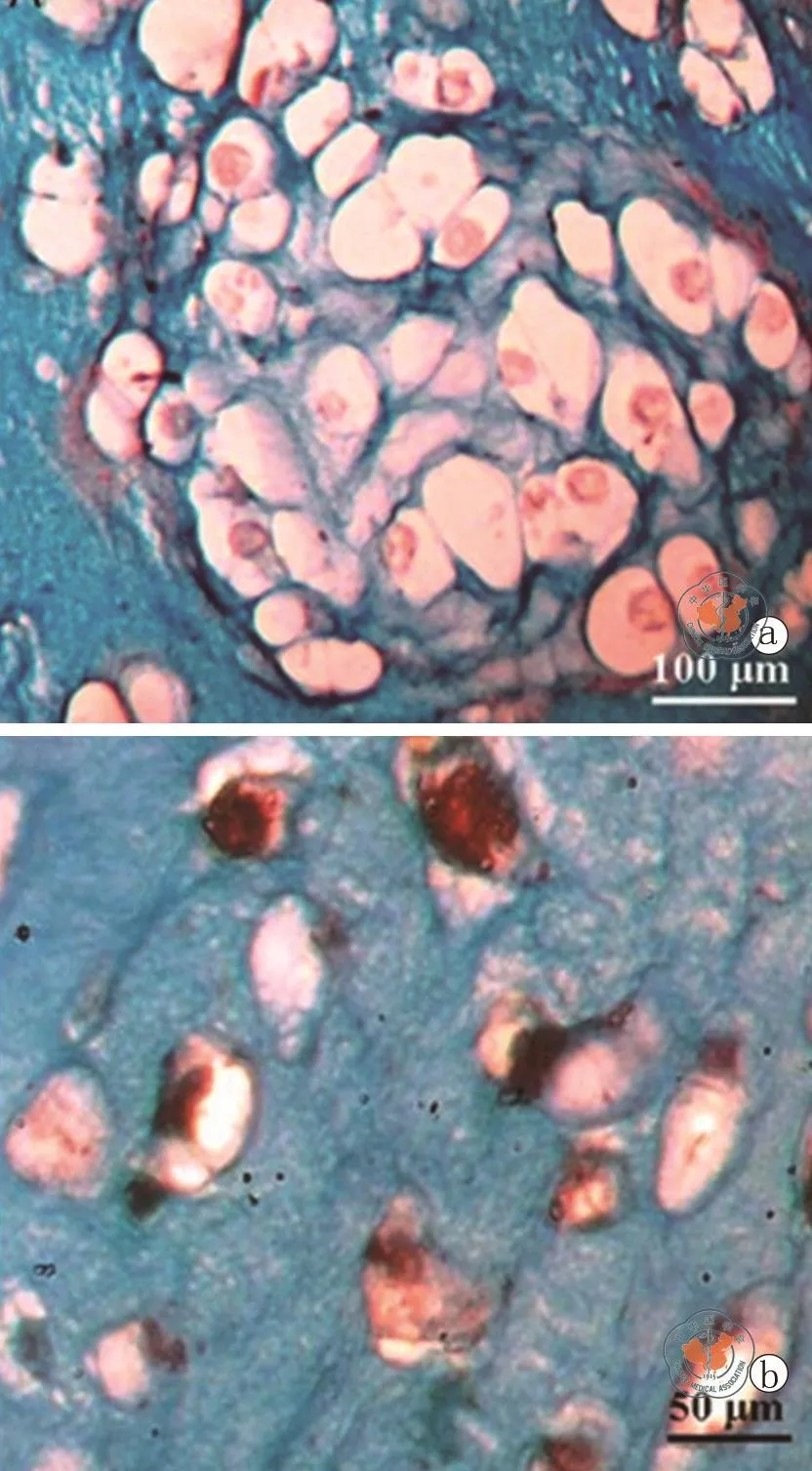
图1 波长594nm-倒置显微镜(Olympus, Japan)下观察存在3D支架和无支架条件下培养USSCs的特征(阿尔新蓝染色)[10]
Kögler等[11]研究认为,USSCs是脐带血中具有基质细胞特性的一类干细胞,它和脐带血多能基质细胞(cord blood multipotent stromal cells,CB-MSCs)的成脂分化能力不同,前者不响应成脂诱导,不表达脂肪前体细胞标志δ 样 1型同源物(delta like 1 homologue,DLK-1)和同源框(homeobox,HOX)基因,而 CB-MSCs与骨髓来源的MSCs类似,可形成脂质空泡并表达人HOX基因。目前已有多个研究团队分别从脐带血中制备得到USSCs和CBMSCs细胞系,但两种细胞是原本并行存在于脐带血,还是在细胞培养过程中可从其他细胞转化,有待进一步研究。据Karagianni推测[12],脐带血来源的所有基质细胞原本只是USSC而非MSC样细胞,并且它们可能是在外因如地塞米松的刺激下获得成脂的能力,然而该假设机制尚需进一步的实验证实。Kluth等[13]研究发现,相比于CB-MSC,USSC可增加造血细胞扩增,促进胰岛素样生长因子结合蛋白1(insulin-like growth factor binding protein 1,IGFBP1)的表达,但胰岛素生长因子2(insulin-like growth factor,IGF)的表达水平则较低,后者对成脂分化具有与胰岛素一样重要的调节作用,该实验结果提示,DLK-1可能不是抑制USSCs成脂分化的唯一因素。
脐带血USSCs增殖分化作用的机制研究较少,一般认为脐带血USSC自我更新和分化与转录因子Nanog和Rex-1密切相关。Langroudi等[14]通过siRNA干扰实验证实Nanog和Rex-1在USSCs诱导分化中的作用。研究显示,Nanog敲除可促进成骨标志物、骨钙素和骨桥蛋白的表达,并可得到茜素红染色阳性的骨细胞,这说明USSCs已向骨细胞分化。USSCs敲除基因后经油红染色呈阳性,这意味着USSCs已向成脂分化。而USSCs敲除REX-1可增加神经细胞分化的标志MAP Ⅱ及Nestin表达。然而,用上述两种siRNA共同干扰,评估指标却没有任何变化。因此,可见Nanog基因控制着USSCs向骨和脂肪的分化,REX-1基因被抑制将导致USSCs向神经细胞分化。Langroudi等认为,这两种转录因子是USSCs自我更新的核心活化剂,同时也受到其他因素影响,该结果显示在USSCs自我更新的调控网络中存在一个正向反馈机制。
三、多系性祖细胞(multilineage progenitor cells,MLPCs)和多潜能祖细胞(multipotent progenitor cells,MPCs)
MLPCs是一种报道较少但确定存在于脐带血中数量很少的多能干细胞[15],可通过抗体亲和分离培养基分离得到。新分离的MLPCs呈白细胞样形态,表达CD45、CD34、CD133、CD9、Nestin、SSEA-3、SSEA-4和几种 MSC 的标志如 :CD13、CD29、CD44、CD73、CD90 和 CD105。培养扩增后细胞形态变为纤维细胞样,且丢失造血干细胞标志CD34、CD133和胚胎干细胞标志SSEA-3、SSEA-4,但仍表达MSC的标志。而且,MLPCs也可以从脐带血MSCs中通过单细胞克隆获得[16]。MLPCs因扩增细胞类型范围更广、可塑性更高而区分于MSCs。与脐带血MSCs和骨髓MSCs相比,脐带血MLPC显著的表型特征是高表达CD9。微量测定分析显示,MLPCs是一类相对静止的原始细胞,相对于骨髓MSC,它具有更宽的可塑性,也不能简单地归入哪一类胚层细胞。据报道,MLPCs可以分化成3个胚层中任意种类的细胞,例如内胚层的肝胰前体细胞、成熟干细胞和Ⅱ型肺泡细胞;中胚层的脂肪细胞、成软骨细胞、成骨细胞、心肌细胞和内皮细胞以及外胚层的神经元细胞、星形胶质细胞和少突胶质细胞。尽管MLPCs具有广泛的扩增能力和较高的可塑性,但不具备胚胎干细胞样的自发分化和畸胎瘤形成能力,这也预示MLPCs将成为再生医学关注的重要干细胞来源。
MPCs由Lee等[17]在冻存的脐带血中分离提取,该类细胞不表达造血干细胞常见的标志物CD34和CD133,高表达CD14、CD45、CD33及SSEA-4,由此可与其他干细胞分离。Lee等通过分离培养发现,MPCs可分化成神经组织特异的细胞群,包括神经元细胞和神经胶质细胞,这提示MPCs在未来同种异体细胞治疗中可发挥作用。在成功分离MPCs后,Moon等[18]通过研究发现MPCs在适当的培养条件下可诱导分化成肝细胞系,表达肝细胞特异性标志物,如白蛋白、肝细胞核因子(hepatocyte nuclear factor,HNF)-1α、HNF-4、角蛋白(CK)-8、CK-18等。其中,能够分泌白蛋白说明脐带血来源的MPCs具有多向分化潜能并有分化成功能性肝细胞系的能力。MPCs诱导后,在基因和蛋白水平均能表现肝细胞合成、代谢等特性[19],这也提示MPCs可能会成为组织工程或肝细胞治疗的重要来源。因此,随着研究的深入,MPCs将会在多种领域发挥作用,成为重要的细胞治疗来源。
四、神经祖细胞(neuronal progenitor cells,NPCs)
2002年Buzańska等[20]从脐带血中分离得到NPCs,它具有形成神经细胞球和神经分化的潜能。研究者通过CD34免疫磁珠负筛选,去除表达CD34和CD45的细胞后,再经细胞表面分子特异吸附法富集得到神经前体细胞。这些神经前体细胞在表皮生长因子(EGF)存在条件下,低细胞密度培养可得到球状神经元。Buzańska的研究团队还建立非永久基因克隆型的脐带血神经干细胞系(umbilical cord blood neuronal stem cells UCB-NSCs),该细胞系可通过培养维持其神经祖细胞发生发展的不同阶段[21]。从UCB-NSCs来源的神经细胞球可以表达神经干/祖细胞标志nestin和胶质纤维酸性蛋白(GFAP),并能分化成神经纤维、星形胶质细胞和少突胶质细胞系。McGuckin等从不表达造血细胞标志(CD45,CD33,CD7和glycophorin-A)的脐带血MNC中诱导获得类似神经干细胞的细胞球,其采用的诱导培养体系包含胸腺蛋白、Flt-3配体和c-kit配体(TPOFLK)。
研究者通过实验还发现[22],脐带血MNC中存在神经细胞分化潜能的细胞,体外可形成神经细胞球并能分化成神经细胞、星形胶质细胞和少突胶质细胞(图2)。新分离的p75NTR+细胞可表达各种神经脊细胞的特异标志,如Slug、Snail、Twist、Wnt-1和Sox9,由此可推断这部分细胞起源于神经脊干细胞。
脐带血来源的具有神经分化潜能的UCB-nHSC,具有多向分化潜能和长期培养可塑性。对于UCB-nHSC的应用前景,Domanska等[22]认为,目前仍缺少足够的理论知识,急需的不是开展相关临床应用实验研究,而应该根据现有基础进行动物实验研究以提供充足的证据,发掘成体干细胞的生物学特征,这对深入发挥人干细胞的潜力有重要意义。另外,神经干(祖)细胞移植物的免疫原性尚未充分研究。总体而言,只有在解决神经干细胞移植治疗达到何种疗效程度、发挥作用的机制是什么等问题后,才能决定是否移植UCB来源的神经干(祖)细胞来治疗人类脑病。

图2 UCB-NSCs可形成的神经球免疫组化结果[22]
事实上,已证实人脐带血移植可以促进中风[23]、肌肉萎缩性脊髓侧索硬化症[24-25]、外伤性脑损伤[26]以及脊髓损伤小鼠的功能恢复[27-28],但目前并未确定是哪些细胞在改善功能中起作用。因为移植的细胞,甚至包括脑内输注细胞,难以在脑部找到,行业内人员更倾向于认同细胞通过分泌营养因子增强脑部修复的内源性机制。
Sun等[29]的研究表明UCB-nHSC有望用于神经元和神经胶质细胞损伤的修复或定向诱导分化后用于遗传性神经系统疾病中替代异常细胞。干细胞治疗需要体外制备大量干细胞,并建立可直接有效分化成特定的神经元和胶质细胞的细胞培养条件。UCB作为这种神经修复的干细胞来源容易获得,且不会产生像人胚胎细胞ESCs带来的伦理问题。因此,UCB是一种神经修复干细胞的重要来源。
五、展望
UCB-nHSC是再生医学发展的重要资源,并能在一定程度上避免多能或全能干细胞的医学伦理问题,必将受到临床应用的广泛欢迎。
应该看到,目前报道的UCB-nHSC中,有些干细胞种类定义的范围可能存在相互重叠的情况,这些干细胞一般根据细胞的发现者以及他们采取的分离和扩增的方法来命名。UCB-nHSC的研究重点关注干细胞的起源、分化潜能和致瘤性,其实用性有待进一步研究。另外,扩增或诱导分化为临床移植所需数量的特定干细胞的方法尚未完全建立。需说明的是,脐带血中的VSELs并未发现致瘤性,虽然这些细胞有效分离和扩增的方法尚未形成固定体系,但已受到未来临床应用研究的重视。近期研究表明,体细胞可以被重编程强制表达四种转录因子,包括Oct4,Sox2,c-Myc和Klf4,从而使细胞返祖到一种多能状态,称为诱导多能干细胞(iPSCs)。iPSCs具有多向分化能力,且可来自自体的体细胞不会引起免疫排斥作用,又能够避开医学伦理问题,因此有望成为再生医学期待的重要细胞来源。尽管如此,目前iPSCs重编程的效率极低以及致瘤性倾向的问题阻碍iPSCs的临床应用。正因如此,相对于iPSCs未来应用存在的问题,胎盘(脐带)血中存在的低抗原性、无致瘤性、易制备、不使用病毒载体和基因转导的脐带血多能干细胞,将会在再生医学中显现重要价值。
UCB-nHSC以其特有的原始性、多样性、多能性等特征,将会吸引越来越多的科研人员进行深入研究,对再生医学及前沿技术推广应用有重要作用,必将对广大患者带来希望。
1 金婷, 王利, 王红祥. 非血缘脐血移植治疗成人急性白血病的研究进展[J]. 中华器官移植杂志, 2015, 36(2):120-123.
2 Matsumoto T, Mugishima H. Non-hematopoietic stem cells in umbilical cord blood[J]. Int J Stem Cells, 2009, 2(2):83-89.
3 Kucia M, Reca R, Campbell FR, et al. A population of very small embryonic-like (VSEL) CXCR4(+)SSEA-1(+)Oct-4+ stem cells identi fi ed in adult bone marrow[J]. Leukemia, 2006, 20(5):857-869.
4 Zhao Y, Wang H, Mazzone T. Identification of stem cells from human umbilical cord blood with embryonic and hematopoietic characteristics[J]. Exp Cell Res, 2006, 312(13):2454-2464.
5 Halasa M, Baskiewicz-Masiuk M, Dabkowska E, et al. An efficient two-step method to purify very small embryonic-like (VSEL) stem cells from umbilical cord blood (UCB)[J]. Folia Histochem Cytobiol,2008, 46(2):239-243.
6 Shaikh A, Nagvenkar P, Pethe P, et al. Molecular and phenotypic characterization of CD133 and SSEA4 enriched very small embryonic-like stem cells in human cord blood[J]. Leukemia, 2015,29(9):1909-1917.
7 Ratajczak MZ, Suszynska M, Pedziwiatr D, et al. Umbilical cord blood-derived very small embryonic like stem cells (VSELs) as a source of pluripotent stem cells for regenerative medicine[J]. Pediatr Endocrinol Rev, 2012, 9(3):639-643.
8 Ratajczak J, Zuba-Surma E, Klich I, et al. Hematopoietic differentiation of umbilical cord blood-derived very small embryonic/epiblast-like stem cells[J]. Leukemia, 2011, 25(8):1278-1285.
9 Kögler G, Sensken S, Airey JA, et al. A new human somatic stem cell from placental cord blood with intrinsic pluripotent differentiation potential[J]. J Exp Med, 2004, 200(2):123-135.
10 Soleimani M, Khorsandi L, Atashi A, et al. Chondrogenic differentiation of human umbilical cord blood-derived unrestricted somatic stem cells on a 3D Beta-tricalcium phosphate-alginate-gelatin scaffold[J]. Cell J, 2014, 16(1):43-52.
11 Kögler G, Radke TF, Lefort A, et al. Cytokine production and hematopoiesis supporting activity of cord blood-derived unrestricted somatic stem cells[J]. Exp Hematol, 2005, 33(5):573-583.
12 Karagianni M, Brinkmann I, Kinzebach S, et al. A comparative analysis of the adipogenic potential in human mesenchymal stromal cells from cord blood and other sources[J]. Cytotherapy, 2013, 15(1):76-88.
13 Kluth SM, Radke TF, Kögler G. Increased haematopoietic supportive function of USSC from umbilical cord blood compared to CB MSC and possible role of DLK-1[J]. Stem Cells Int,2013,2013:985285.
14 Langroudi L, Forouzandeh M, Soleimani M, et al. Induction of differentiation by down-regulation of Nanog and Rex-1 in cord blood derived unrestricted somatic stem cells[J]. Mol Biol Rep, 2013,40(7):4429-4437.
15 van de Ven C, Collins D, Bradley MB, et al. The potential of umbilical cord blood multipotent stem cells for nonhematopoietic tissue and cell regeneration[J]. 2007, 35(12):1753-1765.
16 Berger MJ, Adams SD, Tigges BM, et al. Differentiation of umbilical cord blood-derived multilineage progenitor cells into respiratory epithelial cells[J]. Cytotherapy, 2006, 8(5):480-487.
17 Lee MW, Moon YJ, Yang MS, et al. Neural differentiation of novel multipotent progenitor cells from cryopreserved human umbilical cord blood[J]. Biochem Biophys Res Commun, 2007, 358(2):637-643.
18 Moon YJ, Yoon HH, Lee MW, et al. Multipotent progenitor cells derived from human umbilical cord blood can differentiate into hepatocyte-like cells in a liver injury rat model[J]. Transplant Proc,2009, 41(10):4357-4360.
19 Moon YJ, Lee MW, Yoon HH, et al. Hepatic differentiation of cord blood-derived multipotent progenitor cells (MPCs)in vitro[J]. Cell Biol Int, 2008, 32(10):1293-1301.
20 Buzańska L, Machaj EK, Zabłocka B, et al. Human cord blood-derived cells attain neuronal and glial featuresin vitro[J]. J Cell Sci, 2002,115(Pt 10):2131-2138.
21 Buzańska L, Jurga M, Domańska-Janik K. Neuronal differentiation of human umbilical cord blood neural stem-like cell line[J]. Neurodegener Dis, 2006, 3:19-26.
22 Domanska-Janik K, Buzanska L, Lukomska B. A novel, neural potential of non-hematopoietic human umbilical cord blood stem cells[J]. Int J Dev Biol, 2008, 52(2/3):237-248.
23 Bliss T, Guzman R, Daadi M, et al. Cell transplantation therapy for stroke[J]. Stroke, 2007, 38(S2):817-826.
24 Chen R, Ende N. The potential for the use of mononuclear cells from human umbilical cord blood in the treatment of amyotrophic lateral sclerosis in SOD1 mice[J]. J Med, 2000, 31(1/2):21-30.
25 Garbuzova-Davis S, Willing AE, Zigova T, et al. Intravenous administration of human umbilical cord blood cells in a mouse model of amyotrophic lateral sclerosis: distribution, migration, and differentiation[J]. J Hematother Stem Cell Res, 2003, 12(3):255-270.
26 Lu D, Sanberg PR, Mahmood A, et al. Intravenous administration of human umbilical cord blood reduces neurological de fi cit in the rat after traumatic brain injury[J]. Cell Transplant, 2002, 11(3):275-281.
27 Saporta S, Kim JJ, Willing AE, et al. Human umbilical cord blood stem cells infusion in spinal cord injury: engraftment and bene fi cial in fl uence on behavior[J]. J Hematother Stem Cell Res, 2003, 12(3):271-278.
28 Zhao ZM, Li HJ, Liu HY, et al. Intraspinal transplantation of CD34+human umbilical cord blood cells after spinal cord hemisection injury improves functional recovery in adult rats[J]. Cell Transplant, 2004,13(2):113-122.
29 Sun T, Ma QH. Repairing neural injuries using human umbilical cord blood[J]. Mol Neurobiol, 2013, 47(3):938-945.
徐峰波,崔光晶,曹光鑫综述,等.脐带血非造血性功能定向干(祖)细胞研究进展[J/CD].中华细胞与干细胞杂志(电子版),2017,7(5):304-308.
Research progress of non-hematopoietic functional committed progenitor/stem cells in umbilical cord blood
Xu Fengbo, Cui Guangjing, Cao Guangxin, Shen Baijun.1Yinfeng Biological Group,Jinan 250101, China;2Shandong Cord Blood Bank, Jinan 250101, China
Shen Bojun, Email: sbj915@yeah.net
There are a variety of non-hematopoietic stem cells in the umbilical cord blood and their potential use in non-hematopoietic fields have attracted great attention in recent years. This review summarizes the characteristics of embryonic-like stem cells, unrestricted somatic stem cells,multilineage progenitor cells, multipotent progenitor cells and neuronal progenitor cells which were found in the umbilical cord blood. The clinical application and existing problems of these cells are discussed. Finally, the prospect of the research and application are also presented.
Non-hematopoietic stem cells in umbilical cord blood; Very small embryoniclike stem cells; Unrestricted somatic stem cells; Multilineage progenitor cells; Neuronal progenitor cells
10.3877/cma.j.issn.2095-1221.2017.05.009
250101 济南,银丰生物工程集团有限公司1;250101 济南,山东省脐带血造血干细胞库2
沈柏均,Email:sbj915@yeah.net

