Epha4基因通过FGF信号通路调节大脑皮层发育
陈清法 韩发彬
Epha4基因通过FGF信号通路调节大脑皮层发育
陈清法 韩发彬
目的阐明Epha4基因在大脑皮层发育早期放射性胶质细胞(RGCs)命运决定中的功能。方法利用Cre-loxp技术分别在孕龄为11.5 d或13.5 d的小鼠皮层细胞中敲掉Epha4基因。根据小鼠的基因型分为3组:对照组、Nestin;Epha4fx/fx及GFAP;Epha4fx/fx,分别通过尼氏染色、免疫荧光共染色及免疫印迹分析了突变小鼠大脑皮层表现型、大脑皮层RGCs增殖和分化及皮层细胞信号通路。组间比较利用F检验进行统计学分析。结果尼氏染色结果表明,与正常新生小鼠皮层(709±30)µm相比,在孕龄11.5 dEpha4基因敲除新生小鼠大脑皮层厚度减少至(475±66)µm,差异具有统计学意义(t=7.252,P<0.05),而孕龄 13.5 dEpha4基因敲除新生小鼠大脑皮层厚度(727±37)µm,差异无统计学意义。BrdU标记及免疫荧光共染色结果表明,在孕龄14.5 d两种突变小鼠中RGCs增殖能力减弱(46±1)﹪vsEpha4fx/fx(58 ± 2)﹪,t=10.72,P<0.05 ;GFAP;Epha4fx/fx(50±2)﹪vsEpha4fx/fx(58±2)﹪,t=5.575,P<0.05),而向神经元分化能力增强(Nestin;Epha4fx/fx(34±5)﹪vsEpha4fx/fx(25±1)﹪,t=4.269,P<0.05 ;GFAP;Epha4fx/fx(35±2)﹪vsEpha4fx/fx(25±1)﹪,t=12.48,P<0.05。Western blotting分析表明分离的皮层细胞经成纤维生长因子(FGFs)作用时ERK及FRS2α磷酸化减弱。结论Epha4基因决定大脑皮层发育早期RGCs的命运,这一过程是通过FGFs信号通路完成的。这些发现为临床治疗脊髓损伤及阿尔茨海默症等神经疾病提供了理论依据。
大脑皮层; 胶质细胞;Epha4; FGF; 信号通路; Cre-loxp
在大脑皮层发育过程中,放射性胶质细胞(radial glial cells,RGCs)在室管膜区顶端扩增并在胚胎发育早期分化产生神经前体祖细胞(intermediate progenitor cells,IPCs),接着在胚胎发育晚期分化成各种类型的神经元细胞,最先形成神经元细胞位于皮层内侧,然后形成的神经元跨过先形成的神经元迁移到皮层板上,最终形成六层层状结构[1-2]。
成纤维生长因子( fi broblastic growth factors,FGFs)通过磷酸化FRS2α及ERK促进RGCs的增殖,在神经系统发育中起重要作用[3-4],但是FGFs信号通路如何诱导RGCs到神经元细胞的转换还未知。EphA4是Eph受体酪氨酸激酶家族的一员,可以被所有的ephrin-A配体和ephrin-B配体激活[5]。在成年小鼠皮层中EphA4促进神经干细胞分化及迁移[6],Epha4基因突变小鼠比野生小鼠具有较薄的皮层及减弱的皮层RGCs增殖能力[7]。但是,在皮层发育过程中Epha4基因在大脑皮层发育早期中的功能还不清楚,有待进一步研究。
为了研究Epha4基因在大脑皮层发育早期中的功能,本文利用Cre-loxP技术构建了两种不同发育阶段Epha4基因的条件性敲除小鼠。
材料与方法
一、材料
1.样本来源:Epha4fx等位基因的小鼠、Nestin-Cre及hGFAP-Cre转基因小鼠购自美国Jackson实验室。
2.主要试剂和仪器:DMEM培养基(美国Invitrogen公司)、青链霉素(美国Invitrogen公司)、胎牛血清(美国Invitrogen公司)、胰酶细胞消化液(美国Invitrogen公司)、细胞培养孵箱(美国Thermo公司)、CO2孵箱(美国Thermo公司)、荧光显微镜(日本 Keyence公司)、低速离心机(德国 eppendorf公司)、超净工作台(日本Airtech公司)。
二、方法
1.基因突变小鼠:靶向Epha4敲除是通过Cre介导的loxP包被的Epha4fx等位基因序列同源重组完成的。具体操作是将带有Epha4fx等位基因的小鼠[8]与带有Nestin-Cre[9]或hGFAP-Cre[10]转基因小鼠交配,得到Epha4fx同源等位基因和由Nestin或GFAP启动子调控的Cre小鼠(Nestin;Epha4fx/fx和GFAP;Epha4fx/fx)(图 1)。带有同源Epha4fx等位基因的小鼠用来作为对照。Nestin或GFAP启动子特定介导Cre重组酶在背部端脑及大脑皮层的RGCs表达分别开始于孕龄11.5 d和孕龄13.5 d时期,导致Epha4等位基因在大多数RGCs及它们子代中通过同源重组被敲除。阴道栓刚鉴定到的早晨被认定为孕龄0.5 d,阴道栓鉴定后的第19天被认定为出生后0天(P0)。本研究严格按照国家卫生部的实验动物饲养与使用指南进行。所用动物手术都是通过麻醉进行的,并尽可能避免动物疼痛。所有实验都按照聊城大学/聊城市人民医院动物饲养与使用委员会规则进行并得到批准。
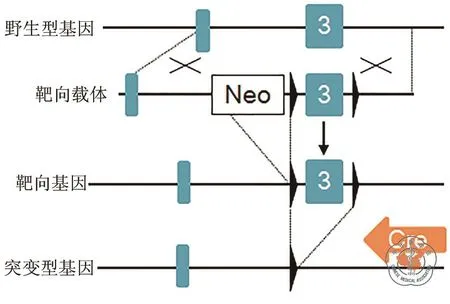
图1 Cre-loxP方法获得Epha4基因特异敲除小鼠
2.免疫荧光共染色、尼氏染色及定量分析:(1)免疫荧光共染色:分离的胚胎小鼠大脑通过4﹪多聚甲醛(PFA)在4℃固定过夜,石蜡包埋。6 µm厚的石蜡切片经脱蜡、水解、在10 mmol/L柠檬酸钠(pH值6.0)中121℃加热1 min进行抗原修复,然后使用标准染色方法进行免疫荧光染色分析。具体操作是切片在含10﹪羊血清的Tris碱和Tween 20缓冲液(pH值8.0)室温孵育30 min,然后在4 ℃孵育一抗过夜。本文中所使用的一抗有:兔抗人Class Ⅲ β-tubulin(TUBB3)(Cat.#MRB-435P,1:1000,Covance),兔 抗 人 Ki67抗体(Cat.#ab16667,1:200,Abcam),小鼠抗人 BrdU抗 体(Cat.#MI-11-3,1:1000,MBL)。PBS 洗 去 一抗,切片在连接有Alexa Flour 488及Alexa Flour 568(Molecular Probes)二抗室温孵育1 h用于免疫荧光染色。经PBS洗涤后复染DAPI(Molecular Probes),并用封固剂Gel/Mount(DAKO)封片。染色结果通过Keyence BZ-9000显微镜或Zeiss LSM5激光共聚焦显微镜进行检测。(2)尼氏染色:使用0.1﹪甲基蓝溶液对10 µm厚的石蜡切片进行染色[11]。染色结果通过Keyence BZ-9000显微镜检测。(3)定量分析:P0皮层的厚度测量位点在连接pallial-subpallial VZ界线与半球间裂沟的皮层VZ dosalmost弯曲的中间线(图2),增殖区的厚度也在相同位点测量。BrdU+细胞、BrdU+Ki67+细胞、BrdU+TUBB3+细胞数目在100~300 µm宽的矩形区域计算而来,该矩形区域的中线与pallialsubpallial VZ界线与背部VZ弯曲的中线对应。
3. BrdU标记:将BrdU通过皮内注射入孕鼠,每千克体重注射50 mg BrdU。对于细胞循环逃逸分析,将孕龄13.5 d的母鼠注射入BrdU,然后免疫组化分析。石蜡切片经1.5 mol/LHCl 37 ℃变性30 min,然后用0.1 mol/L硼酸钠(pH值8.5)中和后进行一抗孵育。每个基因型检测至少5只小鼠。
4. Western blotting:经端脑皮层分离而来的细胞经机械法分离,并在含有0.6﹪葡萄糖、25 mmol/L HEPES、1﹪青霉素/链霉素的DMEM培养基中37 ℃含5﹪ CO2培养箱中培养60 min。细胞悬液分到两管,一管对照,另一管经FGF2处理20 min。FGF2处理细胞及对照细胞在裂解液中裂解。15~50 µg上样量的蛋白经 SDS-PAGE 电泳分离并在PVDF膜上杂交(Millipore,Billerica,MA,USA)。经 Immobilon Western Blotting 检测系统(Millipore)检测。用于western blotting的抗体有兔抗人 EphA4多克隆抗体(Cat. #sc-921;1:2000,Santa Cruz),兔 抗 人 FRS2α 多 克 隆 抗 体(Cat.#sc-8318 ;1:1000,Santa Cruz),兔抗人 GAPDH 多克 隆 抗 体(Cat. #sc-25778,1:3000,Santa Cruz),兔抗人有丝分裂活化蛋白激酶(MAPK)(ERK)(Thr202/Tyr204)多克隆抗体(Cat.#9101;1:4000,Cell Signaling Tech),兔抗人 MAPK(ERK)多克隆 抗 体(Cat. #9102 ;1:4000,Cell Signaling Tech),及兔抗人 pFRS2α(Y196)(Cat. #3861;1:1000,Cell Signaling Tech)。蛋白灰度通过CS 分子软件版本3.0(日本ATTO公司)进行定量。
三、统计学分析方法
使用GraphPad Prism6软件进行统计学处理,皮层厚度、增殖区(VZ+SVZ)厚度、Ki67+BrdU+细胞占总BrdU+细胞的比例及Tuj1+BrdU+细胞占总BrdU+细胞的比例平均值以± s表示。组间比较采用F检验进行统计学分析。以P<0.05为差异有统计学意义。

图2 Epha4基因敲除小鼠冠状脑切片甲基蓝染色及定量分析
结 果
一、Epha4基因敲除对皮层大小影响呈现阶段依赖性
为了研究Epha4基因在皮层发育过程时间调控性,分别在深层皮层形成起始阶段或表层皮层形成起始阶段在RGCs中敲掉Epha4。免疫印迹结果表明Epha4等位基因在大多数RGCs及它们子代中通过同源重组分别在孕龄11.5 d时期(图3a)和孕龄13.5 d时期(图3b)被敲除。
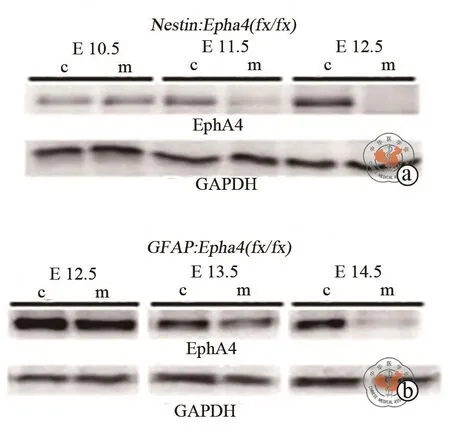
图3 Western blotting检测Epha4基因在Nestin;Epha4(fx/fx)及GFAP;Epha4(fx/fx)突变小鼠中的表达
脑切片的尼氏染色表明Nestin;Epha4fx/fx小鼠大脑皮层在P0时期具有正常的大体层状结构(图2)。GFAP;Epha4fx/fx小鼠也有正常的整体皮层结构。Nestin;Epha4fx/fx小鼠大脑半球的大小与同笼对照小鼠相比略微减小,并且整个大脑皮层的放射状厚度减小。另外,皮层增殖区域的VZ及SVZ的厚度在皮层前部区域减小(表1)。通过比较Nestin;Epha4fx/fx和GFAP;Epha4fx/fx间的早期大脑皮层RGCs的命运决定,进一步对Epha4基因缺失在大脑皮层发育过程中的生物学功能进行研究。
表1 突变小鼠同正常小鼠皮层厚度及VZ+SVZ厚度比较(μm,± s)

表1 突变小鼠同正常小鼠皮层厚度及VZ+SVZ厚度比较(μm,± s)
注 :与对照组比较,aP<0.05 ;与 Nestin ;Epha4(fx/fx)比较,bP<0.05
组别 动物数 皮层厚度 VZ+SVZ厚度对照组 5 709±30 65± 4 Nestin ;Epha4(fx/fx) 5 475±66a 39±13a GFAP ;Epha4(fx/fx) 5 727±37b 63± 8b F值 44.75 12.61 P值 <0.01 <0.01
二、Epha4基因在RGCs命运决定中的作用
为了寻找直接的证据证明Epha4缺失在大脑皮层发育过程中的作用,对RGCs向细胞分裂的细胞数及向神经元转变的细胞数进行了定量检测。有丝分裂活性前体细胞在孕龄13.5 d时期用BrdU标记,24 h后有丝分裂细胞群体的命运通过共染色法进行分析。进入分裂前体细胞中的BrdU与分裂细胞蛋白标记物Ki67或者与神经元的标记物Tuj1结合,确定细胞重新进入细胞周期或逃逸细胞周期的数目。与对照小鼠相比,发现在突变小鼠中Ki67+BrdU+细胞在总BrdU+细胞中的比例明显降低(图 4a~c,表 2),相反 Tuj1+BrdU+ 细胞在总体BrdU+ 细胞中比例增加(图 4d~f,表 2)。
表2 突变小鼠同正常小鼠皮层RGCs和IPCs的增殖和分化比较(﹪,± s)

表2 突变小鼠同正常小鼠皮层RGCs和IPCs的增殖和分化比较(﹪,± s)
注 :与对照组比较,aP<0.05 ;与 Nestin ;Epha4(fx/fx)比较,bP<0.05
Tuj1+BrdU+细胞占总BrdU+细胞的比例对照组 5 58±2 25±1组别 动物数Ki67+BrdU+细胞占总BrdU+细胞的比例Nestin;Epha4(fx/fx) 5 46±1a 34±5a GFAP;Epha4(fx/fx) 5 50±2ab 35±2a F值 62.22 15.17 P值 <0.01 <0.01
三、Epha4基因通过调控FGFs信号通路调节皮层神经发育
为了检测Epha4基因是否影响皮层FGFs信号传导通路。通过Western blotting对Epha4突变小鼠及对照小鼠FGF2刺激下FGFs信号通路下游分子磷酸化进行检测(图5)。结果表明,在对照小鼠中经FGF2刺激后FRS2α及ERK1/2都被磷酸化,而在突变小鼠中这些蛋白的活化程度明显弱于对照小鼠。
讨 论
在大脑皮层发育过程中,RGCs不仅通过对称分裂自身增殖还可以通过非对称分裂产生IPCs及进一步向神经元分化[1-2]。在孕龄14.5 d时期出现神经分化的高峰[12]。本研究通过Cre-loxp技术构建了两种Epha4缺失突变小鼠。Epha4基因分别在Nestin;Epha4fx/fx的孕龄11.5 d时期[9],GFAP;Epha4fx/fx的 孕 龄 13.5 d时 期[10]被 敲 除(图 1)。Epha4基因作用于决定RGCs的命运。
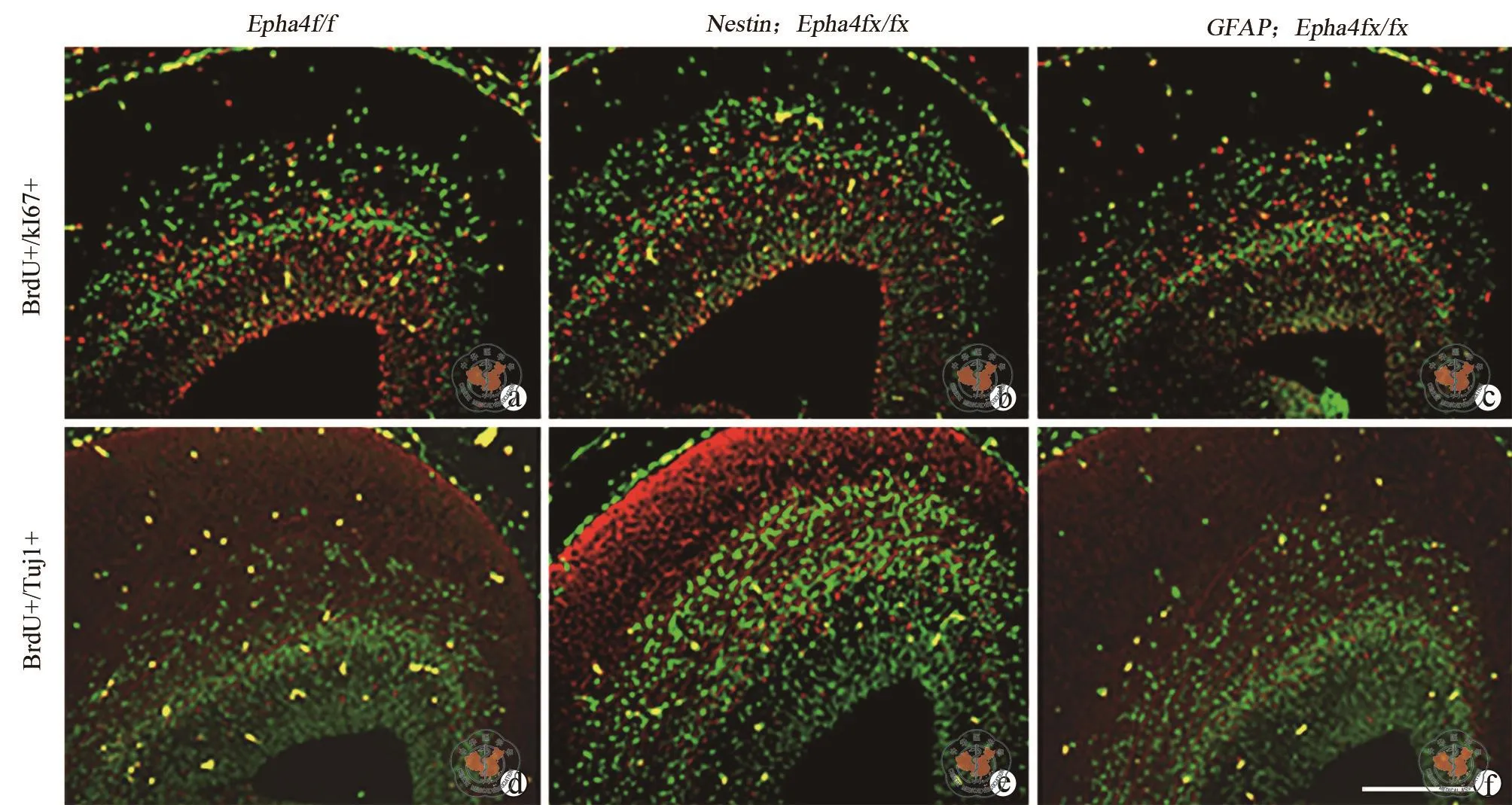
图4 Epha4基因敲除小鼠皮层神经干细胞或神经前体祖细胞的增殖和分化

图5 Epha4基因敲除小鼠皮层细胞经FGF2刺激ERK1/2及FRS2α磷酸化
Nestin;Epha4fx/fx小鼠大脑半球的大小与同笼对照小鼠相比略微减小,并且整个大脑皮层的放射状厚度明显减小。另外,皮层增殖区域的VZ及SVZ的厚度在皮层前部区域明显减小(表1)。然而,与Nestin;Epha4fx/fx小鼠不同,GFAP;Epha4fx/fx小鼠皮层或增殖区域的放射状厚度与对照同笼小鼠比较没有明显区别,说明Epha4基因缺失影响皮层大小发生于孕龄11.5 d时期。与对照小鼠相比,发现在突变小鼠中 Ki67+BrdU+细胞在总BrdU+细胞中的比例明显降低,表明RGCs的分裂能力在两种突变小鼠中都减弱。与之相对应的是Tuj1+BrdU+细胞在总体BrdU+细胞中比例增加,表明突变小鼠中RGCs向神经元转变能力增强(表2)。
前面报道了EphA4蛋白与FGFR蛋白在体外通过直接作用相互磷酸化,通过FRS2α的酪氨酸磷酸化及活化ERK增强了FGFs信号通路[13-14]。在这篇报道中发现在孕龄15.5 d时期两种Epha4突变小鼠中分离的皮层细胞经FGF2刺激时FRS2α及ERK1/2活性比正常小鼠弱,表明FGFs在Epha4缺失的皮层细胞中活化能力降低。在孕龄10 d或孕龄13.5 d胎鼠皮层中共同敲除FGFR1、FGFR2及FGFR3,FGFs信号缺失引起的皮层表现型与Epha4突变小鼠的表现型相似[3],推测Epha4基因在RGCs命运决定中的作用是由FGFs信号介导的。
总之,本研究表明Epha4基因在胚胎大脑皮层发育过程中通过FGFs信号通路调节RGCs命运决定中起重要作用。Epha4基因表达影响P0时期皮层大小的的关键时期发生在孕龄13.5 d之前,孕龄13.5 d之后Epha4基因缺失也会瞬间影响皮层神经发育。然而,即使在孕龄10.5 d时期之后Epha4基因表达缺失也不会影响总体的大脑皮层层状结构。本研究为研究阶段特异性神经元的发育及将来临床治疗神经退行性疾病如脊髓损伤、阿尔兹海默症等提供了有力的理论依据。
1 Rapacioli M, Palma V, Flores V. Morphogenetic and histogenetic roles of the Temporal-Spatial organization of cell proliferation in the vertebrate corticogenesis as revealed by inter-speci fi c analyses of the optic tectum cortex development[J]. Front Cell Neurosci, 2016, 10:67.
2 Homman-Ludiye J, Bourne JA. The marmoset: An emerging model to unravel the evolution and development of the Primate neocortex[J].Dev Neurobiol, 2017, 77(3):263-272.
3 Rash BG, Lim HD, Breunig JJ, et al. FGF signaling expands embryonic cortical surface area by regulating Notch-Dependent neurogenesis[J]. J Neurosci, 2011, 31(43):15604-15617.
4 Dabrowski A, Umemori H. Buttressing a balanced brain:Targetderived FGF signaling regulates excitatory/inhibitory tone and adult neurogenesis within the maturating hippocampal network[J].Neurogenesis (Austin), 2016, 3(1):e1168504.
5 Cramer KS, Miko IJ. Eph-ephrin signaling in nervous system development[J]. F1000Res, 2016, 5:413.
6 Todd KL, Baker KL, Eastman MB, et al. EphA4 regulates neuroblast and astrocyte organization in a neurogenic niche [J]. J Neurosci, 2017,37(12):3331-3341.
7 North HA, Zhao XM, Kolk SM, et al. Promotion of proliferation in the developing cerebral cortex by EphA4 forward signaling [J].Development, 2009, 136(14):2467-2476.
8 Herrmann JE, Pence MA, Shapera EA, et al. Generation of an EphA4 conditional allele in mice [J]. Genesis, 2010, 48(2):101-105.
9 Tronche F, Kellendonk C, Kretz O, et al. Disruption of the glucocorticoid receptor gene in the nervous system results in reduced anxiety [J]. Nat Genet, 1999, 23(1):99-103.
10 Kang W, Wong LC, Shi SH, et al. The transition from radial glial to intermediate progenitor cell is inhibited by FGF signaling during corticogenesis[J]. J Neurosci, 2009, 29(46):14571-14580.
11 Furushima K, Yamamoto A, Nagano T, et al. Mouse homologues of Shisa antagonistic to Wnt and Fgf signalings[J]. Dev Biol, 2007,306(2):480-492.
12 Noctor SC, Martínez-Cerdeño V, Kriegstein AR. Distinct behaviors of neural stem and progenitor cells underlie cortical neurogenesis[J]. J Comp Neurol, 2008, 508(1):28-44.
13 Yokote H, Fujita K, Jing X, et al. Trans-activation of EphA4 and FGF receptors mediated by direct interactions between their cytoplasmic domains [J]. Proc Natl Acad Sci U S A, 2005, 102(52):18866-18871.
14 Sawada T, Jing X, Zhang Y, et al. Ternary complex formation of EphA4, FGFR and FRS2 alpha plays an important role in the proliferation of embryonic neural stem/progenitor cells[J]. Genes to Cells, 2010, 15(3):297-311.
2016-09-24)
(本文编辑:陈媛媛)
陈清法,韩发彬.Epha4基因通过FGF信号通路调节大脑皮层发育[J/CD].中华细胞与干细胞杂志(电子版),2017,7(5):259-264.
Epha4 gene regulates corticogenesis through FGF signaling
Chen Qingfa, Han Fabin. Institute ofTissue Engineering and Regenerative Medicine, The Liaocheng People's Hospital, Liaocheng 252000,China
Han Fabin, Email:fhan2013@126.com
ObjectiveTo illuminate the function ofEpha4gene in RGC cell fate determination during early corticogenesis.MethodsEpha4gene was deleted in cortical cells at E11.5 or E13.5 using Cre-loxp method. The mice were divided into 3 groups: Group A (control mice),Group B (Nestin;Epha4fx/fxmutant mice) and Group C (GFAP;Epha4fx/fxmutant mice). Nissle staining was used to analyze the morphological changes of the mutant mice. Co-immunofluoresence was used to determine the proliferation and differentiation of RGC. Western blotting was used to detect the signaling pathway in the mutant mice. And the statistical analysis was achieved using Student'st-test.ResultsNissle stainingshowed the size of the cerebral cortex at P0 was smaller than that of controls whenEpha4was deleted at E11.5 (475±66 µmvs709±30 µm,P<0.05) but not when it was deleted at E13.5 (727±37 µmvs709±30 µm,P>0.05). BrdU labeling followed by co-immunofluoresence showed the proliferation ability of RGC decreased (Nestin;Epha4fx/fx46±1﹪vsEpha4fx/fx58±2﹪,P<0.05;GFAP;Epha4fx/fx50±2﹪vsEpha4fx/fx58±2﹪,P<0.05), while the differentiation ability of RGC increased (Nestin;Epha4fx/fx34±5﹪vsEpha4fx/fx25±1 ﹪ ,P<0.05;GFAP;Epha4fx/fx35±2 ﹪vsEpha4fx/fx25±1 ﹪ ,P<0.05). Western blotting showed cortical cells from both deletion mutants revealed lower phosphorylation of ERK and FRS2α in the presence of FGF.ConclusionEpha4gene, in cooperation with an FGF signal, contributes to function in RGC cell fate determination during early corticogenesis. These findings provide important molecular evidence for the clinical treatment of neurodegenerative diseases such as spinal cord injury and Alzheimer disease.
Cerebral cortex; Glial cells;Epha4; FGF; Signal pathway; Cre-loxp
10.3877/cma.j.issn.2095-1221.2017.05.002
252000 聊城市人民医院组织工程与再生医学研究所
韩发彬,Email:fhan2013@126.com

