间充质干细胞更改名称的时候到了
ARNOLD I. CAPLAN 著 廖联明 王萍 译 谭建明 审校
·专家论坛·
间充质干细胞更改名称的时候到了
ARNOLD I. CAPLAN1著 廖联明2王萍3译 谭建明3审校
编者按:间充质干细胞(mesenchymal stem cell,MSC)作为临床试验研究中应用最为广泛的细胞取得令人瞩目的效果而倍受临床医师关注。然而关于间充质干细胞的命名却存在争议。为澄清其命名源由,1991年为间充质干细胞命名、业界称之为“间充质干细胞之父”的美国医学与生物工程院院士,阿诺得・卡普兰(Arnold I. Caplan)教授撰写专家论述:间充质干细胞更改名称的时侯到了(Mesenchymal Stem Cells: Time to Change the Name!)。为准确理解将Mesenchymal stem cell更改为Medicinal Signaling Cell的中文译文,本刊编辑部特邀阿诺得・卡普兰院士在2017年10月28日武汉全国器官移植大会报告期间,和我国业界学者讨论,形成Medicinal Signaling Cell中文译文为“医用信号细胞”的共识。本刊谭建明主编获得阿诺得・卡普兰授权,全文翻译其论述并在本刊发表。
间充质干细胞(mesenchymal stem cell,MSC)在25年前被正式命名[1],它代表了一类可从人和哺乳动物的骨髓和骨膜中分离出来的细胞,它们在体外培养扩增后可以保持在诱导剂下形成各种中胚层细胞和组织的能力(图1)。体外形成骨、软骨、脂肪等的能力是鉴定这一类多能细胞的方法[9]。20世纪90年代有几家公司开始开发MSC产品用于再生医学。开始的时候,很多人不认可在骨髓中有这类干/祖细胞的概念。今天,有数百个诊所[10]采用MSC进行治疗;有数百个MSC的临床试验在进行中[11]。但只有极少数的临床应用是基于这些细胞的体外多能性的。
不幸的是,很多人将MSC是“干细胞”这个概念等同于MSC在任何患者身上都会有治疗效果,因为他们想象这些细胞将分化为能够再生组织的细胞。这种干细胞治疗被认为可能治愈和MSC功能相关的疑难杂症,如骨性关节炎,以及包括痴呆在内的各种神经系统疾病。我很早就呼吁更改MSC的名称为医用信号细胞(Medicinal Signaling Cells)[12],它更准确地反映这些细胞以下特征:可以归巢到损伤或疾病的部位;可分泌具有免疫调节、营养、促进机体再生的生物活性因子[13],这些细胞就像是能够在体内“现场”生产药物,这些药物是有医用价值的[14-15]。实际上,是患者自身病灶特异性和组织特异性的原位干细胞在外源性MSC分泌的生物活性因子的刺激下形成了新组织[16-17]。
一、从Caplan视角了解MSC的历史
在20世纪70年代早期到20世纪80年代,我和同事发表了一些论文,报道了在特定的培养条件下观察到鸡胚肢芽中胚层细胞(embryonic chick limb bud mesodermal cells,ECLBMC)在培养到C24期时分化成了软骨、肌肉和骨骼[18-22]。这些体外研究与体内进行的胚胎肢骨[23]、软骨[24]和肌肉[25]相关的细胞和分子调控的研究有关。这些研究对当时的一些观点提出了挑战。例如,“骨替代软骨”的概念意味着如果在体外胚胎中胚层祖细胞可以形成软骨后进一步转化为骨。此外,软骨内的骨替代意味着在体外软骨可以分化为肥大软骨并钙化,为随后的骨形成提供钙化基质。但事实上我们只观察到肥大软骨,没有观察到钙化,倒是在软骨之间的结缔组织中观察到了钙化。
当我们回到发育中的鸡胚,仔细地完成对发育胫骨骨干中段的严格组织学分析后坚定地认为,形成的新骨骼来自于软骨核心外的祖细胞层。重要的是,肥大软骨核心先被入侵的脉管系统替代、然后被骨髓替代,而不是骨骼。此外,其他人的研究也清楚地表明,这些胚胎肥大软骨细胞可以在体外培养多个星期,证明肥大软骨细胞不会发生“程序”死亡(即它们的死亡是由于周边的骨形成后营养和氧缺乏导致的)。此外,在我们和Vincent Hascall团队采用ECLBMC细胞研究软骨蛋白聚糖的合成的研究后,我们先后进行了软骨细胞[35-36],肌肉[37-38]和骨骼的胞外基质(extracellular matrix, ECM)的研究,这些对于我们进行血管周围的基底膜研究起到重要作用(下面将讨论)。
我们花了相当多的时间和精力来优化这些C24期的ECLBMC细胞培养。不过我们从未称这些细胞为间充质或中胚层“干细胞”,尽管证据显示它们是多能的。在这段时间以及上世纪80年代的早期,Marshal Urist等从脱矿质后的骨基质中分离到了一些活性分子。他们这么做是因为发现将脱矿质后的骨块植入到啮齿动物的肌肉或皮下后,宿主细胞可以在这些骨块上长出新的骨组织。Urist将脱矿骨质基质中释放出来的生物活性分子称为“骨形态发生蛋白(bone morphogenetic proteins,BMPs)”,因为这些活性分子可在非骨组织如肌肉或皮下诱导出新生骨。在Urist的讲座和论文的激励下,加上1981年Urist在加州大学洛杉矶分校培养的博士后Glenn Syftestad应聘到了我的实验室工作,我们加入了纯化BMP的竞赛。我们的第一种方法是按照Urist所公布的方法,采用高盐溶液提取脱矿质骨块中的成分,并将它们添加到C24期ECLBMC的培养基中。令我们惊奇的是,这些提取物导致细胞形成软骨。我们将其命名为软骨形成刺激活性成分,并委托大学为提取物申请了专利。但后来由于担心专利可能会受到质疑,大学没有为专利交维持费。1987年,约翰·沃兹尼博士及其在遗传学研究所公司(位于马萨诸塞州剑桥市)的同事已经克隆了BMP2基因,并且已经获得了BMP家族分子的专利[46-47]。BMP的竞赛结束了,我和同事没有赢。
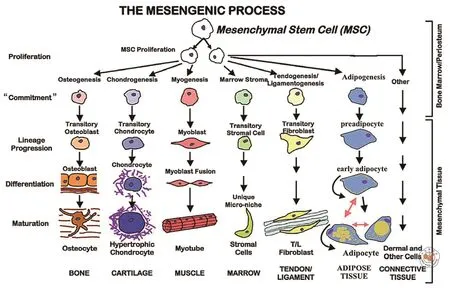
图1 间充质组织形成过程
在其中一种脱矿质骨植入模型中,Hari Reddi博士纯化了该BMPs家族的一个蛋白,更重要的观察了这些分子诱导的体内组织的形成过程,包括宿主间充质细胞侵入植入物,细胞分裂后分化成软骨,软骨变肥大,并被血管化和骨髓化的骨代替。在研究了Reddi博士慷慨提供的这些皮下植入标本的组织切片后,我提出骨骼替代软骨的时间顺序与我们在发育中的鸡胚胫骨中描述的相同[5],即软骨祖细胞被吸引到矿物质碎片周围形成软骨。骨块被一层与胚胎胫骨堆叠细胞层相当的间质细胞包围,所以血管被阻隔。间充质细胞周围的血管诱导堆叠的间质细胞的底层细胞分化为成骨细胞,形成了一层矿化的类骨质。营养物质和氧气的缺失导致软骨细胞形成肥大软骨,这些细胞死亡后释放大量的血管内皮生长因子(vascular endothelial growth factor,VEGF),导致外部脉管系统侵入,就如同在鸡胚胫骨的中期变化[5,29-30]。这些入侵的血管带来了间充质祖细胞,形成血管化和骨髓化的骨。
上述研究的核心是,当将脱矿骨块植入成年啮齿动物肌肉或皮下时,可以观察到间充质祖细胞的聚集。与这些事实一致的是,成年骨髓包含相同或相似的原始骨-软骨祖细胞[51-57]。这些间充质祖细胞的存在可以从以下途径推断出:(1)自亚里斯多德以来就知道骨髓可以促进骨形成和骨愈合[51]。(2)最近 Connolly等人[52-53]和 Hernigou[58]证明了骨髓或来自骨髓的细胞能够直接长出骨和软骨;(3)弗里登斯坦等人发现,成体骨髓中分离的细胞可以粘附在培养皿上并长出成骨祖细胞克隆[54-57];该结果得到了欧文的验证和宣传;最后(4)欧文提出一个与造血干细胞(HSC)分化为后代相似的间质细胞的初步谱系[57]。重要的是要强调,在20世纪80年代和90年代初期,普遍认为成年人中唯一存在的干细胞是造血干细胞。
上述研究(特别是在成体动物的脱矿质骨移植实验)导致斯蒂芬·海恩斯沃斯博士和我试图从成年人骨髓中分离和纯化间充质祖细胞[1,59-63]。那时候,我们并不知道弗里登斯坦和欧文在做和我们类似的工作。幸运的是我们的ECLBMC系统与弗里登斯坦和欧文的培养条件有很大的不同。我们早已优化了这种ECLBMC系统,特别是我们发现有些胎牛血清(fetal bovine serum, FBS)非常适合培养鸡胚细胞。这些挑选出来的血清也非常适于培养成人骨髓细胞,使其贴壁、维持多能性与增殖[65-66]。实际上,通过ECLBMC培养系统,我们在每10~20批次的FBS中可以挑出一批非常适合人骨髓来源的MSC培养[66]。在添加合适的FBS到培养液中后,MSC可附着到培养皿中,形成集落(称为成纤维细胞集落形式单位,CFU-f[56]),这些集落的数量即代表了MSC的含量。在新生儿,每10000个骨髓细胞中含有1个MSC;而80岁的成年人每20000个骨髓细胞只有1个[67]。鉴于上述研究,我将这些在培养液中具有多系分化能力的细胞命名为MSC[1]。
二、MSC各种各样的名称其表达同一个意思
从上述历史不难理解可贴壁和传代的成人骨髓衍生的多能间充质细胞曾经被不同的研究者赋予不同的名称。
三、骨髓基质细胞(Marraw Stromal Cells)
术语“基质”是较旧的形态学术语,意味着来自结缔组织或组织结构组分。如欧文1988年[57]所定义的,这些是粘附于塑料皿底并扩张的成纤维细胞,形成具有成骨能力的细胞集落(CFU-f)。人们还可以设想,骨髓基质是支持HSC的不同后代的独特支架。虽然这个想法很迷人,但事实上骨髓没有这样的三维结缔组织支架。
(一)多能基质细胞(Multipotent Stromal Cells)
MSC在多种培养条件下均被证明是多能的。
(二)中胚层干细胞(Mesodermal Stem Cell)
由于我们对ECLBMC细胞的研究,业内非常认可这个术语,特别是因为在培养体系中,通过诱导或生物活性分子培养出来的细胞都是中胚层起源的。
(三)间充质干细胞(MSC)
我选择了这个术语,因为间质组织的特征是包含松散联系的、无极性的细胞,并被大量ECM包围。由于其体外多能性和克隆性[68],我称之为“干细胞”,以引起骨科领域的重视。根据血液学家的定义,所有的干细胞都必须能够进行连续移植和无限制的倍增。确实,已发表的论文支持这个定义[69-70]。
(四)间质基质细胞(Mesenchymal Stromal Cell)
在一次国际会议上,一些科学家将MSC称为“基质”细胞,因为他们不赞成把这些细胞归为干细胞,并且错误地认为各种组织的MSC来源于该组织的结缔组织[9]。
(五)医用信号细胞(Medicinal Signaling Cell)
因为体内MSC具有分泌功能,主要在损伤、疾病或炎症部位起作用,所以我现在赞成这个术语[12]。
四、新科学:MSC来自于周细胞
重命名的核心原因是大多数MSC来源于血管周围(血管壁)的周细胞[71]。布鲁诺博士和同事通过细胞表面抗原及体外多能性研究,证明从各种组织分离的周细胞均会产生MSC。更重要的是,MSC可以从每个有血管的组织[73]甚至从经血中分离得到[74-75](即,破裂的血管释放出血管周围细胞,并分化成MSC)。MSC起源于血管周围,具有免疫调节和营养功能(包括合成和分泌抗菌蛋白[76]),这些都对过去MSC的“基质”名称和起源提出了挑战。
基于上述,我们采用周细胞MSC(pericyte MSCs,pMSCs)最新的研究成果制作了一张海报,其中包含许多以前不被了解的、不同寻常的有趣信息[79]。如每个组织特异性干细胞都与其相邻的血管内皮细胞和特异性周细胞/MSC之间进行信息互换(Universal Stem Cell Niche)。每不同组织干细胞周边的pMSC是完全不同的,如骨髓中活跃与静止的HSC其相邻的pMSC具有不同的化学成份[80-81]。在经过充分研究的组织中,如骨髓、神经组织[82]、肝脏[83]、心脏[84]等,组织特异性干细胞都紧挨着血管边上的特异性pMSC。这些研究结果进一步支持了所有pMSC具有共同的MSC特征,也有其独特的特征,包括化学成分和功能。在体外多能性鉴定时,必须针对每个组织的MSC优化诱导方案。例如,TGF-b可以诱导骨髓来源的hMSC向软骨细胞分化[85],而脂肪源的hMSC需要TGFb和BMP-6才能分化为软骨细胞[86]。虽然不同的MSC在疾病或损伤部位的主要治疗功能非常相似[87],但不同组织或器官的MSC的体内功能差异在很大程度上是未知的。
五、更改名称
由于MSC在机体内并没有表现出多能性[88],因此不是干细胞[89-91],所以我建议改名。改变医学术语的先例并不新鲜。例如多发性硬化症曾经被称为歇斯底里瘫痪,因为人们认为这是由与压力相关的因素引起的。慢性疲劳综合征是一种严重的疾病,但85﹪的临床医生将其视为精神疾病,大家正在试图改变名字以消除偏见和烙印。虽然大家认为MSC术语没有什么不妥,但我还是认为它在体内不是一个真正的“干细胞”。有人认为,由于MSC的科学研究和临床用途如此火爆(这从www.clinicaltrails.gov上注册的临床试验有近700项之多可以看出),MSC命名应该保留下来。问题不在于名称的“间充质”部分;有问题的是“干细胞”这部分。
如我们的海报中所述,pMSC的功能和释放出的周细胞功能截然不同,后者在活化后形成组织特异性的MSC。输注的自体或同种异体MSC似乎会归巢到受伤或发炎部位的活化的血管[93]。在这样的疾病部位,MSC很少或从未分化为该部位的组织[13,88],但它们分泌生物活性因子(有些因子已被鉴定出来[94])。通过分析病变或受伤组织的特异性临床参数,我们可以证明MSC的治疗效果。已经报道了其对移植物抗宿主病、急性心肌梗塞、腰痛、骨关节炎膝盖,腱炎和炎症性肠病或克罗恩病等方面的疗效(www.mesoblast.com)。再次强调,这些MSC效应是有医学用途的。
六、MSC不是干细胞
由于胚胎干细胞知识的普及,促进了MSC的科学研究和商业化。尤其是布什总统禁止使用和研究胚胎干细胞(ESCs),大家对MSC更加有兴趣。ESC的普及也带来了一个坏处,即所有的“干细胞”被公众视为具有多能性。因此,大家认为在骨关节炎膝关节中输注hMSC后,输注的MSC通过形成功能性软骨细胞而直接再生为软骨组织。同样,hMSC被输注到心脏病患者中后将直接转化为功能性心肌细胞以代替心肌缺血后的死细胞。这种例子太多了。尽管我们这一领域的研究者当观察到阳性治疗结果时都有自己最喜欢的机制解析,但是在体内hMSCs后的作用确实不是因为输注的细胞再生或替代了组织[96-99],而是因为输注的细胞具有医用价值。
这些对干细胞误解导致美国和全世界的一些从业者宣传干细胞治疗(即,MSC可以治愈盲人、治愈跛脚,并使老化组织变得年轻[10])。当然,我希望保持MSC这个名字,而不是干细胞。也许我们还可以称之为魔术信号细胞、强战略细胞、强分泌细胞、强敏感细胞、主要分泌细胞或信息分泌细胞。我建议更改MSC的名称以反映我们新的理解,即它们在身体正常稳态与疾病伤害情况下均不发挥组织的祖细胞那样的功能,它们不是干细胞。
七、MSC与癌症转移
最后,我们最近发表了一篇文章,证明pMSC主动结合并将循环中的黑素瘤细胞拉入骨髓[100]。黑色素瘤转移的这种抓取(牵引)机制与目前的观点相反,即转移性细胞分泌消化酶,使黑色素瘤侵蚀到骨骼中。我们进一步假设,血管的基底膜ECM中的层粘连蛋白在黑素瘤外渗到骨中起主要作用和积极作用。因此,黑素瘤必须通过内皮细胞层、基底层或基底膜并经过壁细胞的致密覆盖层。活性pMSC不仅促进了这种外渗,而且通过分泌活性物质促进了从循环到骨髓的易位。显然,在这种情况下,pMSC没有治疗价值,即使其分化的后代MSC在其他情况下提供强大的治疗作用。最后,pMSC不是多能的,它本身也不会导致肿瘤形成。pMSC会被癌细胞破坏但它不会促进正常细胞癌变。
八、结论
应该允许提出MSC这个名字的人将干细胞这个含义从MSC中抛弃,以避免科学和治疗上的误导。2010年,我提出改名为医疗性信号细胞[12]。这些培养的间充质细胞有很强的可塑性(正如我们可以在体外诱导成年人软骨细胞形成骨骼或脂肪[101]),意味着叫它们为干细胞是不合适的。我错了,我收回了我给这些非常重要的细胞的名字。就称它们为MSC,但请不要称为干细胞。
1 Caplan AI. Mesenchymal stem cells[J]. J Orthop Res, 1991,9(5):641-650.
2 Haynesworth SE, Goshima J, Goldberg VM, et al. Characterization of cells with osteogenic potential from human marrow[J]. Bone, 1992,13(1):81-88.
3 Nakahara H, Bruder SP, Goldberg VM, et al.In vivoosteochondrogenic potential of cultured cells derived from the periosteum [J]. Clin Orthop Relat Res, 1990, 259:223-232.
4 Caplan AI. Biomaterials and bone repair[J]. Biomaterials, 1988, 87:15-24.
5 Caplan AI. Cartilage begets bone versus endochondral myelopoiesis[J].Clin Orthop Relat Res, 1990, 261:257-267.
6 Caplan AI. Cell delivery and tissue regeneration[J]. J Control Release,1990, 11:157-165.
7 Caplan AI. Stem cell delivery vehicle[J]. Biomaterials, 1990, 11:44-46.
8 Caplan AI. The mesengenic process[J]. Clin Plast Surg, 1994,21(3):429-435.
9 Horwitz EM, Le Blanc K, Dominici M, et al. Clarification of the nomenclature for MSC: The International Society for Cellular Therapy position statement[J]. Cytotherapy, 2005, 7(5):393-395.
10 Turner L, Knoepfler P. Selling stem cells in the USA: assessing the Direct-to-Consumer industry[J]. Cell Stem Cell, 2016, 19(2):154-157.
11 ClinicalTrials. Gov. Mesenchymal stem cells (MSCs) clinical trials.Available at https://clinicaltrials.gov/. Accessed February 1, 2017.
12 Caplan AI. What's in a Name?[J]. Tissue Eng Part A, 2010, 16(8):2415-2417.
13 Meirelles Lda S, Fontes AM, Covas DT, et al. Mechanisms involved in the therapeutic properties of mesenchymal stem cells[J]. Cytokine Growth Factor Rev, 2009, 20(5-6):419-427.
14 Caplan AI, Dennis JE. Mesenchymal stem cells as trophic mediators[J].J Cell Biochem, 2006, 98(5):1076-1084.
15 Caplan AI, Correa D. The MSC: an injury drugstore[J]. Cell Stem Cell,2011, 9(1):11-15.
16 Le Blanc K, Mougiakakos D. Multipotent mesenchymal stromal cells and the innate immune system[J]. Nat Rev Immunol, 2012,12(5):383-396.
17 Caplan AI. Adult mesenchymal stem cells: When, where, and how[J].Stem Cells Int, 2015, 2015:628767.
18 Caplan AI, Zwilling E, Kaplan NO. 3-acetylpyridine:Effectsin vitrorelated to teratogenic activity in chicken embryos[J]. Science, 1968,160(3831):1009-1010.
19 Caplan AI, Rosenberg MJ. Interrelationship between poly (ADPRib) synthesis, intracellular NAD levels, and muscle or cartilage differentiation from mesodermal cells of embryonic chick limb[J]. Proc Natl Acad Sci USA, 1975, 72(5):1852-1857.
20 Caplan AI. The molecular control of muscle and cartilage development[M]. In:39th Annual Symposium of the Society for Developmental Biology, Ed. S Subtelney and U Abbott, Alan R. Liss, Inc.,New York, pp. 37-68(1981).
21 Caplan AI, Koutroupas S. The control of muscle and cartilage development in the chick limb: the role of differential vascularization[J]. J Embryol Exp Morphol, 1973, 29(3):571-583.
22 Caplan AI. Molecular basis for limb morphogenesis[M]. In:Proceedings of the 5th International Conference on Birth Defects, Ed.J Littlefield and J DeGrouchy, Excerp. Medica.Amsterdam-Oxford,1978:208-220.
23 Osdoby P, Caplan AI. First bone formation in the developing chick limb[J]. Dev Biol, 1981, 86(1):147-156.
24 Osdoby P, Caplan AI. Characterization of a bone-specific alkaline phosphatase in chick limb mesenchymal cell cultures[J]. Dev Biol,1981, 86(1):136-146.
25 Caplan AI, Stoolmiller AC. Control of chondrogenic expression in mesodermal cells of embryonic chick limb[J]. Proc Natl Acad Sci USA, 1973, 70(6):1713-1717.
26 Rosenberg MJ, Caplan AI. Nicotinamide adenine dinucleotide levels in cells of developing chick limbs: possible control of muscle and cartilage development[J]. Dev Biol, 1974, 38(1):157-164.
27 Caplan AI, Syftestad G, Osdoby P. The development of embryonic bone and cartilage in tissue culture[J]. Clin Orthop Relat Res, 1983(174):243-263.
28 Fell HB. The histogenesis of cartilage and bone in the long bones of the embryonic fowl[J]. J Morphol, 1925, 40(3):417-459.
29 Caplan AI. Bone development and repair[J]. Bioessays, 1987,6:171-175.
30 Caplan AI, Pechak, David G. The cellular and molecular embryology of bone formation[J].In: Peck W, ed. Bone and Mineral Research.New York: Elsevier, 1987:117-184.
31 Schmid TM, Linsenmayer TF. Immunohistochemical localization of short chain cartilage collagen (type X) in avian tissues[J]. J Cell Biol,1985, 100(2):598-605.
32 Solursh M, Jensen KL, Reiter RS, et al. Environmental regulation of type X collagen production by cultures of limb mesenchyme,mesectoderm, and sternal chondrocytes[J]. Dev Biol, 1986, 117(1):90-101.
33 Caplan AI, Hascall VC. Structure anddevelopment changes in proteoglycans[M]. In:Naftolin F,Stubble fi eld PG, eds. Dilatation of the Uterine Cervix. New York: Raven Press,1980:79-98.
34 Caplan AI. Cartilage[J]. Sci Am, 1984,251:84-94.
35 Hascall VC, Oegema TR, Brown M, et al. Isolation and characterization of proteoglycans from chick limb bud chondrocytes grownin vitro[J]. J Biol Chem, 1976, 251(11):3511-3519.
36 De Luca S, Caplan AI, Hascall VC. Biosynthesis of proteoglycans by chick limb bud chondrocytes[J]. J Biol Chem, 1978, 253(13):4713-4720.
37 Carrino DA, Caplan AI. Isolation and preliminary characterization of proteoglycans synthesized by skeletal muscle[J]. J Biol Chem, 1982,257(23):14145-14154.
38 Carrino DA, Caplan AI. Proteoglycans produced by skeletal musclein vitroandin vivo[J]. Prog Clin Biol Res, 1982, 110(Pt B):379-389.
39 Urist MR. Bone: formation by autoinduction[J]. Science, 1965,150(3698):893-899.
40 Urist MR, Dowell TA, Hay PH, et al. Inductive substrates for bone formation[J]. Clin Orthop Relat Res, 1968, 59:59-96.
41 Urist MR, Mikulski A, Lietze A. Solubilized and insolubilized bone morphogenetic protein[J]. Proc Natl Acad Sci USA, 1979, 76(4):1828-1832.
42 Syftestad GT, Caplan AI. A fraction from extracts of demineralized adult bone stimulates the conversion of mesenchymal cells into chondrocytes[J]. Dev Biol, 1984, 104(2):348-356.
43 Syftestad GT, Lucas PA, Caplan AI. Thein vitrochondrogenic response of limb-bud mesenchyme to a water-soluble fraction prepared from demineralized bone matrix[J]. Differentiation, 1985,29(3):230-237.
44 Caplan AI, Syftestad GT, inventors; Patent, assignee. Bone protein puri fi cation process.1986. Patent No. 4,608,199.
45 Caplan Ai SG, Patent A. Process of adapting soluble bone protein for use in stimulating osteoinduction[J]. July 5, 1986 (4):327.
46 Wozney JM, Rosen V, Celeste AJ, et al. Novel regulators of bone formation: molecular clones and activities[J]. Science, 1988,242(4885):1528-1534.
47 Celeste AJ, Iannazzi JA, Taylor RC, et al. Identi fi cation of transforming growth factor beta family members present in bone-inductive protein purified from bovine bone[J]. Proc Natl Acad Sci USA, 1990,87(24):9843-9847.
48 Reddi AH. Role of morphogenetic proteins in skeletal tissue engineering and regeneration[J]. Nat Biotech, 1998, 16(3):247-252.
49 Reddi AH, Huggins C. Biochemical sequences in the transformation of normal fi broblasts in adolescent rats[J]. Proc Natl Acad Sci USA, 1972,69(6):1601-1605.
50 Reddi AH. Bone and cartilage differentiation[J]. Curr Opin Genet Dev,1994,4:737-744.
51 Cooper B. The origins of bone marrow as the seedbed of our blood:from antiquity to the time of Osler[J]. Proc (Bayl Univ Med Cent),2011, 24(2):115-118.
52 Connolly JF, Guse R, Tiedeman J, et al. Autologous marrow injection as a substitute for operative grafting of tibial nonunions[J]. Clin Orthop Relat Res, 1991 (266):259-270.
53 Connolly J, Guse R, Lippiello L, et al. Development of an osteogenic bone-marrow preparation[J]. J Bone Joint Surg Am, 1989, 71(5):684-691.
54 Friedenstein AJ, Petrakova KV, Kurolesova AI, et al. Heterotopic of bone marrow. Analysis of precursor cells for osteogenic and hematopoietic tissues[J]. Transplantation, 1968, 6(2):230-247.
55 Friedenstein AJ, Deriglasova UF, Kulagina NN, et al. Precursors for fibroblasts in different populations of hematopoietic cells as detected by thein vitrocolony assay method [J]. Exp Hematol, 1974,2(2):83-92.
56 Owen M, Friedenstein AJ. Stromal stem cells: marrow-derived osteogenic precursors[J]. Ciba Found Symp, 1988, 136:42-60.
57 Owen M. Marrow stromal stem cells[J]. J Cell Sci Suppl, 1988,10:63-76.
58 Hernigou P. Autologous bone marrow grafting of avascular osteonecrosis before collapse[J]. Rev Rhum (Engl Ed), 1995,62:650-651.
59 Caplan AI, Haynesworth SE, inventors; Patent assignee. Method for enhancing theimplantation and differentiation of marrowderived mesenchymal cells[P]. 1993. Patent No.5,197,985.
60 Caplan AI, Haynesworth SE, inventors; Patent assignee. Method for treating connective tissue disorders[P]. 1993. Patent No.5, 226, 914.
61 Caplan AI, Haynesworth SE, inventors; Patent assignee. Human mesenchymal stem cells[P]. 1996. Patent No. 5,486,359.
62 Gerson SL, Caplan AI, Haynesworth SE, inventors; Patent, assignee.Transduced mesenchymal stem cells[P]. 1997. Patent No.5,591,625.
63 Caplan AI, Haynesworth SE, inventors; Patent, assignee. Monoclonal antibodies for human osteogenic cell surface antigens[P]. July 1, 1997.Patent No. 5,643,736.
64 Caplan AI. Muscle, cartilage and bone development and differentiation from chick limb mesenchymal cells[M]. In: Vertebrate Limb and Somite Morphogenesis. Ed. DA Ede, JR Hinchliffe and M Balls,Cambridge University Press, Cambridge, England, 1977:199-213.
65 Osdoby P, Caplan AI. The possible differentiation of osteogenic elements in vitro from chick limb mesodermal cells. I. Morphological evidence[J]. Dev Biol, 1976, 52(2):283-299.
66 Lennon DP, Haynesworth SE, Bruder SP, et al. Human and animal mesenchymal progenitor cells from bone marrow: Identification of serum for optimal selection and proliferation[J]. In Vitro Cell Dev Biol Anim, 1996, 32(10):602-611.
67 Haynesworth SE, Caplan AI. Diminution of the number of mesenchymal stem cells as a cause for skeletal aging[M]. In:Buckwalter JA, Goldberg VM, Woo SLY, eds. Musculoskeletal Soft-Tissue Aging: Impact on Mobility. Rosemont, IL: American Academy of Orthopedic Surgeons, 1994:79-87.
68 Pittenger MF, Mackay AM, Beck SC, et al. Multilineage potential of adult human mesenchymal stem cells[J]. Science, 1999, 284(5411):143-147.
69 Dennis JE, Carbillet JP, Caplan AI, et al. The STRO-1+ marrow cell population is multipotential[J]. Cells Tissues Organs, 2002,170(2-3):73-82.
70 Dennis JE, Caplan AI. Advances in mesenchymal stem cell biology[J].Curr Opin Orthop, 2004, 15:341-346.
71 Caplan AI. All MSCs are pericytes?[J]. Cell Stem Cell,2008,3:229-230.
72 Crisan M, Yap S, Casteilla L, et al. A perivascular origin for mesenchymal stem cells in multiple human organs[J]. Cell Stem Cell,2008, 3(3):301-313.
73 Nombela-Arrieta C, Ritz J, Silberstein LE. The elusive Nature and function of mesenchymal stem cells[J]. Nat Rev Mol Cell Biol, 2011,12(2):126-131.
74 Alcayaga-Miranda F, Cuenca J, Luz-Crawford P, et al. Characterization of menstrual stem cells: angiogenic effect, migration and hematopoietic stem cell support in comparison with bone marrow mesenchymal stem cells[J]. Stem Cell Res Ther, 2015, 6:32-43.
75 Khoury M, Alcayaga-Miranda F, Illanes SE et al. The promising potential of menstrual stem cells for antenatal diagnosis and cell therapy[J]. Front Immunol, 2014,5:205.
76 Krasnodembskaya A, Song Y, Fang X, et al. Antibacterial effect of human mesenchymal stem cells is mediated in part from secretion of the antimicrobial peptide LL-37[J]. Stem Cells, 2010,28(12):2229-2238.
77 da Silva Meirelles L, de Deus Wagatsuma VM, Malta TM, et al. The gene expression pro fi le of non-cultured, highly puri fi ed human adipose tissue pericytes: Transcriptomic evidence that pericytes are stem cells in human adipose tissue [J]. Exp Cell Res, 2016, 349(2):239-254.
78 da Silva Meirelles L, Malta TM, de Deus Wagatsuma VM, et al.Cultured human adipose tissue pericytes and mesenchymal stromal cells display a very similar gene expression pro fi le[J]. Stem Cells Dev,2015, 24(23):2822-2840.
79 Somoza RA, Correa D, Caplan AI. Roles for mesenchymal stem cells as medicinal signaling cells[J]. Nat Protoc, Vol 11 No 1. 2015 [Epub ahead of print]. Available at http://www. nature.com/nprot/posters/msc/index.html.
80 Kunisaki Y, Bruns I, Scheiermann C, et al. Arteriolar niches maintain haematopoietic stem cell quiescence[J]. Nature, 2013,502(7473):637-643.
81 Sá da Bandeira D, Casamitjana J, Crisan M. Pericytes, integral components of adult hematopoietic stem cell niches[J]. Pharmacol Ther, 2017, 171:104-113.
82 Tavazoie M, Van der Veken L, Silva-Vargas V, et al. A specialized vascular niche for adult neural stem cells[J]. Cell Stem Cell, 2008,3(3):279-288.
83 Bautch VL. Stem cells and the vasculature[J]. Nat Med, 2011,17(11):1437-1443.
84 Chong James JH, Chandrakanthan V, Xaymardan M, et al. Adult cardiac-resident MSC-like stem cells with a proepicardial origin[J].Cell Stem Cell, 2011, 9(6):527-540.
85 Yoo JU, Barthel TS, Nishimura K, et al. The chondrogenic potential of human bone-marrow-derived mesenchymal progenitor cells[J]. J Bone Joint Surg Am, 1998, 80(12):1745-1757.
86 Diekman BO, Rowland CR, Lennon DP, et al. Chondrogenesis of adult stem cells from adipose tissue and bone marrow: induction by growth factors and cartilage-derived matrix[J]. Tissue Eng Part A, 2010,16(2):523-533.
87 Geevarghese A, Herman IM. Pericyte-endothelial crosstalk:implications and opportunities for advanced cellular therapies[J].Transl Res, 2014, 163(4):296-306.
88 Guimarães-Camboa N, Cattaneo P, Sun Y, et al. Pericytes of multiple organs do not behave as mesenchymal stem cellsin vivo[J]. Cell Stem Cell, 2017, 20(3):1-15.
89 Deasy BM, Gharaibeh BM, Pollett JB, et al. Long-term self-renewal of postnatal muscle-derived stem cells[J]. Mol Biol Cell, 2005,16(7):3323-3333.
90 Tao H, Han Z, Han ZC, et al. Proangiogenic features of mesenchymal stem cells and their therapeutic applications[J]. Stem Cells Int, 2016,2016:1314709.
91 Overturf K, al-Dhalimy M, Ou CN, et al. Serial transplantation reveals the stem-cell-like regenerative potential of adult mouse hepatocytes[J].Am J Pathol, 1997, 151(5):1273-1280.
92 Kay M. Lexemic change and semantic shift in disease names[J]. Cult Med Psychiatry, 1979, 3(1):73-94.
93 Lin P, Correa D, Kean TJ, et al. Serial transplantation and long-term engraftment of intra-arterially delivered clonally derived mesenchymal stem cells to injured bone marrow[J]. Mol Ther, 2014, 22(1):160-168.
94 Murphy MB, Moncivais K, Caplan AI. Mesenchymal stem cells:environmentally responsive therapeutics for regenerative medicine[J].Exp Mol Med, 2013, 45:e54.
95 Murugan V. Embryonic stem cell research: a decade of debate from Bush to Obama[J]. Yale J Biol Med, 2009, 82(3):101-103.
96 Couzin J, Vogel G. Renovating the heart[J]. Science, 2004, 304(5668):192-194.
97 Phinney DG, Isakova IA. Mesenchymal stem cells as cellular vectors for pediatric neurological disorders[J]. Brain Res, 2014, 1573:92-107.
98 Maes C, Kobayashi T, Selig MK, et al. Osteoblast precursors, but not mature osteoblasts, move into developing and fractured bones along with invading blood vessels[J]. Dev Cell, 2010, 19(2):329-344.
99 Boyle AJ, Schulman SP, Hare JM. Stem cell therapy for cardiac repair.Ready or the next step. Circulation, 2006,114: 339-352.
100 Correa D, Somoza RA, Lin P, et al. Mesenchymal stem cells regulate melanoma cancer cells extravasation to bone and liver at their perivascular niche [J].Int J Cancer, 2016, 138(2):417-427.
101 Tallheden T, Dennis JE, Lennon DP, et al. Phenotypic plasticity of human articular chondrocytes[J]. J Bone Joint Surg Am, 2003,85-A(suppl 2):93-100.
2017-08-24)
(本文编辑:朱东屏)
ARNOLD I. CAPLAN 著,廖联明,王萍译等. 间充质干细胞更改名称的时候到了[J/CD].中华细胞与干细胞杂志(电子版),2017,7(5):253-258.
10.3877/cma.j.issn.2095-1221.2017.05.001
44106 美国俄亥俄州克利夫兰市凯斯西储大学生物系骨骼研究中心1;350112 福州,福建医科大学附属协和医院中心实验室2;350025 福州总院福建省移植生物学重点实验室3;
ARNOLD I. CAPLAN,Email:arnold.caplan@case.edu
1942年出生,凯斯西储大学生物系骨骼研究中心主任,获得约翰霍普金斯大学医学院的博士学位。主要研究领域是肌肉、骨骼和皮肤发育,已发表超过400篇论文。由于其对间充质干细胞的开创性研究,被国际同行尊称为“The Father of the Mesenchymal Stem Cell”。

