尖叶石竹种子的EMS和60Co-γ诱变
龚束芳,刘恩慧,姜童童,周爱民,王金刚
(东北农业大学园艺园林学院,黑龙江 哈尔滨 150030)
尖叶石竹种子的EMS和60Co-γ诱变
龚束芳,刘恩慧,姜童童,周爱民,王金刚
(东北农业大学园艺园林学院,黑龙江 哈尔滨 150030)
为了获得更多尖叶石竹(Dianthusspiculifolius)新品种,本研究利用EMS和60Co-γ射线对尖叶石竹种子进行了诱变处理。结果显示,处理时间为16 h时,1.0%的EMS浓度接近诱变的半致死剂量,变异率达到7.0%。当剂量率为0.1 Gy·min-1时,300 Gy的60Co-γ射线接近诱变的半致死剂量,变异率达到4.2%。通过表型观察共获得了1 038株M1代变异植株,其中,EMS诱变处理获得了95株,60Co-γ射线诱变处理获得了943株。本研究为丰富尖叶石竹种质资源提供了帮助,而且为石竹属其他植物的诱变研究提供了技术参考。
种子;诱变;变异率;甲基磺酸乙酯;60Co-γ射线;突变体;石竹属
尖叶石竹(Dianthusspiculifolius)为石竹科石竹属多年生草本花卉植物,具有抗寒性、抗旱性、绿期长等特点,能在东北地区露地越冬,适合在中国东北等高寒地区栽培推广,是未来极具应用前景的地被资源[1]。但目前因其品种单一,阻碍了尖叶石竹的应用推广。国内对尖叶石竹研究主要集中在栽培养护、应用管理上[1-3],育种工作研究较少[4-6]。
甲基磺酸乙酯(EMS)是一种常见的化学诱变剂,具有效率高、频率高、范围广等特点[7],能诱发产生高密度的系列等位基因点突变,染色体畸变相对较少[8],可以产生范围较广的突变类型[9]。目前,已成功应用于甘蔗(Saccharumofficinarum)、草莓(Fragaria×ananassa)、大白菜(Brassicapekinensis)等的诱变育种中[10-16]。γ射线是目前辐射育种中最常用的射线之一,主要用于外照射,比X射线能量更高、穿透力更强,可诱发植物染色体畸变及基因突变,从而获得有利突变体,为作物育种及性状的改良提供了技术手段[17-19]。60Co-γ射线应用范围较广,在大蒜(Alliumsativum)、桂花(Osmanthusfragrans)、无芒隐子草(Cleistogenessongorica)等植物育种研究中均有应用[18-23]。
本研究以尖叶石竹种子为试验材料,摸索不同浓度及不同剂量的EMS与60Co-γ射线处理对尖叶石竹种子致死率及变异率的影响,从而获得EMS、60Co-γ射线诱变尖叶石竹种子的最适宜浓度和剂量。通过对尖叶石竹诱变后代植株进行形态学观察和比较,初步获得尖叶石竹表型变异体植株,以期为获得尖叶石竹新的种质资源提供基础。
1 材料与方法
1.1材料
以2015年6月在东北农业大学园艺站内采收的尖叶石竹种子为研究材料,母株是由西伯利亚地区引进、并经无性繁殖得到的尖叶石竹。
1.2EMS诱变处理方法
2015年12月,选用EMS作为诱变剂,用0.1 mol·L-1、pH 7的磷酸缓冲液(PB)配制浓度为0(蒸馏水,对照)、0.4%、0.7%、1.0%的EMS溶液。将尖叶石竹的种子浸种(24±1) ℃ 2 h后进行诱变处理,各浓度分别处理2、4、8、16、32 h,每个处理100粒种子。处理结束后,马上加入2% NaS2O3溶液终止诱变反应,用蒸馏水冲洗2 h,接种于铺有滤纸的培养皿中,置于(24±1) ℃恒温培养箱培养。种子萌发后生长15 d统计各浓度处理尖叶石竹致死率及变异率,以筛选EMS最适诱变体系。
用摸索出的最佳EMS诱变体系对尖叶石竹种子进行大量处理,共处理4 000粒,于2016年4月点播在穴盘中,置于阳光温室培养。尖叶石竹种子萌发后,从第1对子叶萌发开始,对幼苗茎、叶进行观察,筛选出表型明显区别于野生型幼苗的变异体,对各类变异体进行标记、拍照,统计同一类型变异体的数目,计算各类表型的变异率。
致死率=死亡种子数/(播种总数-自然死亡数)×100%。
式中:自然死亡数为未诱变处理种子播种后的平均死亡数;
变异率=发生变异的植株数目/播种总数。
1.360Co-γ射线诱变处理方法
2016年5月在黑龙江省科学院物理所,用60Co-γ射线对尖叶石竹种子进行辐照处理,共6个处理,辐照剂量分别为0(对照)、50、100、150、200、250和300 Gy,剂量率为0.1 Gy·min-1,每处理2 500粒,将处理后的种子点播于穴盘中,置于温室培养。播种15 d后统计各剂量处理尖叶石竹种子致死率与幼苗的变异率,筛选最佳的60Co-γ射线辐照剂量。
在苗期对尖叶石竹诱变群体的茎叶、株型等进行形态学观察,对表型有明显变化的植株进行标记、拍照,统计同一类型变异体的数目,并计算各变异表型的变异率。
1.4数据的处理与分析
采用Excel和DPS 16.05软件对致死率和变异率进行差异显著性的T检验分析。
2 结果与分析
2.1EMS对尖叶石竹种子致死率及变异率的影响
当EMS浓度一定时,随着处理时间的增加,尖叶石竹种子致死率和变异率都逐渐升高(表1)。处理时间和处理浓度对致死率和变异率均有极显著影响(Plt;0.01)。对照组(浓度为0)自然死亡率为7.0%,变异率为0。EMS浓度为0.4%时,处理时间从2 h到32 h的致死率由10.0%升高至56.0%,变异率由2.0%升高至5.0%。EMS浓度为0.7%时,致死率由13.0%升高至61.0%,变异率由1.0%升高至8.0%。EMS浓度为1.0%时,致死率由17.0%升高至86.0%,变异率先由2.0%升高至7.0%再降至1.0%。相同处理时间,不同EMS浓度处理间致死率和变异率差异极显著,随着浓度的增加,致死率呈上升趋势,除了处理32 h1.0% EMS的变异率低于0.4%、0.7%处理的变异率外,1.0% EMS的其他处理时间的变异率均高于0.4%与0.7%,浓度为0.7%的EMS只在处理2、4 h时变异率低于0.4% EMS。
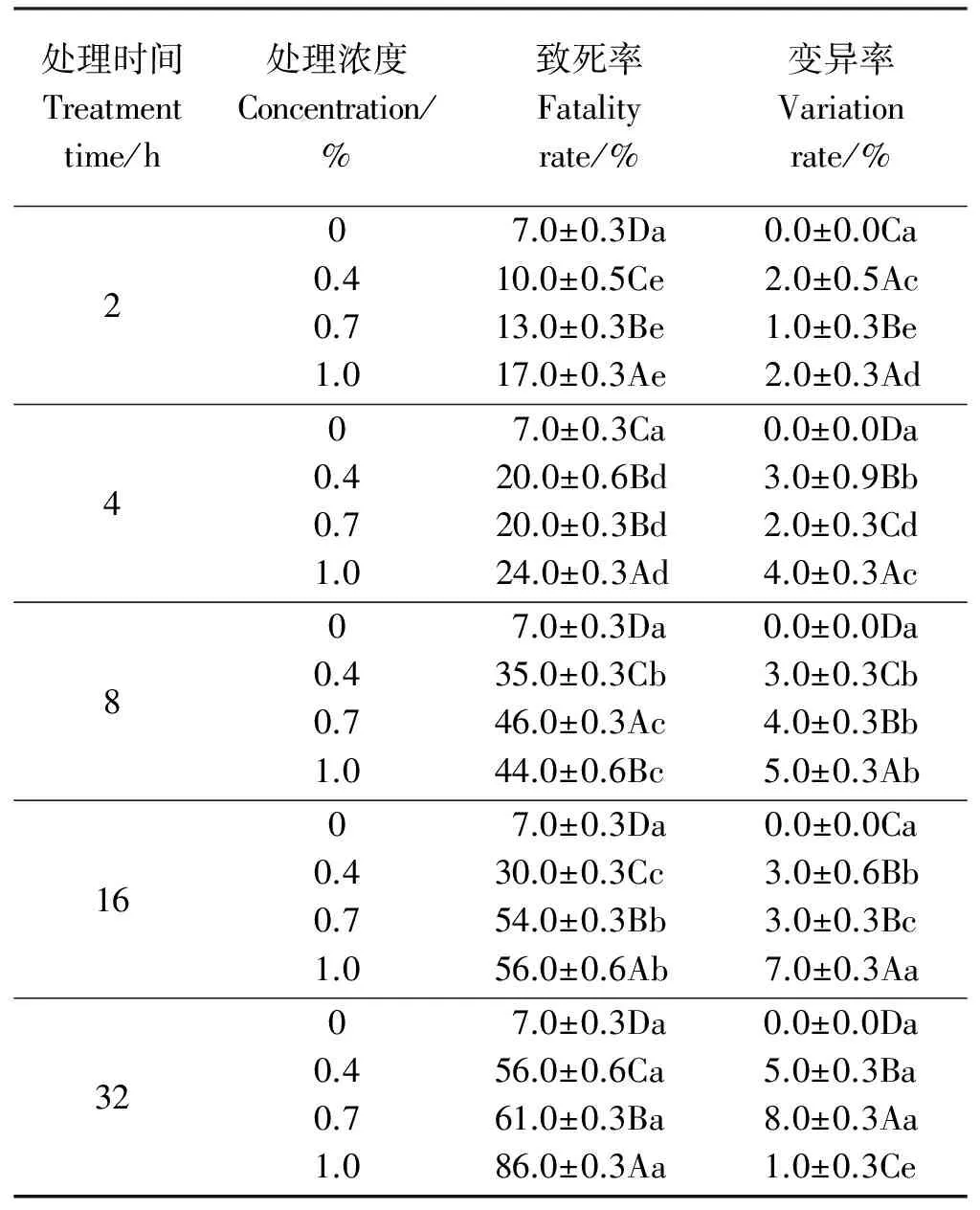
表1 不同EMS诱变处理组合对尖叶石竹种子萌发的影响
注: 同列不同大写字母表示同一时间不同浓度各处理间差异极显著(P≤0.01),不同小写字母表示同一浓度不同时间各处理间差异极显著(P≤0.01)。
Note: Different capital letters within the same column indicate significant difference at the same treatment time at different concentration at the 0.01 level, different lowercase letters indicate significant difference at the same concentrations under difference time treatment at the 0.01 level.
接近半致死率的处理有0.4%-32 h、0.7%-8 h、0.7%-16 h、1.0%-8 h、1.0%-16 h,综合考虑种子致死与变异情况,1.0%浓度EMS处理种子16 h的诱变效果最佳,变异率为7.0%,致死率为56.0%。
2.2EMS诱变尖叶石竹M1代变异植株幼苗期筛选
EMS浓度为1.0%,处理时间为16 h时诱变效果最佳,选择该浓度进行下一步诱变处理。诱变后20 d,种子开始长出第1片子叶,40 d后统计种子出苗数。结果显示,诱变处理后的4 000粒种子,半数成活。与对照植株(图1 a1-a3)相比,在尖叶石竹诱变幼苗植株中筛选出叶片数目、叶片开裂、子叶大小、叶片褶皱、叶片畸形、叶片卷曲、叶片颜色7类变异表型植株共95株。其中,叶片数目变化的包括单片叶(图1 b1)、三叶轮生(图1 b2)、四叶轮生(图1 b3)共3种变异类型,共39株,占总变异植株的1.0%;叶片开裂共27株,占变异群体的0.7%,因开裂部位及深浅不同,可分为单片叶开裂(图1 c1-c3,c5)、双片叶开裂(图1 c4)、叶片尖端开裂(图1 c1,c3,c5)和叶片边缘开裂(图1 c2,c4),叶片开裂多表现在两叶植株,少数表现在三叶植株上(图1 c3);4株子叶大小有变化(图1 d1,d2),变异率0.1%;5株叶片出现褶皱(图1 e1-e3),变异率0.1%;6株叶片出现畸形(图1 f1-f4),变异率0.1%;5株叶片出现卷曲(图1 g),变异率0.1%;EMS还会导致叶片颜色的变化,包括叶片黄化、紫化(图1 h1-h3),共发现9株,变异率为0.2%。多数变异体仅有上述一种表型,也有少数植株同时拥有两种或两种以上变异类型,如植株叶片数目为三叶且叶片开裂(图1 c3),植株子叶大小不等且单叶子叶开裂(图1 d2)等,拥有两种表型的植株在计算变异率时分别记入两种表型。

图1 EMS诱变尖叶石竹变异体类型
注:a1-a3,对照;b1,单子叶;b2,三子叶;b3,四子叶;c1-c5,叶片开裂;d1,子叶大小;d2,子叶大小不一且叶片开裂;e1-e3,子叶褶皱;f1,子叶细长;f2-f4,叶片畸形;g,叶片卷曲;h1,子叶尖端黄化;h2,子叶尖端紫化;h3,子叶紫化。
Note: a1-a3, control; b1, monocotyledon; b2, tricotyledon; b3, tetracotyledon; c1-c5, incision leaf; d1, cotyledons size; d2, cotyledons vary in size and cracked; e1-e3, fold the cotyledons; f1, slender cotyledon; f2-f4, malformed leaf; g, curly leaf; h1, cotyledon tip yellowing; h2, cotyledon tip purple; h3, cotyledon purple.
2.360Co-γ射线对尖叶石竹致死率及变异率的影响
利用60Co-γ射线对尖叶石竹种子进行诱变处理,播种后5 d即有种子开始发芽,至20 d,调查并计算对照组及不同剂量60Co-γ射线处理种子的致死率及变异率。剂量率一定时,随着60Co-γ射线剂量加大,尖叶石竹种子的致死率呈曲线上升趋势,剂量为100 Gy时致死率最低,为34.9%,300 Gy时致死率最高,为49.2%,各剂量间致死率差异极显著(Plt;0.01)(表2)。当辐射剂量低于100 Gy时,变异率逐渐增加;辐射剂量为100 Gy时,变异率最高,为11.2%;辐射剂量高于100 Gy时,变异率逐渐下降,各剂量间的变异率差异极显著(Plt;0.01)。接近半致死率的剂量有250、300 Gy,综合考虑种子致死与变异情况,剂量率为0.1 Gy·min-1时,剂量为300 Gy的诱变效果最佳,变异率为4.2%,致死率为49.2%。
2.460Co-γ射线诱变尖叶石竹M1代变异植株幼苗期筛选
从种子发芽开始对尖叶石竹进行表型观察,子叶期筛选得到9类特殊表型,包括叶片数目,叶片开裂,对生子叶大小不一,圆形子叶,叶片褶皱,匙形叶片,叶片畸形、卷曲,叶片颜色。与对照植株相比(图2 a1-a3),变异体中叶片数目的变异率为1.7%,包括单叶片(图2 b1)、三叶及四叶轮生变异表型植株(图2 b2,b3),共253株;在9种表型中,叶片开裂表型的变异率最高,为2.1%,共307株,包括单叶开裂(图2 c1,c2,c4,c5)、双叶开裂(图2 c3)、叶片边缘(图2 c4,c5)、叶尖端开裂(图2 c1-c3)等,开裂深浅也有所不同;匙形叶片占变异群体比例为1.0%(图2 f1-f3),为144株,虽在子叶期没有表现,却在第2对叶或第3对叶长出后表现出其性状,且变异体个数较多,性状明显;叶片畸形的植株表型变化多样(图2 g1-g10),重复表型数目较少,为77株,变异率为0.5%;叶片卷曲植株有54株(图2 i1-i3),变异率为0.4%;变异体中还有4类性状明显但变异率低的表现,包括对生子叶大小植株的变异率(0.4%)(图2 d1-d3),共52株;圆形子叶变异率为0.1%(图2 e),共19株;叶片褶皱有两种类型(图2 h1-h3),变异率为0.1%,共9株;叶片颜色变异体多为叶片紫化(图2 j1-j2),有28株,变异率为0.2%。也有少量植株同时拥有两种或两种以上的变异性状,如子叶大小不一且子叶开裂(图2 d2),叶色变化且叶裂(图2 j2)等,拥有两种表型的植株在计算变异率时分别记入两种表型。
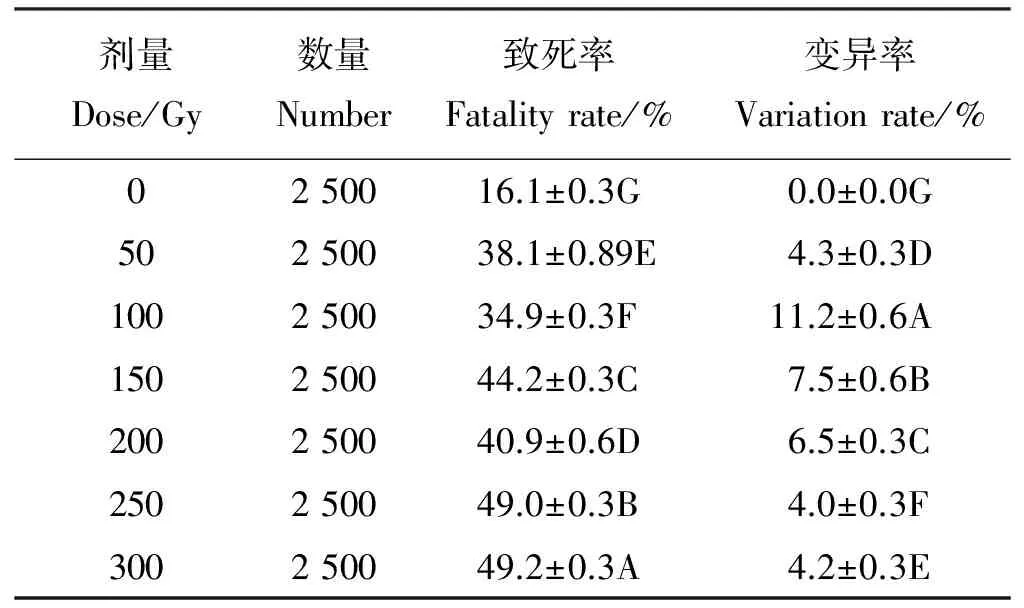
表2 不同辐射剂量的60Co-γ射线对尖叶石竹种子萌发的影响
注:同列不同大写字母表示同一剂量率不同剂量各处理间差异显著(P≤0.01).
Note: Different capital letters within the same column mean significant difference among different doses at the 0.01 level.
EMS诱变获得7类变异表型共95株,60Co-γ射线诱变获得9类变异表型共943株(表3)。EMS最佳诱变浓度1.0%处理16 h的变异率为7.0%,60Co-γ最佳诱变剂量300 Gy的变异率为4.2%,60Co-γ射线的诱变效果要优于EMS。
2.5尖叶石竹M1代植株成苗期表型观察
在成苗期对尖叶石竹全部变异群体进行形态学观察,与对照植株相比(图3a),在叶片颜色上筛选出4类叶色变异体,包括灰绿色叶片变异体(图3b),嫩绿色叶片变异体(图3c),白边叶片变异体(图3d)及金边叶片变异体(图3e);对叶片的宽窄进行测量,与对照植株叶片宽度相比(0.2 cm),筛选出叶片宽度为0.3 cm的宽叶变异体(图3g)与叶片宽度为0.1 cm的狭叶变异体(图3h);对植株整体形态进行观察,发现全株80%以上的叶片均为卷曲状的叶片卷曲变异体(图3f)及茎节较长的长茎变异体(图3i)。

图2 60Co-γ射线诱变尖叶石竹变异体类型
注:a1-a3,对照;b1,单子叶;b2,三子叶;b3,四子叶;c1-c5,叶片开裂;d1,子叶大小;d2,子叶大小不一且叶片开裂;d3,子叶大小不一且褶皱;e,圆形子叶;f1-f2,匙形叶片;f3,匙形叶片且褶皱;g1-g10,叶片畸形;h1-h3,叶片褶皱;i1-i3,叶片卷曲;j1,子叶紫化;j2,子叶紫化且真叶开裂。
Note: a1-a3, contrast; b1, monocotyledon; b2, tricotyledon; b,: tetracotyledon; c1-c5, incision leaf; d1, cotyledons size; d2, cotyledons vary in size and cracked; d3, cotyledons vary in size and fold; e, round cotyledons; f1-f2, spoon-shaped leaf; f3, spoon-shaped leaf and fold; g1-g10, malformed leaf; h1-h3, fold the leaf; i1-i3, curly leaf; j1, cotyledon purple; j2, purple cotyledon and incision euphylla.
3 讨论
3.1尖叶石竹最佳诱变体系的筛选
在诱变育种中,诱变剂的处理浓度越高,处理时间越长,对植物造成的损伤越大,如果损伤过大,植物生长势弱或者死亡,反之,诱变效果不明显。因此,选择适宜的处理浓度和时间是至关重要的[20]。一般选择半致死率浓度、剂量作为最佳诱变方法,或者对致死率及其他因素进行综合考虑再做筛选。姜莉等[7]采用了15个EMS浓度及6个时间处理甜菜(Betavulgaris)种子,以半致死率浓度作为最佳诱变浓度,确定了2.5%处理10 h,2.3%处理12 h是最佳诱变组合。包建忠等[19]采用4个不同剂量的60Co-γ射线对大花君子兰(Cliviaminiata)种子进行辐射发现,辐射剂量为4 Gy时,能同时保证较高的萌发率及变异率,是最适宜的辐射剂量。

表3 EMS、60Co-γ射线变异性状的植株数量及变异率统计

图3 尖叶石竹成苗期变异体类型
注:a,对照;b,灰绿色叶片;c,嫩绿色叶片;d,白边叶片;e,金边叶片;f,叶片卷曲;g,宽叶;h,狭叶;i,长茎。
Note: a, contrast; b, gray green leaf; c, tender green leaf; d, white side leaves; e, golden side leaves; f, curly leaf; g, the broad leaf; h, narrow leaves; i, long stem.
本研究采用15个EMS诱变组合处理尖叶石竹种子,筛选出5组接近半致死率的EMS处理组合,结合各处理的变异率,最终确定了1.0%浓度EMS处理种子16 h的诱变效果最佳。本研究采用6个不同剂量的60Co-γ射线对尖叶石竹种子进行辐射,接近半致死率的剂量有250、300 Gy,结合变异情况,在剂量率为0.1 Gy·min-1时,选择300 Gy剂量作为最佳诱变体系。
3.2尖叶石竹突变体变异性状的稳定性
由于以EMS和60Co-γ射线诱变种子得到的M1代是复杂的嵌合体,所以可能是生物学损伤,筛选到的突变性状在后代消失,或者性状在M1代不表现,但在后代表现出来。因此,在突变体的筛选过程中,为了调查性状的稳定性,往往对获得的突变体进行多代筛选或不同生长时期的筛选,并对获得的突变体进行遗传学鉴定[21]。卢银等[10]在筛选EMS诱变的大白菜(Brassicapekinensis)突变体时,分别对M2群体苗期及莲座期植株的叶片性状进行了形态学调查,发现莲座期与苗期表型几乎没有关联性,为了稳定变异表型,还需对M3代植株进行验证。杨建华等[22]利用EMS对番茄(Lycopersiconesculentum)种子进行诱变后,对M1、M2代植株进行形态学观察,发现M2代植株的部分叶片表型会随着生育期的推进而逐渐消失,尚未经M3代验证其遗传稳定性,另选取了15个性状的M2材料进行SSR检测,结果表明9份材料在DNA水平上有变异。
本研究在幼苗期和成苗期对变异体植株的表型进行了两次观察,在幼苗期获得7类EMS表型变异体,包括叶片数目、叶片开裂、叶片褶皱、叶片卷曲、叶片颜色、子叶大小、叶片畸形,以及9类60Co-γ射线表型变异体,包括叶片数目、叶片开裂、子叶大小、匙形叶片、叶片畸形、叶片褶皱、叶片卷曲、叶片颜色、圆形子叶。在苗期共获得8类变异表型,有灰绿色叶片、嫩绿色叶片、白边叶片、金边叶片、叶片卷曲、 宽叶、狭叶、长茎。发现幼苗期与成苗期的变异体表型除了叶片卷曲外,其他表型均无明显关联性。为了保证现有的变异性状的稳定性,在通过无性繁殖技术保留变异体性状的同时,还需经M2、M3代验证,并对筛选出的变异体进行进一步鉴定。此外,在本研究中,仅观察到了植株的叶片变异,为了丰富变异类型,在今后的工作中将对材料的其他部位进行性状观察。
4 结论
本研究主要利用两种诱变剂EMS和60Co-γ射线对尖叶石竹种子进行了诱变处理,结果显示1%的EMS浓度处理下的诱变率为7%,0.1 Gy·min-1剂量率下300 Gy的60Co-γ射线的诱变率为4.2%,表明EMS作为尖叶石竹种子诱变育种的诱变剂优于60Co-γ射线。两种诱变处理共获得了包括9种变异表型的1 038株变异M1植株,其中,EMS诱变处理获得了95株,60Co-γ射线诱变处理获得了943株。本研究能够为尖叶石竹及其他石竹属植物的诱变育种研究提供帮助。
References:
[1] 董丽华.节水地被尖叶石竹.内蒙古林业调查设计,2009,32(1):67-68.
Dong L H.Water-saving ground cover plantsDianthusspiculifoliusSchur.Inner Mongolia Forestry Investigation and Design,2009,32(1):67-68.(in Chinese)
[2] 于良祖,魏玉萍,马彦,冯海山.5种适宜兰州种植的耐寒宿根花卉.甘肃农业科技,2010(1):41-42.
Yu L Z,Wei Y P,Ma Y,Feng H S.Five kinds of cold-resistant and perennial flowers suitable for planting in Lanzhou.Gansu Agricultural Science and Technology,2010(1):41-42.(in Chinese)
[3] 梁艳萍,孙彦.地被植物尖叶石竹特性及栽培技术.西南园艺,2006,34(4):44-45.
Liang Y P,Sun Y.Characteristics and cultivation techniques of ground cover plantsDianthusspiculifoliusSchur.Southwest HorticuIture,2006,34(4):44-45.(in Chinese)
[4] Cristea V,Craciunas C,Marcu D,Palada M,Butiuc-Keul A.Genetic stability during in vitro propagation ofDianthusspiculifoliusSchur.Propagation of Ornamental Plants,2014,14(1):26-31.
[5] 梁艳萍,孙彦,杨青川,韩建国,戴忠宪.地被植物尖叶石竹组织培养及再生体系的建立.北方园艺,2007(4):210-212.
Liang Y P,Sun Y,Yang Q C,Han J G,Dai Z X.The establishment system of tissue culture and plant regeneration ofDianthusspiculifoliusSchur.Northern Horticulture,2007(4):210-212.(in Chinese)
[6] 樊金萍,柴志坚,初雪清,龚束芳.尖叶石竹组织培养及快繁技术.东北农业大学学报,2008,39(1):39-42.
Fan J P,Cai Z J,Chu X Q,Gong S F.Study on tissue culture and rapid propagation ofDianthusspiculifoliusSchur.Journal of Northeast Agricultural University,2008,39(1):39-42.(in Chinese)
[7] 姜莉,李卫华,王维成,李蔚农.不同浓度EMS对甜菜种子诱变致死率的影响.中国糖料,2013(1):28-29.
Jiang L,Li W H,Wang W C,Li W N.Effect of different concentration EMS on mutagenic fatality rate of sugarbeet seed.Sugar Crops of China,2013(1):28-29.(in Chinese)
[8] Greene E A,Codomo C A,Taylor N E,Henikoff J G,Till B J,Reynolds S H,Enns L C,Burtner C,Johnson J E,Odden A R,Comai L,Henikoff S.Spectrum of chemically induced mutations from a large-scale reverse-genetic screen in Arabidopsis.Genetics,2003,164(2):731-740.
[9] Wani M R,Khan S,Kozgar M I.Induced Chloropyll mutations.I.Mutagenic ellectiveness and elliciency of EMS,HZ and SA in mungbean.Frontiers of Agriculture in China,2011,5(4):514-518.
[10] 卢银,刘梦洋,赵建军,王彦华,罗双霞,轩淑欣,代双燕,王超硕,申书兴.大白菜突变体库的构建及M2叶片表型变异的研究.园艺学报,2014,41(8):1609-1619.
Lu Y,Liu M Y,Zhao J J,Wang Y H,Luo S X,Xuan S X,Dai S Y,Wang C S,Shen S X.Construction of one mutant library and research on phenotypic variation of M2population leaves in Chinese cabbage.Acta Horticulturae Sinica,2014,41(8):1609-1619.(in Chinese)
[11] 卢银,刘梦洋,王超硕,汪珊,赵建军,王彦华,罗双霞,陈雪平,申书兴.EMS处理对大白菜种子和幼苗活力的影响及M2表型变异分析.植物遗传资源学报,2015,16(2):349-358.
Lu Y,Liu M Y,Wang C S,Wang S,Zhao J J,Wang Y H,Luo S X,Chen X P,Shen S X.Effects of EMS mutagenesis on seed and seedling vigor and phenotypic variation of M2population in Chinese cabbage.Journal of Plant Genetic Resources,2015,16(2):349-358.(in Chinese)
[12] 陈天龙,王彦荣,王宇,张吉宇,刘志鹏.蒺藜苜蓿EMS诱变突变体库的构建及突变体表型的分析.草业科学,2015,32(1):71-77.
Chen T L,Wang Y R,Wang Y,Zhang J Y,Liu Z P.Construction of mutant populations by EMS and phenotypic analysis ofMedicagotruncatula.Pratacultural Science,2015,32(1):71-77.(in Chinese)
[13] 何慧怡,樊丽娜,齐永文,劳方业,邓海华,胡斐.EMS诱变甘蔗茎尖分生组织的初步研究.中国农学通报,2016,32(6):55-60.
He H Y,Fan L N,Qi Y W,Lao F Y,Deng H H,Hu F.Mutagenesis application toSaccharumofficinarumshoot tip culture with EMS.Chinese Agricultural Science Bulletin,2016,32(6):55-60.(in Chinese)
[14] 张经纬.草莓EMS诱变突变体筛选与再生体系建立.合肥:安徽农业大学硕士学位论文,2014.
Zhang J W.Screening of strawberry mutants induced by EMS and construction of strawberry regeneration system.Master Theis.Hefei:Anhui Agriculture University,2014.(in Chinese)
[15] Watanabe S,Mizoguchi T,Aoki K,Kubo Y,Mori H,Imanishi S,Yamazaki Y,Shibata D,Ezura H.Ethylmethane sulfonate(EMS) mutagenesis ofSolanumlycopersicumcv. Micro-Tom for largescale mutant screens.Plant Biotechnology,2007,24(1):33-38.
[16] 廖晓英,阎晋东,钟鸣,卓宇红,吴丹,贺热情,赵小英,刘选明.甘蓝型油菜EMS诱变及多分枝和长角突变体分析.生命科学研究,2016,20(5):435-441.
Liao X Y,Yan J D,Zhong M,Zhuo Y H,Wu D,He R Q,Zhao X Y,Liu X M.EMS mutagenesis and analysis of multi-branched and long-silique mutants inBrassicanapusL.Life Science Research,2016,20(5):435-441.(in Chinese)
[17] 肖鑫丽,刘京宏,尹德松,宋静武,彭磊.辐射在园艺植物诱变育种中的应用研究进展.贵州农业科学,2015,43(1):20-23.
Xiao X L,Liu J H,Yin D S,Song J W,Peng L.Advances in induced mutation breeding by radiation for horticultural plants.Guizhou Agricultural Sciences,2015,43(1):20-23.(in Chinese)
[18] 耿兴敏,王良桂,李娜,杨秀莲.60Co-γ辐射对桂花种子萌发及幼苗生长的影响.核农学报,2016,30(2):216-223.
Geng X M,Wang L G,Li N,Yang X L.Study on the seed germination and seedling growth ofOsmanthusfragransunder60Co-γ irradiation.Journal of Nuclear Agricultural Sciences,2016,30(2):216-223.(in Chinese)
[19] 包建忠,李风童,孙叶,刘春贵,马辉,张甜,陈秀兰.60Co-γ射线辐照大花君子兰种子对其萌发特性及其开花性状的影响.核农学报,2013,27(11):1681-1685.
Bao J Z,Li F T,Sun Y,Liu C G,Ma H,Zhang T,Chen X L.Effects of60Co-γ rays seed irradiation on the germination characteristic and flowering traits ofCliviaminiata.Journal of Nuclear Agricultural Sciences,2013,27(11):1681-1685.(in Chinese)
[20] 孔素萍,段乃彬,刘冰江,高莉敏,刘波,徐坤.不同诱变剂对大蒜四倍体诱导的影响.核农学报,2016,30(6):1067-1073.
Kong S P,Duan N B,Liu B J,Gao L M,Liu B,Xu K.Study on tetraploids induction by different mutagens inGarlic.Journal of Nuclear Agricultural Sciences,2016,30(6):1067-1073.(in Chinese)
[21] 温岚,龚友才,陈基权,戴志刚,粟建光.EMS和60Co-γ射线辐照复合诱变黄麻突变体苗期生理生化特性研究.中国麻业科学,2014,36(5):224-228,257.
Wen L,Gong Y C,Chen J Q,Dai Z G,Su J G.Physiological and biochemical characteristics of mutant jute seedlings induced by EMS and60Co-γ radiation.Plant Fiber Sciences in China,2014,36(5):224-228,257.(in Chinese)
[22] 张代玉,吴凡,张吉宇,王彦荣,张岩,罗栋.秋水仙素和60Co-γ射线对无芒隐子草种子萌发的影响.草业科学,2016,33(3):424-430.
Zhang D Y,Wu F,Zhang J Y,Wang Y R,Zhang Y,Luo D.Effect of colchicines and60Co-y-rays on germination ofCleistogenessongoricaseeds.Pratacultural Science,2016,33(3):424-430.(in Chinese)
[23] 韩亚楠,吴琼,高睿,马淼,赵红艳.60Co-γ辐照对Na2SO4胁迫下乌拉尔甘草种子发芽特性的影响.草业科学,2015,32(3):421-426.
Han Y N,Wu Q,Gao R,Ma M,Zhao H Y.Effects of60Co-y radiation on seed germination ofGlycyrrhizauralensisunder Na2SO4stress.Pratacultural Science,2015,32(3):421-426.(in Chinese)
(责任编辑 武艳培)
AnalysisofEMSand60Co-γmutagenesisofDianthusspiculifoliusseeds
Gong Shu-fang, Liu En-hui, Jiang Tong-tong, Zhou Ai-min, Wang Jin-gang
(College of Horticulture and Landscape Architecture, Northeast Agricultural University, Harbin 150030, Heilongjiang, China)
In order to develop new varieties ofDianthusspiculifolius, we mutagenized seeds using EMS and60Co-γ rays. Treatment of seeds for 16 h with 1% EMS, close to the half-lethal dose, resulted in a mutation rate of 7.0%. Seeds treated with 300 Gy60Co-γ rays (dose rate 0.1 Gy·min-1, close to the half-lethal dose, resulted in a mutation rate of 4.2%. We obtained 1 038 phenotypic mutants in the M1generation, of which 95 were derived from seeds treated with EMS, and 943 were obtained following irradiation of the seeds. This study has enriched the germplasm resources ofD.spiculifoliusand has provided a technical reference for the mutagenesis of otherDianthusspecies.
seed; mutagenesis; mutation rate; ethyl methane sulfonate;60Co-γ rays; mutant;Dianthus
Wang Jin-gang E-mail:wangjingang99@neau.edu.cn
10.11829/j.issn.1001-0629.2017-0053
龚束芳,刘恩慧,姜童童,周爱民,王金刚.尖叶石竹种子的EMS和60Co-γ诱变.草业科学,2017,34(11):2226-2234.
Gong S F,Liu E H,Jiang T T,Zhou A M,Wang J G.Analysis of EMS and60Co-γ mutagenesis ofDianthusspiculifoliusseeds.Pratacultural Science,2017,34(11):2226-2234.
S681.503.7;Q943.2
A
1001-0629(2017)11-2226-09
2017-01-30接受日期2017-05-04
国家重点研发计划项目(2016YFC0500300);哈尔滨市应用技术研究与开发项目(2015RQQXJ021)
龚束芳(1971-),女,黑龙江哈尔滨人,教授,博士,主要从事园林植物遗传育种研究。E-mail:shufanggong@neau.edu.cn
王金刚(1974-),男,黑龙江哈尔滨人,教授,博士,主要从事园林植物遗传育种研究。E-mail:wangjingang99@neau.edu.cn

