Ames试验重要影响因素研究
管 莹,李雪梅,米其利,熊国行,夭建华
(云南中烟工业有限责任公司,云南 昆明 650231)
Ames试验重要影响因素研究
管 莹,李雪梅,米其利,熊国行,夭建华*
(云南中烟工业有限责任公司,云南 昆明 650231)
为了提高Ames试验的可靠性和可重复性,对检测体系中组氨酸浓度、菌液浓度和S9浓度对细菌回变菌落数的影响进行了研究。先以组氨酸浓度、菌液浓度和S9浓度分别为单一变量考察其对Ames试验结果的影响;再以正交试验综合考察组氨酸浓度、菌液浓度、S9浓度3个因素的交互作用。结果表明,组氨酸浓度、菌液浓度、S9浓度均对Ames试验的结果产生影响,且3个影响因素之间可能存在交互关系。因此,应对组氨酸浓度、菌液浓度、S9浓度予以控制。
Ames试验;剂量效应关系;假阴性;假阳性
现今,化学物质及其污染物对人体的潜在危害越来越受到社会的普遍关注与重视。Ames等于1975年建立并不断发展完善的沙门氏菌回复突变试验(Ames试验)被世界各国及组织广为采用,是目前国际公认的检测新药、食品添加剂、食品包装材料及化妆品等的致突变性、致癌性的首选试验[1-5]。Ames试验是利用鼠伤寒沙门氏菌Salmonellatyphimurium的组氨酸 (histidine)营养缺陷型突变株 (His-) 发生回复突变的性质,对化学物质致突变性进行初步筛选的短期体外试验方法[6]。
自Ames检测体系建立以来,不断有研究者对其进行各方面的改进,Ames试验的准确性、有效性也得以不断提高。但至今该试验仍存在一些不确定性因素,例如被检测体系中的组氨酸及其前体物(如多肽、蛋白质等)的量对Ames试验结果存在重要影响[7-10],因为它们可以支持His-缺陷型细胞生长和分裂,增加最终回复子菌落数,从而造成假阳性;Ames试验所用的沙门氏菌属于原核生物,缺少代谢活化系统,故Ames试验中需加入S9混合液作为代谢活化系统,该活化体系活性的强弱可能会对试验结果产生影响;此外,由于Ames试验是对产生回复突变的菌落数进行计数,检测使用菌的量过低可能会导致受试物诱变能力表现不完全。
因此,为了提高Ames试验结果的稳定性与准确性,作者对影响Ames试验结果的关键因素如组氨酸浓度、菌液浓度、S9浓度等进行了研究,以期为Ames试验结果的稳定性及可比性提供参考。
1 实验
1.1 主要试剂与仪器
牛肉膏、琼脂粉、氯化钠、磷酸氢二钾、葡萄糖、L-组氨酸、D-生物素、氯化钾、氯化镁、葡萄糖-6-氯酸钠、S9混合液、2-氨基芴。
超净工作台、CERULEAN SM 450型低温高速离心机、OLS 200型恒温摇床、GSP-9270型恒温培养箱、高速匀浆器、涡轮混合器、数迅V2型菌落计数仪、CERULEAN SM450型自动吸烟机。
1.2 方法
1.2.1 卷烟烟气样品的制备
按GB/T 19609-2004[11],利用自动吸烟机抽吸20支标准测试用卷烟3R4F,用直径92 mm的剑桥滤片捕集燃吸后产生的烟气总粒相物(TPM),并称重TPM量;剑桥滤片放入三角瓶中,加入适量二甲基亚砜(DMSO),置于超声仪上超声20 min;用无菌滤纸过滤,收集TPM提取液,调整TPM在DMSO中的终浓度为10 mg·mL-1。将样品分装后储存于-80 ℃,待用。
1.2.2 Ames试验
取营养肉汤培养基于无菌小三角瓶中,将主平板或冷冻保存的TA98菌株接种于营养肉汤培养基中,37 ℃振荡(100 r·min-1)培养10 h或静置培养16 h。达到对数生长期时,活菌数浓度不少于1×109个·mL-1。试验设置阳性对照、溶剂对照以及受试物TPM等3个试验组,其中受试物TPM设4个剂量组(每皿25 μg、50 μg、100 μg、200 μg)。将测试菌株新鲜菌液0.1 mL、受试物TPM 0.1 mL、10% S9混合液0.5 mL加入约2.0 mL保温的顶层培养基中,在涡轮混合器上混匀后迅速倒入底层培养基上,转动平皿使顶层培养基均匀分布在底层上,平放固化,于37 ℃培养48 h,观察结果。
1.2.3 Ames试验影响因素正交设计
在确定Ames试验平板掺入法的基础上,采用L16(45)正交试验考察组氨酸浓度、菌液浓度(OD600)、S9浓度对Ames试验的影响。正交试验的因素与水平见表1。
表1正交试验的因素与水平
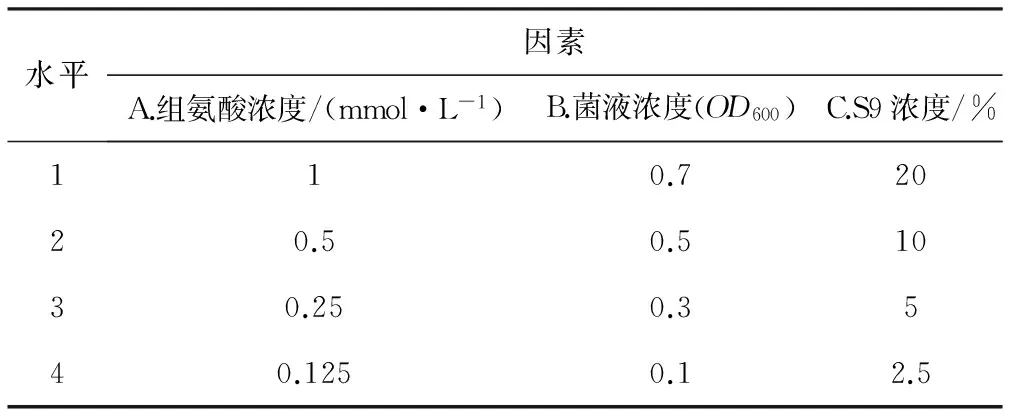
Tab.1Factors and levels of orthogonal experiment
2 结果与讨论
由于受试样品3R4F TPM在TA98(-S9)、TA100(+S9)、TA100(-S9)试验体系中均不会产生剂量效应关系,故以下试验均在TA98(+S9)试验体系中进行。
2.1 组氨酸浓度对Ames试验的影响
固定TA98菌液的OD600为0.476,S9浓度为10%(体积分数,下同),分别在组氨酸浓度(mmol·L-1)为1、0.5、0.25、0.125条件下检测3R4F TPM诱发回变菌落数,结果如表2所示。
表2组氨酸浓度对Ames试验的影响
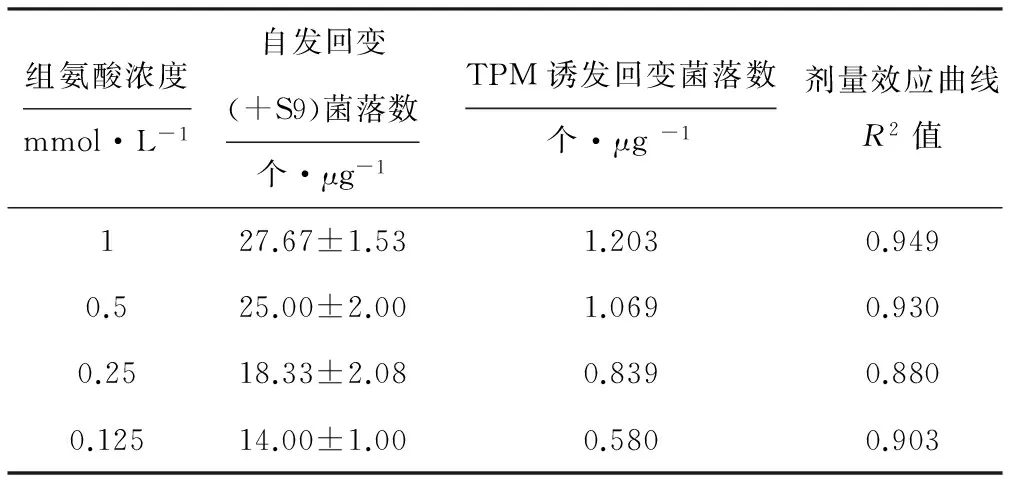
Tab.2Effect of histidine concentration on Ames test
从表2可以看出,组氨酸浓度的改变并未对剂量效应曲线的线性关系产生显著影响,但随着组氨酸浓度的降低,TPM诱发回变菌落数呈下降趋势,可见组氨酸浓度会对Ames试验结果产生重要影响。
2.2 菌液浓度对Ames试验的影响
固定组氨酸浓度为0.5 mmol·L-1,S9浓度为10%,600 nm波长下检测待用TA98菌液吸光值,用肉汤培养基将菌液按比例稀释至所需浓度后,分别检测3R4F TPM诱发回变菌落数,结果见表3。
由表3可以看出,菌液浓度较低时,同一受试物TPM诱发回变菌落数出现了明显降低,且剂量效应曲线不存在线性关系。由此证明菌液浓度会对Ames试验结果产生直接影响。
表3菌液浓度对Ames试验的影响
Tab.3EffectofbacterialsolutionconcentrationonAmestest

菌液OD600自发回变(+S9)菌落数个·μg-1TPM诱发回变菌落数个·μg-1剂量效应曲线R2值0.70021.67±3.211.0630.9850.50220.33±1.531.1470.9420.29521.00±3.000.6850.2540.09214.00±2.650.4610.191
2.3 S9 浓度对Ames试验的影响
固定TA98菌液的OD600为0.476,顶层组氨酸浓度为0.5 mmol·L-1,分别用新制备的S9混合液和冻存于液氮中1.5年的S9混合液进行Ames试验,检测3R4F TPM诱发回变菌落数,结果见表4。
从表4可以看出,随着S9浓度的降低,同一受试物TPM诱发回变菌落数出现了明显降低,而自发回变菌落数并未有显著变化。
表4S9浓度对Ames试验的影响

Tab.4Effect of S9 concentration on Ames test
根据Ames试验判定标准,当受试物组回变菌落数大于自发回变组回变菌落数2倍以上,即可认为该受试物诱变实验结果呈阳性。从以上结果可知,由于S9浓度的降低导致受试物诱发回变菌落数的减少,而与之作为参照的自发回变菌落数并未受S9浓度降低的影响,由此可见S9浓度过低会影响Ames试验对需要代谢活化才能表现致突变效应的物质毒性的检出,产生假阴性。
2.4 正交试验的结果与分析
正交试验不同试验组剂量效应曲线结果见图1。
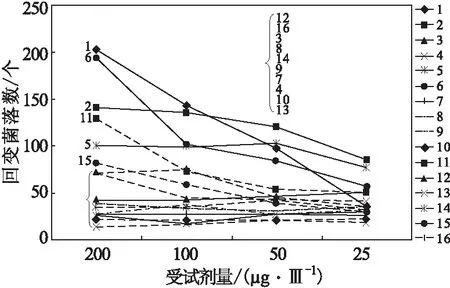
图1 正交试验剂量效应关系曲线Fig.1 Dose-effect relationship curves of orthogonal experiment
Ames试验结果可信应满足以下2个重要指标:首先,在检测剂量范围内剂量效应曲线应呈线性关系,对相应试验条件下剂量效应曲线求其R2值,R2值越接近1则表示线性关系越好;其次,阳性对照组回变菌落数应gt;1 000。根据以上原则,对16个试验组关键试验数据进行统计,结果如表5所示。
由表5可以看出,以R2值gt;0.6为界,满足以上条件的有试验组1、2、6、12,对以上4个试验组进行Duncan多重比对,结果无显著差异(Pgt;0.05)。但这是对各个检测剂量整体趋势差异与否的检测,产生阳性结果最低剂量(μg·皿-1)除试验组1为50 μg·皿-1,其它可检测到阳性结果的试验组均为25 μg·皿-1,除此之外对平均回变菌落数进行统计分析,试验组12仅为0.607个·μg-1,与其它3组存在显著差异(Plt;0.05)。由以上结果还可看出,3个影响因素之间存在交互关系,并不是在某个限量范围内任意组合就能得出较好结果,因此不能单一的就每个影响因素给出一个限量范围。
以剂量效应曲线R2值为衡量标准,R2值越大试验剂量效应关系越好,以此为依据作正交试验的因子趋势图,如图2所示。
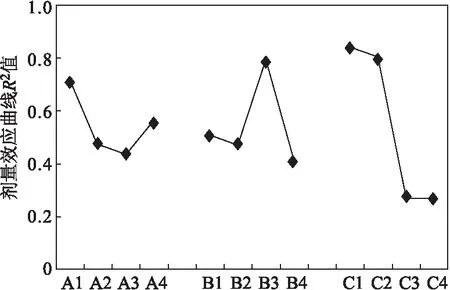
图2 Ames影响因素正交试验的因子趋势图Fig.2 Impact factor trend graphs of Ames testby orthogonal experiment
表5Ames试验影响因素的正交试验结果

Tab.5The orthogonal experiment results of Ames test influencing factors
由图2可以看出,所考察的3个因素对Ames试验的影响主次顺序为C(S9浓度)gt;A(组氨酸浓度)gt;B(菌液浓度)。
2.5 讨论
以组氨酸浓度、菌液浓度和S9浓度分别为单一变量考察其对Ames试验结果的影响。首先,组氨酸浓度试验结果显示,组氨酸浓度的改变并未对剂量效应曲线的线性关系产生显著影响,但随着组氨酸浓度的降低,TPM诱发回变菌落数呈下降趋势。而TPM诱发回变菌落数越多并不代表试验结果越可靠,这是由于组氨酸在试验体系中扮演着一个特殊的角色,一方面Ames试验中所用的培养基并非完全缺乏组氨酸,而是加入了微量的组氨酸,使营养缺陷型细菌能繁殖数代成为菌苔,同时使诱变物所产生的DNA损伤在复制过程中得到固定,从而又表现为功能基因细菌,只有这样的回变细菌才能进一步生长为菌落;另一方面,检测体系中的组氨酸及其前体物(如多肽、蛋白质等)达到一定量时可以支持His-缺陷型细胞生长和分裂,增加最终回复子菌落数,从而造成假阳性。因此,作为影响Ames试验结果的重要因素之一,组氨酸较为适宜的浓度还需进一步研究。
其次,菌液浓度试验结果表明,菌液浓度较低时,TPM诱发回变菌落数出现了明显降低,且剂量效应曲线不存在线性关系。从所选定的4个菌液浓度检测结果来看,菌液浓度OD600值应不低于0.5。
再者,S9浓度试验结果表明,随着S9浓度的降低,TPM诱发回变菌落数出现了明显降低,而自发回变菌落数并未有显著变化。根据Ames试验判定标准,当受试物组回变菌落数大于自发回变组回变菌落数2倍以上,即可认为该受试物诱变实验结果呈阳性。从以上结果可知,由于S9浓度的降低导致TPM诱发回变菌落数减少,而与之作为参照的自发回变菌落数并未受S9浓度降低的影响,由此可见S9浓度过低会影响Ames试验对需要代谢活化才能表现致突变效应的物质毒性的检出产生假阴性。目前Ames试验标准仅对所制备S9混合液蛋白量上限做出规定,而未对S9的实际使用量做出明确规定,由于S9混合液的制备过程涉及生物活体,存在个体诱导差异及环境等复杂因素,因此,不同人员不同批次制备的S9混合液必然存在一定差异。故对S9的实际使用量进行确定是十分必要的。
单变量试验结果表明组氨酸浓度、菌液浓度、S9浓度均会对Ames试验产生直接影响,但以上试验结果并不能给出一个确定的条件范围以保证Ames试验结果的稳定性及可比性。于是为了能够找到较佳的试验条件,我们设计了正交试验,对3种因素的4个水平进行了考察,由于TPM诱发回变菌落数越多并不代表试验结果越可靠,因此以剂量效应曲线的线性程度R2值为衡量标准,R2值越大试验条件越佳。正交试验结果表明,在所考察的3个因素对Ames试验影响的主次顺序依次为:S9浓度gt;组氨酸浓度gt;菌液浓度。由于Ames试验结果的正确性还存在多个标准,因此不能简单地像一般正交试验通过计算得出最优处理条件。因此,我们首先以剂量效应曲线线性程度和阳性对照组诱发回变菌落数为条件初筛,在16个试验组中同时满足R2值gt;0.6和阳性对照组回变菌落数gt; 1 000的有试验组1、2、6、12;在这4组中除试验组1产生阳性结果最低剂量为50 μg·皿-1,其它可检测到阳性结果的试验组最低剂量均为25 μg·皿-1;除此之外对平均回变菌落数(个·μg-1)进行统计分析,试验组12仅为0.607个·μg-1,与其它3组存在显著差异(Plt;0.05)。由以上结果还可看出,3个影响因素之间可能存在交互关系,并不是在某个限量范围内任意组合就能得出较好结果,因此不能单一的就每个影响因素给出一个限量范围。从现已验证的试验条件来看,在试验条件为试验组2和6的试验条件组合时,Ames试验在检测剂量范围内结果剂量效应关系线性程度较高。由于正交试验试验组数有限,因此可能存在更优的试验条件组合,但试验组2(1 mmol·L-1组氨酸、菌液OD6000.5、S9浓度10%)和试验组6(0.5 mmol·L-1组氨酸、菌液OD6000.5、S9浓度20%)的试验条件已经能够满足试验的灵敏度和准确度。
3 结论
为了提高Ames试验结果的稳定性及可比性,单因素试验结果表明组氨酸浓度、菌液浓度、S9浓度是需要控制的重要影响因素。正交试验表明3个影响因素之间可能存在交互关系,并不是在某个限量范围内任意组合就能得出较好结果,因此不能单一的就每个影响因素给出一个限量范围。以1 mmol·L-1组氨酸、菌液OD6000.5、S9浓度10%或0.5 mmol·L-1组氨酸、菌液OD6000.5、S9浓度20%为组合条件,既能保证Ames试验的灵敏度,也能够使剂量效应关系在所检测剂量范围内呈较好的线性关系,保证了Ames试验结果的准确性。
[1] GB 15193-2003,食品安全性毒理学评价程序[S].
[2] YY/T 0127.10-2009,口腔医疗器械生物学评价第2单元:试验方法鼠伤寒沙门氏杆菌回复突变试验(Ames试验) [S].
[3] GB 7919-87,化妆品安全性评价程序和方法[S].
[4] GB 15670-1995,农药登记毒理学试验方法[S].
[5] CJ/T 150-2001,城市供水水质检验方法标准及编制说明和研究报告[S].
[6] MORTELMANS K,ZEIGER E.The Ames/microsome mutagenicity assay[J].Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis,2000,455(1/2):29-60.
[7] VERHAGEN H,BRUIJNTIES-ROZIER G C D M,Coenen T M M,et al.Modified suspension Ames test for testing proteinaceous substances:an initial step[J].Food Chemical Toxicology,1994,32(12):1161-1166.
[8] AUFDERHEIDE M,GRESSMANN H.A modified Ames assay reveals the mutagenicity of native cigarette mainstream smoke and its gas vapour phase[J].Experimental amp; Toxicologic Pathology,2007,58(6):383-392.
[9] FLUCKIGER-ISLER S,BAUMEISTER M,BRAUN K,et al.Assessment of the performance of the Ames Ⅱ assay:a collaborative study with 19 coded compounds[J].Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis,2004,558(1/2):181-197.
[10] 刘波,金建玲,高培基,等.Ames测试不确定性分析[J].应用与环境生物学报,2007,13(5):726-730.
[11] GB/T 19609-2004,卷烟用常规分析用吸烟机测定总粒相物和焦油[S].
MajorFactorsInfluencingAmesTest
GUAN Ying,LI Xue-mei,MI Qi-li,XIONG Guo-hang,YAO Jian-hua*
(ChinaTobaccoYunnanIndustrialCo.,Ltd.,Kunming650231,China)
In order to improve the reliability and repeatability of Ames test,we studied the effects of concentrations of histidine,bacterial solution,and S9 on the number of bacterial reversion mutation.Firstly,using histidine concentration,bacterial solution concentration,and S9 concentration as a single variable,respectively,we investigated the effects of them on Ames test results.Then,we studied the interaction among histidine concentration,bacterial solution concentration,and S9 concentration by an orthogonal experiment.Results show that histidine concentration,bacterial solution concentration,and S9 concentration all affect Ames test results,and there might be an interaction among the three factors.Therefore,histidine concentration,bacterial solution concentration,and S9 concentration should be controlled.
Ames test;dose-effect relationship;false negative;false positive
中国烟草总公司科技项目(110201501002(XX-02)),云南中烟工业有限责任公司科技项目(2016JC01)
2017-06-06
管莹(1984-),女,云南曲靖人,博士,助理研究员,研究方向:毒理学,E-mail:guan_ying2011@126.com;通讯作者:夭建华,博士,研究员。
10.3969/j.issn.1672-5425.2017.11.009
管莹,李雪梅,米其利,等.Ames试验重要影响因素研究[J].化学与生物工程,2017,34(11):35-39.
X503
A
1672-5425(2017)11-0035-05

