QuEChERS-GPC-GC/MS同时测定鱼肉中9种羟基类兽药残留
薛良辰,蔡勤仁,郑 璇,刘 陆,凌芸辉,李 忠,彭玉芬,陈 敬,蔡德琳,蔡 杰,黄 晶
(1.珠海出入境检验检疫局,广东 珠海 519015;2.广东出入境检验检疫局,广东 广州 510623)
QuEChERS-GPC-GC/MS同时测定鱼肉中9种羟基类兽药残留
薛良辰1,蔡勤仁1,郑 璇2,刘 陆1,凌芸辉1,李 忠1,彭玉芬1,陈 敬1,蔡德琳1,蔡 杰1,黄 晶1
(1.珠海出入境检验检疫局,广东 珠海 519015;2.广东出入境检验检疫局,广东 广州 510623)
采用QuEChERS前处理方法和在线凝胶渗透色谱-气相色谱-质谱联用法(gel permeation chromatography-gas chromatography-mass spectrometry,GPC-GC/MS)快速测定鱼肉中9种羟基类兽药残留。采用在线凝胶色谱进行在线净化,除去鱼肉中大部分油脂,有效缩短了样品前处理时间,结合选择离子监测采集方式,可减少基质干扰,提高方法的选择性。样品经乙腈提取,分散基质固相萃取方式净化后,使用选择离子监测(SIM)模式检测,外标法定量。经方法学验证,9种羟基类兽药在0.5~20.0 μg/L浓度范围内的线性关系良好,相关系数r大于0.99;样品的平均回收率为63.5%~90.2%,相对标准偏差为3.6%~15.4%,方法检出限为0.3~1.0 μg/kg。将该方法应用于10批实际样品的检测,其中1批样品的氯霉素检测结果呈阳性,含量为6.1 μg/kg。该方法灵敏度高、准确可靠,可用于鱼肉中9种羟基类兽药的定性定量分析。
羟基类兽药;QuEChERS;在线凝胶渗透色谱-气相色谱-质谱联用法(GPC-GC-MS);鱼肉
雌激素、甲硝唑、氯霉素等兽药分子结构都含有羟基(—OH)官能团,可以将它们归为羟基类兽药,该类药物可由食物链进入人体,具有致突变、致癌的潜在危害。有报道[1-2]表明,食品中的雌性激素残留与儿童性早熟、女性乳腺癌和子宫癌发病率的上升有关,氯霉素会抑制骨髓造血机能,甲硝唑具有潜在的致癌和致突变性。我国农业部176号公告明确规定:禁止饲料和动物饮用水中添加己烯雌酚、雌二醇等雌激素[3];235号公告明确规定:己烯雌酚、氯霉素、甲硝唑在动物性食品中的最高残留限量(MRL)为不得检出[4];欧盟(EEC)96/23指令也将氯霉素列入禁用药,并规定MRPL值为0.3 μg/kg[1]。
目前,检测雌激素、甲硝唑、氯霉素的方法主要有酶联免疫吸附测定(ELISA)[5]、高效液相色谱(HPLC)[6]、气相色谱(GC)[7]、液相色谱-串联质谱(LC/MSn)[8-10]、气相色谱-串联质谱(GC/MSn)[9-15]等。其中,ELISA主要用于初筛,得到的阳性试样需要进一步用质谱确证,而且它不能同时筛选具有不同化学结构、不同功能兽药(如氯霉素、己烯雌酚、甲硝唑等)的多残留组分。此外,基于化学结构或元素组成共性进行药物残留检测的HPLC、GC技术也只能作为初步筛选,阳性试样也必须进一步用质谱法确证。LC/MSn联用技术可进行多残留的同时分析,但因其设备昂贵,难以在大多数实验室推广,而GC/MSn联用技术已广泛用于兽药的多残留检测,特别是QuEChERS方法结合GPC-GC/MS快速检测技术,不仅应用于我国兽药残留的日常监控,更有望成为动物源食品进出口的有力“绿色壁垒”技术。
QuEChERS是近年来国际上最新发展起来的一种用于农产品检测的快速样品前处理技术,具有简便快捷、成本低廉、易于操作等特点[16-17],常和LC-MS/MS法联用用于同时检测多种兽药残留,但将其作为气相色谱-质谱法的前处理技术检测兽药残留的报道较少。利用QuEChERS法结合GPC-GC/MS法同时检测雌激素、氯霉素、甲硝唑等9种羟基类兽药残留的研究尚未见报道。
本研究拟采用改进的QuEChERS法结合SPE技术提取、净化样品,通过在线凝胶色谱净化和富集待测样液,希望建立一种鱼肉中羟基类兽药残留的GPC-GC/MS快速检测方法。
1 实验部分
1.1仪器与试剂
QP2010 Plus在线凝胶渗透色谱-气相色谱/质谱联用仪:日本岛津公司产品;Turbo Vap LV 氮吹浓缩仪:美国Caliper公司产品;IKA MS3迷你振荡器:德国IKA公司产品;步琦Syacore R-12平行蒸发仪:瑞士Buchi公司产品;KQ-5200DE水浴超声波仪:中国昆山舒美超声仪器有限公司产品。
己烯雌酚、己二烯雌酚、己烷雌酚、雌二醇、雌三醇、雌酮、炔雌醇、甲硝唑、氯霉素标准品:纯度均大于96.1%,德国Dr.Ehrenstorfer公司产品;乙腈、甲醇、甲苯、环己烷、丙酮:均为色谱纯,美国Spectrum公司产品;实验用水为超纯水:由美国Millipore公司Elix5纯水机制备;无水硫酸钠、无水硫酸镁、氯化钠:均为分析纯,广州化学试剂厂产品;双(三甲基硅烷基)三氟乙酰胺(BSTFA)-甲基氯硅烷(TMCS)(99∶1,V/V)衍生化试剂:美国Sigma公司产品;Primary Secondary Amine(PSA)吸附剂、SPE中性氧化铝柱(2 g/6 mL):博纳艾杰尔公司产品。
标准溶液的配制:用甲醇分别配制9种样品的标准储备溶液,质量浓度为100 mg/L,保存于 4 ℃下,有效期6个月,分析前用甲醇稀释到所需浓度。混合标准工作液的配制:用上述标准溶液根据需要配制混合标准工作液。
1.2前处理方法
1.2.1提取 准确称取(5.00±0.01) g样品于50 mL带螺旋盖的聚丙烯离心管中,加入10 mL水,在涡旋振荡器上充分混匀30 s后,加入15 mL乙腈,继续充分涡旋混匀30 s,超声提取15 min;加入QuEChERS盐析剂(10 g无水硫酸钠、1.5 g氯化钠),充分涡旋混匀2 min后,以4 000 r/min离心5 min,取上清液。残渣用10 mL乙腈重复提取1次,合并上清液,待净化。
1.2.2净化 将QuEChERS净化剂(500 mg无水硫酸镁、500 mg PSA)加入上述装有上清液的离心管中,涡旋振荡混匀1 min,以4 000 r/min离心5 min;移取全部上清液至已用5 mL乙腈活化的中性氧化铝柱上,接收流出液;用4 mL乙腈洗涤中性氧化铝柱,收集全部流出液,于45 ℃ 减压蒸发至约剩1 mL,转移至10 mL衍生管中,于45 ℃氮吹浓缩至干。
1.2.3衍生化 将衍生管置于70 ℃烘箱中,10 min后取出,加入100 μL甲苯和100 μL衍生化试剂,涡旋振荡混匀30 s后,于70 ℃烘箱中衍生化60 min;于45 ℃氮吹浓缩至干,加入0.5 mL丙酮-环己烷溶液(3∶7,V/V)溶解,过0.22 μm一次性针头式滤头(有机相),上机待测。
1.3测定方法
1.3.1GPC参数设置 Shodex CLNpak EV-200凝胶色谱柱(2.00 mm×150 mm×16 μm),柱温40 ℃,流动相为丙酮-环己烷溶液(3∶7,V/V),流速0.1 mL/min,进样量25 μL,GPC淋出液收集时间2.67~4.67 min。
1.3.2GC参数设置 载气:高纯氦气;柱流速1.75 mL/min;程序升温:进样口温度120 ℃,保持5 min,以100 ℃/min升至300 ℃,保持27.2 min;色谱柱:惰性前置柱(5 m×0.53 mm),Rtx-5MS预柱(5 m×0.25 mm×0.25 μm),Inert Cap Pesticides分析柱(30 m×0.25 mm×0.25 μm);升温程序:初温82 ℃,保持5 min,以10 ℃/min升至300 ℃,保持7.2 min。
1.3.3质谱条件 电子轰击离子源(EI),离子源温度230 ℃,接口温度300 ℃,溶剂延迟时间13 min,检测器电压0.85 kV,数据采集模式为SIM,监测离子列于表1。

表1 9种化合物部分质谱参数Table 1 MS parameters of 9 compounds
注:* 表示用于定量分析的离子
2 结果与讨论
2.1色谱条件的优化
由于在线凝胶色谱-气相色谱/质谱(GPC-GC/MS)系统的凝胶色谱柱一般只采用Shodex CLNpak EV-200(2.00 mm×150 mm×16 μm),因此不需要对凝胶色谱柱进行选择,只需对GPC定位时间进行优化。化合物在GPC色谱柱中根据其相对分子质量的不同,将油脂、色素等杂质成分与目标化合物分离,并通过切换阀排出GPC洗脱时间短的大分子油脂和色素等杂质,将目标化合物注入捕集环,通过气相色谱柱分离,按分离时间的先后进入质谱检测。若切换阀切换时间太早,油脂等干扰成分去除不彻底;若切换阀切换时间太晚,则检测目标化合物被排出系统外而不能导入质谱中,因此检测不到目标物质,所以必须根据不同化合物选择最优的淋出液收集时间。9种目标化合物中,雌三醇分子质量最大,甲硝唑分子质量最小,故以雌三醇流出时间作为开始切入目标化合物的时间,以甲硝唑流出时间作为停止切入的时间。雌三醇和甲硝唑混标溶液(1.0 mg/L)在紫外210 nm波长的色谱图示于图1。可知,雌三醇和甲硝唑混标溶液在GPC的流出时间为3.40 min,所以选择3.40 min前1.0 min左右,即2.60 min加上混标溶液从紫外检测器流至切换阀的时间0.07 min作为样品开始收集时间,即样品开始收集时间为2.67 min。选择3.40 min 后1.0 min左右,即4.60 min加上混标溶液从紫外检测器流至切换阀的时间0.07 min作为样品结束收集时间,即样品结束收集时间为4.67 min。因此,GPC的淋出液收集时间为2.67~4.67 min,在该时间段能够保证收集到所有目标化合物。

图1 210 nm检测波长的混标凝胶渗透色谱图Fig.1 GPC chromatogram of mixed standard of 210 nm wavelength
对于气相色谱柱的选择,比较了Inert Cap 5MS(30 m×0.25 mm×0.25 μm)与Rtx-5MS(30 m×0.25 mm×0.25 μm)的分离效果。结果表明,采用Rtx-5MS气相色谱柱进行色谱分离时,该组分的出峰时间稳定、分离度和峰形较好,耐受性好,梯度洗脱程序见1.3.2节。
2.2质谱条件的优化
根据目标化合物的分子质量和分子结构,选择EI源Scan扫描模式进样,将经过衍生化的浓度为1.0 mg/L标准溶液用标准进样方式进样,进样量10 μL,在Scan模式下进行质谱分析,得到9种化合物的特征碎片离子,列于表1。以丰度最高的离子作为定量离子,其他丰度较低的2~3个离子作为参比离子,进行定性和定量分析。
2.3样品前处理条件的选择
2.3.1提取溶剂的选择 QuEChERS法常用的提取溶剂有甲醇、乙腈、乙酸乙酯等。由于甲醇能与盐溶液互溶,无法产生盐析效应,因此排除了甲醇,只比较了乙腈、乙酸乙酯作为提取溶剂的提取效果。实验结果表明:乙腈与乙酸乙酯对9种目标化合物的提取效率相当,但采用乙酸乙酯能够提取出更多的脂肪和弱极性基质成分,提取的上清液颜色较深,提取液用氮吹浓缩近干后,试管底部和管壁有大量黄褐色脂肪和其他杂质。考虑到使用的检测仪器为GPC-GC/MS系统,兽药检测需要衍生化,这要求提取液中脂肪和弱极性基质成分尽量少,以免影响后续实验,而乙腈具有沉淀蛋白质能力强和共提物少的特点,所以选择乙腈作为提取液。在实验中,还比较了用乙腈直接提取和先加水分散再用乙腈提取两种方法,结果显示,后者能够获得更理想的回收率。
2.3.2除水剂及盐析剂的选择 本实验选择先加水分散再用乙腈提取的前处理方法,而乙腈能与水互溶,如果只使用除水剂,很难完全除去水分,因此本研究选用盐析与除水剂相结合的除水方式。实验证明,盐析效应降低了提取液中的水分含量,同时降低了基质中亲水性成分的溶解度,从而大大提高了萃取效率。本研究考察了0.5、1.0、1.5、2.0 g NaCl作为盐析剂的盐析效果,实验结果表明,加入0.5、1.0 g NaCl时,盐析效果不理想,加入1.5、2.0 g NaCl时,盐析效果较好,按节约试剂的原则,最终确定NaCl的使用量为1.5 g。
QuEChERS法常用的除水剂有无水硫酸镁和无水硫酸钠。2~5 g无水硫酸钠可除掉其中 43%~50%的水;1.5 g无水硫酸镁能够除去97%左右的水,瞬时放热可达65 ℃以上,热不稳定的兽药,如甲硝唑等,其回收率降至10%以下[13]。如果把加入无水硫酸镁的样品马上放入冰水中降温,可以解决发热量太大的问题,但是操作繁琐且不好控制。基于以上原因,本研究采用分段除水方法,即提取阶段采用10 g无水硫酸钠和1.5 g氯化钠盐析剂相结合的除水方法,以除去90%以上的水分;在净化阶段加入500 mg无水硫酸镁除去剩余的水分。结果表明,该方法除水效果理想,而且能很好地解决由于发热量过大而导致的兽药回收率偏低的问题。
2.3.3净化条件的优化 QuEChERS法的净化方式主要是分散固相萃取,常用的吸附剂有NH2、PSA、C18、中性氧化铝及石墨化炭黑(GCB)等。石墨化炭黑可去除提取液中的色素成分,但也会吸附目标化合物,因此不能在本实验中使用;NH2吸附剂通常用于去除提取液中的弱酸性物质;PSA吸附剂通常用于去除提取液中脂类和糖类物质;C18及中性氧化铝都具有较强的去除脂肪能力,且对9种化合物都有较强的吸附作用。在添加相同浓度标准物质的空白样品中分别加入相同质量的不同吸附剂,然后净化上机测定。结果表明,NH2、C18、石墨化炭黑这3种吸附剂对9种化合物均有较强的吸附作用,而PSA与中性氧化铝对目标化合物的吸附较少,可作为净化剂进一步优化。实验发现,PSA、中性氧化铝与无水硫酸镁的组合净化剂能有效去除提取液中的油脂和杂质,但会有一些无法通过高速离心沉淀下来的粉末漂浮在液面上,如果将粉末去除干净,需要考虑使用SPE技术。中性氧化铝SPE柱的除脂能力强,过柱速度快,可选用此柱替代中性氧化铝吸附剂除去脂肪和浮末等杂质。因此,本实验最终的净化组合确定为:PSA、500 mg无水硫酸镁、中性氧化铝柱。根据样品的特点,考察了500 mg无水硫酸镁、200~1 000 mg PSA、1 g/6 mL和2 g/6 mL中性氧化铝柱不同组合的净化效果。结果表明,采用500 mg PSA、500 mg无水硫酸镁及2 g/6 mL中性氧化铝SPE柱,样品溶液澄清,基质干扰较小,回收率好。
2.3.4衍生化条件的选择 9种羟基类兽药分子中含有多个极性基团,极性较大、挥发性低,必须首先对样品进行衍生化处理才能进行GPC-GC/MS测定。由于9种目标化合物都含有羟基,可用硅烷化试剂与化合物分子中的羟基进行硅醚化反应。本研究比较了单独使用BSTFA硅烷化试剂与BSTFA-TMCS复合硅烷化试剂的衍生化效果。结果表明,以BSTFA-TMCS溶液(99∶1,V/V)作为9种羟基类兽药的衍生化试剂,衍生效果较好。乙腈、正己烷、苯及甲苯均可作为衍生化溶剂。其中,乙腈容易含有水分,影响衍生化;正己烷挥发性过强,影响实验重复性;甲苯沸点高,含水极少,有利于衍生化,实验重复性好。
BSTFA-TMCS复合硅烷化试剂容易吸水,在实验中需要注意避水。吹干的提取液先在70 ℃烘箱中放置10 min,干燥,再加入有机试剂和硅烷化试剂衍生化,以去除水分,避免硅烷化试剂吸水失效。本实验考察了在60、70、80 ℃,反应40、50、60 min条件下,50、100 μL硅烷化试剂不同组合的衍生化效果。结果表明:80 ℃时的衍生化效果不好;60 ℃、60 min时仍未反应完全;70 ℃、60 min时,50 μL硅烷化试剂基本可以衍生完全;但由于衍生化试剂稍过量为宜,因此选择100 μL硅烷化试剂。衍生化后,氮吹浓缩至干,以终止在进样时的进一步衍生反应,同时也净化了反应液,消除了硅烷化试剂的干扰。
2.3.5基质效应 基质效应包括基质增强效应和基质抑制效应。本研究采用(基质匹配标准溶液所做曲线的斜率/无基质标准溶液所做曲线的斜率-1)×100%[2]评价9种化合物的基质效应。结果表明:9种化合物的基质均存在不同程度的基质效应,且抑制效应多于增强效应。消除基质效应主要是改进样品净化方法,得到尽量干净的待测样品液,除此之外,还有使用同位素内标低基质影响(同位素内标价格昂贵,不适合普遍使用)、多倍稀释待测样品液以降低基质效应成分浓度(需要高灵敏仪器,不适合本方法的测定仪器)、以空白样品待测液配制标准系列 (该方法简单有效,环保节约)等方法。综合考虑,本实验采用以空白样品待测液配制标准系列的方法。
2.4方法的检测限、回收率、重复性及线性范围
在以上测定条件下配制标准系列溶液(n=6),以化合物的浓度比为横坐标(x),以峰面积比为纵坐标(y),绘制标准曲线。结果表明,9种目标化合物的浓度在0.5~20 μg/L范围内,线性关系良好,相关系数及回归方程列于表2。
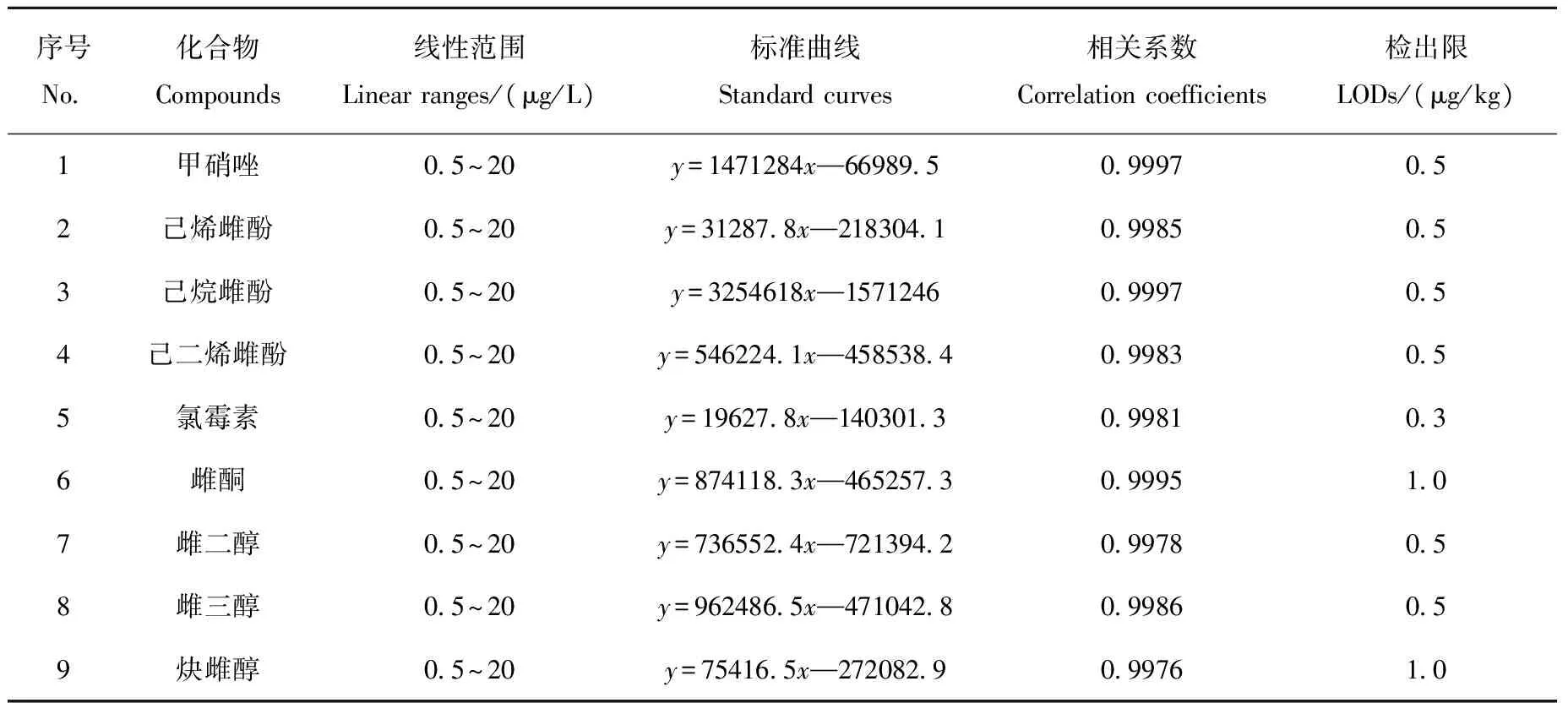
表2 9种化合物的标准曲线、线性范围、相关系数和检出限Table 2 Standard curves, linear ranges, correlation coefficients and limits of detection (LODs) of 9 compounds
在空白样品中添加9种目标化合物的标准溶液,进行3个水平浓度添加回收实验,每个浓度做6次重复实验。结果表明,回收率和变异系数分别在63.5%~90.2%、3.6%~15.4%之间,检测低限为0.3~1.0 μg/kg。9种化合物加标5.0 μg/kg的重构离子色谱图及质谱图示于附图1。
2.5样品测定结果
采用本方法测定市场上随机采购的10个鱼样品,9个样品中未发现目标兽药残留,在1个样品中检出氯霉素,其含量为6.1 μg/kg。阳性可疑样品的重构离子色谱图和质谱图示于图2。
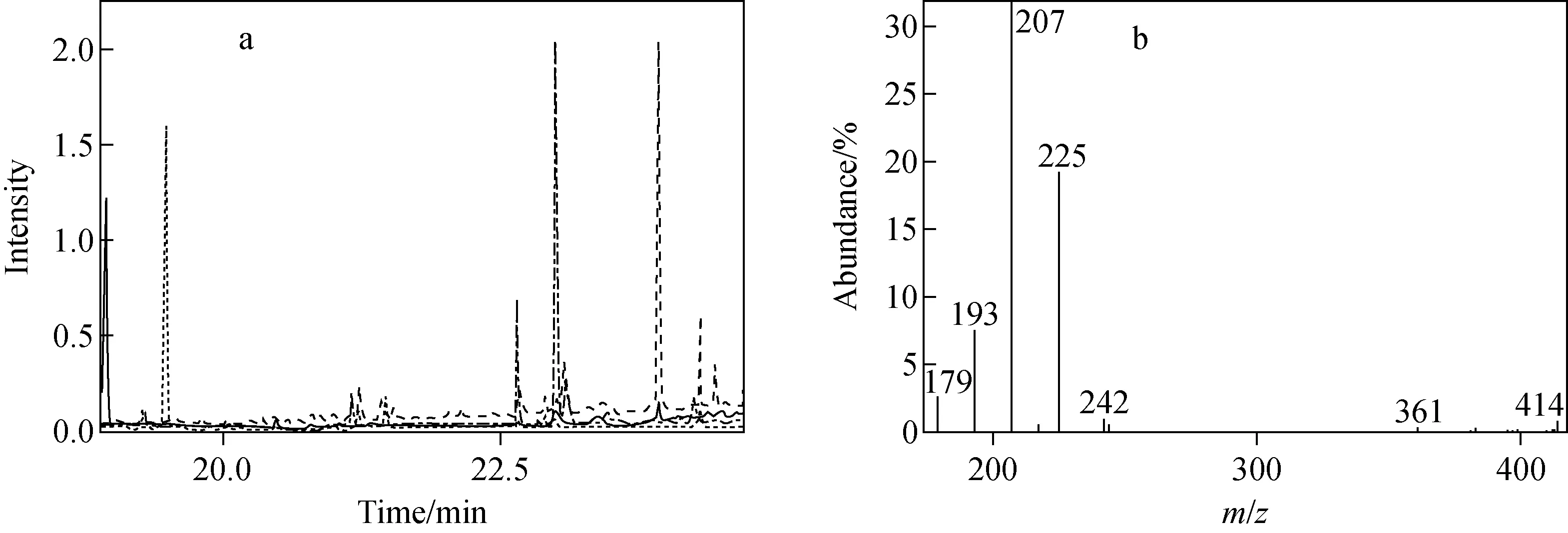
图2 阳性可疑样品的重构离子色谱图(a)及质谱图(b)Fig.2 Extracted product ion chromatogram (a) and mass spectrum (b) of a doubtful positive sample
3 结论
本研究采用改进的QuEChERS方法净化样品,并通过在线凝胶色谱净化和富集待测样液,建立了鱼肉制品中9种羟基类兽药残留的GPC-GC/MS快速检测方法。经方法学验证:9种羟基类兽药在0.5~20.0 μg/L范围内呈现良好的线性关系,相关系数大于0.99;样品平均回收率为62.1%~90.2%;相对标准偏差为3.1%~15.4%;方法检出限为0.3~1.0 μg/kg。本方法简便、可靠、可检测的种类多样,能满足对市场上相关非法使用和滥用的9种羟基类兽药残留的检测监控要求,可以为动物源性食品的监督检测提供新的方法参考。
[1] 田寒友,李家鹏,周彤,等. 我国与欧盟、美国、日本、CAC畜禽兽药残留限量标准对比研究[J]. 肉类研究,2012,26(2):43-46.
TIAN Hanyou, LI Jiapeng, ZHOU Tong, et al. Comparative analysis of standards for veterinary drug residue limits among China, the EU, Japan, the US and the Codex Alimentarius Commission (CAC)[J]. Meat Research, 2012, 26(2): 43-46(in Chinese).
[2] 罗辉泰,黄晓兰,吴惠勤,等. QuEChERS/液相色谱-串联质谱法同时测定鱼肉中30种激素类及氯霉素类药物残留[J]. 分析测试学报,2011,30(12):1 239-1 337.
LUO Huitai, HUANG Xiaolan, WU Huiqin, et al. Simultaneous determination of 30 hormones and chloramphenicols residuesin fish using QuEChERS sample preparation and liquid chromatography-tandem mass spectrometry[J]. Journal of Instrumental Analysis, 2011, 30(12): 1 239-1 337(in Chinese).
[3] 中华人民共和国农业部公告第176号. 禁止在饲料和动物饮用水中使用的药物品种目录[EB/OL]. http:∥www.moa.gov.cn/zwllm/tzgg/gg/201104/t20110422_1976307.htm.
[4] 中华人民共和国农业部公告第235号.动物性食品中兽药最高残留量[EB/OL]. http:∥www.moa.gov.cn/zwllm/nybz/200803/t20080304_1028649.htm.
[5] 潘明飞,王俊平,方国臻,等. 食品中农兽药残留检测新技术研究进展[J]. 食品科学,2014,35(15):277-282.
PAN Mingfei, WANG Junping, FANG Guozhen, et al. Advances in new detection techniques of pesticide and veterinary drug residues in foods[J]. Food Science, 2014, 35(15): 277-282(in Chinese).
[6] 中华人民共和国国家质量监督检验检疫总局,中国家标准化管理委员会. GB/T 20443—2006鸡组织中已烯雌酚残留的测定 高效液相色谱-电化学检测器法[S]. 北京:中国标准出版社,2006.
[7] 中华人民共和国国家质量监督检验检疫总局,中国家标准化管理委员会. GB/T 8381.9—2005饲料中氯霉素的测定-气相色谱法[S]. 北京:中国标准出版社,2005.
[8] MOLINA-DIAZ A, VILLAR-PULIDO M, GILBERT-LOPEZ B,et al. Multiclass detection and quantitation of antibiotics and veterinary drugs in shrimps by fast liquid chromatography time-of-flight mass spectrometry[J]. Talanta,2011, 85(3): 1 419-1 427.
[9] 郭海霞,肖桂英,张禧庆,等. QuEChERS-超高效液相色谱-串联质谱法同时检测猪肉中121种兽药[J]. 色谱,2015,33(12):1 242-1 250.
GUO Haixia, XIAO Guiying, ZHANG Xiqing, et al. Simultaneous determination of 121 veterinary drugs in pork by QuECHERS and ultra performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Chromatography, 2015, 33(12): 1 242-1 250(in Chinese).
[10] 李娜,张玉婷,刘磊,等. QuEChERS-超高效液相色谱-串联质谱法测定动物源食品中4类29种禁限用兽药残留[J]. 色谱,2014,32(12):1 313-1 319.
LI Na, ZHANG Yuting, LIU Lei, et al. Simultaneous determination of 4 kinds of 29 banned and restricted veterinary drugs in animal-derived foods by ultra performance liquid chromatography-tandem mass spectrometry and modified QuECHERS for sample preparation[J]. Chinese Journal of Chromatography, 2014, 32(12): 1 313-1 319(in Chinese).
[11] 吴银良,刘素英,单吉浩,等. 气相色谱-质谱法分析鸡肝中己烯雌酚残留量[J]. 中国兽药杂志,2005,39(11):12-14.
WU Yinliang, LIU Shuying, SHAN Jihao, et al. Determ ination of the diethylstilbestrol residues in chicken liver by gas chromatography-mass spectrometry (GC/MS)[J]. China Journal of Veterinary Medicine, 2005, 39(11): 12-14(in Chinese).
[12] 阮华,荣维广,马永建,等. QuEChERS-在线凝胶色谱-气相色谱-质谱法测定大米、黍子和小麦中34种农药残留[J]. 色谱,2013,31(12):1 211-1 217.
RUAN Hua, RONG Weiguang, MA Yongjian, et al. Determination of 34 pesticide residues in rice,proso millet and wheat with QuEChERS-online gel permeation chromatography-gas chromatography-mass spectrometry[J]. Journal of Instrumental Analysis, 2013, 31(12): 1 211-1 217(in Chinese).
[13] 林维宣,董伟峰,陈溪,等.气相色谱-质谱法同时检测动物组织中多种激素类兽药的残留量[J]. 色谱, 2009,32(3):294-298.
LIN Weixuan, DONG Weifeng, CHEN Xi, et al. Determination of hormone multi-residues in animal tissues by gas chromatography-massspectrometry[J]. Chinese Journal of Chromatography, 2009, 32(3): 294-298(in Chinese).
[14] KOESUKWIWAT U, LEHOTAY S J, MIAO S, et al. High throughput analysis of 150 pesticides in fruits and vegetables using QuEChERS and low-pressure gas chromatography-time-of-flight mass spectrometry[J]. Journal of Chromatography A, 2010, 1 217(43): 6 692-6 703.
[15] 胡雪郢,桂勇,薛丰. QuEChERS-在线凝胶渗透色谱-气相色谱/质谱法同时测定蔬菜中种常见农药残留[J].现代预防医学,2016,43(2):327-332.
HU Xueying, GUI Yong, XUE Feng. Simultaneous determination of 49 common pesticide residues in vegetables by QuEChERS-online gel permeation chromatography-GC/MS[J]. Modern Preventive Medicine, 2016, 43(2): 327-332(in Chinese).
[16] LEHOTAY S J, SON K A, KWON H, et al. Comparison of QuEChERS sample preparation methods for the analysis of pesticide residues in fruits and vegetables[J]. Journal of Chromatography A, 2010, 1 217(16): 2 548-2 560.
[17] 易江华,段振娟,方国臻,等. QuEChERS方法在食品农兽药残留检测中的应用[J]. 中国食品学报,2013,13(2):153-158.
YI Jianghua, DUAN Zhenjuan, FANG Guozhen, et al. Study of QuEChERS method for the detection of pesticide and veterinary drug residues in foods[J]. Journal of Chinese Institute of Food Science and Technology, 2013, 13(2): 153-158(in Chinese).

注:a.甲硝唑;b.己烯雌酚;c.己烷雌酚;d.己二烯雌酚;e.氯霉素;f.雌酮;g.雌二醇;h.雌三醇;i.炔雌醇附图1 空白样品加标5.0 μg/kg重构离子色谱图及质谱图Attached Fig.1 Extracted product ion chromatogram and mass spectrum of a blank sample containing of 5.0 μg/kg
Determinationof9HydroxyVeterinaryDrugResiduesinFishbyQuEChERS-GPC-GC/MS
XUE Liang-chen1, CAI Qin-ren1, ZHENG Xuan2, LIU Lu1, LING Yun-hui1, LI Zhong1, PENG Yu-fen1, CHEN Jing1, CAI De-lin1, CAI Jie1, HUANG Jing1
(1.ZhuhaiInspectionamp;QuarantineBureau,Zhuhai519015,China; 2.GuangdongInspectionamp;QuarantineBureau,Guangzhou510623,China)
A method of QuEChERS-online gel permeation chromatography gas chromatography-mass spectrometry (QuEChERS-GPC-GC/MS) was established for 9 hydroxy veterinary drug residues in fish. GPC system was adopted for online purifying pretreatment to remove most of the fat in fish so as to effectively reduce the time of sample pretreatment. At the same time, the selective ion monitoring acquisition mode could greatly reduce the interference and provide selectivity. Extracted with acetonitrile and purified by dispersive solid phase extraction method, the analytes were detected and determined under SIM scan type with tandem mass analyzer. The analytical method was well validated, and the results were obtained at the respect of precision, repeatability and spiked recovery. The detection limits of 9 hydroxy veterinary drug residues are 0.3-1.0 μg/kg with the linear range of 0.5-20.0 μg/L. The overall recoveries are between 63.5% and 90.2% with the relative standard deviations (RSDs) of 3.6%-15.4%. Finally, the validated method was carried out in total of 10 samples to evaluate 9 hydroxy veterinary drug residues, and one sample has chloramphenicol positive, and the content is 6.1 μg/kg. This method is suitable for the determination of 9 hydroxy veterinary drugs in fish.
hydroxy veterinary drug; QuEChERS; gel permeation chromatography gas chromatography-mass spectrometry (GPC-GC/MS); fish
O657.63
A
1004-2997(2017)06-0655-09
10.7538/zpxb.2016.0148
2016-09-09;
2016-09-19
2014年珠海市本级农业专项资金项目(2014ZH26);2014 年珠海出入境检验检疫局科技计划项目(ZH 2013-5)资助
薛良辰(1982—),男(汉族),广东人,硕士研究生,从事食品安全检测研究。E-mail: 171518672@qq.com
蔡勤仁(1974—),男(汉族),湖北人,高级工程师,从事食品安全检测研究。E-mail: mr.cai@vip.163.com

