云南鲷鱼皮酸溶性胶原蛋白的组成及理化特性
姚行行,庄永亮
(昆明理工大学 云南省食品安全研究院,云南 昆明,650500)
云南鲷鱼皮酸溶性胶原蛋白的组成及理化特性
姚行行,庄永亮*
(昆明理工大学 云南省食品安全研究院,云南 昆明,650500)
采用低温酸法提取云南鲷鱼皮酸溶性胶原蛋白(ASC),对ASC的氨基酸组成、亚基组成、结构特征、热稳定性以及溶解性等理化性质进行了研究,为云南鲷鱼皮的综合利用提供了理论依据。研究表明,ASC的主要氨基酸为甘氨酸、脯氨酸和丙氨酸,酪氨酸、蛋氨酸和半胱氨酸含量较低,脯氨酸的羟化率为35.47%;SDS-PAGE电泳图谱表明ASC主要由α1、α2以及β链组成,符合I型胶原蛋白的特征;ASC的最大紫外吸收波长为230 nm;红外光谱和X-射线图谱表明ASC分子排列规则紧凑,具有完整的三螺旋结构;差示热量扫描显示ASC的热变性温度分别为82.1和222.3℃,表明ASC的热稳定性较好;扫描电镜显示ASC分子呈三维的多片状结构,分布均匀,适合用作食品、药品和化妆品的载体和生物医学的基料;在pH值小于4或NaCl浓度低于40 g/L时,ASC具有良好的溶解性。
鲷鱼皮;胶原;结构;热变性温度;溶解度
胶原蛋白是动物体内含量较为丰富的一类蛋白质,是细胞外基质的结构蛋白,分子结构稳定,具有低免疫原性和良好的生物相容性,广泛地应用于食品、医药、化妆品以及生物医学等领域。近年来,我国水产养殖业和水产加工业得到了迅猛发展,鱼类加工下脚料等副产品的产量也越来越大[1],据报道,鱼类产品加工过程中,产生的下脚料占原料鱼总重的40%~55%。目前,这些下脚料未被充分利用。研究表明,鱼加工下脚料中,胶原蛋白含量非常丰富,是生产胶原蛋白的潜在来源[2]。云南鲷鱼(Oreochromissp.)养殖是云南高原特色的水产产业,云南鲷鱼主要加工成生鱼片、鱼豆腐、鱼糜等产品。鲷鱼在加工过程中产生了大量的下脚料,主要包括皮、骨、鳍等。本文主要对云南鲷鱼皮中的酸溶性胶原蛋白进行了提取纯化并评价其理化性质,拓宽了胶原蛋白的加工来源,并为促进云南鲷鱼加工下脚料的综合利用提供理论依据和数据支持。
1 材料与方法
1.1材料与试剂
云南鲷鱼皮由云南海王水产有限公司提供,加工现场收集,加冰保存带回实验室,-20℃储存备用。蛋白标品(Marker),大连宝生物工程有限公司(Takara);透析袋,武汉市盖云天生物技术有限公司(biosharp);胰蛋白酶(4 000 U/g),上海源叶生物科技有限公司。试剂均为分析纯。
1.2主要仪器与设备
L-8900氨基酸分析仪,日本日立公司;DYCZ-25E型电泳仪,北京六一生物科技有限公司;5700型傅立叶红外光谱仪,美国尼高力仪器公司;TU-1901紫外可见光光度计,北京普析通用仪器有限责任公司;DSC 214 Polyma型差示扫描量热仪,德国耐驰公司;Empyrean型X射线衍射仪,荷兰帕纳科公司;Hitachi S-4800型电子显微镜,日本日立公司。
1.3鱼皮胶原蛋白的提取
鱼皮胶原的提取采用低温酸法[1]。向鱼皮中加入0.1 mol/L的NaOH[鱼皮质量(g)∶NaOH倍液体积(mL)=1∶20,2 d,每隔12 h换液)和体积分数10%正丁醇(鱼皮质量(g)∶正丁醇(mL)=1∶20,2 d,每隔1 d换液]除去杂蛋白和脂肪,然后加入0.5 mol/L乙酸[鱼皮质量(g)∶乙酸液体积(mL)=1∶40,3 d〗提取胶原蛋白,离心(4 ℃;10 000 g,1 h),上清液用0.9 mol/L NaCl进行盐析,离心(4 ℃;10 000 g,15 min),沉淀用0.5 mol/L乙酸复溶,转入透析袋对去离子水透析2 d,冷冻干燥制备鲷鱼皮酸溶性胶原蛋白(acid soluble collagen,ASC)。
1.4氨基酸组成分析
称取一定ASC样品于水解管中,按1∶60(g∶mL)的比例加入6 mol/L HCl溶液,110 ℃条件下水解22 h。用氨基酸分析仪对ASC的氨基酸组成进行分析。
1.5SDS-PAGE
ASC的电泳方法参考文献[3]并稍作修改。取一定量的ASC样品于0.02 mol/L磷酸缓冲液中(1% SDS,3.5 mol/L 尿素,pH 7.2),100 ℃加热使其溶解(5 min),离心,上清液以体积比4∶1的比例与电泳缓冲液(4% SDS,0.5 mol/L Tris-HCl,20%甘油,含或不含10% β-巯基乙醇,pH 6.8)混合,用SDS-PAGE对ASC的亚基组成进行分析,电泳中分离胶和浓缩胶浓度分别为10%和5%。
1.6傅里叶变换红外光谱(FTIR)
取一定量的ASC样品与KBr混合碾磨(质量比=1∶200),压片后用傅立叶红外光谱仪记录ASC在400~4 000 cm-1范围内的红外吸收特征。
1.7紫外光谱吸收(UV)
取一定量的ASC样品于0.5 mol/L乙酸中,配制成3 g/L的胶原溶液,进行紫外光谱扫描,0.5 mol/L的乙酸溶液为对照,波长190~400 nm。
1.8差示扫描量热法(DSC)
以空坩埚作为对照,测定ASC在0~250 ℃的DSC图谱,升温速率为10 ℃/min。
1.9X-射线衍射(X-ray)
采用X-射线衍射仪记录ASC在5~40°(2θ)衍射图谱。线源为Cu靶Ka辐射(λ=0.154 nm),扫描速度4°/min,电压和电流分别为40 kV和40 mA。
1.10微观结构分析
采用电子扫描显微镜观察ASC的微观结构,选用放大倍数分别为200×,500×和2 000×。
1.11溶解性测定
1.11.1 pH值对ASC溶解度的影响
取20 mL ASC溶液(3 g/L)于离心管中,用6 mol/L HCl或6 mol/L NaOH调节pH值为1~10,用蒸馏水(已调至与溶液pH一致)补齐到30 mL,振荡30 min,离心(13 000 g,20 min),采用双缩脲法测定计算上清液蛋白质含量。
1.11.2 NaCl浓度对ASC溶解度的影响
取15 mL ASC溶液(6 g/L)于离心管中,等体积加入NaCl溶液使溶液盐离子的最终浓度分别为0、1、2、3、4、5、6 g/L,振荡 30 min,离心(13 000 g,20 min),采用双缩脲法测定计算上清液蛋白质含量。
1.12数据统计
用Origin 8.5版本进行数据处理以及作图,数据表达为(平均值±标准偏差)。
2 结果与讨论
2.1氨基酸组成
ASC的氨基酸组成如表1所示。ASC的甘氨酸为主要氨基酸(159.49 mg/g),符合胶原蛋白的特征;丙氨酸和谷氨酸的含量也较高,分别为72.93和69.34 mg/g。此外,ASC中甲硫氨酸、异亮氨酸、酪氨酸以及组氨酸的含量较低,半胱氨酸未检出。羟脯氨酸是胶原蛋白的特征性氨基酸,它参与胶原内部氢键的形成,其含量与胶原的变性温度呈正相关[4]。ASC中脯氨酸和羟脯氨酸的含量分别为82.79和60.60 mg/g,脯氨酸的羟化率为35.47%,与三文鱼[5]、虹鳟鱼[4]以及鳕鱼[5]等鱼皮胶原的结果相似,具有冷水鱼胶原蛋白的氨基酸组成特点。

表1 鲷鱼皮胶原蛋白的氨基酸组成 单位:mg/g
2.2SDS-PAGE分析
云南鲷鱼皮胶原蛋白的电泳图谱如图1所示。ASC主要由α1链、α2链以及β链组成。α1链含量较高,约为α2链含量的2倍;α1链中可能还含有α3链,因为α1链和α3链在SDS-PAGE胶上无法分离[6]。在α链的上方是β链,分子质量约为200 kDa,它是胶原多肽链通过共价交联作用形成的二聚体,此外,ASC的电泳图中还检测到少量的γ链。β-巯基乙醇的添加对ASC电泳结果并无影响,说明ASC中不含二硫键,这与氨基酸分析中胶原不含半胱氨酸的结果相吻合。ASC的电泳图谱特征表明,ASC属于I型胶原蛋白。
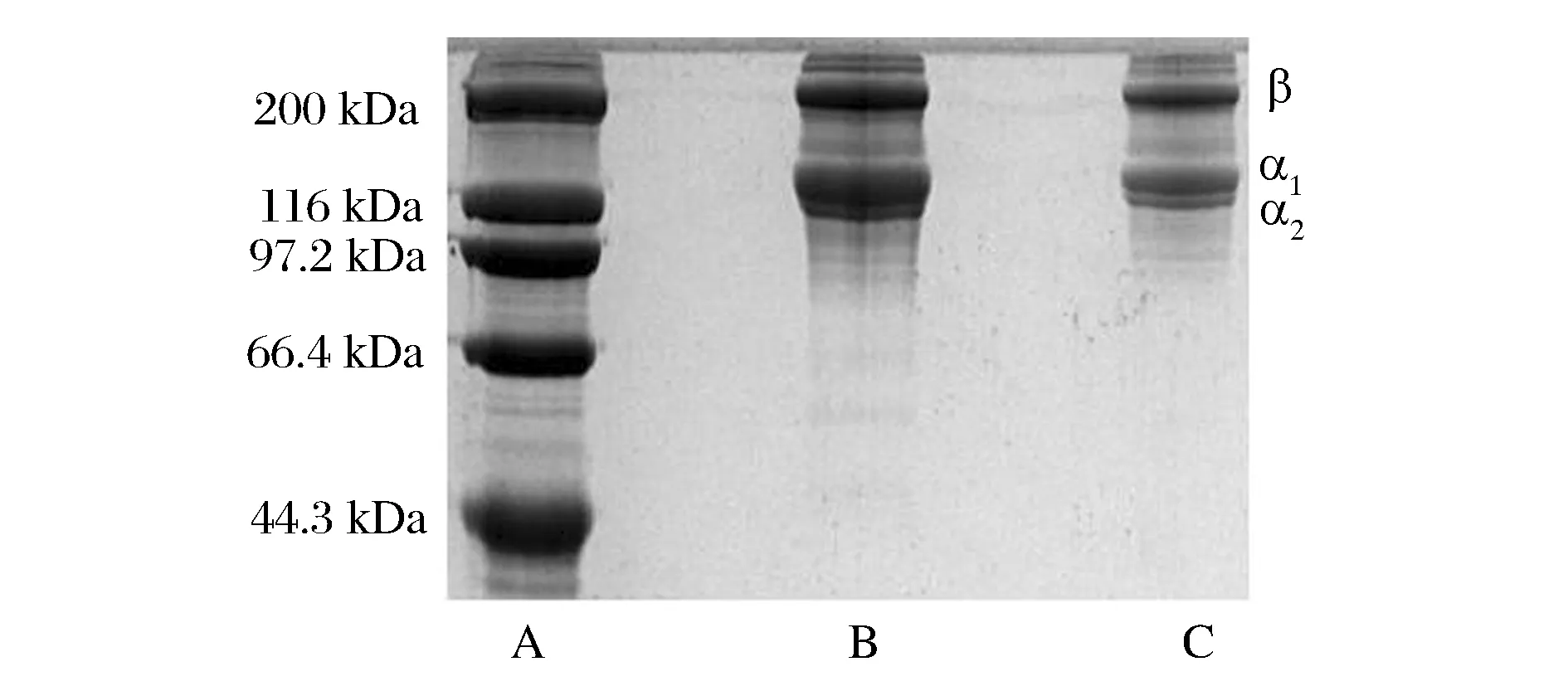
A-蛋白Marker;B-添加了β-巯基乙醇的ASC;C-没有添加β-巯基乙醇的ASC图1 鲷鱼皮胶原蛋白的 SDS-PAGE 电泳图谱Fig.1 SDS-PAGE patterns of ASC of Yunnan bream
2.3UV分析

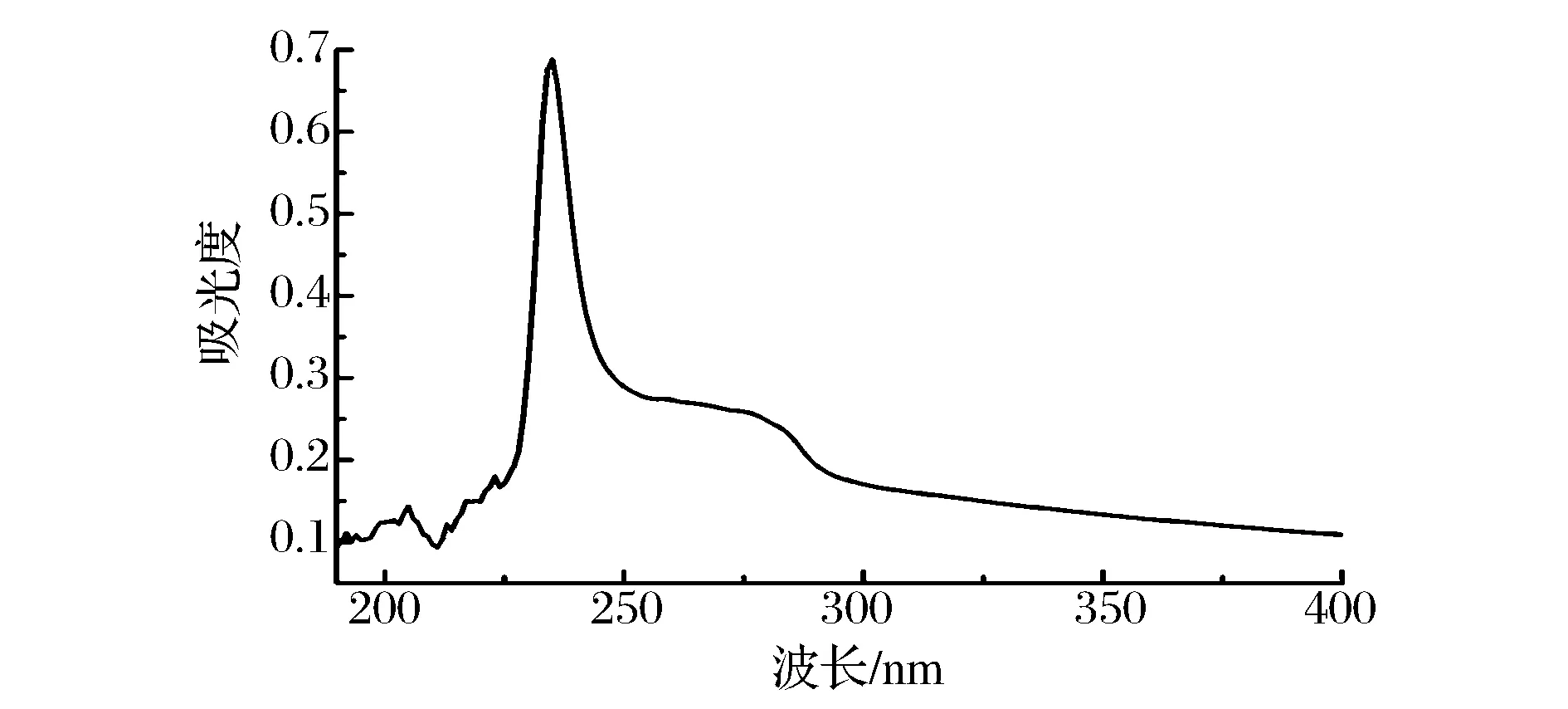
图2 鲷鱼皮胶原蛋白的紫外扫描图谱Fig.2 UV-Vis spectra of ASC of Yunnan bream
2.4FTIR分析
红外光谱是研究蛋白质构象的常用方法。胶原蛋白的红外光谱通常含有5个特征吸收峰,即酰胺A、B及Ⅰ、Ⅱ和Ⅲ带。酰胺A带归属于N—H基团的伸缩振动,其吸收峰通常位于3 400~3 440 cm-1,当它与氢键缔合程度较高时,其吸收频率会发生蓝移[7]。ASC的酰胺A带位于3 440 cm-1(图3和表2),没有发生蓝移现象,这说明ASC分子N—H基团与氢键缔合程度较低。酰胺B带的吸收峰位于2 950 cm-1,它是CH2基团的不对称伸缩振动产生的。


图3 鲷鱼皮胶原蛋白的红外光谱图Fig.3 Fourier transforms infrared spectra (FTIR) of ASC of Yunnan bream

表2 鲷鱼皮胶原蛋白主要特征峰位置极其归属
2.5X-ray分析
X-射线衍射是研究胶原蛋白内部结构的重要方法之一。如图4所示ASC有3个衍射峰,与先前研究的胡子鲶鱼皮胶原蛋白的衍射图谱相似[11]。已知X-射线的波长(λ=154 nm)和θ角,根据布拉格方程2dsinθ=λ计算各个衍射峰对应的d值,计算结果见表3。
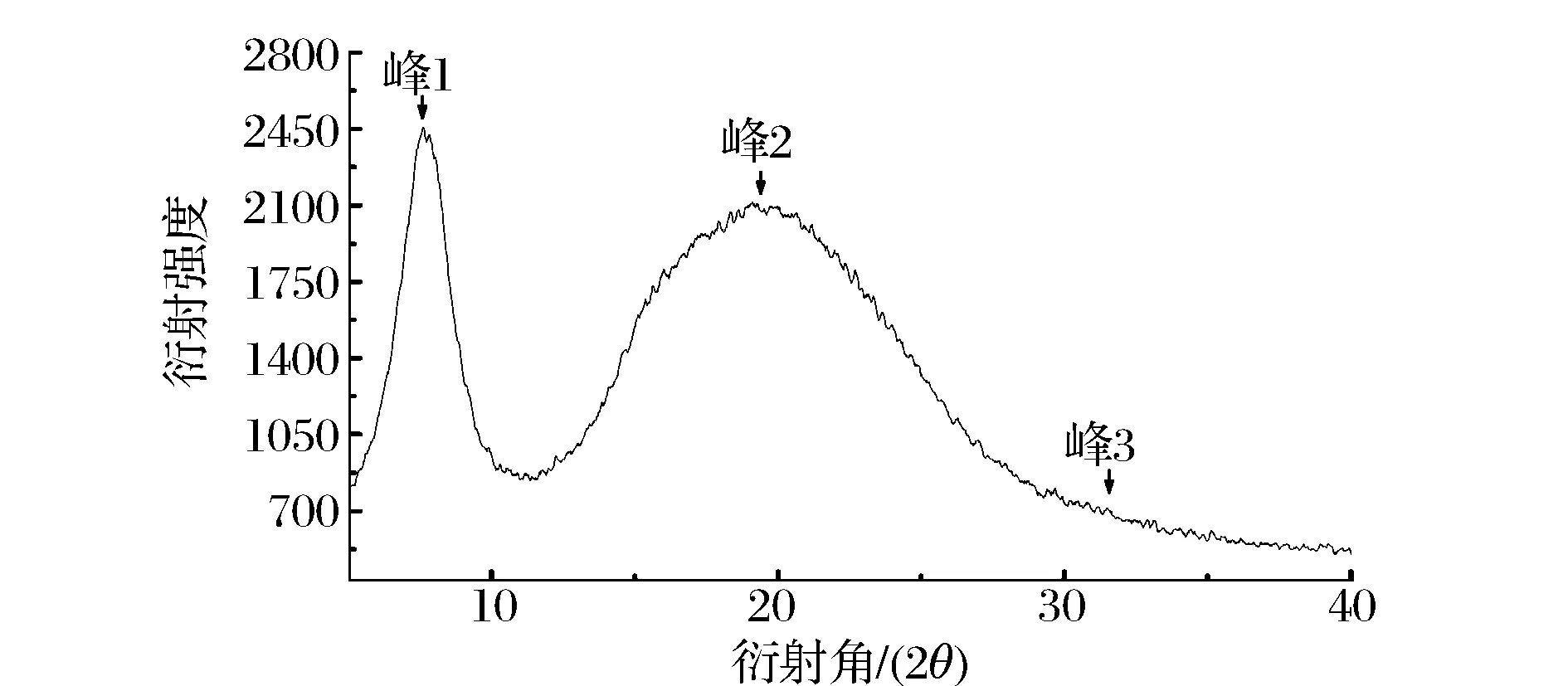
图4 鲷鱼皮胶原蛋白的X射线衍射图谱Fig.4 X-ray diffraction diagrams of ASC Yunnan bream

表3 胶原蛋白X射线衍射峰对应d值
ASC的峰1出现在7.66°处,峰型尖锐。峰1的d值代表了胶原纤维分子链间的距离[12],计算得(表3)ASC峰1的d值为0.15 nm,略小于先前报道的罗非鱼皮和鱼鳞胶原蛋白的d值[12],说明ASC分子间的距离较小,排列规则紧密。峰2是一个宽且大的馒头峰,出现在19.11°处,该峰反映了胶原蛋白内部复杂结构层次所引起的漫散射;峰3峰型较小,出现在31.16°处,峰3的d值可反映胶原螺旋中心轴上相邻两个氨基酸残基间的距离。根据文献描述[13],在胶原蛋白的三螺旋结构中,螺旋中心轴上相邻氨基酸残基间的距离为0.29 nm,这与ASC峰3的d值一致。以上结果表明,低温酸法提取后的鲷鱼皮胶原蛋白仍然较好的保持了其原有的结构。
2.6DSC分析
DSC是一种通过测定样品热焓变化来研究物质结构变化的热分析技术,广泛应用于蛋白质的热变性研究领域。ASC的DSC图谱如图5所示。
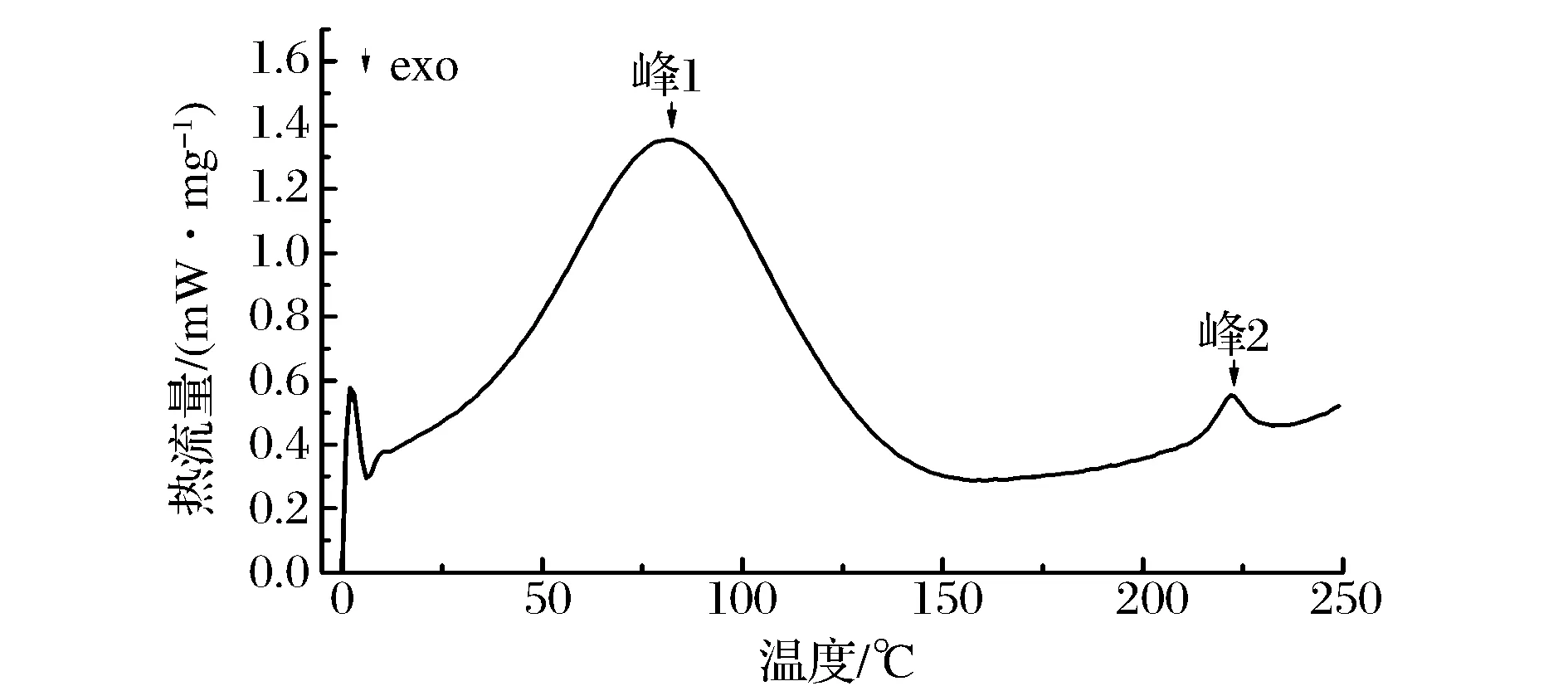
图5 鲷鱼皮胶原蛋白的DSC图谱Fig.5 DSC thermogram of ASC of Yunnan bream
ASC在0~250℃共有2个热吸收峰(峰1和峰2)。第一个吸收峰的变性温度为82.1℃(T1),它是胶原三螺旋结构的降解以及水分子的释放引起的[14];第二个峰的变性温度为222.3℃(T2),它是胶原蛋白交联部分结构改变、蛋白质结构完全破坏时的熔融温度[14]。鲷鱼皮胶原蛋白的热变性温度略高于北梭鱼胶原的热变性温度(T1=80.1℃,T2=203.1℃)[15],表明ASC具有较好的稳定性。胶原的热变性温度主要与胶原的水分含量,氨基酸组成,提取方法以及栖息地温度有关[15]。
2.7微观结构分析
胶原蛋白的显微结构是胶原工业应用重要参数。ASC放大200×、500×以及2 000×后的电镜扫描如图6所示。在低倍镜下(200×和500×),ASC呈三维立体的多层状空间结构,由片状的胶原纤维相互交联而成,分布规则且均匀;在高倍镜下(2 000×),ASC呈薄膜状,表面光滑且质密,无褶皱和折叠现象。ASC的微观结构特点与先前报道的银鳍鲛鲨的微观结构相似[16],适合用作食品、药品、化妆品和保健品的载体以及生物医学材料的基料。

a-200×;b-500×;c-2000×图6 鲷鱼皮胶原蛋白的扫描电镜图像Fig.6 Scanning electron microscopic images of ASC of Yunnan bream
2.8溶解性分析
2.8.1 pH值对胶原溶解度的影响
ASC在pH 1~10条件下的相对溶解度如图7所示。在酸性范围内,ASC的溶解度较大,在pH 4时达到最大值;继续增大溶液的pH值,胶原的溶解度剧烈下降,在pH 7时ASC的溶解度最低,总体呈现先升高后下降再略有回升的趋势。胶原蛋白的溶解性与其等电点密切相关。在等电点附近,胶原静电荷为零,蛋白相互聚集而沉降,因而溶解度较小;偏离等电点,胶原静电荷增大,分子间分散性较好,因而溶解度较大[17]。
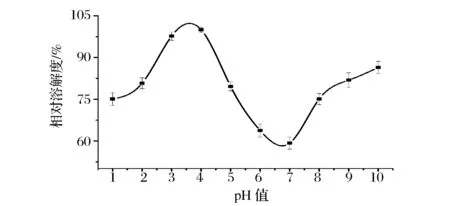
图7 pH值对胶原溶解度的影响Fig.7 The effects of pH on the solubility of ASC of Yunnan bream
2.8.2 NaCl浓度对胶原溶解度的影响
图8表示ASC在不同NaCl浓度下的溶解度变化。ASC在NaCl浓度为0~4%时有较好的溶解性;当盐离子浓度大于4%后,ASC的溶解性随离子强度浓度的增大而明显下降。蛋白质的溶解性的变化是盐溶和盐析反应共同作用的结果。在低浓度时,盐离子能与胶原结合,使胶原分子所带正电荷的增加,分子间相互排斥,稳定了蛋白质的结构,因而溶解度越大;当盐浓度较高时,盐离子能与蛋白分子周围的水分子结合,破坏了蛋白质水化膜,使蛋白质脱水而析出,导致溶解度的降低[18]。
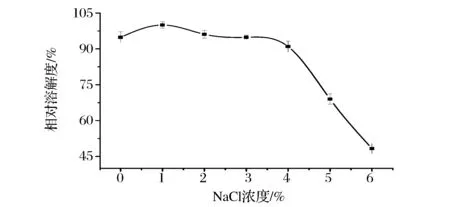
图8 NaCl浓度对胶原溶解度的影响Fig.8 The effects of NaCl concentrationson the solubility of ASC of Yunnan bream
3 结论
本文对鲷鱼皮中的酸溶性胶原蛋白进行了提取,并测定了其理化性质。结果表明,鲷鱼皮胶原蛋白为I型胶原蛋白,脯氨酸羟化率为35.47%;红外光谱和X-射线衍射图谱表明ASC分子排列紧凑,保持了完整的三螺旋结构;DSC显示ASC的变性温度分别为82.1和222.3 ℃,热稳定性较好;ASC分子呈三维的多片状结构,分布均匀;在pH值小于4和NaCl浓度低于40 g/L时,ASC的溶解性较好。综上所述,鲷鱼皮是较好的水产类胶原蛋白来源,在功能性食品、化妆品、医药、制药等行业有潜在的商业应用。
[1] 陈明辉, 汤海青, 欧昌荣,等. 鲟鱼皮胶原蛋白的理化特性研究[J].现代食品科技, 2015, 31(12): 191-196.
[2] 庄永亮, 侯虎, 林琳. 鱼皮鱼骨胶原肽制备及生物活性研究[M].北京:科学出版社, 2015:1.
[3] TAMILMOZHI S, VEERURAJ A, ARUMUGAM M. Isolation and characterization of acid and pepsin-solubilized collagen from the skin of sailfish (Istiophorusplatypterus)[J].Food Research International, 2013, 54(2): 1 499-1 505.
[4] 张治国, 肖朝耿,唐宏刚,等. 虹鳟鱼皮胶原蛋白提取及其性质研究[J].中国食品学报, 2015, 15(8): 148-154.
[5] ARNESEN J A, GILDBERG A. Extraction and characterisation of gelatin from Atlantic salmon (Salmosalar) skin[J].Bioresource Technology, 2007, 98(1): 53-57.
[6] NALINANON S, BENJAKUL S, KISHIMURA H, et al. Type I collagen from the skin of ornate threadfin bream (Nemipterushexodon): Characteristics and effect of pepsin hydrolysis[J].Food Chemistry, 2011, 125(2): 500-507.
[7] DOYLE B B, BENDIT E G, BLOUT E R. Infrared spectroscopy of collagen and collagen-like polypeptides[J].Biopolymers, 1975, 14(5): 937-957.
[8] 段蕊, 张俊杰, 陈玲,等. 鲤鱼鱼皮和鱼骨酶溶性胶原蛋白的性质比较[J].食品与发酵工业, 2008, 34(5): 10-13.
[9] 叶韬, 林琳, 张晓霞,等. 罗非鱼骨胶原蛋白质的提取及其性质[J].食品与生物技术学报, 2015(3): 302-310.
[10] 万琼红, 党美珠, 曾建成,等. 几种淡水鱼鱼鳞酶溶性胶原蛋白的比较研究[J].食品科学, 2009, 30(19): 28-31.
[11] 李八方, 郭鸣, 侯虎,等. 胡子鲶鱼皮酸溶性胶原蛋白的理化性质研究[J].现代食品科技, 2013, 29(11): 2 580-2 585.
[12] CHEN JUN-DE, LI LONG, YI RUI-ZAO, et al. Extraction and characterization of acid-soluble collagen from scales and skin of tilapia (Oreochromisniloticus)[J].Food Science and Technology, 2015, 66: 453-459.
[13] EYRE D R. Collagen: molecular diversity in the body's protein scaffold[J].Science, 1980, 207(4437): 1 315.
[14] SIONKOWSKA A, KOZOWSKA J, SKORUPSKA M, et al. Isolation and characterization of collagen from the skin of Bramaaustralis[J].International Journal of Biological Macromolecules, 2015, 80: 605-609.
[15] KOZLOWSKA J, SIONKOWSKA A, SKOPINSKA-WISNIEWSKA J, et al. Northern pike (Esoxlucius) collagen: Extraction, characterization and Potential application[J].International Journal of Biological Macromolecules, 2015, 81: 220-227.
[16] JEEVITHAN E, WU Wen-hui, WANG Nan-ping, et al. Isolation, purification and characterization of pepsin soluble collagen isolated from silvertip shark (Carcharhinusalbimarginatus) skeletal and head bone[J].Process Biochemistry, 2014, 49(10): 1 767-1 777.
[17] INWOO B, KIYOSHI O, ASAMI Y, et al. Biochemical properties of acid-soluble collagens extracted from the skins of underutilised fishes[J].Food Chemistry, 2008, 108(1): 49-54.
[18] VEERURAJ A, ARUMUGAM M, BALASUBRAMANIAN T. Isolation and characterization of thermostable collagen from the marine eel-fish (Evenchelysmacrura)[J].Process Biochemistry, 2013, 48(10): 1 592-1 602.
CompositionandphysicochemicalpropertiesofacidicsolublecollagenofYunnanbreamskin
YAO Hang-hang, ZHUANG Yong-liang*
(Yunnan Institute of Food Safety, Kunming University of Science and Technology, Kunming 650500, China)
The acidic soluble collagen (ASC) from the skin of Yunnan bream was extracted. The amino acids composition, subunit composition, structural characteristics, thermal stability and solubility were investigated. Research showed that ASC was rich in Gly, Pro, Ala, low in Tyr, Met, Cys, and the hydroxylation rate of proline was 35.47%; SDS-PAGE revealed that ASC was mainly composed of α1、α2and β chains, which was in accordance with the structural features of type I collagen. The maximum UV absorption wavelength was at 230 nm; XRD and FTIR showed that the molecule of ASC was closely and regularly arranged and the helical structure was maintained. DSC showed the thermal denaturation temperature of ASC were 86.5 and 226.2℃; SEM showed that ASC was uniformly distributed and had a multi-layered micro structure, which was suitable to be used as a carrier in food, medicine, cosmetics industry and base material in biomedicine. The solubility of ASC was relatively high under acidic (pHlt;4) and low with NaCl concentration (lt;4% (w/v)). This paper provides a theoretical basis for the comprehensive utilization of Yunnan bream skin.
bream skin; collagen; structure; thermal denaturation temperature; solubility
10.13995/j.cnki.11-1802/ts.014288
硕士研究生(庄永亮教授为通讯作者,E-mail:km ̄ylzhuang@163.com)。
国家自然科学基金(31360381)
2017-03-13,改回日期:2017-05-22

