盐胁迫下不同抗性砧木杂交F1代株系渗透调节物质分析探究
付晴晴,谭雅中,翟衡,王军伟,杜远鹏*
(1. 山东农业大学园艺科学与工程学院/作物生物学国家重点实验室,山东泰安 271018;2. 史丹利化肥宁陵公司,河南商丘 476700)
总目次
盐胁迫下不同抗性砧木杂交F1代株系渗透调节物质分析探究
付晴晴1,谭雅中1,翟衡1,王军伟2,杜远鹏1*
(1. 山东农业大学园艺科学与工程学院/作物生物学国家重点实验室,山东泰安 271018;2. 史丹利化肥宁陵公司,河南商丘 476700)
为研究耐盐能力不同的葡萄砧木在盐胁迫下的渗透调节响应,以引进砧木中耐盐性较强的砧木1103P为标准参照,对左山一×SO4杂种砧木F1代的6个株系(A15、A17、A34、A35、A38、A48)和左山一×101-1杂种F1代2个株系(B24、B26)的盆栽一年生扦插苗进行100 mmol/L NaCl胁迫处理,21 d后测定叶片和根系的丙二醛含量以及植株相对含水量、叶片相对电导率、根系活力及可溶性糖、甜菜碱、脯氨酸。结果表明,A15、A17、A34和A35盐胁迫21 d后植株含水量降低幅度与对照没有显著差异,叶片相对电导率、叶片和根系MDA含量增加幅度较小,根系活力降低幅度较小,叶片和根系中渗透调节物质含量均升高,可溶性糖对渗透调节的贡献均达到了96%以上,但盐胁迫后甜菜碱及脯氨酸的增加量较多,分别比对照升高了43.72%和50.98%。各指标相关分析进一步说明耐盐能力强的砧木与保持较高有机渗透物质密切相关。
葡萄砧木;杂交株系;耐盐性;渗透调节物质
西北干旱、半干旱地区是我国葡萄生产的重要产区,随着集约化栽培面积的扩大,盐渍化土壤造成的葡萄生理障碍问题越来越明显,这与该地区普遍采用的抗寒砧木品种贝达[1]容易缺铁黄化有关。在国外常用的抗根瘤蚜砧木中,只有1103P具有较强的耐盐性[2],但其耐盐碱能力仍然低于西北地区的土壤盐碱水平,不能满足葡萄正常生产的需求。葡萄砧木育种的首要目标是抗根瘤蚜,第二位的目标是栽培技术难以克服的逆境因素,如抗盐碱,培育耐盐性强的抗根瘤蚜砧木是我国葡萄砧木育种的重大课题,但目前该领域的研究获突破还很少。本实验室前期利用左山一为母本分别与砧木SO4和101-1杂交出抗根瘤蚜砧木,并完成了这些砧木的耐盐性筛选[3],其中A34、A35、A15和A17株系的耐盐性较强,A38、A48和B24的耐盐性中等,1103P和B26耐盐性较弱。
高盐环境中的渗透胁迫是植物遭受盐害的主要原因之一,植物生长的基质中盐浓度过高会对植物造成渗透胁迫,引起活性氧(ROS)代谢失调[4],进而引起丙二醛(MDA)的升高,破坏细胞膜系统的完整性;过低的基质水势使植物吸水困难,影响植株的正常生长和发育[5]。长期的盐渍环境使植物形成了抵御渗透胁迫的有效机制[6],当植物遭受渗透胁迫时,通常体内会主动合成有机小分子物质等来提高细胞液的浓度、降低渗透势,进而维持植物对外界水分的吸收,减少或避免渗透胁迫对植物造成的伤害,植物这种主动通过渗透调节而适应胁迫环境的行为被称为渗透调节作用[7]。渗透胁迫作用是植物应对渗透胁迫环境最主要的方式和途径[8]。本研究旨在探讨抗盐能力不同的砧木在盐胁迫下的渗透调节物质的响应,揭示杂交砧木的耐盐机理。
1 材料与方法
1.1 试验材料与设计
试验于2016年6~7月在山东农业大学南校区葡萄园避雨棚内进行,试验材料为左山一×SO4杂种F1代的6个株系(A15、A17、A34、A35、A38和A48);左山一×101-1杂种F1代的2个株系(B24、B26),以引进砧木中耐盐性较强的1103P品种为标准参照。试材种植于园土、沙、基质比例2∶1∶1的花盆(直径17 cm、高25 cm)中,每盆一株,待长至8~10片完全展开叶时,选用长势一致的苗子进行100 mmol/L NaCl处理,各株系以浇清水为对照,每隔3 d于下午5∶00~6∶00进行浇灌,每盆浇1000 mL,浇至从盆底外流。在第21天取样,完整取出各处理植株,用去离子水冲洗3遍,并用滤纸擦拭干净称重,将各植株根、茎和叶分开,取部分鲜样进行叶片电导率、叶片和根系MDA含量和根系活力测定。剩余样品装入信封,105 ℃杀青20 min,然后80 ℃下烘至恒重,用磨样机磨碎备用,每个处理3株。
1.2 测定项目与方法
采用赵世杰等[9]方法进行相对电导率的测定;根系活力采用2,3,5-氯化三苯基四氮唑(TTC)染色法测定;MDA含量采用硫代巴比妥酸(TBA)比色法测定[9];参照Yemm等[10]采用蒽酮法测定可溶性糖含量;甜菜碱含量按照Grattan等[11]方法测定;脯氨酸含量参照Bates等[12]用茚三酮法测定。
1.3 数据处理及统计分析
1.3.1 植株相对含水量的计算
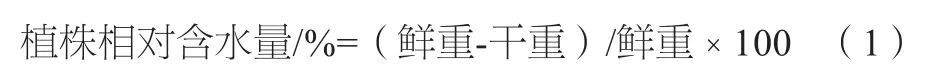
1.3.2 各株系叶片和根系计算渗透势

式中i为溶液中溶质的活度系数,c为质量摩尔浓度,R为气体常数,T为绝对温度,计算叶片和根系各种有机渗透调节物质的渗透势,即为计算渗透势(COP)。将所得各有机渗透调节物质的COP分别相加,即为有机渗透调节物质的计算渗透势(COPOO)。
各有机渗透调节物质对渗透势的贡献:
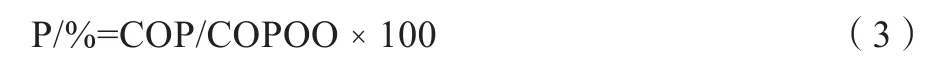
1.3.3 各指标的耐盐系数[14]

1.3.4 数据分析
采用Excel 2013软件处理数据和制图,采用DPS软件进行方差分析,多重比较用的LSD法进行差异显著性检验。显著水平P<0.05,P<0.01。
2 结果与分析
2.1 盐胁迫对植株含水量和叶片电导率的影响
盐胁迫21 d后各供试材料的植株含水量均降低,但耐盐性较强的A15、A17、A34、A35株系处理21 d后植株含水量与对照没有显著差异;其他植株含水量下降明显,1103P、A38、A48、B24和B26含水量分别降低了12.6%、8.21%、5.38%、8.52%和15.43%(图1)。100 mmol/L NaCl胁迫处理导致各株系葡萄叶片相对电导率呈现不同程度的升高,但A15、A17、A34和A35等耐盐性较强株系的升高幅度较小,叶片相对电导率比对照分别升高了58.75%、58.28%、15.40%和51.42%,而耐盐性较弱的1103P和B26的升高幅度较大,比对照分别升高了193.26%、219.2%。
2.2 盐胁迫对叶片和根系MDA含量的影响
由图2可以看出,100 mmol/L NaCl胁迫处理导致各株系葡萄叶片和根系MDA含量呈现不同程度的升高,以A15、A17、A34和A35叶片升高幅度较小,MDA含量分别比对照升高了9.56%、35.56%、12.19%和15.28%,而1103P和B26的升高幅度较大,叶片MDA含量分别比对照升高了84.68%、164.42%;A15、A34和A35根系中的MDA含量较对照增加幅度较小,且未达到差异显著水平。而1103P、B24和B26根系中的MDA含量的升高幅度较大,比对照分别增加了56.82%、72.77%和66.87%。
2.3 盐胁迫对根系活力的影响
100 mmol/L NaCl胁迫显著降低了各株系葡萄的根系活力(图3),与对照相比,A15、A17、A34、A35和A3的降低幅度较小,分别比对照降低了34.26%、29.13%、33.59%、36.14%和37.36%,1103P、A48、B24和B26分别比对照降低了59.44%、43.07%、41.70%和72.87%。
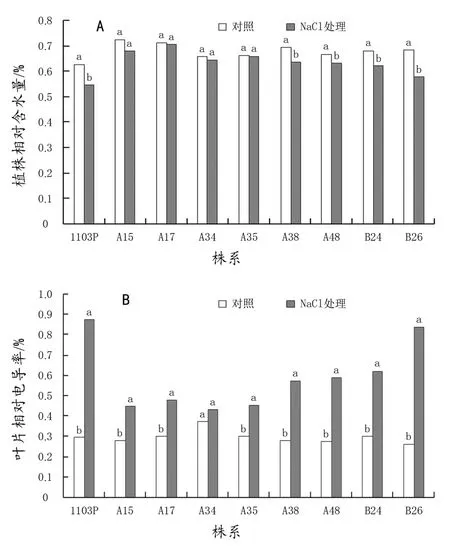
图1 盐胁迫对植株相对含水量(A)和叶片相对电导率(B)的影响
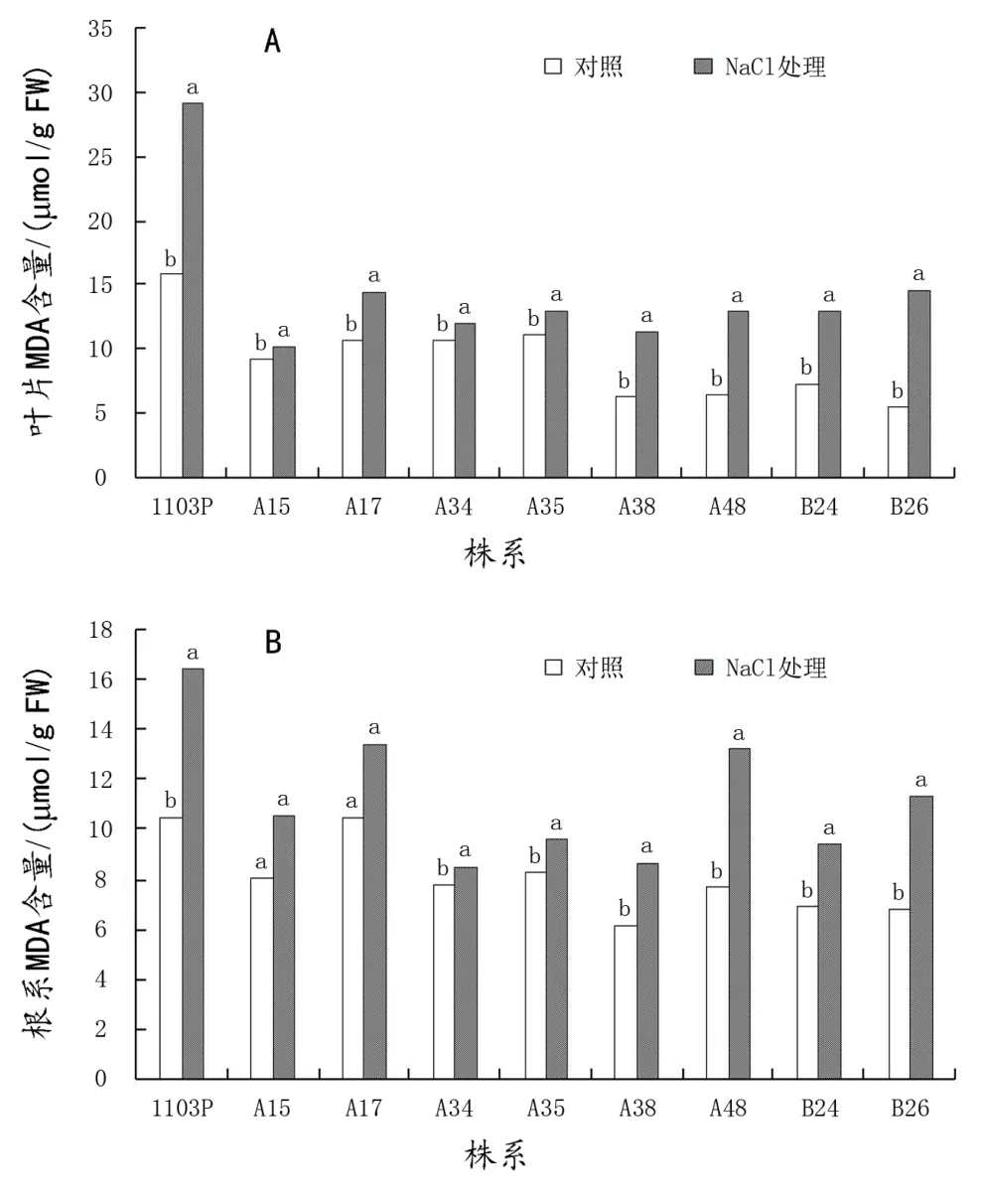
图2 盐胁迫对叶片MDA含量(A)和根系MDA含量(B)的影响
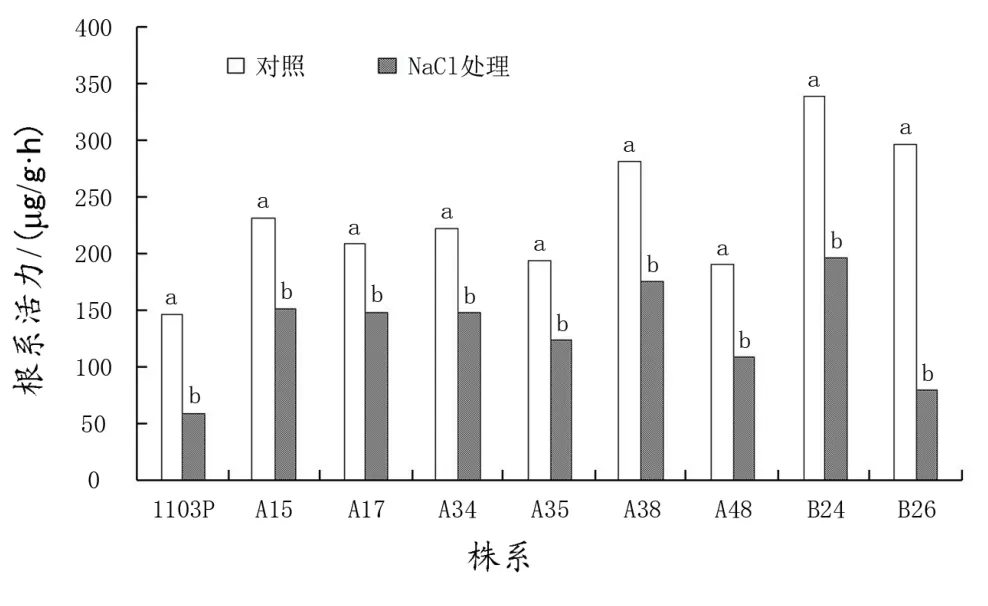
图3 盐胁迫对根系活力的影响
2.4 盐胁迫对叶片和根系渗透调节物质含量和组分的效应
100 mmol/L NaCl处理不同程度的增加了各株系葡萄叶片和根系的可溶性糖、甜菜碱和脯氨酸含量,并且同一株系的叶片或根系中的各有机渗透调节物质的含量也表现各异(表1),盐胁迫下三种渗透调节物质中以甜菜碱和脯氨酸增加量较多,各株系叶片中的甜菜碱均增加显著,其中以1103P、A15、A17和B24叶片中甜菜碱增加较多,A15、A34和A35根中甜菜碱显著增加,分别是对照的1.30倍、1.45倍和1.47倍;叶片中脯氨酸含量较多的株系分别是A15、A34、A35、A38和B24、A15、A17、A34、A35和B24的根中脯氨酸含量较其他株系含量高;胁迫后叶片中可溶性糖含量显著提高的株系为1103P、A34、A35,同时,除B26株系外,其余各株系根系可溶性糖均显著增加,并且以A15、A17、A34和A35根系中可溶性糖含量提高较多。
利用公式(2)可以得出叶片和根系的计算渗透势,并根据公式(3)计算出各有机渗透调节物质对渗透势的贡献。由表2可以看出,100 mmol/L NaCl处理下叶片和根系有机渗透调节物质的渗透势出现不同程度的降低,并且1103P、A34和A35叶片中的渗透势降低幅度较大,A15、A17、A34和A35根系中的渗透势降低幅度较大,各株系渗透势的降低,增加了叶片及根系的渗透压,有利于抵抗外界的高盐环境。比较可溶性糖、甜菜碱和脯氨酸等有机渗透调节物质在叶片和根系中贡献率发现,胁迫前后均以可溶性糖对渗透调节的贡献率最高,均达到了96%以上,其次是甜菜碱,渗透调节作用最小的是脯氨酸。但是盐胁迫之后的可溶性糖含量增加较少,对渗透势的贡献率比对照略有降低,而甜菜碱和脯氨酸对渗透势的贡献均高于对照。
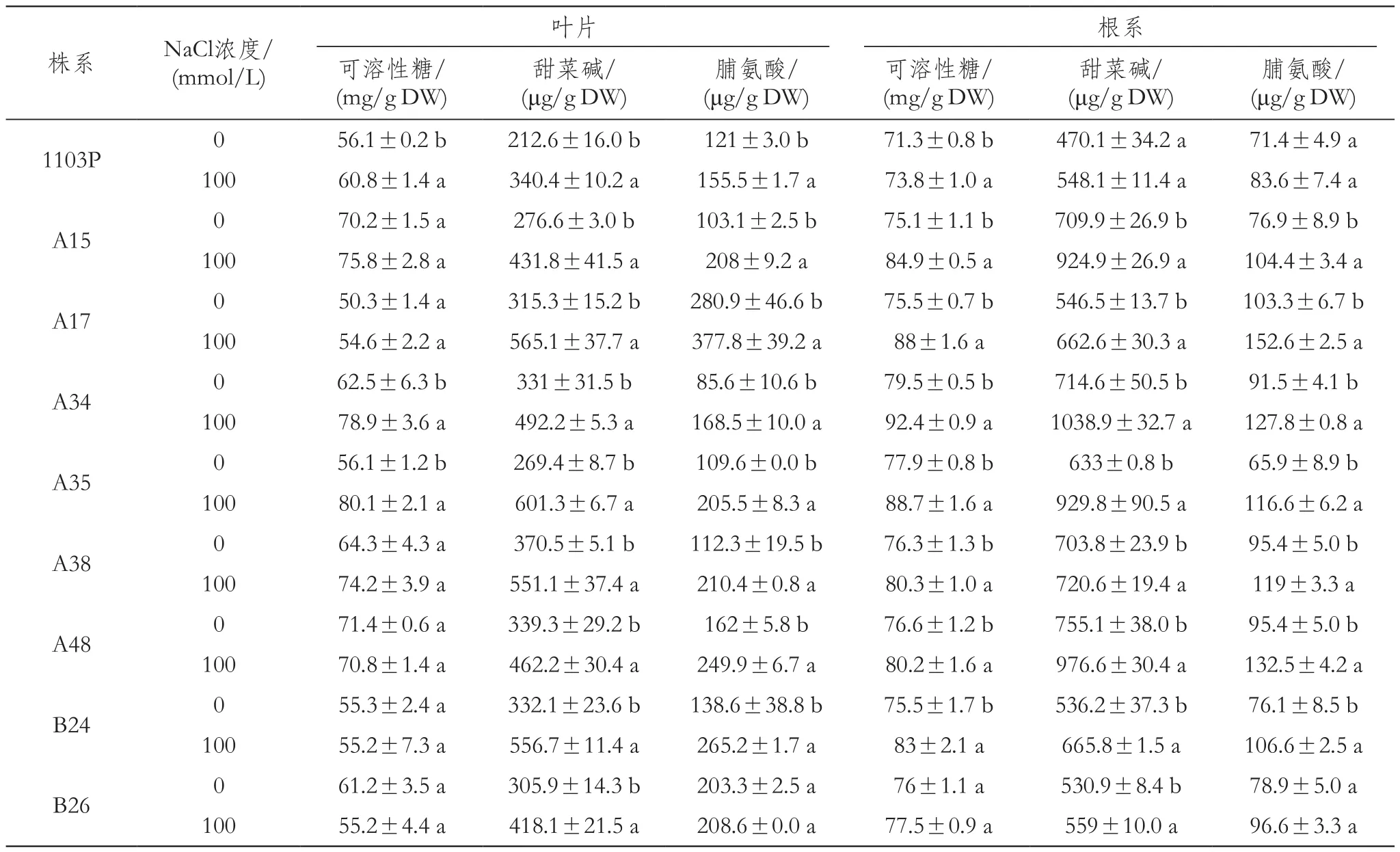
表1 盐胁迫对葡萄叶片和根系渗透调节物质含量的影响
2.5 盐胁迫下各指标相关系数分析
通过光合荧光参数、各生物量等指标对盐胁迫下葡萄种间杂交砧木F1代株系的耐盐性进行鉴定[3],得到各株系在盐胁迫条件下的耐盐性综合评价值D(表3)。
为了更直观的比较和分析各株系细胞膜系统和有机渗透调节物质对NaCl胁迫的响应,根据公式(4)计算出各株系各指标的耐盐系数(表4)。
将各指标耐盐系数进行相关性分析,得到结果如表5,相关系数的大小能够反映一个指标与另一个指标间的间接作用的大小[15]。表中显示植株相对含水量、叶片相对电导率、叶片和根系MDA含量以及根系活力与各株系在盐胁迫条件下的耐盐性综合评价值D呈极显著相关关系,并且与有机渗透调节物质是有一定相关性的。说明植株细胞膜系统完整性与耐盐性是密切相关的,另外植株相对含水量与根系可溶性糖、甜菜碱和脯氨酸含量呈显著性正相关关系;叶片相对电导率与叶片甜菜碱含量呈明显的负相关关系;叶片MDA含量与叶片可溶性糖和甜菜碱含量呈显著性负相关关系,说明叶片可溶性糖和甜菜碱对叶片膜质过氧化产物的降低有明显的间接作用;而根系可溶性糖含量对根系MDA含量和根系的活力的贡献达到了极显著水平,说明根系中可溶性糖等在盐胁迫中对根系起到明显的保护作用。

表2 葡萄叶片和根系的计算渗透势和有机渗透调节物质对渗透势的贡献率

表3 各株系耐盐性综合评价值

表4 盐胁迫下各株系各指标的耐盐系数
3 讨论与结论
葡萄栽培品种是耐盐性较强的果树,可耐受0.35%左右(约60 mmol/L)NaCl[16]。新疆盐渍土0~30 cm土层的含盐量达2.2%~24%,北疆以硫酸盐为主,南疆以氯化盐为主[17]。生产上常用砧木均不能满足当地土壤要求,土壤盐分过高导致土壤溶质浓度过大,外界渗透势的降低导致植物根系水势下降,植物体内水分亏缺造成大量活性氧产生,由氧化胁迫破坏细胞膜系统的完整性[18],进而对植物体内各种代谢途径造成影响。
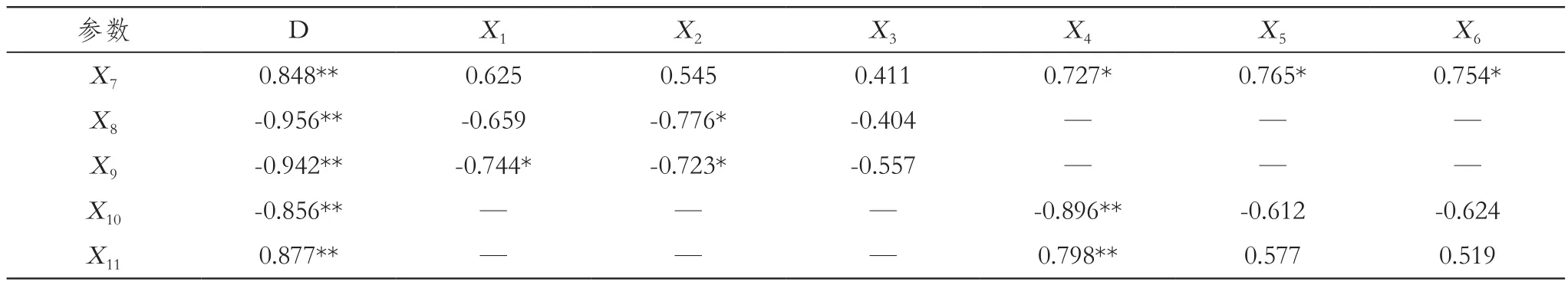
表5 盐胁迫下各指标相关系数分析
盐胁迫造成的渗透胁迫[19]不仅包括盐分胁迫,还包括水分胁迫,两者都会造成植物吸水受限,进而导致膜系统的完整性受到破坏和电导率增加,根系活力下降。本试验发现100 mmol/L NaCl处理后,植株的相对含水量呈下降趋势(图1),耐盐性强的砧木株系A15、A17、A34和A35的叶片和根系的MDA含量较少,较好的维持膜系统的完整性,电解质外渗少,能够保持较低的相对电导率和较高的根系活力,维持较高的植株含水量,而1103P和B26盐胁迫后植株含水量受到显著影响,电导率和MDA含量显著升高,根系活力显著降低。
在盐胁迫环境下,植物通常会通过从体外吸收、积累无机盐和在体内合成有机物质进行渗透调节降低体内的渗透势,以维持植株对环境中水分的吸收,减少或避免渗透胁迫对植物造成的伤害[20]。有研究表明,盐胁迫下植物积累的小分子有机渗透调节物质能被排泄到核酸、蛋白质等生物大分子的水化膜外层,对稳定大分子空间构象起到重要作用,而这是无机离子无法替代的[21]。有机渗透调节物质主要包括可溶性糖、甜菜碱和脯氨酸等一些分子量低的细胞相容性物质[22],其积累量和植物遭受渗透胁迫的强度密切相关[23],是植物适应盐胁迫环境来维持细胞渗透压和生理功能的重要组成部分。因此,盐胁迫条件下各葡萄株系体内积累有机渗透调节物质可能也具有保护生物大分子物质和维持植物各项生理功能的作用[24]。
植物对逆境胁迫的渗透调节作用既有共性特征,也存在差异性,其差异性主要表现在不同的植物积累的渗透调节物质的种类不同,并且同一渗透调节物质在不同植物的渗透调节作用中的贡献大小也各有差异[25]。其中可溶性糖即作为渗透调节物质在逆境中起作用,还可以提供碳架用于蛋白质合成,另外还可间接转化成脯氨酸等[26];甜菜碱不仅能够提高盐胁迫条件下活性氧清除酶的活性[27],还可以诱导植物体内可溶性糖、脯氨酸和可溶性蛋白等含量增加,进而提高渗透调节能力,降低对细胞内大分子蛋白的伤害[28],能够维持膜系统的完整性[29];可溶性糖和脯氨酸还能够清除细胞的自由基以及稳定亚细胞结构等对植物起到直接保护作用[30],脯氨酸含量在盐胁迫条件下能够迅速增加,其起到的直接保护作用要远大于渗透调节作用[31]。本试验发现,100 mmol/L NaCl胁迫处理下各葡萄株系叶片和根系中的可溶性糖、甜菜碱和脯氨酸含量等有机渗透调节物质均表现升高的趋势,耐盐性较强的A34和A35的叶片和根系的渗透势降低幅度均较大,表明在此强度胁迫条件下有机渗透调节物质在A34和A35中可能发挥着更为重要的渗透调节作用;A15和A17根系的渗透势降低幅度较大,但叶片中渗透势与对照并未表现出明显差异,这可能与无机离子对叶片的渗透势具有较明显的贡献有关[32]。
在盐胁迫后的渗透调节物质中,可溶性糖虽然升高幅度较小,但对渗透调节的贡献均达到了96%以上,表明可溶性糖是增加渗透性溶质的重要组成成分,在盐逆境胁迫下葡萄株系可通过促进可溶性糖的积累维持细胞内较低的渗透势,发挥了重要的渗透调节作用。甜菜碱和脯氨酸含量虽然较低,但与耐盐能力呈显著性正相关[33],盐胁迫下三种渗透调节物质中以甜菜碱和脯氨酸增加幅度较大,无论叶片还是根系,耐盐性强的株系甜菜碱和脯氨酸含量均比耐盐性差的株系高,表明甜菜碱和脯氨酸是响应最为敏感的渗透调节物质,对维持细胞内外的渗透平衡,对维持细胞正常的生理功能起到重要作用[34]。本研究表明,在盐胁迫下葡萄植株中可溶性糖、甜菜碱以及脯氨酸可以改善葡萄植株内的渗透调节能力,渗透调节物质的积累也是耐盐性强的葡萄株系的体现和重要原因,可溶性糖是渗透调节物质的主要成分,而甜菜碱和脯氨酸是反应最为敏感的渗透调节物质。
[1] 杜远鹏, 晋学娟, 郭淑华, 等. 不同盐碱类型胁迫对红地球/贝达葡萄植株离子分布的影响[J]. 应用生态学报, 2015(6): 1801-1806.
[2] GALET P. Precis de pathologie viticole[M]. 6th Edition. 1991: 285.
[3] 付晴晴, 孙鲁龙, 翟衡, 等. 葡萄种间杂交砧木育种F1代植株耐盐性分析[J]. 植物学报 (已录用)
[4] KANAZAWA S, SANO S, KOSHIBA T, et al. Changes in antioxidative enzymes in cucumber cotyledons during natural senescence: comparison with those during dark-induced senescence[J].Physiologia Plantarum, 2000(2): 211-216.
[5] BLUMWALD E, AHARON G S, APSE M P. Sodium transport in plant cells[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes,2000(1): 140-151.
[6] XIONG L, ZHU J K. Molecular and genetic aspects of plant responses to osmotic stress[J]. Plant, Cell amp; Environment, 2002(2): 131-139.
[7] MARTÍNEZ-BALLESTA M C, MARTÍNEZ V, CARVAJAL M.Osmotic adjustment, water relations and gas exchange in pepper plants grown under NaCl or KCl[J]. Environmental amp; Experimental Botany,2004, 52(2):161-174.
[8] ZHU J K. Plant salt tolerance[J]. Trends in Plant Science, 2001(2):66-71.
[9] 赵世杰, 史国安, 董新纯. 植物生理学实验指导[M]. 北京: 中国农业科学技术出版社, 2002.
[10] YEMM E W, WILLIS A J. The estimation of carbohydrates in plant extracts by anthrone[J]. Biochemical Journal, 1954(3): 508.
[11] GRATTAN S R, GRIEVE C M. Mineral element acquisition and growth response of plants grown in saline environments[J]. Agriculture,Ecosystems amp; Environment, 1992(4): 275-300.
[12] BATES L S, WALDREN R P, TEARE I D. Rapid determination of free proline for water-stress studies[J]. Plant and Soil, 1973(1): 205-207.
[13] 赵可夫, 李军. 盐浓度对3种单子叶盐生植物渗透调节剂及其在渗透调节中贡献的影响[J]. 植物学报, 1999, 41(12): 1287-1292.
[14] 周广生, 梅方竹, 周竹青, 等. 小麦不同品种耐湿性生理指标综合评价及其预测[J]. 中国农业科学, 2003, 36(11): 1378-1382.
[15] 李晓芬, 尚庆茂, 张志刚, 等. 多元统计分析方法在辣椒品种耐盐性评价中的应用[J]. 园艺学报, 2008, 35(3): 351-356.
[16] 周志文. 葡萄种质资源的耐盐性鉴定及其生理基础的研究[D].山东农业大学, 2003.
[17] XI J, ZAHNG F, MAO D, et al. Saline-soil distribution and halophyte resources in Xinjiang[J]. Chinese Journal of Soil Science,2005(3): 299-303.
[18] JALEEL C A, GOPI R, MANIVANNAN P, et al. Antioxidative potentials as a protective mechanism in Catharanthus roseus (L.) G.Don. plants under salinity stress[J]. Turkish Journal of Botany, 2007,31(3): 245-251.
[19] WAKEEL A, ASIF A R, PITANN B, et al. Proteome analysis of sugar beet (Beta vulgaris L.) elucidates constitutive adaptation during the first phase of salt stress[J]. Journal of Plant Physiology, 2011, 168(6):519-526.
[20] TESTER M, DAVENPORT R. Na+tolerance and Na+transport in higher plants[J]. Annals of Botany, 2003(5): 503-527.
[21] 刘友良, 汪良驹. 植物对盐胁迫的反应和耐盐性[M]//余叔文, 汤章城. 植物生理与分子生物学. 3版. 北京: 科学出版社, 1998:752-769.
[22] SONG J, FENG G, TIAN C Y, et al. Osmotic adjustment traits of Suaeda physophora, Haloxylon ammodendron and Haloxylon persicum in field or controlled conditions[J]. Plant Science, 2006(1): 113-119.
[23] 杨春武, 李长有, 尹红娟, 等. 小冰麦(Triticum aestivum-Agropyron intermedium)对盐胁迫和碱胁迫的生理响应[J]. 作物学报, 2007, 33(8): 1255-1261.
[24] 刘爱荣, 张远兵, 钟泽华, 等. 盐胁迫对彩叶草生长和渗透调节物质积累的影响[J]. 草业学报, 2013, 22(2): 211-218.
[25] 王文颖, 柴薇薇, 马清, 等. 植物环核苷酸门控离子通道的研究进展[J]. 植物生理学报, 2015(11): 1799-1808.
[26] 李洪燕, 郑青松, 刘兆普, 等. 海水胁迫对苦荬菜幼苗生长及生理特性的影响[J]. 植物学报, 2010, 45(1): 73-78.
[27] 王娟, 李德全. 逆境条件下植物体内渗透调节物质的积累与活性氧代谢[J]. 植物学报, 2001, 18(4): 459-465.
[28] FLOWERS T J, HAJIBAGHERI M A, CLIPSON N J W.Halophytes[J]. The Quarterly Review of Biology, 1986, 61(3): 313-337.
[29] SAKAMOTO A, MURATA N. Genetic engineering of glycinebetaine synthesis in plants: current status and implications for enhancement of stress tolerance[J]. Journal of Experimental Botany,2000, 51(342): 81-88.
[30] CAMPOS M K F D, CARVALHO K D, SOUZA F S D, et al.Drought tolerance and antioxidant enzymatic activity in transgenic'Swingle' citrumelo plants over-accumulating proline[J]. Environmentalamp; Experimental Botany, 2011, 72(2): 242-250.
[31] CHINNUSAMY V, JAGENDORF A, ZHU J K. Understanding and improving salt tolerance in plants[J]. Crop Science, 2005, 45(2):437-448.
[32] 岳利军, 崔彦农, 袁坤, 等. NaCl 胁迫下沙芥的渗透调节作用[J]. 植物生理学报, 2016(4): 569-574.
[33] 陈少良, 李金克, 毕望富, 等. 盐胁迫条件下杨树盐分与甜菜碱及糖类物质变化[J]. 植物学报, 2001, 18(5): 587-596.
[34] 柳福智, 羊健麟. 盐胁迫对甘草愈伤组织渗透调节的影响[J].植物生理学报, 2015(7): 1038-1044.
Analysis of osmotic adjustment substances in F1generation hybrids of different resistance rootstocks under salt stress
FU Qingqing1, TAN Yazhong1, ZHAI Heng1, WANG Junwei2, DU Yuanpeng1*
(1. College of Horticultural Science and Engineering, Shandong Agricultural University/State Key Laboratory of Crop Biology,Tai'an, Shandong 271018, China; 2. Stanley Fertilizer Ningling Co., Ltd, Shangqiu, Henan 476700, )
To study the osmotic responses of grape rootstocks with different salt tolerance under salt stress, rootstock 1103P with higher salt tolerance among the introduced rootstocks was used as control, one-year cuttings of 6 hybrids of V.amurensis Rupr. Zuoshanyi×SO4 and 2 hybrids of V.amurensis Rupr. Zuoshanyi×101-1 were used as materials to be irrigated with 100 mmol/L NaCl, the soluble sugar, betaine, proline and MDA content of leaves and roots, relative water content, relative conductivity and root activity were measured after 21 days of treatment. The results showed that the content of soluble sugar in leaves and roots of A15, A17, A34 and A35 increased significantly under NaCl treatment, the osmotic potential decreased significantly, and the osmotic contribution of soluble sugar reached above 96%, followed by betaine and proline. Water content had no significant difference with control after NaCl treatment, leaf relative conductivity, MDA content of leaf and root increased slightly, and root activity had slight reduction. Correlation analysis showed that salt tolerance might be closely related to organic osmotic adjustment substances in leaves and roots.
grape rootstock; hybrids; salt tolerance; osmotic adjustment substances
S663.1;S601
A
10.13414/j.cnki.zwpp.2017.06.001
2017-08-23
现代农业产业技术体系建设专项(No.CARS-29-02);国家自然基金(No.31501738);长江学者和创新团队发展计划(No.IRT15R42)
*通讯作者:杜远鹏,女,博士,副教授,主要从事葡萄生理和抗逆栽培研究。E-mail: duyuanpeng001@163.com

