鸢尾甲黄素A对脂多糖诱导小鼠RAW264.7细胞分泌炎性因子的调节作用
邹桂欣 ,孙小玲 ,王光函 ,尤献民,李国信
(1.辽宁省中医研究院,辽宁 沈阳 110034; 2.辽宁省药品检验检测院,辽宁 沈阳 110023)
鸢尾甲黄素A对脂多糖诱导小鼠RAW264.7细胞分泌炎性因子的调节作用
邹桂欣1,孙小玲2,王光函1,尤献民1,李国信1
(1.辽宁省中医研究院,辽宁 沈阳 110034; 2.辽宁省药品检验检测院,辽宁 沈阳 110023)
目的 研究射干中鸢尾甲黄素A对脂多糖(LPS)诱导小鼠巨噬细胞RAW264.7分泌炎性因子一氧化氮(NO)和白细胞介素6(IL-6)的调节作用。方法 采用LPS诱导RAW264.7细胞,建立细胞炎性反应模型。用不同质量浓度的鸢尾甲黄素A进行干预,并设立空白对照组。通过噻唑蓝(MTT)法测定不同质量浓度鸢尾甲黄素A对RAW264.7细胞活力的影响,Griess法检测NO生成量,酶联免疫吸附试验(ELISA)检测细胞上清液中炎性因子IL-6的含量。结果 鸢尾甲黄素A能明显抑制LPS诱导RAW264.7细胞生成NO和IL-6,且作用强度呈浓度依赖性。结论 鸢尾甲黄素A的抗炎作用可能与减少炎性因子NO和IL-6的生成有关。
鸢尾甲黄素A;脂多糖;RAW264.7细胞;一氧化氮;白细胞介素6;小鼠
射干是鸢尾科植物射干 Belamcandachinensis(L).DC.干燥根状茎,主含异黄酮类化合物[1],包括射干苷、野鸢尾苷、鸢尾黄素、野鸢尾黄素、次野鸢尾黄素[2-3]、鸢尾甲黄素B、鸢尾甲黄素A等成分[4],具有明显的抗炎作用[5]。通过网络药理学软件(http: //TCMSPnw.com /default)对射干药材中黄酮类成分进行口服利用度(oral bioavailability,OB)和类药性(drug-likeness,DL)分析,结果鸢尾甲黄素A综合得分最高,OB值约为64%,提示口服利用度良好;DL值为0.4,表明成为候选药物的可能性较大(当化合物的 DL≥0.18时即可作为候选药物)。但目前对鸢尾甲黄素A药理活性的相关研究鲜见报道。本研究中以脂多糖(LPS)刺激的小鼠RAW264.7细胞为炎症模型,观察鸢尾甲黄素A对炎性因子一氧化氮(NO)和白细胞介素6(IL-6)作用的影响,在细胞水平上探讨鸢尾甲黄素A的抗炎机制。
1 材料与方法
1.1 仪器与试药
1.1.1仪器
W-CJ-1B型标准净化工作台(苏州净化设备厂);CB150CE3型二氧化碳(三气)培养箱(路易企业有限公司);XDS-500C型倒置显微镜(上海蔡康光学仪器有限公司);400C型离心机(北京白洋医疗器械有限公司);酶标仪(美国柏腾仪器有限公司);HH-S210R4型电热恒温水浴锅(上海锦屏仪器仪表有限公司);Y-LS-50A型立式压力蒸汽消毒器(上海博迅实业有限公司)。
1.1.2试药
DMEM高糖培养基、10%胎牛血清、青霉素、链霉素(Hyclone公司);胰蛋白酶(Gibco公司);乙二胺四乙酸(EDTA)、噻唑蓝(MTT)、LPS,Sigma 公司;二甲基亚砜(DMSO)、台盼蓝(Typan Blue),Amerseco 公司;小鼠 NO及IL-6酶联免疫吸附试验(ELISA)检测试剂盒(南京建成生物科技有限公司)。鸢尾甲黄素A(江苏永健医药科技有限公司,批号为20140724)。细胞株为小鼠巨噬细胞RAW264.7(中国科学院上海细胞库)。
1.2 方法
1.2.1药物溶液配制
LPS溶液:取LPS粉末 5 mg,溶解在1 mL磷酸盐缓冲液(PBS)中,制成质量浓度为5 g/L的LPS溶液,使用前用含有10%血清的DMEM培养液稀释至2 μg/mL即可。
鸢尾甲黄素A药液:取鸢尾甲黄素A适量,加DMSO溶解,用 PBS 稀释成质量浓度为 352,176,88,44,22,11,5.5 μg /mL 的贮备液。
MTT 溶液:称取 MTT 0.5 g,溶于 100 mL PBS 中,制成质量浓度为5 g/L的MTT溶液。
1.2.2细胞培养
将RAW264.7细胞置高糖DMEM培养基中,并加入 10% 青霉素及链霉素 100 mg /L,在 95%O2、5%CO2、37℃条件下传代培养。
1.2.3MTT 试验
取对数生长期的RAW264.7细胞,制得细胞浓度为每1 mL含1×105个的单细胞悬液,接种于96孔细胞培养板中,每孔100 μL,培养过夜;吸弃各孔培养液,分组处理,即鸢尾甲黄素 A组分别加入 352,176,88,44,22,11,5.5 μg/mL 7 个质量浓度的药液,LPS 模型组加 LPS(2 μg /mL)溶液;空白对照组加含 10% 胎牛血清的EMDM培养液,每组平行5孔,各孔加液终体积为200 μL,在 5%CO2、37 ℃ 条件下继续培养 24 h;然后在各孔加入 20 μL MTT 的 PBS 水溶液(5 g/mL),培养 4 h;吸弃培养液,每孔加入DMSO溶液150 μL振荡溶解。使用酶标仪在490 nm波长处测定吸光度(OD)值,计算各组细胞活力,并将空白对照组细胞活力记作100.00%;其他各组与对照组细胞的存活百分率进行比较。
1.2.4Griess试验
取对数生长期的RAW264.7细胞,制得细胞浓度为每1 mL含1×105个的单细胞悬液,接种于96孔细胞培养板中,每孔100 μL,培养过夜;吸弃各孔培养液,分组处理,即给药组分别加入 22,11,5.5 μg/mL 的 3个质量浓度药液,LPS模型组和空白对照组加入含10%胎牛血清的DMEM培养液,每组平行5孔,各空加液体积为 200 μL,处理 1 h后,空白对照组加入含有10%胎牛血清的DMEM培养液,其他各组均加LPS(2 μg /mL)溶液,每孔加液体积为 100 μL,在 5%CO2及37℃条件下继续培养 24 h;吸取各孔培养液 50 μL,加入等体积的Griess试剂,室温反应10 min,用酶标仪在540 nm波长处测定 OD值,依据所测亚硝酸钠浓度,推算各组细胞培养液中NO含量,从而计算各药液组对LPS处理的细胞产生NO的抑制率。
1.2.5双抗体夹心ELISA法试验
细胞分组及处理等设计同1.2.4项,各组细胞培养24 h后,按照IL-6细胞因子的ELISA试剂盒说明书操作,吸取各孔培养液,用酶标仪在450 nm波长处测定OD,依据标准曲线,通过各组培养液中IL-6的含量计算抑制率。
1.3 统计学处理
采用SPSS 17.0统计学软件分析,组间数据比较采用 t检验。P<0.05为差异显著,P<0.01为差异非常显著。
2 结果
2.1 对小鼠巨噬细胞RAW264.7细胞活力的影响
MTT试验结果显示,随着鸢尾甲黄素A质量浓度的增加,RAW264.7细胞被抑制的效果越明显。与空白对照组细胞存活率相比,药物浓度在2.75~22 μg/mL范围内对RAW264.7细胞活力基本不产生影响。镜下观察,细胞状态良好,表明在此浓度范围内鸢尾甲黄素A无明显细胞毒性作用。因此,选择 22,11,5.5 μg /mL 3个质量浓度继续进行试验(图1)。

图1 鸢尾甲黄素A对RAW264.7细胞活力的影响
2.2 对 LPS诱导小鼠 RAW264.7细胞分泌 NO的抑制
空白对照组细胞上清液中检测到的NO浓度非常低,仅为 2.1 μmol/L。予 2 μg /mL LPS 刺激后,巨噬细胞释放大量的 NO (34.5 μmol/L),提示造模成功。与模型组相比,鸢尾甲黄素A作用的RAW264.7细胞上清液中,NO含量显著减少,结果表明,质量浓度在5.5~22 μg/mL范围内的鸢尾甲黄素A能明显抑制LPS诱导的 NO产生(图2)。
2.3 对LPS诱导小鼠RAW264.7细胞分泌IL-6的抑制
空白对照组细胞上清液中IL-6质量浓度为190.2 pg/mL,给予 2 μg /mL LPS 刺激后,巨噬细胞释放 IL -6 的含量显著增加(5 819.2 pg/mL)。而与模型组相比,鸢尾甲黄素A 3个剂量组均可显著抑制LPS诱导RAW264.7细胞释放IL-6,且具有明显的浓度依赖关系(图3)。
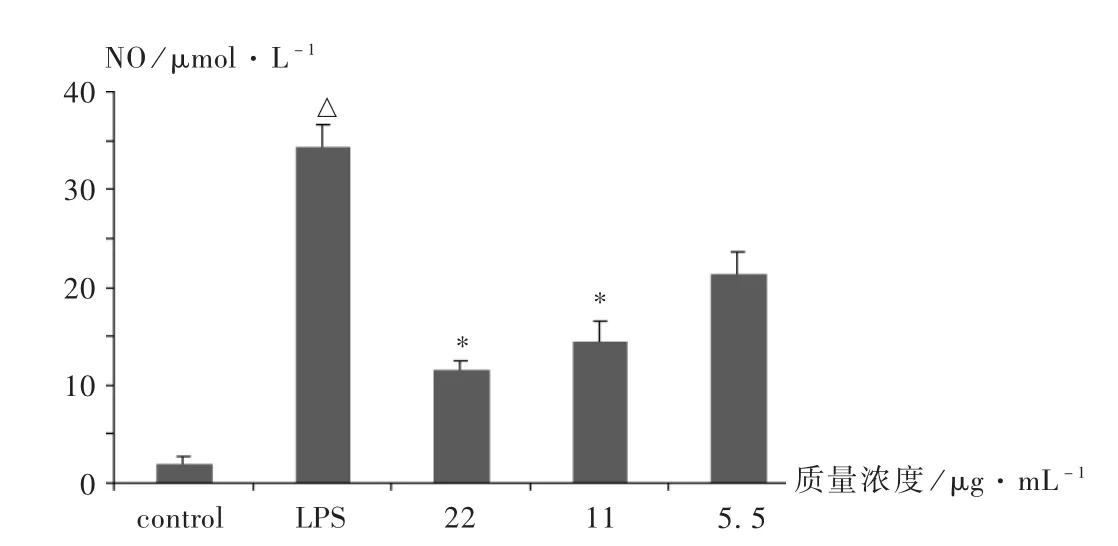
图2 鸢尾甲黄素A对巨噬细胞产生NO的影响
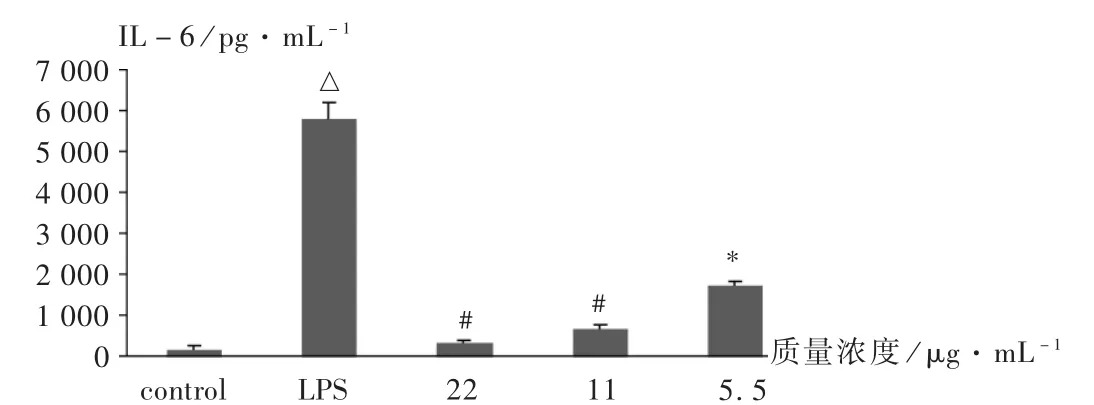
图3 鸢尾甲黄素A对巨噬细胞产生IL-6的影响
3 讨论
巨噬细胞是免疫效应细胞,在机体的免疫系统中起着非常重要的作用,也是体内启动炎症介质产生的中心细胞。LPS是革兰阴性菌细胞壁的主要成分,也是革兰阴性菌的主要致病物质,也是引起严重感染的直接原因[6]。当机体发生炎性反应时,LPS通过MyD88分子等途径激活NF-κβ,启动一系列细胞因子及其生物活性分子如NO,TNF-α,IL-6等,促进巨噬细胞释放多种炎性因子参与反应。结果显示,2 μg/mL的LPS作用于RAW264.7细胞24 h后,细胞存活率为99.91%,表明对细胞无毒性作用,2 μg/mL 的 LPS RAW264.7 细胞与作用24 h后,NO和IL-6的释放量与空白对照组有显著性差异。因此,本试验中采用2 μg/mL的LPS作用于RAW264.7细胞。
NO是重要的天然免疫应答调节性效应分子,参与血管调节、神经传递、炎症与免疫反应等过程。NO由一氧化氮合酶(NOS)催化左旋精氨酸而产生,在病理情况下NO大量合成会引起急、慢性炎性反应,诱发组织损伤和病变,进而参与某些炎症性疾病的发生[7]。本研究结果显示,与空白对照组相比,LPS模型组NO的分泌量增加;鸢尾甲黄素A各组的NO量均低于LPS模型组。
IL-6是近年来研究较多的一种多功能细胞因子,具有广泛的生物学活性和潜在的临床应用前景。本试验结果表明,2 μg/mL的LPS刺激巨噬细胞产生大量的IL-6,与空白对照组相比,有显著性差异;而与模型组相比,质量浓度在 5.5~22 μg/mL范围内的鸢尾甲黄素A能显著抑制由 LPS诱导的RAW264.7细胞释放IL-6,并呈现良好的浓度依赖关系。
[1]刘合刚.野生射干与栽培射干化学成分的定性比较[J].时珍国医国药,2001,12(8):685 -686.
[2]秦民坚,吉文亮,王峥涛.射干的化学成分研究(Ⅱ)[J].中草药,2004,35(5):487 - 489.
[3]邱鹰昆,高玉白,徐碧霞,等.射干异黄酮类化合物的分离与结构鉴定[J].中国药物化学杂志,2006,16(3):175 -177.
[4]Woo WS,Woo EH.An isoflavone noririsflorentin from Belamcanda chinensis[J].Phytochemistry,1993,33(4):939 - 940.
[5]秦文艳,赵金明,齐 越,等.射干提取物体内体外抑菌作用的研究[J].中国实验方剂学杂志,2011,27(4):147 -150.
[6]Alvarez Perez Gil AL,Barbosa Navarro L,Patipo Vera M,et al.Anti-inflammatory and antinociceptive activities of the ethanolic extract of Bougairwillea xbuttiana[J].J Ethnopharmacol,2012,144(31):712.
[7]Ding D,Jing Y.Recent advance in macrophge pattwen recognition receptors for lipopolysaccharide Recognition[J].Chinese Journal of Pathophysiology,2008,24(8):1650 - 1655.
Regulation EffectofIristectorigenin A on Secretion ofInflammatory Factor in Mouse RAW264.7 Cells Induced by Lipopolysaccharide
Zou Guixin1, Sun Xiaoling2, Wang Guanghan1, You Xianmin1, Li Guoxin1
(1.Liaoning Provincial Academy of Traditional Chinese Medicine,Shenyang, Liaoning, China 110034; 2.Liaoning Provincial Institute for Drug Control and Inspection,Shenyang,Liaoning,China 110023)
Objective To investigate the regulation effect of iristectorigenin A on secretion of inflammatory factors (NO and IL -6) in mouse RAW264.7 macrophage cells induced by lipopolysaccharide(LPS).Methods LPS was adopted to induce RAW264.7 macrophage cells in order to establish the model of cellular inflammatory response.Different concentrations of iristectorigenin A were used to intervene the RAW264.7 macrophage cells,and the blank control was set.The effects of different concentrations of iristectorigenin A on the viability of RAW264.7 cells were determined by MTT method,the production of NO was detected by Griess method,and the content of inflammatory factor(IL - 6) in cell supernatant was detected by ELISA.Results Iristectorigenin A can significantly inhibit the production of NO and IL -6 in RAW264.7 cells induced by LPS,and the concentration of the action was in a concentration dependent manner.Conclusion The anti- inflammatory effect of iristectorigenin A may be related to the reduction of the production of inflammatory factors(NO and IL - 6).
iristectorigenin A;lipopolysaccharide;RAW264.7 cell;NO;IL - 6;mouse
R285.5;R282.71
A
1006-4931(2017)22-0001-03
10.3969 /j.issn.1006 - 4931.2017.22.001
国家自然科学基金[81273927];国家“重大新药创制”项目[SQ2017ZX090328]。
邹桂欣(1965-),女,研究员,研究方向为中药药效物质基础,(电子信箱)zou650430@126.com。
李国信(1963-),男,博士研究生,博士研究生导师,研究方向为中药新药开发,(电子信箱)yying_65@126.com。
2017-06-06)

