氮胁迫对埃氏小球藻生长及油脂积累的影响
程蔚兰 邵雪梅 宋程飞 史飞飞 季春丽 李润植
(山西农业大学 分子农业与生物能源研究所,太谷 030801)
氮胁迫对埃氏小球藻生长及油脂积累的影响
程蔚兰 邵雪梅 宋程飞 史飞飞 季春丽 李润植
(山西农业大学 分子农业与生物能源研究所,太谷 030801)
以生长快、可除污的埃氏小球藻株系SXND-25为试材,研究不同氮浓度培养条件对其生物量和油脂产量的影响,以期建立优化培养体系利用该株小球藻生产优质生物燃油。以硝酸钠为氮源、BG11培养基中的氮浓度为基准(1.5 g/L),设置氮浓度梯度对小球藻进行培养。通过光密度测定、尼罗红染色、转酯化法抽提油脂和GC分析,对小球藻生物量、油脂含量及脂肪酸组分进行分析。结果显示,培养8 d时,在氮浓度为1.5 g/L时,生物量达到最大,干重为3.4 g/L,而油脂含量仅为28.24%,油脂产量为0.96 g/L;在氮浓度为0 g/L时生物量最小,干重为0.49 g/L,而油脂含量最高,为44.57%,油脂产量为0.22 g/L;在氮浓度为0.75 g/L时,干重为3.2 g/L,油脂含量为40.36%,油脂产量最高为1.3 g/L,是标准氮浓度下油脂产量的1.4倍。0.75 g/L氮浓度下连续培养8 d,藻油脂肪酸组成更适于制取优质生物柴油。综合生物量、油脂含量及脂肪酸组成等指标,确定0.75 g/L氮浓度为该埃氏小球藻株系规模化培养以生产优质生物燃油的优化参数。
埃氏小球藻(Chlorella emersionii);缺氮培养;生物量;油脂积累;脂肪酸组成
小球藻(Chlorella spp.)是一种可自养或异养培养的单细胞真核绿藻,广泛分布在世界范围水系中,具有生长速度快、光合效率高、适应性强等特点[1,2]。小球藻通过光合作用可将CO2转化为高值有机化合物,用于生产食物、饲料、饵料、高附加值的生物活性物质和保健食品,亦是生产可再生生物燃料的良好原料。由于其生物量大、生长快、易培养、油脂积累多,小球藻愈来愈多地用于规模化生产生物柴油研发[3,4]。分离培育高生物量、高含油、耐逆境的小球藻藻种和建立可连续培养的高效培养体系是实现微藻生物柴油商业化生产的关键环节。
氮是组成微藻的基本元素之一。在营养元素中,氮元素对微藻具有十分显著的影响[5]。在一定条件下,氮浓度升高可以促进细胞生物量增加,但同时会使细胞内储藏物积累量减少,油脂含量降低,特别是极性油脂含量。在缺氮胁迫条件下,微藻生长减慢甚至停止,细胞内的储藏物大量积累,油脂含量快速增加,并且多为中性油脂[6]。氮胁迫不仅影响细胞内总脂的积累,还对细胞内的油脂组分产生影响。有研究表明[7]氮胁迫会促进短链饱和脂肪酸和单不饱和脂肪酸的积累。而优质的生物柴油对脂肪酸组分有一定要求,欧盟的生物柴油标准[8]EN14214规定亚麻酸(C18∶3)不能高于12%、多于4个双键(含4个双键)的脂肪酸含量不能高于1%。因此,研究不同氮浓度下微藻的油脂含量及组分变化对于制备优质的生物柴油具有重要的价值。
同时获得高生物量、高油脂和良好的油脂组分是微藻规模化生产制备生物柴油难点之一[9]。本实验室在山西一个煤化厂附近水体中分离到一株埃氏小球藻(Chlorella emersonii)新株系SXND-25。对该株系培养及鉴定发现其具有自絮凝的特点,生长速度是普通小球藻的1.15倍,含油量28%,净化污水能力强,是进一步应用于生物柴油生产的优异种质。本研究以本实验室分离的埃氏小球藻株系SXND-25为材料,用竖直密闭管式光反应器进行20 L放大培养,以BG11培养基为基础,设置氮浓度梯度,研究不同氮浓度对埃氏小球藻生长、油脂积累和油脂组分的影响。旨在找出适宜的氮浓度和培养条件,以获得小球藻生物量快速增长、油脂产量较高、适于生产优质生物柴油的油脂组分比例增加的生产指标。为该株特色小球藻规模化培养体系建立,以及生产优质微藻生物柴油提供科学依据。
1 材料与方法
1.1 材料
实验藻种为本实验室从山西一煤化厂附近水体分离和保存的小球藻株系SXND-25,经形态学和18S RNA鉴定其为埃氏小球藻(Chlorella emersonii)一个新株系。
1.2 方法
1.2.1 培养条件 埃氏小球藻用竖直密闭管式光反应器进行20 L放大培养,培养条件为:温度(25±1)℃,湿度45%,光照强度4 500 lux,光暗比16 h∶8 h,CO2含量2%(V/V)。
1.2.2 氮浓度梯度设置 以BG11中的氮浓度(1.5 g/L)为基准,设置5个氮浓度梯度:0 g/L(0 N)、0.375 g/L(1/4 N)、0.75 g/L(1/2 N)、1.125 g/L(3/4 N)、1.5 g/L(1 N),并将STOCK 1中的硝酸钠替换为氯化钠,STOCK 2中的柠檬酸铁铵替换为柠檬酸铁。每组实验设置3 个生物学重复试验。
1.2.3 接种 在无菌条件下,取一定量处于对数生长期的小球藻藻液,将其转入离心管中以5 000 r/min离心5 min,将离心后得到的藻团用双蒸水进行3次重悬、离心以彻底去除小球藻表面的培养基,之后,分别用少量各个氮浓度的培养基等量重悬,并接种到对应氮浓度的培养基中,使接种后的藻液干重为0.28 g/L。
1.2.4 生物量及油脂含量的测定 小球藻共培养8 d,每2 d取样一次。生物量的测定方法为:称量孔径为0.45 μm混合纤维素脂滤膜的质量m0,取一定量的藻液v在滤膜上抽滤去除水分,置于60℃烘箱烘至恒重,称量滤膜及藻干重m1。根据公式DW=(m1-m0)/v计算藻样干重。根据得到的结果计算干重为5 mg时所需要的藻液量,并取对应量的藻液用于油脂含量测定及油脂组分分析,另各取800 μL藻液进行尼罗红染色。
1.2.5 藻粉的制备 将1.2.4中所取藻液,以5 000 r/min 离心3 min,收集藻样并用双蒸水重悬洗涤后,将藻样冷冻干燥。冻干藻粉存入4℃冰箱中保存。
1.2.6 尼罗红染色荧光拍照 将800 μL藻液与200 μL二甲基亚砜(DMSO),10 μL尼罗红丙酮溶液(0.1 mg/mL)均匀混合,42℃条件下避光水浴5 min,使用蓝光作为激发光,在正置荧光显微镜下观察并拍照。
1.2.7 提取油脂与油脂组分的测定 本实验提取油脂的方法是直接转酯化法:将 5 mg冻干藻粉、0.1-0.3 mL 氯仿∶甲醇(2∶1,V/V)、0.1-0.5 mL HCl-甲醇(5%,V/V)依次加入特氟龙密封垫片的玻璃螺纹管中。85℃水浴30 min,冷却至室温后,加入 900 μL正己烷。将其在设定条件为25℃,150 r/min 的摇床上提取 1 h,静置过夜,取正己烷萃取液,使用气相色谱仪(GC)测定脂肪酸组成及含量。
1.2.8 气相色谱(GC)测试条件 用 Agilent 7890D进行脂肪酸组分分析。色谱柱为 Agilent HP-88 弱极性毛细管色谱柱(30 m×250 μm×0.25 μm);样品 1 μL 分流进样,分流比1∶40 进样口温度260℃;使用氮气作为载气,流速为 1.0 mL/min。
计算各组分的百分含量:峰面积归一化法。实验重复 6 次,实验结果值表示为:平均值±标准差(±s)(n = 6)。
2 结果
2.1 不同氮浓度培养对小球藻生物量的影响
用干重法测定不同氮浓度培养下各时段的小球藻样品的生物量,结果(图1)。显示,在氮浓度为0 g/L时,小球藻处于基本不生长的状态。在氮浓度为0.375 g/L时,小球藻前2 d生长较缓慢,从第2天开始生物量快速增加,进入对数生长期,第6-8天时进入稳定前期,生长速度减慢。其原因可能是培养基中的氮基本耗尽,处入缺氮胁迫状态。在氮浓度为0.75 g/L、1.125 g/L、1.5 g/L时,生物量相差不大,小球藻生长趋势基本相同。即前2 d处于延滞期,生物量增长较为缓慢。在培养的2-6 d时处于对数生长期,生物量迅速增加,在第6-8天达到稳定期,生物量增加缓慢。

图1 不同氮浓度下生物量随时间的变化
2.2 尼罗红染色测试不同氮浓度培养条件下小球藻油脂积累变化
用尼罗红染色定性测试不同氮浓度培养条件下小球藻油脂积累变化。结果(图2)表明,在同一氮浓度下,藻细胞内油脂含量随时间的增长而增多。在培养第2天时,A1、B1、C1藻细胞内可以观察到小油滴,D1、E1基本观察不到油滴;在培养第6天时,A2、B2、C2藻细胞内油滴清晰可见,D2、E2隐约可见小油滴;在培养第8天时,A3、B3、C3藻细胞内的油滴多且亮,D3、E3藻细胞内油滴较小。由此可知缺氮培养可以促进油脂的积累。
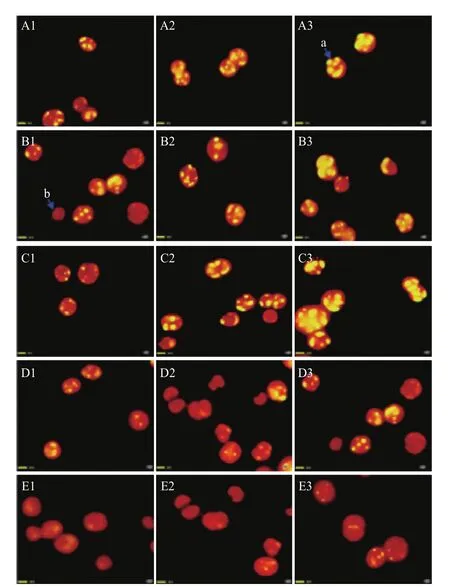
图2 尼罗红染色显示不同氮浓度培养条件下小球藻油脂积累变化
2.3 不同氮浓度培养条件下小球藻油脂含量及组分分析
取不同氮浓度培养条件下不同时段的小球藻样品,定量分析藻细胞总油脂含量。结果(图3)显示,在同一氮浓度条件下,藻细胞内的油脂含量随培养时间的增加而增加,且氮浓度越低,油脂积累越快,最终的油脂含量也越高。在氮浓度为1.5 g/L时,培养8 d,最终的油脂含量仅为28.24%,而在氮浓度为0 g/L时,油脂含量达到最大值44.57%(干基),是氮浓度为1.5 g/L时的1.6倍。

图3 不同氮浓度下油脂含量的变化
对不同氮浓度培养条件下各时段微藻样品单位油脂产量测试结果(图4)显示,在同一氮浓度下,单位体积油脂产量随培养时间的增加而增加。培养8 d,单位体积油脂产量最大值出现在氮浓度为0.75 g/L时,达到1.3 g/L。

图4 不同氮浓度下单位体积的油脂产量
进一步用GC定量分析不同氮浓度培养第8天小球藻脂肪酸组成测试结果(表1)表明,小球藻的脂肪酸组成包括C14∶0、C16∶0和C18∶0的饱和脂肪酸,C16∶1和C18∶1的单不饱和脂肪酸,以及C16∶2、C16∶3、C18∶2和C18∶3的多不饱和脂肪酸。随着氮浓度的降低,饱和脂肪酸占总脂肪酸含量由26.2%降低至18%,其中C14∶0降低了3%,C16∶0含量降低了33%,C18∶0含量增加了2.2倍。N浓度减低也导致单不饱和脂肪酸含量占总脂肪酸含量由11%增加至51%,其中C16∶1含量增加了5.5倍,C18∶1含量增加了3.45倍。在低N或缺N胁迫下,多不饱和脂肪酸含量占总脂肪酸含量由62.8%降至31%,其中C16∶2含量降低了58%、C16∶3含量降低了80%、C18∶2含量降低了44%、C18∶3含量降低了27.5%。单不饱和脂肪酸含量增加及多不和脂肪酸含量减少正是制取优质生物柴油所要求的脂肪酸组成。显然,氮胁迫有利于微藻积累更适合制取优质生物柴油的脂肪酸成分。
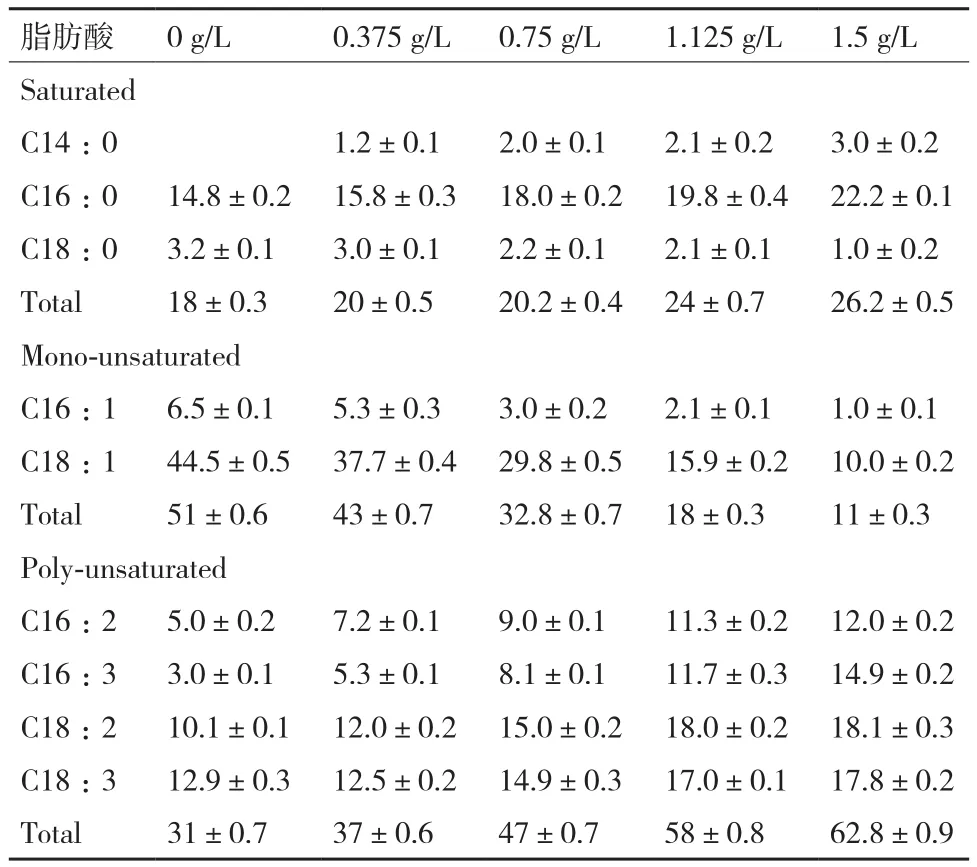
表1 不同氮浓度培养条件下藻细胞各脂肪酸组分的平均含量(%)
3 讨论
已有研究表明氮胁迫促进微藻中油脂的积累,但会导致核酸合成受阻,限制微藻的繁殖与生物量的增加[10]。本试验也证实这一点,即在氮浓度为0 g/L条件下培养3 d干重仅增加了0.12 g/L,生物量增长极其缓慢。微藻在缺氮培养时,还能极缓慢生长可能是因为接种时细胞内储存了少量氮源。氮浓度为1.5 g/L时,干重增加量为1.82 g/L,是氮浓度为0 g/L增长量的15倍。很明显,氮缺乏是限制生物量增加的重要因素。江怀真[11]等研究了不同硝酸钠浓度对小球藻生长的影响,发现当f/2培养基中的初始氮浓度达到150 mg/L时,继续增加氮供应量并不能进一步提高生物量。然而,本研究结果表明,当BG11培养基中初始氮浓度小于750 mg/L时,随着初始氮浓度的增加,生物量快速增长;当初始氮浓度大于750 mg/L时继续增加氮浓度,对生物量的增长影响不大。说明在氮浓度较低时,随着氮浓度的增加生物量会迅速增长,当氮达到一定浓度时,继续增加氮的初始浓度,并不能促进生物量的大量增加。
氮胁迫不仅影响微藻生物量的增长,而且对微藻的油脂积累也产生了明显的影响。刘金丽[12]等研究表明氮胁迫条件下产油栅藻(Scenedesmus dimorphus)油脂含量由22.4%提高到36.3%。赵萍[13]对三角褐指藻(Phaeodactylum tricornutum)培养条件优化,经缺氮诱导产油,油脂含量由22.19%升高至31.02%。本研究中,随着氮浓度的降低,该埃氏小球藻(Chlorella emersonii)株系油脂含量由28.24%提高到44.57%,提高后的油脂含量明显高于其他产油微藻的油脂含量。氮浓度为0 g/L时,由于生物量极少,单位体积内的油脂产量很低。氮浓度为0.375 g/L时,虽然生物量低,但由于油脂含量较高,其单位体积的油脂含量也较高,8 d时达到0.99 g/L。氮浓度为0.75 g/L时微藻不仅能获得相对较高的生物量,其油脂含量也很高,所以单位体积的油脂产量达到了1.3 g/L。在氮浓度为0.75 g/L时,氮源相对充足,没有因缺氮严重限制微藻细胞的繁殖。当细胞达到一定浓度时,因消耗了大量的氮,进入了氮限制的条件,这样就促进了细胞内油脂的快速积累。氮浓度为1.125 g/L和1.5 g/L条件下,虽然单位体积的生物量较高,但因细胞内的油脂含量并不太高,单位体积的油脂产量分别为1.05 g/L和0.96 g/L。显然,在1/2 N浓度时,既获得了较高的生物量,同时单位体积的油脂产量达最高。
氮胁迫对微藻细胞的脂肪酸组分及比例也产生了影响。本研究结果表明,随着氮浓度的降低,在总脂中饱和脂肪酸和多不饱和脂肪酸的比例减少,单不饱和脂肪酸的比例增加。廖启斌等[14]研究表明,伴随氮浓度的升高,三角褐指藻(Phaeodactylum tricornutum Bohlin)内总脂中多不饱和脂肪酸的比例有所增加,这与本研究结果一致。梁英等[15]研究了NO3
-浓度对P. tricornutum MACC/ B226藻株脂肪酸组分的影响,多不饱和脂肪酸占总脂的比例在氮浓度为22.1 mmol/L时大于氮浓度为17.6 mmol/L时。这也可以间接地说明,氮胁迫能更好的促进微藻中单不饱和脂肪酸的积累。
综上所述,对不同氮浓度下微藻的生物量和油脂含量等指标的分析显示,氮浓度为1.5 g/L时生物量最高,干重为3.4 g/L,是氮浓度为0 g/L时的7倍,但油脂产量低。油脂含量在氮浓度为0 g/L时最高,为44.57%,是氮浓度为1.5 g/L时的1.6倍,然而生物量最低。在氮浓度为0.75 g/L时,既可获得较高的生物量和油脂积累量,又能获得更适合制取优质生物柴油的脂肪酸组成。
4 结论
综合不同氮浓度下微藻的生物量、油脂含量及单位油脂产量等分析结果,可知氮浓度在0.75 g/L时,油脂产量最高达1.3 g/L,脂肪酸成分也更适合制取优质生物柴油。因此,0.75 g/L的氮浓度可作为一个优化参数,用于进一步建立该特色埃氏小球藻株系商业化培养体系以期生产优质生物柴油。
[1]赵卓, 李定国, 张玉霞. 不同光强和光质对室内小球藻生长的影响[J]. 化工管理 , 2015(20):186.
[2]塔依尔, 宋于洋, 周源. 气象因子变化对沙棘速生期和果实成熟期光合速率的影响[J]. 西北林学院学报, 2006(5):37-39.
[3]袁程. 微藻生产生物柴油评价及其高产条件的优化[D]. 保定:河北农业大学, 2011.
[4]丁彦聪, 高群, 刘家尧, 等. 环境因子对小球藻生长的影响及高产油培养条件的优化[J]. 生态学报, 2011(18):5307-5315.
[5]张敬键, 展望, 李爱芬, 等. 不同硝酸钠浓度对多形拟绿球藻和模式拟绿球藻生长及脂类积累的影响[J]. 热带海洋学报,2013(1):64-69.
[6]Kumaresan V, Nizam F, Ravichandran G, et al. Transcriptome changes of blue-green algae, Arthrospira sp. in response to sulfate stress[J]. Algal Research, 2017, 23 :96-103.
[7]沈雄, 焦媛媛, 朱葆华, 等. 培养基限氮和添加钨酸钠对微拟球藻脂肪酸组成的影响[J]. 海洋湖沼通报, 2011(4):78-82.
[8]Breuer G, Lamers PP, Martens DE, et al. The impact of nitrogen starvation on the dynamics of triacylglycerol accumulation in nine microalgae strains[J]. Bioresource Technology, 2012, 124:217-226.
[9]陈林, 张维, 刘天中, 等. 两步法催化高酸价微藻油脂制备生物柴油[J]. 生物质化学工程, 2011(3):1-7.
[10]朱云龙. 具有气液分离膜的光生物反应器内微藻吸附生长及CO2固定特性研究[D]. 重庆:重庆大学, 2014.
[11]江怀真, 张维, 刘天中, 等. 氮、磷浓度对小球藻生长及油脂积累的影响[J]. 食品工业科技, 2011, 32(6):204-211.
[12]刘金丽, 王俊峰, 刘天中, 等. 缺氮条件对栅藻油脂积累与光合作用的影响[J]. 海洋科学, 2013(7):13-19.
[13]赵萍. 三角褐指藻富油培养条件的优化及活性物质分析[D].烟台:鲁东大学, 2013.
[14]廖启斌, 李文权, 陈清花, 等. 营养盐对三角褐指藻脂肪酸含量和百分组成的影响[J]. 海洋环 境科学, 2000, 19(2):6-9.
[15]梁英, 麦康森, 孙世春. 硝酸钠浓度对三角褐指藻(Phaeodactylum tricornutum)MACC/ B226 生长及脂肪酸组成的影响[J]. 海洋科学, 2002, 26(5):48-51.
Effects of Nitrogen Stress on Growth and Oil Accumulation of Chlorella emersionii
CHENG Wei-lan SHAO Xue-mei SONG Cheng-fei SHI Fei-fei JI Chun-li LI Run-zhi
(Institute of Molecular Agriculture & Bioenergy,Shanxi Agricultural University,Taigu 030801)
Fast-growing Chlorella emersionii strain SXND-25 with great ability of purifying waste water was used as the target microalgae to investigate the effects of culture condition under varied nitrogen(N)concentration on microalgae biomass and oil yield,aiming at establishing an optimized culture system of such valued chlorella for commercial production of high quality biofuels. BG11 medium was used as the standard medium containing NaNO3as nitrogen(N)source(1 N). This new strain of C. emersionii was continuously cultured in the medium containing different nitrogen concentrations in the medium set as 0 g/L(0 N),0.375 g/L(1/4 N),0.75 g/L(1/2 N),1.125 g/L(3/4 N),and 1.5 g/L(1 N),respectively. The biomass,oil content and fatty acid composition of the microalgae were analyzed by means of optical density measurement,Nile red staining,direct ester extraction of oil and GC analysis. When cultured in 1 N-medium for 8 d,the C.emersionii increased its biomass up to the maximum level with 3.4 g/L dry weight(DW),whereas oil content was only 28.24% of DW,with 0.96 g/L oil yield on average. Culture of 8 days at 0 N-medium led to the minimum biomass of the C. emersionii with 0.49 g/L DW,but the highest level of oil accumulation(44.57% of DW)and small average oil yield(0.22 g/L). Notably,cultivation of 8 d in 1/2 N-medium resulted in the C. emersionii to achieve high biomass(3.2 g/L DW)and moderate oil contents(40.36% of DW),but the highest oil yield of 1.3 mg/L on average. which was 1.4 folds of oil yield cultured in the standard medium(1 N). Moreover,the fatty acid profile in the Chlorella cultured in 1/2 N-medium for 8 d was detected to be more suitable for production of high-quality biodiesel. In conclusion,comprehensive analysis of various indexes including biomass,oil content and oil yield per unit demonstrates that 0.75 g/L nitrogen concentration can be used as an optimized parameter for developing an effective cultivation system of this special Chlorella strain in producing high-quality biodiesel at large scale.
Chlorella emersionii;nitrogen-deficient cultivation;biomass;oil accumulation;fatty acid components
10.13560/j.cnki.biotech.bull.1985.2017-0519
2017-06-22
国家“948”项目(2014-Z39),山西省煤基重点科技攻关项目(FT-2014-01),山西省重点研发计划重点项目(201603D312005)
程蔚兰,女,硕士研究生,研究方向:微藻生物能源;E-mail:503491969@qq.com
李润植,男,教授,博士生导师,研究方向:生物能源与代谢工程;E-mail:rli2001@126.com
(责任编辑 狄艳红)

