抗结核海洋放线菌的筛选及菌株HY286生物活性研究
瞿佳 赵玲侠 陈锐 路鹏鹏 孙晓宇 沈卫荣
(陕西省微生物研究所微生物资源中心,西安 710043)
抗结核海洋放线菌的筛选及菌株HY286生物活性研究
瞿佳 赵玲侠 陈锐 路鹏鹏 孙晓宇 沈卫荣
(陕西省微生物研究所微生物资源中心,西安 710043)
海洋放线菌是研究抗结核药物及其先导化合物的重要来源。以耻垢分枝杆菌(Mycobacterium smegmatis,Msm)作为指示菌,采用平板对峙法,从漳州浅滩泥土分离的77株放线菌中筛选出9株对Msm具有抑制作用的抗性放线菌,其中1株对Msm具有高效抑制作用的拮抗放线菌HY286。通过对菌株HY286的菌落形态观察、生理生化鉴定及16S rDNA序列分析,初步鉴定其为一株马杜拉属放线菌。通过测定菌株HY286发酵产物的抗耻垢分枝杆菌MIC值、抗菌活性和细胞毒活性。结果表明,该菌株产生化合物的抗耻垢分枝杆菌MIC值为200 μg/mL,具有较好的抗结核分枝杆菌的潜力,且对枯草芽孢杆菌、短小芽孢杆菌也具有较好的抑制作用,对HeLa和HepG2的抑制率分别为89.3%和94.2%。
抗结核;马杜拉属;海洋放线菌;筛选;生物活性
结核病是由结核分枝杆菌(Mycobacterium tuberculosis,MTB)引发的传染性疾病,严重威胁人类健康[1]。近年来,由于人口流动性增大,以及多药耐药结核病及广泛耐药结核病检出率不断增加,使得目前抗结核药物的药效急剧下降,结核病的流行趋势逐年回升[2]。面对结核病现状,筛选新型结核药物靶标,研发新型抗结核药物已成为当务之急[3]。
海洋放线菌是研究潜力新药先导化合物的重要研究资源[4],由于海洋放线菌生存环境具高盐、高压、低温、寡营养、无光照等特点,使其具有独特的代谢途径,这为开发新型微生物资源及发现新药先导化合物提供了重要来源[5]。近十几年来,已从海洋放线菌中分离获得了多种新型抗性菌株,如砂嗜盐产孢菌(Salinispora arenicola)[6]、海洋疣孢菌(Verrucosipora maris)[7]、海孢菌(Marinispora sp.)[8]等,可用于生产如抗肿瘤制剂[9]、抗感染制剂[10]和免疫抑制剂[11]等。
由于结核分枝杆菌MTB具有高度的传染性和较长的生长周期,直接应用结核分枝杆菌筛选发现抗结核新药存在极大限制[12]。而耻垢分枝杆菌(Mycobacterium smegmatis,Msm)具有生长迅速、安全性高等特点,可作为模式菌替代MTB筛选具有抗结核活性的菌株及化合物[13-14]。
本研究从福建省漳州市东山县海洋浅滩泥土样中分离筛选出一株对耻垢分枝杆菌具有较好抑制作用的拮抗放线菌,对其发酵产物进行MIC及生物活性测定,并进行多样性分析,旨为下一步从该菌株中分离出具抗结核活性代谢产物奠定基础,以及为结核病防治的应用提供参考。
1 材料与方法
1.1 材料
1.1.1 材料与培养基 土壤样品采集自福建省漳州市东山县海洋浅滩,取15 cm 处土样,装入无菌样品袋内,于 4℃保存备用。
供试菌株:耻垢分枝杆菌由陕西省西安市疾病预防控制中心惠赠;枯草芽孢杆菌(Bacillus subtilis,简称 BS)、大肠杆菌(Escherichia coli,EC)、短小芽孢杆菌(Bacillus pumilus,BP)、金黄色葡萄球菌(Staphlococcus aureus,SA)、藤黄微球菌(Micrococcus luteus,简称ML)、白色假丝酵母(Candida albicans,CA)和黑曲霉(Aspergillus niger,AN)由陕西省微生物研究所微生物资源中心保藏。人子宫颈癌 HeLa细胞、人肝癌 HepG2 细胞,由西安交通大学医学院惠赠。
供试培养基:高氏1号培养基:可溶性淀粉20 g,KNO31 g,NaCl 0.5 g,K2HPO4·3H2O 0.5 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.01 g,H2O 500 mL,海水500 mL,pH 7.4-7.6。用于放线菌的分离和纯化,同时培养基中添放线菌酮50 ppm,萘啶酮酸25 ppm。
燕麦培养基:燕麦片20 g(加部分水煮20 min,然后经离心或过滤得澄清滤液并补水至500 mL),微量盐1 mL,海水500 mL,pH 7.2-7.4,用于放线菌的培养。改良LB培养基:胰蛋白胨5 g,酵母提取物 5 g,NaCl 10 g,甘油 10 g,ddH2O 1 000 mL,pH 7.2-7.4。用于耻垢分枝杆菌的培养。PDA培养基:马铃薯200 g,葡萄糖20 g。用于真菌的培养。若制备固体培养基需加入 20 g/L 琼脂。
1.1.2 主要仪器 隔水式培养箱 GH500(北京科伟永兴仪器有限公司),立式压力蒸汽灭菌锅 LDZX-50KBS(上海申安医疗器械厂),摇瓶培养箱 TS-2102(上海天呈实验仪器制造有限公司),高速冷冻离心机 GL-20G-H(上海安亭科学仪器厂),基因扩增仪(TProfessional Standard Gradient 96),CO2培养箱 3110 Series(Forma Scientific,Inc 公司),酶标仪MVLTISKAWMK3(Thermo公司)。
1.2 方法
1.2.1 菌株的分离纯化 取 5 g 土样加入 45 mL生理盐水中,震荡5 min 后,分别稀释102-107倍后,取各稀释液100 μL 涂布于高氏一号平板上,每个浓度重复3次,28℃倒置培养14 d。待平板内长出单菌落后,挑取不同形态的单菌落于新的平板上划线纯化。
1.2.2 抗耻垢分枝杆菌菌株的筛选 采用平板对峙法测定纯化菌株对耻垢分枝杆菌的抗性作用,即取100 μL生长至对数期的耻垢分枝杆菌菌液涂布于改良LB平板上,待菌液晾干后,用打孔器(7 mm)接种1块待筛选菌株的菌丝块,37℃、倒置培养2-3 d后,测量抑菌圈直径,重复3次。
1.2.3 菌株的初步鉴定 将筛选到的菌株划线接种于燕麦培养基(ISP3)平板上,28℃培养 7 d,观察菌落形态。参照《常见细菌鉴定手册》对筛选得到的菌株进行碳源利用、硝酸盐利用、淀粉利用、明胶液化等试验[15]。
参照《分子克隆实验指南》提取菌株HY286的基因组DNA[16]。16S rDNA基因 PCR 扩增引物为:27F(5'-AGAGTTTGATCCTGGCTCA-3') 和 1492R(5'-GGTTACCTTGTTACGACTT-3')。扩增条 件 为 :首先94℃预变性5 min;94℃下变性1 min,55℃ 退火45 s,72℃延伸2 min,30个循环;最后72℃延伸10 min。
基因扩增产物纯化后由生工生物工程(上海)股份有限公司测序,将所得序列与GenBank数据库中已有的细菌16S rDNA序列进行Blast相似性比对分析,运用ClustalX和 MEGA5.1软件选取N-J法构建系统发育树[17]。
1.2.4 菌株的发酵培养及发酵产物制备 将菌株HY286划线接种于100 mL固体燕麦培养基平板上,28℃培养14 d,切碎培养基,用等体积的提取液,即:乙酸乙酯∶甲醇∶甲酸=80∶15∶5(V∶V∶V)萃取 3 次,合并提取液,将提取液用旋转蒸发仪 45℃减压浓缩至干,甲醇充分溶解于2 mL玻璃样品瓶中,得到该菌株发酵产物。
1.2.5 发酵产物抗耻垢分枝杆菌的MIC值测定 采用微量肉汤稀释法[10]测定菌株发酵产物抗耻垢分枝杆菌的MIC值。将倍比稀释后不同浓度的发酵产物分别加到灭菌的96孔板中,第1至第11孔加药液,浓度分别为1000、900、800、700、600、500、400、300、200、100 和 50 μg/mL 每孔 10 μL,第 12孔不加药。将浓度约0.5麦氏比浊标准的耻垢分枝杆菌菌悬液,经肉汤1∶100稀释后,向每孔中加100 μL,密封后37℃培养72-96 h判断结果,每个处理重复3次。
1.2.6 发酵产物的抗菌活性测定 采用滤纸片扩散法测定抗菌活性。将样品瓶中的发酵产物抽干,称重后甲醇定容至 20 mg/mL,作为抗菌活性测定的母液。取10 μL母液加于直径5 mm的滤纸片上,测量并记录抑菌圈直径,每个处理重复3次。
1.2.7 发酵产物的细胞毒活性测定 用MTT法测定发酵产物的抗肿瘤活性。将培养好的肿瘤细胞制成单细胞悬液,用血细胞板计数并稀释至细胞浓度为6×104-1×105个/mL。将细胞接种在96孔板中,每孔80 μL。另设2个没有细胞、仅有80 μL培养液的空白对照孔用于仪器调零。将96孔板置于37℃,5% CO2的培养箱中培养24 h,然后加入20 μL用培养液稀释好的样品,样品终浓度为50 μg/mL和100 μg/mL。同时,在阳性对照孔加20 μL顺铂(100 μg/mL),在阴性对照孔和空白对照孔各加20 μL培养液。继续培养72 h,每孔加10 μL 5 mg/mL MTT。37℃反应3 h,每孔加100 μL MTT终止液反应8-12 h。用酶标仪比色测定(595 nm)。

2 结果
2.1 耻垢分枝杆菌抗性菌株的分离筛选
本研究从土壤样品中分离获得77株放线菌,筛选获得9株具耻垢分枝杆菌抗性的菌株,占总分离菌株数的11.69%。不同菌株抑菌圈大小见表1,其中菌株HY286对耻垢分枝杆菌的抑菌效果最佳,抑菌圈达 22.3 mm(>20 mm)(图 1)。

表1 不同抗性菌株对耻垢分枝杆菌的抑菌作用
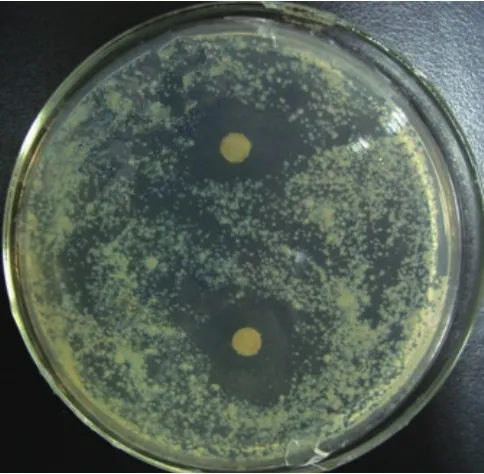
图1 HY286抗耻垢分枝杆菌抑菌圈
2.2 菌株HY286的分类鉴定
菌株HY286在燕麦固体培养基上培养时,菌落初期为白色,随着孢子的不断形成,菌落逐渐变为淡粉色至粉红色。通过对菌株HY286进行生理生化相关实验检测。结果(表2)表明,菌株HY286可在25-40℃范围内生长,可液化明胶、水解淀粉、还原硝酸盐,不能使牛奶凝固、胨化,不产生H2S和黑色素。能利用葡萄糖、果糖、木糖、阿拉伯糖、鼠李糖、甘露糖、蔗糖、海藻糖、甘露醇、肌醇、半乳糖,不能利用棉籽糖、乳糖。

表2 HY286的生理生化特性
对筛选获得的抗性菌株均进行16S rDNA基因的PCR扩增及测序,根据GenBank分析序列及同源性比对,通过N-J法构建系统发育树。结果(图2)表明,HY286属 于 马 杜 拉 属(Actinomadura), 而另外8种抗性菌株中FDF35属于拟诺卡氏属(Nocardiopsis),JMB12属于韩国生工属(Kribbella),其余6株属于链霉菌属(Streptomyces)。
2.3 菌株HY286发酵产物抗耻垢分枝杆菌的MIC值及其抗菌活性、细胞毒活性检测
实验结果(表3)表明,菌株HY286发酵产物的抗耻垢分枝杆菌的MIC为200 μg/mL,其对枯草芽孢杆菌(BS)和短小芽孢杆菌(BP)具有一定的抑制作用,100 μg发酵产物对枯草芽孢杆菌(BS)和短小芽孢杆菌(BP)的抑菌圈大小均超过10 mm,达到15 mm和12 mm。
菌株HY286发酵产物在50 μg/mL时对HeLa和HepG2的抑制率分别为54.6%和54.5%,在100 μg/mL时对HeLa和HepG2的抑制率分别为93.7%和86.9%。
3 讨论
海洋放线菌由于其特殊的生长环境,通常具有特殊的代谢途径和遗传背景,形成了与陆生微生物不同的种类、生理形状及特征,使其具备了产生结构新颖、功能特殊的代谢产物的能力[19]。Goodfellow和Fiedler统计了目前海洋环境中发现的50个放线菌属,研究表明多数海洋放线菌均可代谢产生具有生物活性物质的新化合物,如链霉菌属Streptomyces sp.、海孢菌属Marinispora sp.、皮球菌属Dermacoccus sp.等[20]。近年来,随着海洋放线菌资源的不断开发,可为研究新药提供多种先导化合物,所以,开发研究海洋放线菌资源及其天然产物已逐渐成为当前研究热点[21]。耻垢分枝杆菌具有安全性高、生长迅速等特点,对抗菌药物的敏感性很强[22],关艳等研究表明该菌还可作为模式菌替代MTB筛选具有抗结核活性的菌株及化合物。
本研究从77株海洋放线菌中筛选到9株具有抗耻垢分枝杆菌活性的菌株,比例高达11.69%,表明海洋放线菌可作为结核病新药研究与开发的重要资源。其中,菌株HY286对耻垢分枝杆菌抑菌效果最佳,初步鉴定其为马杜拉属放线菌。马杜拉属为Lechevalier等[23]于1970年建立,该属放线菌广泛分布于热带和亚热带,主要特征为具基内菌丝体(粉红色至玫瑰红)和气生菌丝体(白色、灰色、浅蓝色或浅粉红色),有分枝,不断裂,仅在气生菌丝上形成短孢子链[24]。前人研究表明,马杜拉属放线菌可产生多种抗性化合物[25],结构种类多样,如芳香聚酮类[26]、蒽环类[27]、双萜类[28]、杂环类化合物[29]等。其中,具细菌抗性的化合物有madurastatin A1[30]、madurastatin C1[27]、JBIR-65[28]、CP-82[31]等;具真菌抗性的化合物有madurastatin AC104[32]、madurastatin ACD1[26]等;具抗肿瘤活性的化合物chandrananimycins A-C[33]、BCC27169[34]等。目前,部分化合物已应用于生产如莫能菌素[31]、利福霉素[34]等药物,应用研究前景广阔。本研究中菌株HY286的发酵产物具有较强的抗菌及抗肿瘤作用,表明其具有可观的研究前景和药用潜力。目前,本课题组仍在对该菌株代谢产物进行分离纯化,并对其化合物进行结构鉴定和活性测试,以期为新型结核病药物的研发提供菌株材料和奠基研究基础。
4 结论
本研究以耻垢分枝杆菌为模式菌株,筛选获得9株具有抗耻垢分枝杆菌抗性的放线菌。其中编号为HY286的菌株对耻垢分枝杆菌的抑制作用最为突出。经菌落形态、生理生化特征及16S rDNA测定分析,初步鉴定其为马杜拉属放线菌。通过对HY286发酵产物的测定,该菌MIC为100 μg/ml,对枯草芽孢杆菌、短小芽孢杆菌也有较好的抑制作用,且对HeLa和HepG2的抑制率分别为89.3%和94.2%。
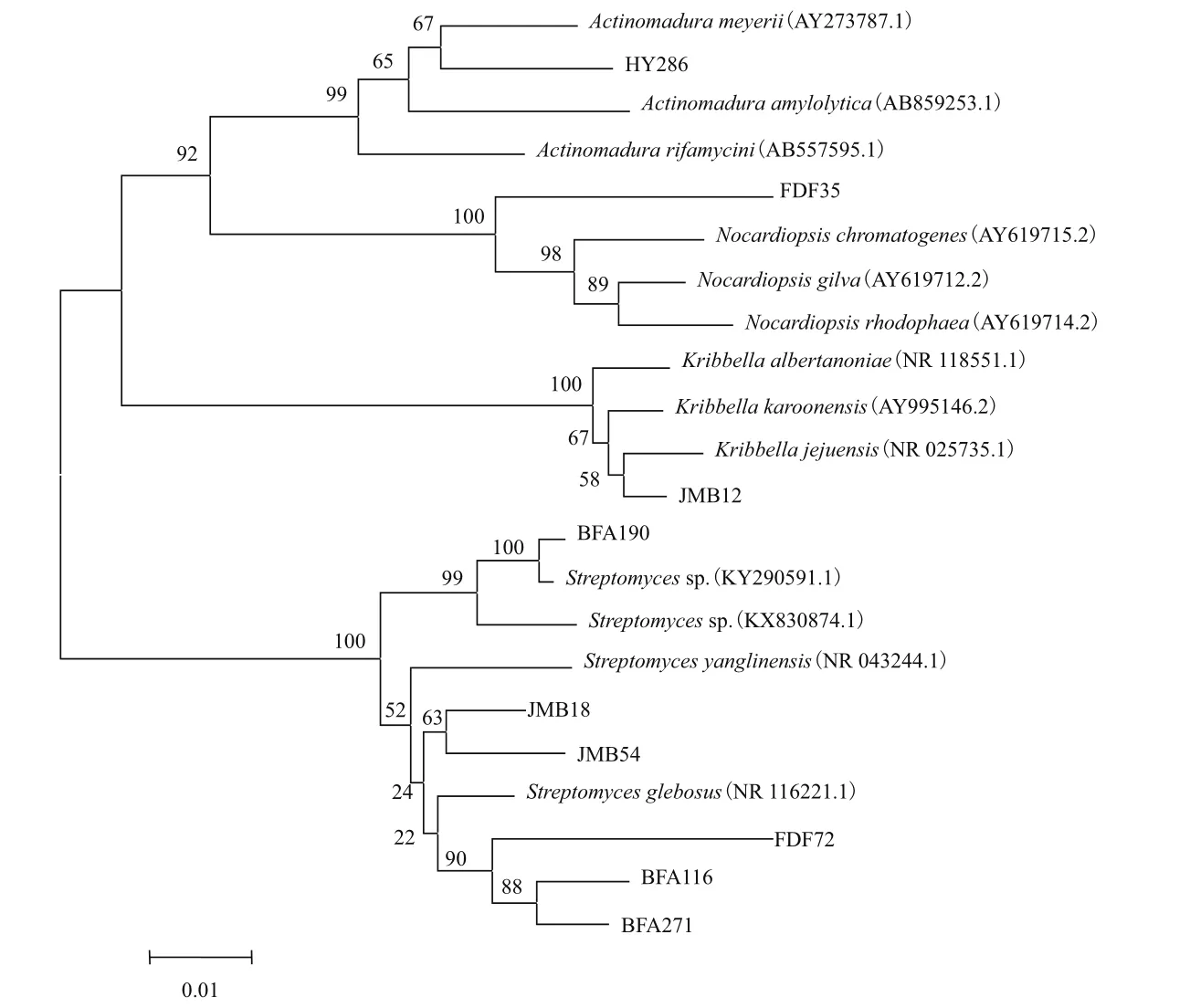
图2 耻垢分枝杆菌抗性菌株的系统发育树
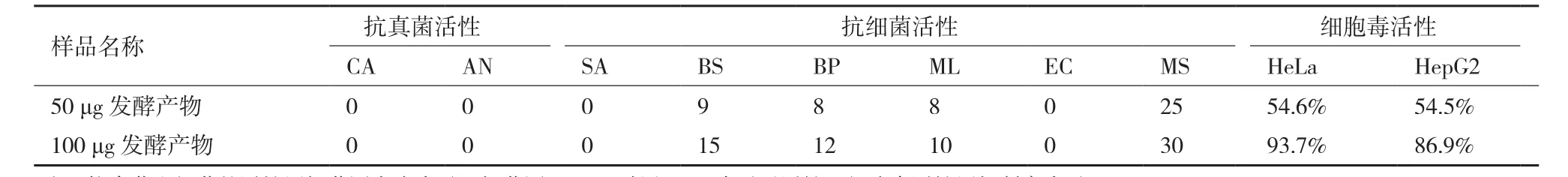
表3 菌株HY286代谢产物的抗菌活性及细胞毒活性
[1]Kim PS, Hafner R. Viewpoint:Challenges and opportunities in tuberculosis research[J]. Journal of Infectious Disease, 2012, 205(suppl. 2):347-352.
[2]Amaral L, Molnar J. Potential therapy of multidrug-resistant and extremely drug-resistant tuberculosis with thioridazine[J]. In Vivo, 2012, 26(2):231-236.
[3]Villemagne B, Crauste C, Flipo M, et al. Tuberculosis:the drug development pipeline at a glance[J]. European Journal of Medicinal Chemistry, 2012, 51(5):1-16.
[4]Fenical W, Jensen PR. Developing a new resource for drug discovery:marine actinomycete bacteria[J]. Nature Chemical Biology, 2006, 2(12):666-673.
[5] 焦炳华, 穆军, 许强芝, 等. 海洋微生物来源新抗生素的研究[J]. 抗感染药学 , 2004, 1(1):1-9.
[6]Feling RH, Buchanan GO, Mincer TJ, et al. Salinosporamide A:a highly cytotoxic proteasome inhibitor from a novel microbial source,a marine bacterium of the new genus Salinospora[J]. Angewandte Chemie International Edition, 2003, 42(3):355-357.
[7] Bister B, Bischoff D, et al. Abyssomicin C-A polycyclic antibiotic from a marine Verrucosispora strain as an inhibitor of the p-aminobenzoic acid/tetrahydrofolate biosynthesis pathway[J]. Angewandte Chemie International Edition, 2004, 43(19):2574-2576.
[8] Kwonhc HC, Kauffman CA, Jensen PR, et al. Fenical W.Marinomycins A-D antitumour antibiotics of a new structure class from a marine actinomycete of the recently discovered genus“Marinispora”[J]. Journal of the American Chemical Society,2006, 128(5):1622-1632.
[9]Olano C, Mendez C, Salas JA, et al. Antitumor compounds from marine actinomycetes[J]. Marine Drugs, 2009, 7(2):210-248.
[10]Rahman H, Austin B, Mitchell WJ, et al. Novel anti-infective compounds from marine bacteria[J]. Marine Drugs, 2010, 8(3):498-518.
[11]Fattorusso E, Taglialatela SO. Marine antimalarials[J]. Marine Drugs, 2009, 7(2):130-152.
[12] Stanley SA, et al. Identification of novel inhibitors of M. tuberculosis growth using whole cell based high-throughput screening[J].ACS Chemical Biology, 2012, 7(8):1377-1384.
[13]李仲兴. 耻垢分枝杆菌群感染及其菌种鉴定[J]. 中华检验医学杂志, 2006, 29(5):475-477.
[14]关艳, 杨延辉, 等. 以耻垢分枝杆菌为模式菌快速筛选新型抗结核药物[J]. 中国新药杂志, 2014, 23(10):1175-1187.
[15]东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社, 2001:162-364.
[16] 萨姆布鲁克, 拉塞尔著;黄培堂, 等译. 分子克隆实验指南[M].第3版, 北京:科学出版社, 2008.
[17]Tamura K, Dulley J, Nei M, et al. MEGA4:molecular evolutionary genetics analysis(MEGA)software verison 4. 0[J]. Molecular Biology Evolution, 2007, 24(8):1596-1599.
[18]鄂征. 组织培养与分子细胞学技术[M]. 北京:北京出版社,1995.
[19]刘全永, 胡江春, 薜德林, 等. 海洋微生物生物活性物质研究[J]. 应用生态学报, 2002, 13(7):901-905.
[20]Goodfellow M, Fiedler HP. A guide to successful bioprospecting:informed by actinobacterial systematics[J]. Antonie Van Leeuwenhoek, 2010, 98(2):119-142.
[21] 王宏梅, 赵心清. 可培养海洋放线菌生物多样性研究进展[J].微生物学通报, 2007, 34(5):996-1000.
[22] Ergan B, Coplu L, Alp A, et al. Mycobacterium smegmatis pneumonia[J]. Respirology, 2004, 9(2):283-295.
[23]Lechevalier HA, Lechevalier MP, Gerber NN, et al. The actinomycetes[M]Jena:Gustav-Fische, 1970.
[24]Stackebrandt E, Woese CR. Towards a phylogeny of the actinomycetes and related organisms[J]. Current Microbiology,1981, 5(4):197-202.
[25]Panchanathan M, Kyong-Hwa K, Kannan S, et al. Marine actinobacteria:An important source of bioactive natural products[J]. Environmental Toxicology and Pharmacology,2014, 38(1):172-188.
[26]Lahouuma A, Aouichea N, Bourasab C, et al. Antifungal activity of a Saharan strain of Actinomadura sp. ACD1 against toxigenic fungi and other pathogenic microorganisms[J]. Journal of Medical Mycology, 2016, 26(3):193-200.
[27]Mazzei E, Iorio M, Maffioli, et al. Characterization of madurastatin C1, a novel siderophore from Actinomadura sp.[J]. The Journal of Antibiotics, 2012, 65(5):267-269.
[28]Motoki T, Keiichiro M, Shams T, et al. JBIR-65, a new diterpene,isolated from a sponge-derived Actinomadura sp. SpB081030SC-15[J]. Cheminform, 2010, 41(49):401.
[29]Han XX, Cui CB, Gu QQ, et al. ZHD-0501, a novel naturally occurring staurosporine analog from Actinomadum sp.[J].Tetrahedron Letters, 2015, 46(36):6137-6140.
[30]Harada K, Tomita K, Fujii K, et al. Isolation and structural characterization of siderophores, madurastatins, produced by a pathogenic Actinomadura madurae[J]. Journal of Antibiotics,2004, 57(2):125-135.
[31]Dirlam JP, Belton AM, Bordner J, et al. CP-82, 996, a novel diglycoside polyether antibiotic related to monensin and produced by Actinomadura sp.[J]. Journal of Industrial Microbiology,1990, 6(2):135-177.
[32]Badji B, Zitouni A, Mathieu F, et al. Antimicrobial compounds produced by Actinomadura sp. AC104 isolated from an Algerian Saharan soil[J]. Canadian Journal of Microbiology, 2006, 52(4):373-382.
33] Maskey RP, Li FC, Qin S, Fiebig HH, Laatsch H. Chandrananimycins A ~ C :Production of novel anti-cancer antibiotics from a marine Actinomadura sp. isolate M048 by variation of medium composition and growth conditions[J]. Journal of Antibiotics,2003, 56(7):373-382.
[34]Chakapong I, Aibrohim D, Sumalee S, et al. 3-Oxyanthranilic acid derivatives from Actinomadura sp. BCC27169[J]. Cheminform,2014, 45(36):102.
Screening of Anti-Tuberculosis Marine Actinomycetes and the Bioactivity of Strain HY286
QU Jia ZHAO Ling-xia CHEN Rui LU Peng-peng SUN Xiao-yu SHEN Wei-rong
(Microbial Resource Center,Microbiology Institute of Shaanxi,Xi’an 710043)
Marine actinomycetes are recognized as an important resource of screening new anti-tuberculosis drugs and their precursor compounds. Nine marine actinomycetes strains with efficient antagonism to Mycobacterium smegmatis(Msm)were screened by plate confrontation method from 77 actinomycetes in shallow soil,Zhangzhou. One strain HY286 with the highest inhibitory effect was identified as Actinomadura genus by colony morphological,physiological and biochemical characteristics,and 16S rDNA sequence analysis. The MIC of fermentation crude extract of strain HY286 was 200 μg/mL,indicating that it had a significant inhibitory effect on Msm. The fermentation crude extract of strain HY286 also showed inhibitory effects on Bacillus subtilis and Bacillus pumilus,and the inhibition rate to HeLa and HepG2 was 89.3% and 94.2%,respectively.
anti-tuberculosis;Actinomadura;marine actinomycetes;screening;bioactivity
10.13560/j.cnki.biotech.bull.1985.2017-0388
2017-05-11
陕西省科技厅项目(2016FWPT-10),陕西省科学院科技计划项目(2014k-35-2)
瞿佳,女,硕士,研究实习员,研究方向:微生物资源;E-mail:q_jia@163.com
沈卫荣,男,研究员,研究方向:微生物菌种选育、发酵工程等应用微生物研究及产业化开发;E-mail:shenweirong@21cn.com
(责任编辑 狄艳红)

