儿童自身免疫性甲状腺疾病血清胃促生长素水平变化分析
潘 伟,莫江萍
儿童自身免疫性甲状腺疾病血清胃促生长素水平变化分析
潘 伟,莫江萍
目的观察儿童自身免疫性甲状腺疾病(autoimmune thyroid disease, AITD)血清胃促生长素(Ghrelin)水平的变化情况。方法选择儿童AITD 96例,根据甲状腺功能将其分为甲状腺功能亢进组50例和甲状腺功能减退组46例,另选取健康体检健康儿童50例作为正常对照组。观察比较甲状腺功能亢进组、甲状腺功能减退组治疗前及正常对照组健康体检时血清游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、促甲状腺激素(TSH)、促甲状腺激素受体抗体(TRAb)及胃促生长素水平,以及甲状腺功能亢进患儿、甲状腺功能减退患儿治疗前、治疗4~6周后和治疗缓解后血清FT3、FT4、TSH、TRAb、胃促生长素水平。结果甲状腺功能亢进组治疗前血清FT3、FT4和TRAb水平明显高于甲状腺功能减退组治疗前和正常对照组健康体检时,而血清TSH和胃促生长素水平明显低于甲状腺功能减退组治疗前和正常对照组健康体检时,差异均具有统计学意义(P<0.05)。甲状腺功能减退组治疗前血清FT3、FT4水平均低于正常对照组健康体检时,血清TSH、TRAb、胃促生长素水平均高于正常对照组健康体检时,差异有统计学意义(P<0.05)。与治疗前比较,治疗4~6周后和治疗缓解后甲状腺功能亢进患儿血清FT3、FT4和TRAb水平均下降,而血清TSH和胃促生长素水平均升高,其中除血清TRAb水平治疗4~6周后与治疗前比较差异无统计学意义外,余差异均有统计学意义(P<0.05);甲状腺功能减退患儿血清FT3、FT4水平均升高,而血清TSH、TRAb、胃促生长素水平均降低,其中除血清FT4、TRAb水平治疗4~6周后与治疗前比较差异无统计学意义外,余差异均有统计学意义(P<0.05)。与治疗4~6周后比较,治疗缓解后甲状腺功能亢进患儿血清FT3、FT4和TRAb水平均下降,而血清TSH 和胃促生长素水平均升高,差异有统计学意义(P<0.05);甲状腺功能减退患儿血清FT3、FT4水平均升高,而血清TSH、TRAb、胃促生长素水平均降低,差异有统计学意义(P<0.05)。结论血清胃促生长素水平可作为儿童AITD治疗效果监测与评价的指标。
甲状腺疾病,自身免疫性;儿童;胃促生长素
甲状腺在小儿神经系统早期发育以及生长发育过程中起着至关重要的作用。甲状腺疾病是一种临床较为常见的疾病,而自身免疫性甲状腺疾病(autoimmune thyroid disease, AITD)是机体对自身成分发生免疫应答而导致的疾病。AITD包括Graves病和慢性淋巴细胞性甲状腺炎、萎缩性甲状腺炎等,其中Graves病和慢性淋巴细胞性甲状腺炎是非碘缺乏地区儿童和青少年甲状腺增大的最为常见原因[1],严重影响小儿的生长发育。因此,对此类疾病及时诊断和治疗显得尤为重要,特别是儿童AITD早期治疗和护理。本研究以儿童AITD为研究对象,探讨儿童AITD血清胃促生长素(Ghrelin)水平变化情况,并对其影响因素进行分析,现报告如下。
1 资料与方法
1.1一般资料 选择2015年1月—2016年9月在广西科技大学第二附属医院就诊已明确诊断但未经治疗的儿童AITD 96例,根据甲状腺功能分为甲状腺功能亢进组(50例)和甲状腺功能减退组(46例)两组,甲状腺功能亢进症及甲状腺功能减退症诊断均符合中华医学会内分泌学分会“中国甲状腺疾病诊治指南”[1]中相关诊断标准;另选取同期在该院进行健康体检的健康儿童50例作为正常对照组。甲状腺功能亢进组男16例,女34例;年龄3.2~14.5(7.8±1.2)岁。甲状腺功能减退组男10例,女36例;年龄3.5~15.5(7.3±1.6)岁。正常对照组男22例,女28例;年龄3.8~14.8(7.6±1.3)岁。3组性别及年龄等一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2方法 甲状腺功能亢进组和甲状腺功能减退组分别于治疗前、治疗4~6周后和治疗缓解后抽取随机静脉血测定血清游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、促甲状腺激素(TSH)、促甲状腺激素受体抗体(TRAb)及胃促生长素水平,正常对照组于健康体检时抽取空腹静脉血测定血清FT3、FT4、TSH、TRAb及胃促生长素水平。血清FT3、FT4、TSH、TRAb及胃促生长素水平测定所用试剂盒均由贝克曼库尔特商贸(中国)有限公司提供,测定所用仪器为Unicel Dxi 800Access型号放射免疫计数仪。以上操作均由广西科技大学第二附属医院检验科检测人员专人完成,测定结果均以实验室正常范围为标准。甲状腺功能亢进组入院后给予甲巯咪唑治疗,甲状腺功能减退组入院后给予左甲状腺素钠治疗。
1.3观察指标 观察比较甲状腺功能亢进组、甲状腺功能减退组治疗前及正常对照组健康体检时血清FT3、FT4、TSH、TRAb、胃促生长素水平,以及甲状腺功能亢进患儿、甲状腺功能减退患儿治疗前、治疗4~6周后和治疗缓解后血清FT3、FT4、TSH、TRAb、胃促生长素水平。

2 结果
2.13组各项观察指标比较 甲状腺功能亢进组、甲状腺功能减退组治疗前及正常对照组健康体检时血清FT3、FT4、TSH、TRAb、胃促生长素水平总体比较差异具有统计学意义(P<0.05)。甲状腺功能亢进组治疗前血清FT3、FT4和TRAb水平明显高于甲状腺功能减退组治疗前和正常对照组健康体检时,而血清TSH和胃促生长素水平明显低于甲状腺功能减退组治疗前和正常对照组健康体检时,差异均具有统计学意义(血清FT3:t=12.08、P<0.001,t=11.54、P<0.001;血清FT4:t=14.27、P=0.006,t=13.09、P<0.001;血清TRAb:t=7.75、P<0.001,t=11.67、P<0.001;血清TSH:t=13.70、P<0.001,t=22.63、P<0.001;血清胃促生长素:t=15.12、P<0.001,t=10.27、P<0.001)。甲状腺功能减退组治疗前血清FT3、FT4水平均低于正常对照组健康体检时,血清TSH、TRAb、胃促生长素水平均高于正常对照组健康体检时,差异具有统计学意义(血清FT3:t=4.36、P<0.001;血清FT4:t=7.47、P<0.001;血清TRAb:t=11.63、P<0.001;血清TSH:t=12.87、P<0.001;血清胃促生长素:t=10.90、P<0.001)。见表1。
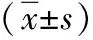
表1 甲状腺功能亢进、甲状腺功能减退患儿治疗前及健康儿童健康体检时各项观察指标比较
注:甲状腺功能亢进组为甲状腺功能亢进患儿,甲状腺功能减退组为甲状腺功能减退患儿,正常对照组为健康体检健康儿童;FT3为游离三碘甲状腺原氨酸,FT4为游离甲状腺素,TSH为促甲状腺激素,TRAb为促甲状腺激素受体抗体;与甲状腺功能亢进组同一指标比较,aP<0.05;与甲状腺功能减退组同一指标比较,cP<0.05
2.2甲状腺功能亢进患儿治疗前后各项观察指标比较 甲状腺功能亢进患儿治疗前、治疗4~6周后及治疗缓解后各项观察指标总体比较差异均具有统计学意义(P<0.05)。与治疗前比较,治疗4~6周后和治疗缓解后甲状腺功能亢进患儿血清FT3、FT4和TRAb水平均下降,而血清TSH和胃促生长素水平均升高,其中除血清TRAb水平治疗4~6周后与治疗前比较差异无统计学意义外,余差异均具有统计学意义(血清FT3:t=6.77、P<0.001,t=11.28、P<0.001;血清FT4:t=7.29、P<0.001,t=12.57、P<0.001;血清TRAb:t=0.97、P=0.331,t=9.98、P<0.001;血清TSH:t=3.16、P=0.002,t=13.13、P<0.001;血清胃促生长素:t=2.87、P=0.004,t=5.73、P<0.001)。与治疗4~6周后比较,治疗缓解后甲状腺功能亢进患儿血清FT3、FT4和TRAb水平均下降,而血清TSH 和胃促生长素水平均升高,差异具有统计学意义(血清FT3:t=5.86、P<0.001;血清FT4:t=6.58、P<0.001;血清TRAb:t=11.06、P<0.001;血清TSH:t=12.41、P<0.001;血清胃促生长素:t=2.98、P=0.003)。见表2。
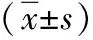
表2 甲状腺功能亢进患儿50例治疗前后各项观察指标比较
注:FT3为游离三碘甲状腺原氨酸,FT4为游离甲状腺素,TSH为促甲状腺激素,TRAb为促甲状腺激素受体抗体;与治疗前同一指标比较,aP<0.05;与治疗4~6周后同一指标比较;cP<0.05
2.3甲状腺功能减退患儿治疗前后各项观察指标比较 甲状腺功能减退患儿治疗前、治疗4~6周后及治疗缓解后各项观察指标总体比较差异均有统计学意义(P<0.05)。与治疗前比较,治疗4~6周后和治疗缓解后甲状腺功能减退患儿血清FT3、FT4水平均升高,而血清TSH、TRAb、胃促生长素水平均降低,其中除血清FT4、TRAb水平治疗4~6周后与治疗前比较差异无统计学意义外,余差异均有统计学意义(血清FT3:t=2.03、P=0.045,t=5.11、P<0.001;血清FT4:t=1.89、P=0.060,t=4.43、P<0.001;血清TRAb:t=1.53、P=0.130,t=11.24、P<0.001;血清TSH:t=4.27、P<0.001,t=12.25、P<0.001;血清胃促生长素:t=2.90、P=0.047,t=7.39、P<0.001)。与治疗4~6周后比较,治疗缓解后甲状腺功能减退患儿血清FT3、FT4水平均升高,而血清TSH、TRAb、胃促生长素水平均降低,差异有统计学意义(血清FT3:t=4.11、P=0.001;血清FT4:t=2.81、P=0.006;血清TRAb:t=4.08、P=0.001;血清TSH:t=12.91、P<0.001;血清胃促生长素:t=4.76、P<0.001)。见表3。
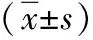
表3 甲状腺功能减退患儿46例治疗前后各项观察指标比较
注:FT3为游离三碘甲状腺原氨酸,FT4为游离甲状腺素,TSH为促甲状腺激素,TRAb为促甲状腺激素受体抗体;与治疗前同一指标比较,aP<0.05;与治疗4~6周后同一指标比较,cP<0.05
3 讨论
近年各种因素导致儿童AITD的发病率逐年增高[2-5]。AITD包括Graves病和慢性淋巴细胞性甲状腺炎等[6-8]。Graves病和慢性淋巴细胞性甲状腺炎的致病机制不同,Graves病主要是由于各种致病因素引起甲状腺组织增生及功能亢进,几乎所有儿童甲状腺功能亢进症都是由Graves病引起的。由于儿童Graves病发展比较缓慢,常不能及时发现,从而易延误病情。Graves病常见临床表现包括烦躁不安、多食易饥且体重下降、怕热、多汗、手抖,并可逐渐出现甲状腺增大及突眼、心率增快症状。慢性淋巴细胞性甲状腺炎主要是由于遗传和环境等各种致病因素引起甲状腺组织破坏,导致甲状腺自身抗体形成。慢性淋巴细胞性甲状腺炎临床上主要表现为甲状腺破坏、萎缩及甲状腺功能减退,患儿常出现生长发育迟缓、食欲减退,伴面部黏液性水肿、怕冷、少汗、乏力、腹胀及便秘等临床症状,并可出现代偿性甲状腺增大、血压降低及心率缓慢等体征[9]。
胃促生长素是生长激素释放激素、食欲刺激肽和生长激素促分泌激素受体相关的内源性配体,跟垂体生长激素促分泌素受体结合后能促进生长激素释放[10]。胃促生长素主要由胃底部胃促生长素细胞合成,绝大部分胃促生长素来源于胃,其他来源于肠道[11]。胃促生长素在甲状腺、肠管、心脏和下丘脑等组织中均有,尤其在胃组织中的浓度最高,有广泛的生理作用。胚胎期8周至20周时甲状腺组织中胃促生长素与胃黏膜中的浓度接近,提示甲状腺组织是胚胎期胃促生长素产生的重要来源[12-13]。胃促生长素具有调节垂体生长激素及糖皮质激素等激素释放作用,可增进食欲,参与能量代谢,影响心血管功能,在自身免疫性疾病的发生、发展中发挥重要作用。它是引起儿童食欲增强的关键性激素,并能和其他的因素一起调节食欲,起到调节能量代谢平衡的作用。
儿童甲状腺功能亢进症通常表现为代谢功能亢进,代偿甲状腺素水平增加引起食欲旺盛,血清中胃促生长素浓度降低,经过治疗临床症状消失后血清胃促生长素浓度可以恢复正常[13]。而儿童甲状腺功能减退症则表现为代谢功能低下,代偿甲状腺激素降低而引起食欲不振,血清中胃促生长素浓度增加,经过治疗临床症状消失后血清胃促生长素可恢复正常。
TRAb检测对AITD诊断具有重要意义,它可以模仿TSH 的作用,与甲状腺细胞上的TSH 受体结合,引起甲状腺组织增生及甲状腺激素合成与分泌,从而导致甲状腺功能紊乱。在AITD早期TRAb可升高,TRAb可视为甲状腺功能亢进症的标志性抗体[14]。AITD经治疗后TRAb慢慢下降,提示临床缓解,也可作为药物治疗停药的依据之一。
本研究以儿童AITD为研究对象,测定患儿血清FT3、FT4、TSH、TRAb、胃促生长素水平,评价AITD包括甲状腺功能亢进和甲状腺功能减退患儿血清中胃促生长素变化情况及其相关的作用,探讨胃促生长素作为AITD疗效监测和评价指标的可能性[15]。胃促生长素在儿童AITD中参与调节体内各种激素水平及能量代谢平衡。本研究结果显示,在甲状腺功能亢进患儿中血清胃促生长素水平在疾病早期是降低的,经甲巯咪唑治疗后,当治疗缓解时血清胃促生长素水平升高;而在甲状腺功能减退患儿中血清胃促生长素水平在疾病早期是升高的,经左甲状腺素钠治疗后,当治疗缓解时血清胃促生长素水平降低。说明儿童甲状腺功能亢进时,症状越严重,血清胃促生长素水平会越低;而儿童甲状腺功能减退时,症状越严重,血清胃促生长素水平则会越高[16]。儿童AITD早期TRAb均升高,特别是甲状腺功能亢进患儿TRAb升高显著,经治疗后TRAb均缓慢下降,与血清胃促生长素水平无明显关系。说明在儿童AITD中,血清胃促生长素水平随着甲状腺功能亢进或减退而降低或升高,随着甲状腺功能好转及正常血清胃促生长素水平可逐渐恢复正常,这与以往文献报道基本一致[17]。因此,我们认为血清胃促生长素水平可作为儿童AITD治疗效果监测与评价的指标,可为临床医师在对儿童AITD治疗效果进行判断时提供参考。
[1] 颜纯.小儿内分泌学[M].北京:人民卫生出版社,1991:175-184.
[2] 叶玉峰,江潮,邵迎新,等.益气化瘀法在自身免疫性甲状腺疾病中的应用[J].中国医药导报,2016,13(10):80-83,107.
[3] 姚秋明,张健,徐健,等.不同亚型自身免疫性甲状腺疾病患者血清25-(OH)D3的改变[J].中国综合临床,2015,31(10):887-890.
[4] 汪宁,陈欢, 赵真真,等.甲状腺激素不敏感综合征合并自身免疫性甲状腺疾病5例报道并文献复习[J].疑难病杂志,2016,15(2):191-194.
[5] 陈娟.丙硫氧嘧啶联合氟羟强的松龙治疗自身免疫性甲状腺疾病伴甲亢70例临床研究[J].中国现代医生,2013,51(15):75-76,78.
[6] 张健,李翠,秦秋,等.细胞趋化因子受体-5和CD57在自身免疫性甲状腺疾病中的表达及意义[J].中国综合临床,2012,28(4):337-340.
[7] 魏宏英.桥本甲状腺炎的超声诊断及误诊分析[J].中国煤炭工业医学杂志,2010,13(12):1861.
[8] 杨玉,杨利,谢理铃,等.儿童自身免疫性甲状腺疾病血清Th1/Th2水平变化的临床意义[J].临床荟萃,2009,24(2):149-150.
[9] 桂永浩,薛辛东.儿科学[M].3版.北京:人民卫生出版社,2015:423-431.
[10] 郁海静,张静,丁士刚,等.血清Ghrelin和瘦素水平与幽门螺杆菌感染的关系研究[J].中国全科医学,2011,14(25):2887-2990.
[11] 胡天一,刘戈力,杨箐岩,等.儿童自身免疫性甲状腺疾病120 例临床诊治和相关因素分析[J].天津医科大学学报,2009,15(1):88-91.
[12] 付德龙.儿童自身免疫性甲状腺疾病患者血清Ghrelin水平变化及其影响因素的研究[D].天津:天津医科大学,2011.
[13] 杜娟,王长江,胡红琳,等.多囊卵巢综合征患者空腹血清Ghrelin 水平变化及相关因素分析[J].安徽医科大学学报,2013,48(2):178-181.
[14] 何永玲,石青峰.甲状腺病患者血清中自身抗体的检测及应用进展[J].华夏医学,2010,23(3):328-331.
[15] 倪桂臣,江载芳,胡亚美.诸福棠实用儿科学[M].7 版.北京:人民卫生出版社,2002:2007-2012.
[16] 程晓红,刘德润.儿童临床甲状腺疾病特点及相关因素初步调查[J].山西医科大学学报,2006,37(5):550-551.
[17] 苏晓辉,刘守军,叶永祥,等.2002 年中国8~10岁儿童甲状腺肿大率分析[J].中国地方病学杂志,2004,23(1):55-57.
ChangesofSerumGhrelinLevelsinChildrenwithAutoimmuneThyroidDisease
PAN Wei1, MO Jiang-ping2
(1. Department of Nuclear Medicine, the Second Affiliated Hospital of Guangxi University of Science and Technology, Liuzhou, Guangxi 545006, China; 2. Department of Pediatrics, School of Medicine, Guangxi University of Science and Technology, Liuzhou, Guangxi 545006, China)
ObjectiveTo observe changes of serum ghrelin levels in children with autoimmune thyroid disease (AITD).MethodsA total of 96 children with AITD were divided into hyperthyroidism group (n=50) and hypothyroidism group (n=46) according to thyroid function, and other 50 healthy children were selected as control group. Serum free triiodothyronine (FT3), free thyroxine (FT4), thyroid stimulating hormone (TSH), thyrotrophin receptor antibody (TRAb) and ghrelin levels in hyperthyroidism and hypothyroidism groups before treatment and at the time of taking medical examination in control group, and serum FT3, FT4, TSH, TRAb and ghrelin levels in hyperthyroidism and hypothyroidism groups before treatment, after treatment for 4-6 weeks and after remission were observed and compared.ResultsBefore treatment in hyperthyroidism group, serum FT3, FT4 and TRAb levels were significantly higher, while serum TSH and ghrelin levels were significantly lower than those before treatment in hypothyroidism group and at the time of taking medical (P<0.05). Before treatment in hypothyroidism group, serum FT3 and FT4 levels were lower, while serum TSH, TRAb and ghrelin levels were higher than those at the time of taking medical examination in control group, and the differences were statistically significant (P<0.05). Compared with those before treatment, after treatment for 4-6 weeks and after remission in hyperthyroidism group, serum FT3, FT4 and TRAb levels were decreased, while serum TSH and ghrelin levels were increased, and the differences were statistically significant excepted for TRAb level after treatment for 4-6 weeks (P<0.05). In patients with hypothyroidism, serum FT3 and FT4 levels were increased, while serum TSH, TRAb and ghrelin levels were decreased, and the differences were statistically significant excepted for serum FT4 and TRAb levels after treatment for 4-6 weeks compared with those before treatment (P<0.05). Compared with those after treatment for 4-6 weeks, in children with hyperthyroidism, serum FT3, FT4 and TRAb were significantly decreased, while serum TSH and ghrelin levels were significantly increased (P<0.05); in children with hypothyroidism, serum FT3 and FT4 levels were significantly increased, while serum TSH, TRAb and ghrelin levels were significantly decreased (P<0.05).ConclusionSerum ghrelin level can be used as an indicator for monitoring and evaluating the therapeutic efficacy of children with AITD.
Thyroid diseases, autoimmune; Child; Ghrelin
2015广西高校科学技术研究立项项目(KY2015LX195)
545006 广西 柳州,广西科技大学第二附属医院核医学科(潘伟);545006 广西 柳州,广西科技大学医学院儿科教研室 (莫江萍)
莫江萍,电话:13627722966;E-mail:mjp132@126.com
R581;R725.8
A
1002-3429(2017)11-0077-05
10.3969/j.issn.1002-3429.2017.11.024
2017-08-05 修回时间:2017-09-02)

