血清和肽素及白细胞介素33与青年缺血性脑卒中关联性分析
冯 霞,仝秀清,彭粉花
血清和肽素及白细胞介素33与青年缺血性脑卒中关联性分析
冯 霞,仝秀清,彭粉花
目的探讨血清和肽素及白细胞介素33(IL-33)与青年缺血性脑卒中的关联性。方法选择2013年1月—2016年1月内蒙古医科大学附属医院收治的青年缺血性脑卒中80例作为青年缺血性脑卒中组,另选择同期在该院行健康体检的健康体检者80例作为健康体检组。据Toast分型将80例青年缺血性脑卒中分为动脉粥样硬化型组41例,心源性栓塞型组20例,小动脉闭塞型组18例,其他明确病因型组1例,其他明确病因型组因病例数过少不进入亚组分析。观察比较青年缺血性脑卒中组、健康体检组及动脉粥样硬化型组、心源性栓塞型组、小动脉闭塞型组血清甘油三酯、总胆固醇、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇、尿酸、和肽素及IL-33水平,并对青年缺血性脑卒中的危险因素及和肽素与IL-33相关性进行分析。结果青年缺血性脑卒中组血清甘油三酯、总胆固醇、低密度脂蛋白胆固醇、尿酸、和肽素及IL-33水平均高于健康体检组,血清高密度脂蛋白胆固醇水平低于健康体检组,两组比较差异有统计学意义(P<0.05)。血清和肽素及IL-33水平,动脉粥样硬化型组高于心源性栓塞型组和小动脉闭塞型组,心源性栓塞型组高于小动脉闭塞型组,差异均有统计学意义(P<0.05)。多因素Logistic逐步回归分析显示血清甘油三酯、高密度脂蛋白胆固醇及IL-33是青年缺血性脑卒中的独立危险因素(P<0.05)。Pearson相关分析显示血清和肽素与IL-33显著相关(r=0.544,P<0.001) 。结论血清和肽素及IL-33与青年缺血性脑卒中发病及Toast分型均显著相关。
卒中;青年人;和肽素;白介素-33;危险因素
缺血性脑卒中是临床上较为常见的一种脑卒中类型,主要由于各种因素造成脑部血液供应障碍,进而导致脑组织缺血性坏死,临床表现为神经功能缺损,严重影响患者的生活质量,甚至可导致患者死亡[1-2]。缺血性脑卒中主要见于老年人,然而近些年来青年缺血性脑卒中发病率呈逐渐上升趋势[3]。青年缺血性脑卒中指45岁以下青年人发生的脑卒中,发病约占脑卒中总人数的10%左右[4-5]。脑卒中可导致患者出现残疾、失语及痴呆等严重的并发症,治疗方法有限[6-7]。因此,分析脑卒中的发病危险因素,并进一步加强预防具有十分重要的临床意义。
既往研究显示年龄、高血压病、高脂血症及颈动脉狭窄等是脑卒中发病的独立危险因素[8-9]。近年来,多项研究结果显示精氨酸加压素与不稳定性心绞痛及脑卒中发生显著相关,然而精氨酸加压素半衰期短(10~20 min),以脉冲形式入血,故临床分析精氨酸加压素与青年缺血性脑卒中的关联性具有很大局限[10]。和肽素是精氨酸加压素前体物质C末端的一部分,临床检测较为方便。有临床研究显示和肽素与脑卒中病灶大小及美国国立卫生研究院脑卒中量表评分(national institute of health stroke scale, NIHSS)呈明显正相关[11-12]。另外,有研究显示白细胞介素33(IL-33)与炎症性疾病关系密切[13]。不同Toast分型脑卒中病因及发病危险因素不同,有关和肽素及IL-33与青年缺血性脑卒中Toast分型的关系在我国人群中的研究尚未见报道。本研究探讨和肽素及IL-33与青年缺血性脑卒中的关联性,现报告如下。
1 资料与方法
1.1一般资料 选择2013年1月—2016年1月内蒙古医科大学附属医院收治的符合纳入及排除标准的青年缺血性脑卒中80例作为青年缺血性脑卒中组。另选择同期在该院进行健康体检的健康体检者80例作为健康体检组。青年缺血性脑卒中组男56例,女24例;年龄(31.74±6.90)岁;体重指数(23.49±2.43)kg/m2。健康体检组男56例,女24例;年龄(31.65±6.78)岁;体重指数(23.54±2.45)kg/m2。两组性别、年龄和体重指数等一般资料比较差异无统计学意义(P>0.05),具有可比性。所有研究对象对本研究均知情同意并签署知情同意书,且本研究通过我院医学伦理委员会批准。
根据Toast分型将80例青年缺血性脑卒中分为动脉粥样硬化型组41例、心源性栓塞型组20例、小动脉闭塞型组18例、其他明确病因型组1例。其他明确病因型组因病例数过少未行亚组分析。
1.2纳入及排除标准 纳入标准:①脑卒中(a.有明显症状和体征;b.头颅CT或MRI检查示新发脑梗死);②年龄18~45岁;③发病后24 h内入院;④未接受脑卒中相关治疗。排除标准:①其他类型脑血管疾病;②原发性或继发性脏器功能不全;③严重感染;④肿瘤;⑤妊娠;⑥抑郁;⑦精神病。
1.3观察指标 观察比较青年缺血性脑卒中组、健康体检组及动脉粥样硬化型组、心源性栓塞型组、小动脉闭塞型组血甘油三酯、总胆固醇、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇、尿酸、和肽素和IL-33水平,并对青年缺血性脑卒中的危险因素及血清和肽素与IL-33相关性进行分析。
1.4检测方法 入院时或健康体检时抽取患者肘静脉血进行检测:①甘油三酯、总胆固醇、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇和尿酸采用全自动生化分析仪(日本日立公司生产)检测;②和肽素采用酶联免疫吸附试验(ILISA)法测定,人和肽素检测试剂盒购于上海威奥生物科技有限公司,检测方法严格按照试剂盒说明书进行;③IL-33采用ILISA法测定,人IL-33检测试剂盒购于上海威奥生物科技有限公司,检测方法严格按照试剂盒说明书进行。

2 结果
2.1青年缺血性脑卒中组和健康体检组血清指标比较 青年缺血性脑卒中组血清甘油三酯、总胆固醇、低密度脂蛋白胆固醇、尿酸、和肽素和IL-33水平均高于健康体检组,血清高密度脂蛋白胆固醇水平低于健康体检组,两组比较差异有统计学意义(P<0.05),见表1。
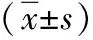
表1 青年缺血性脑卒中和健康体检两组血清指标比较
2.2不同Toast分型青年缺血性脑卒中患者血清指标比较 动脉粥样硬化型组、心源性栓塞型组和小动脉闭塞型组血清和肽素和IL-33水平总体比较差异均有统计学意义(P<0.05)。血清和肽素及IL-33水平,动脉粥样硬化型组高于心源性栓塞型组和小动脉闭塞型组,心源性栓塞型组高于小动脉闭塞型组,差异均有统计学意义(P<0.05)。见表2。
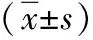
表2 不同Toast分型青年缺血性脑卒中3组血清指标比较
注:与动脉粥样硬化型组同一指标比较,aP<0.05;与心源性栓塞型组同一指标比较,cP<0.05
2.3青年缺血性脑卒中危险因素分析 多因素Logistic逐步回归分析显示血清甘油三酯、高密度脂蛋白胆固醇及IL-33是青年缺血性脑卒中的独立危险因素(P<0.05),见表3。

表3 青年缺血性脑卒中危险因素的多因素Logistic逐步回归分析
2.4血清和肽素与IL-33相关性分析 Pearson相关分析显示血清和肽素与IL-33显著相关(r=0.544,P<0.001),见图1。

图1青年缺血性脑卒中患者血清和肽素与白细胞介素-33Pearson相关分析
3 讨论
既往认为缺血性脑卒中是一种老年病,但近年青年缺血性脑卒中发病率呈逐年增高趋势。缺血性脑卒中青年发病往往危害更大,严重影响患者生活质量。为探讨青年缺血性脑卒中发病的危险因素,国内外学者进行了大量的临床研究,现已明确吸烟、酗酒、高血压病和糖尿病等因素是青年缺血性脑卒中的独立危险因素。目前临床发现血清和肽素及IL-33与心血管疾病密切相关,为探讨青年缺血性脑卒中发病是否与血清和肽素及IL-33相关,我们设计了本研究。本研究结果显示,青年缺血性脑卒中组血清甘油三酯、总胆固醇、低密度脂蛋白胆固醇、尿酸、和肽素和IL-33水平高于健康体检组,血清高密度脂蛋白胆固醇水平低于健康体检组,两组比较差异有统计学意义;血清和肽素及IL-33水平,动脉粥样硬化型组高于心源性栓塞型组和小动脉闭塞型组,心源性栓塞型组高于小动脉闭塞型组,差异均有统计学意义。表明血清和肽素及IL-33与青年缺血性脑卒中发病相关。本研究行多因素Logistic逐步回归分析显示血清甘油三酯、高密度脂蛋白胆固醇及IL-33是青年缺血性脑卒中的独立危险因素。2015年Planas[13]发现IL-33作为一种炎性介质,诱导脑卒中的发生。同一年Korhonen等[14]也发现IL-33与脑卒中相关。近几年,和肽素被发现与脑卒中发病密切相关[15-17]。然而截至目前,尚未有研究探讨血清和肽素及IL-33与青年缺血性脑卒中的关联性。青年缺血性脑卒中与老年缺血性脑卒中发病机制不尽相同,本研究探讨血清和肽素及IL-33与青年缺血性脑卒中的关联性具有一定创新性和临床意义。
不同Toast分型脑卒中患者发病机制显著不同[18-21],我们推测不同Toast分型脑卒中患者血清和肽素及IL-33不同。本研究依据Toast分型将80例青年缺血性脑卒中分为动脉粥样硬化型组、心源性栓塞型组、小动脉闭塞型组、其他明确病因型组,其他明确病因型组因病例数过少未行亚组分析,结果显示动脉粥样硬化型组、心源性栓塞型组和小动脉闭塞型组血清和肽素及IL-33水平总体比较差异均有统计学意义;血清和肽素及IL-33水平,动脉粥样硬化型组高于心源性栓塞型组和小动脉闭塞型组,心源性栓塞型组高于小动脉闭塞型组,差异均有统计学意义。造成不同Toast分型青年缺血性脑卒中血清和肽素及IL-33不同的原因现尚不清楚,有待进一步动物和临床研究证实。本研究因病例数相对较少,仅有1例其他明确病因型,无一例不明原因型,故未对其他明确病因型和不明原因型患者血清和肽素及IL-33水平进行探讨,这是本研究的一个主要不足。
总之,血清和肽素、IL-33与青年缺血性脑卒中发病及Toast分型均显著相关。
[1] Lee S J, Lee D G. Relationship between kidney dysfunction and ischemic stroke outcomes: albuminuria, but not estimated glomerular filtration rate, is associated with the risk of further vascular events and mortality after stroke[J].PLoS One, 2016,11(5):123-129.
[2] Froyshov H M, Bjornerem A, Engstad T,etal. Elevated inflammatory markers predict mortality in long-term ischemic stroke- survivors: a population- based prospective study[J].Aging Clin ExP Res, 2016,21(3):423-428.
[3] Park W B, Cho J S, Shin S D,etal. Comparison of epidemiology, emergency care, and outcomes of acute ischemic stroke between young adults and elderly in Korean population: a multicenter observational study[J].J Korean Med Sci, 2014,29(7):985-991.
[4] Yitshak Sade M, Novack V, Ifergane G,etal. Air pollution and ischemic stroke among young adults[J].Stroke, 2015,46(12):3348-3353.
[5] Chiu Y C, Bai Y M, Su T P,etal. Ischemic stroke in young adults and preexisting psychiatric disorders: a nationwide case-Control study[J].Medicine (Baltimore), 2015,94(38):1520.
[6] Saeed S, Waje Andreassen U, Lonnebakken M T,etal. Covariates of non-dipping and elevated night-time blood pressure in ischemic stroke patients: the Norwegian Stroke in the Young Study[J].Blood Press, 2015,21(3):1-7.
[7] Liu L, Yang F, Li M,etal. Aggressive medical care in young chinese patients with ischemic stroke of undetermined etiology: a retrospective study[J].Interv Neurol, 2015,3(1):56-66.
[8] Kawle A P, Nayak A R, Lande N H,etal. Comparative evaluation of risk factors, outcome and biomarker levels in young and old acute ischemic stroke patients[J].Ann Neurosci, 2015,22(2):70-77.
[9] Kvetkovskaya A A, Evseveva M E, Martynov M Y,etal. Characteristics of risk factors in young and middle-aged patients with first hemispheric ischemic stroke[J].Zh Nevrol Psikhiatr Im S S Korsakova, 2015,115(12):13-18.
[10] Zhao X Y, Wu C F, Yang J,etal. Effect of arginine vasopressin on the cortex edema in the ischemic stroke of Mongolian gerbils[J].Neuropeptides, 2015,51(3):55-62.
[11] Jiao L, Chu C, Zhou S. Prognostic value of copeptin in patients with acute stroke[J].Expert Rev Neurother, 2015,15(5):563-570.
[12] Tu W J, Chen H, Cui L H. Prognostic value of copeptin in patients with acute ischemic stroke[J].Iran J Neurol, 2011,10(3-4):58.
[13] Planas A M. Immunomodulatory role of IL-33 counteracts brain inflammation in stroke[J].Brain Behav Immun, 2015,50(3):39-40.
[14] Korhonen P, Kanninen K M, Lehtonen S,etal. Immunomodulation by interleukin-33 is protective in stroke through modulation of inflammation[J].Brain Behav Immun, 2015,49(6):322-336.
[15] Wendt M, Ebinger M, Kunz A,etal. Copeptin levels in patients with acute ischemic stroke and stroke mimics[J].Stroke, 2015,46(9):2426-2431.
[16] Maravic Stojkovic V, Lausevic Vuk L J, Obradovic M,etal. Copeptin level after carotid endarterectomy and perioperative stroke[J].Angiology, 2014,65(2):122-129.
[17] Fluri F, Morgenthaler N G, Mueller B,etal. Copeptin, procalcitonin and routine inflammatory markers-predictors of infection after stroke[J].PLoS One, 2012,7(10):483-489.
[18] Dziadkowiak E, Chojdak Lukasiewicz J, Guzinski M,etal. The usefulness of the TOAST classification and prognostic significance of pyramidal symptoms during the acute phase of cerebellar ischemic stroke[J].Cerebellum, 2016,15(2):159-164.
[19] Mc Ardle P F, Kittner S J, Ay H,etal. Agreement between TOAST and CCS ischemic stroke classification: the NINDS SiGN study[J].Neurology, 2014,83(18):1653-1660.
[20] 鲁瑞涛,仝秀清,王淑芳.青年缺血性脑卒中患者不同TOAST分型病因及危险因素分析[J].临床误诊误治,2016,29(11):103-108.
[21] 陈漫清,黄书晖.青中年缺血性脑卒中患者颈动脉超声特点及相关危险因素的分析[J].临床荟萃,2015,30(10):1140-1143.
CorrelationsAnalysisbetweenSerumCopeptinandInterleukin-33withYoungPatientswithCerebralIschemicStroke
FENG Xiaa, TONG Xiu-qingb, PENG Fen-huaa
(a. Emergency Department, b. Department of Neurology, Affiliated Hospital of Inner Mongolia Medical University, Hohhot 010050, China)
ObjectiveTo investigate correlations between serum copeptin and interleukin-33 (IL-33) with young patients with cerebral ischemic stroke (CIS).MethodsA total of 80 young patients with CIS admitted during January 2013 to January 2016 were selected as CIS group, while other 80 healthy people taking medical examination at the same period were selected as control group. Patients in CIS group were divided into atherosclerosis subgroup (n=41), cardiogenic embolism subgroup (n=20), arterioles occlusion subgroup (n=18) and other confirming cause of disease subgroup (n=1), but the confirming cause of disease subgroup did not be entered the subgroup analysis because of few patients' number. Levels of serum triglycerides (TG), total cholesterol (TC), low density lipoprotein cholesterol (LDL-Ch), high density lipoprotein cholesferol (HDL-C), uric acid, copeptin and IL-33 were observed and compared between CIS and control groups, and among atherosclerosis, cardiogenic embolism and arterioles occlusion subgroups. Risk factors and correlations between serum copeptin and IL-33 levels were analyzed in CIS group.ResultsTG, TC, LDL-Ch, blood uric acid, copeptin and IL-33 levels in CIS group were significantly higher while serum HDL-C level was significantly lower than those in control group (P<0.05). The copeptin and IL-33 levels in atherosclerosis subgroup were significantly higher than those in cardiogenic embolism subgroup, and the levels in cardiogenic embolism subgroup were significantly higher than those in arterioles occlusion subgroup (P<0.05). Multifactor Logistic gradual regressive analysis showed that TG, HDL-C and IL-33 were independent risk factors of young patients with CIS (P<0.05). Pearson correlation analysis shows that copeptin and IL-33 are significant relation (r=0.544,P=0.001).ConclusionCopeptin and IL-33 levels are associated with the pathogenesy and Toast classification of young patients with cerebral ischemic stroke .
Stroke; Young adult; Copeptin; Interleukin-33; Risk factors
内蒙古自治区自然科学基金项目(2011MS1155)
010050 呼和浩特,内蒙古医科大学附属医院急诊科(冯霞、彭粉花),神经内科(仝秀清)
彭粉花,电话:13734848695;E-mail:pengfenhua1971@163.com
R743
A
1002-3429(2017)11-0089-05
10.3969/j.issn.1002-3429.2017.11.027
2017-08-02 修回时间:2017-09-01)

