儿童腹型过敏性紫癜临床分析
刘福娟 张东风 刘玲 李春珍 杨艳君 尹美娜 崔洁媛 袁晓颖
·论著·
儿童腹型过敏性紫癜临床分析
刘福娟 张东风 刘玲 李春珍 杨艳君 尹美娜 崔洁媛 袁晓颖
目的为儿童腹型过敏性紫癜患儿的早期诊断、病情判断、评估预后、危险预测和药物治疗提供参考依据。方法腹型过敏性紫癜初诊患儿100例作为研究对象,对符合入组条件的患儿按照有无消化道出血症状分为消化道出血组(n=54)和无出血组(n=46)。将所有患儿性别、年龄、临床表现以及入院2 d内所做的血尿便常规、便潜血、C-反应蛋白、血沉、血IgA水平、肝肾功能、心电图及肠道超声检查进行分析。肠道超声主要观察肠管壁厚度、腹腔积液、肠系膜淋巴结情况。分析各项指标在2组之间的差异。结果消化道出血组患儿较无出血组患儿更易合并窦性心动过缓,2组比较差异有统计学意义(Plt;0.05),2组合并呕吐、关节肿痛、腹痛先于皮疹等发生率比较差异无统计学意义(Pgt;0.05)。2组WBC、PLT、CRP增高,ESR增快,蛋白尿和(或)血尿、IgA增高发生率比较,差异无统计学意义(Pgt;0.05)。消化道出血组肠管壁增厚发生率高于无出血组,差异有统计学意义(Plt;0.05)。B超检查示不同程度节段性或广泛性肠壁增厚的患儿为49例;病变多位于小肠,增厚范围3~11 mm;29例患儿合并腹腔淋巴结肿大,20例患儿合并腹腔积液。经抗炎及对症治疗 3~7 d,患儿腹痛明显缓解,49例患儿均行超声复查,3例增厚的肠壁(gt;7 mm)恢复至 4~6 mm,肠壁血流信号较前明显减少;46例增厚的肠壁(3~7 mm)基本恢复正常。结论腹型过敏性紫癜有消化道出血发生窦性心动过缓的概率高于无消化道出血患儿,腹型过敏性紫癜患儿肠管壁增厚可能是消化道出血的一个重要先兆,对于腹型过敏性紫癜患儿应早期行肠道超声检查,呕吐、关节等症状及各项化验检查指标无特异性,与消化道出血的出生与否没有特定联系,但结合患儿临床表现,对疾病诊治有一定的指导意义。
儿童;腹型过敏性紫癜;消化道出血;肠管壁增厚;窦性心动过缓
过敏性紫癜(Henoch-Schonlein purpura,HSP),是常见的一种系统性血管炎,是因含IgA的免疫复合物在血管内沉积而引起的血管变态应性及出血性疾病[1]。临床表现为非血小板减少性紫癜、关节炎或关节痛、腹痛、胃肠道出血以及肾炎等。以学龄前期及学龄期儿童多发,且随着环境污染的越发严重,近年来患HSP的儿童逐年增多。本病并发症多,且病情容易反复,为患儿及其家长的身心带来了极大的痛苦。其中以侵犯胃肠毛细血管及细小动脉为主的腹型HSP,临床上以剧烈腹痛为主要表现,部位不定,部分患儿以腹部症状首发,极易引起误诊。10%~40%的腹型HSP患儿以胃肠道症状为首发临床表现。消化道出血是腹型HSP的严重并发症,18%~52%的腹型HSP患儿可出现消化道出血[2]。尤其是胃肠道出现出血量大且速度快的情况时,甚至会导致患儿出现致命性的失血性休克,因此早期及合理积极的诊治是关键。为了提高对腹型[1]的早期认识,应及早诊断和及时治疗,缩短治疗疗程,防止并发症的发生。本研究通过观察分析肠管壁厚度以及血尿便常规、血清IgA、血沉、C-反应蛋白(CRP)、ESR、心电图、生化检查等实验室检查指标。看是否能成为消化道出血危险预测的信号,为早期诊断和临床诊疗提供参考和依据。
1 资料与方法
1.1 一般资料 选取2014年11月至2015年10月住院的腹型HSP初诊患儿100例作为研究对象,包括男60例,女40例;年龄3~13岁,平均年龄(6.8±2.3)岁。均为初次发病,且处于急性期(病程lt;7 d)。腹型HSP的诊断符合第八版《诸福棠实用儿科学》的HSP诊断标准[3],并以腹痛、便血及呕吐等消化道症状为主要临床表现。将临床表现为呕血、排黑色柏油样便或者鲜红色血便,或者化验检查便潜血实验阳性者为合并消化道出血[4]。所有病例按有无消化道出血分为消化道出血组(n=54)与无出血组(n=46)。消化道出血组中,男34例,女20例;年龄3~13岁,平均年龄(7.1±2.1)岁。无出血组中,男26例,女20例;年龄3~12岁,平均年龄(6.5±2.6)岁。所有病例为初次发病,无家族及个人过敏史。入院前均未予任何激素类药物及免疫抑制药物治疗。
1.2 方法
1.2.1 调查表:设计统一的调查表格对病例资料整理记录,包括姓名、性别、年龄、临床症状体征、超声所示肠管壁厚度以及化验检查。
1.2.2 辅助检查:患儿均于入院2 d内即总病程≤7 d内做血尿便常规、便潜血、血清IgA水平、CRP、红细胞沉降率(ESR)、肝肾功能和心电图检查、腹部超声。腹部超声的检查由我院功能科专门的超声诊断医师(腹部超声组)应用飞利浦IU22型彩色多普勒超声显像仪进行检查,据患儿年龄设置探头频率为5~10 Hz或7~12 Hz,按照操作规范进行胃肠道超声检查。急诊患儿不做胃肠道准备,常规腹部检查患儿以空腹时间4~6 h为宜。检查时患儿取仰卧位,由医师仔细逐段的检查患儿各段肠管内情况:自幽门部、十二指肠、空场、回肠以及结肠依次检查。
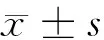
2 结果
2.1 2组临床表现比较 消化道出血组患儿较无出血组患儿更易合并窦性心动过缓,2组比较差异有统计学意义(Plt;0.05),2组合并呕吐、关节肿痛、腹痛先于皮疹等发生率比较差异无统计学意义(Pgt;0.05)。见表1。
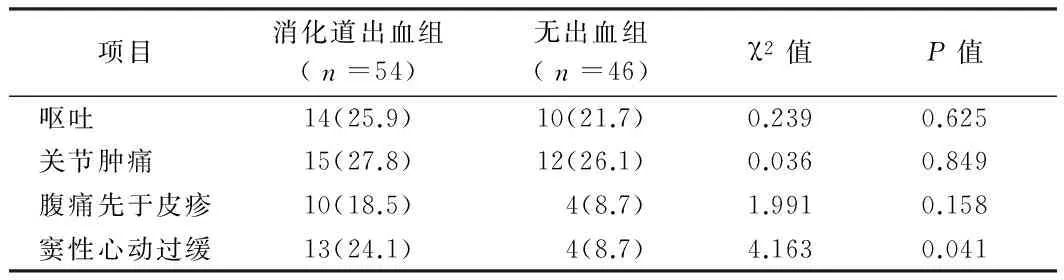
表1 2组患儿的临床表现分析 例(%)
2.2 2组化验室检查 2组WBC、PLT、CRP增高,ESR增快,蛋白尿和(或)血尿、IgA增高发生率比较,差异无统计学意义(Pgt;0.05)。见表2。
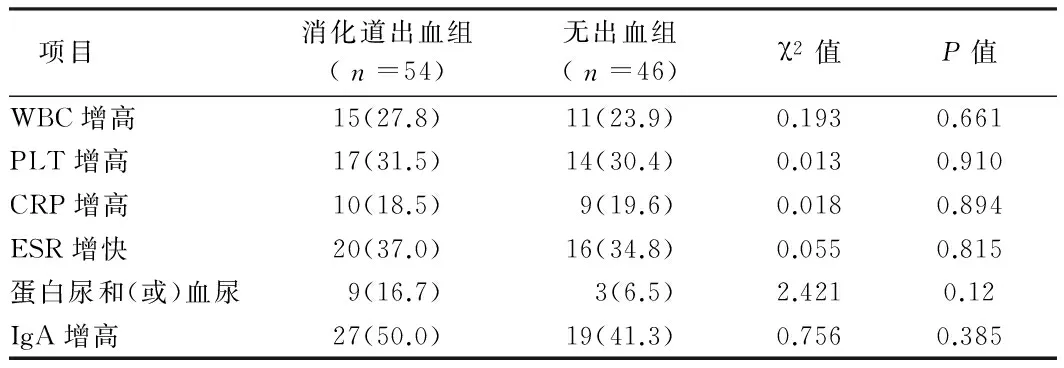
表2 2组患儿的化验室指标分析 例(%)
2.3 2组超声检查比较 消化道出血组肠管壁增厚发生率高于无出血组,差异有统计学意义(Plt;0.05)。见表3。
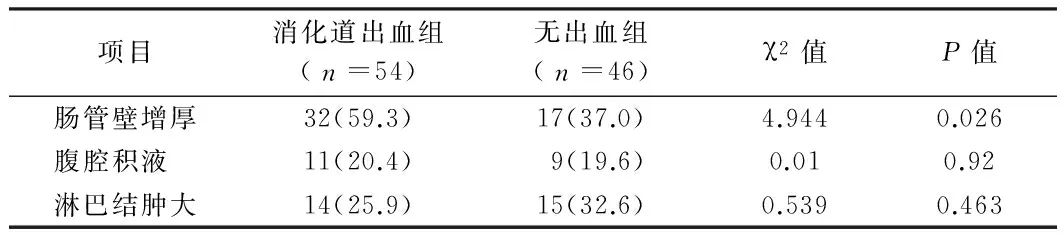
表3 2组患儿的腹部超声表现分析 例(%)
2.4 超声检查结果 B超检查示不同程度节段性或广泛性肠壁增厚的患儿为49例;病变多位于小肠,增厚范围3~11 mm;29例患儿合并腹腔淋巴结肿大,20例患儿合并腹腔积液。经抗炎及对症治疗 3~7 d,患儿腹痛明显缓解,49例患儿均行超声复查,3例增厚的肠壁(gt;7 mm)恢复至 4~6 mm,肠壁血流信号较前明显减少;46例增厚的肠壁(3~7 mm)基本恢复正常。见图1~3。
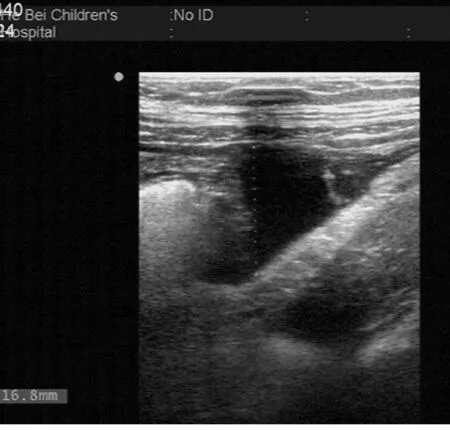
图1 腹腔积液声像图
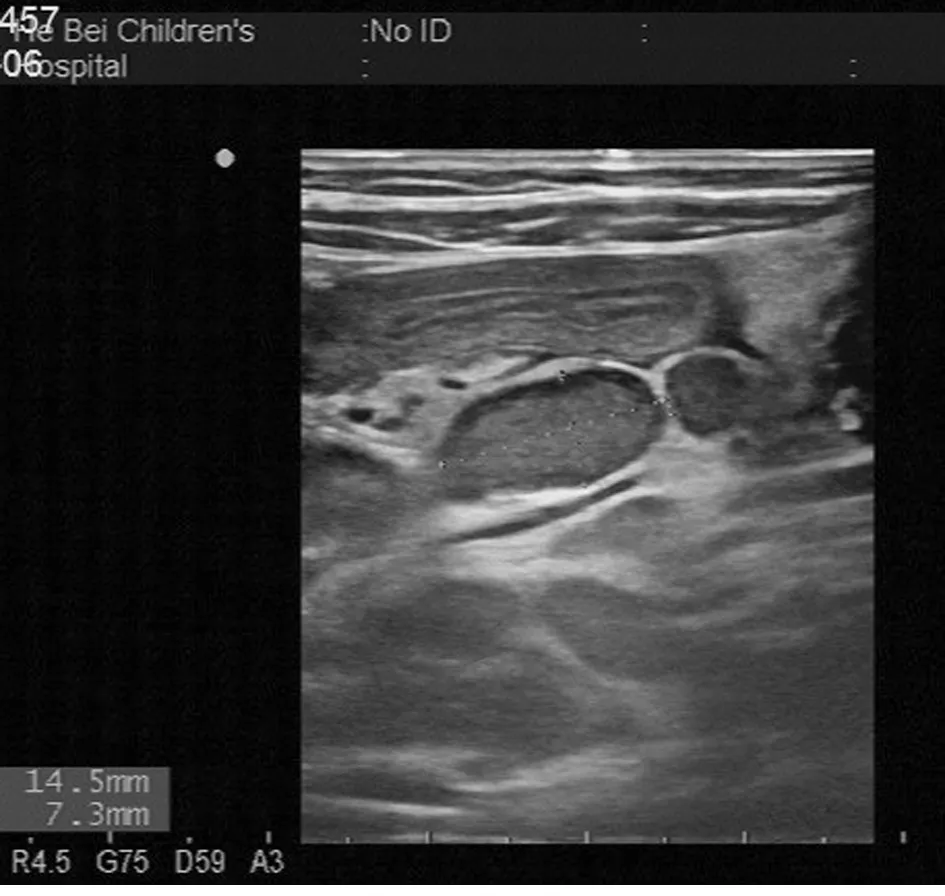
图2 肠系膜淋巴结肿大声像图

图3 肠管壁增厚声像图
3 讨论
HSP又被称为亨-舒综合征是一种全身毛细血管变态反应性及出血性的疾病,在儿童血管炎疾病中发病率最高[5,6]。以学龄前期及学龄期儿童多发,男女发病比例为1.4∶1。本文所选100例患儿发病年龄为3~13岁,平均年龄(7.7±6.5)岁,男女比例为1.5∶1。一年四季均可发病,但有明显的季节性,以秋冬季多发。其并发症多、复发率高,病程持续时间长短不一。随着人们生活水平及就诊率的提高,其患病率呈现明显增多的趋势,严重的威胁着儿童的身心健康。
HSP为系统性血管炎,全身各个系统均可受累,临床表现为非血小板减少性对称性、可触性紫癜,伴或不伴腹痛、关节肿痛、肾脏损害等症状,并发症多,且极易复发。既往根据病变累及的主要部位将HSP分为5型:皮肤型、腹型、关节型、肾型以及混合型。其中,腹型过敏性紫癜是以胃肠道症状为首发或主要临床表现,占本病的50%~75%,以小肠受累多见。其中14%~36%的患儿以胃肠道症状首发[7],可早于皮肤紫癜1~40 d出现。以胃肠道症状首发的患儿,常见的消化系统疾病与其临床特征极为相似,早期诊治很容易误诊。国外临床研究发现以胃肠道症状首发的腹型过敏性紫癜可早于皮疹出现时间平均6.6 d,大约 58%患儿的胃肠道症状表现为腹痛[8]。本组病例中,有19例(19%)患儿胃肠道症状早于皮肤紫癜出现,以胃肠道症状首发的腹型过敏性紫癜早于皮疹出现时间1~7 d,与文献报道[8]一致。腹型HSP患儿腹痛部位多变而不固定,大部分位于脐周,腹部体征轻微,为轻压痛,压痛点不固定,无明显的腹肌紧张和反跳痛,患儿自觉症状明显,呈阵发性或持续性的腹部绞痛,症状与体征分离是腹型HSP的重要特点[9]。腹痛容易复发,餐后疼痛加重,进食量或质稍有不当均可致腹痛反复发作。且可同时伴有恶心、呕吐、血便、呕血等,部分严重病例甚至出现肠坏死、胃肠穿孔等外科急腹症,导致出血性休克[10]。消化道出血是腹型HSP的严重并发症。据报道腹型HSP中18%~52%的患儿可出现消化道出血,出血的部位可以在上消化道,也可能在下消化道[10]。临床常表现为呕血、便血或两者均有。出血量一般较少,有的无明显的临床症状,仅表现为大便潜血阳性。但儿童对失血的耐受力较差,部分严重出血者出血量大、速度快,可导致出血性休克,甚至危及生命,需积极输血治疗,甚至需要内镜或外科手术治疗。马国瑞等[11]也曾报道HSP患者由于消化道出血导致低血容量性休克的相关病例。另外,严重而持续的腹痛、消化道出血也是肾脏及其他脏器受累的危险因素,影响着患儿的预后。胡旭等[12]调查显示腹型HSP消化道出血组患儿肾脏病变以及多脏器受累明显高于非消化道出血组。因此如果能提前预知此类患儿出现消化道出血的风险,可以对临床大夫的诊治方案制定及评估预后起很大作用。目前,尚无关于腹型HSP的诊断检查的金标准,尤其是以胃肠道症状起病的腹型HSP患儿。因此,寻找能早期诊断该病及评估预后等的相关化验检查有重大的意义。本研究通过观察分析腹型HSP患儿(将分为消化道出血组及无消化道出血组)的临床表现及各项实验室及检查指标,旨在为早期诊治、评估预后及合并消化道出血的风险等方面提供参考。本研究发现:2组窦性心动过缓统计结果差异有统计学意义(Plt;0.05),腹型HSP有消化道出血组伴发窦性心动过缓的概率明显高于没有消化道出血组(Plt;0.05),提示我们应该在临床治疗过程中引起重视,早期给予营养心肌治疗;2组呕吐症状,关节症状发生率比较,差异无统计学意义(Pgt;0.05),说明呕吐、关节等症状与消化道出血无明显相关性;白细胞、血小板、ESR、CRP的增高与消化道出血的出现与否亦无明显相关性。
HSP的病因及发病机制至今仍未完全明确。有研究认为,腹型HSP的基本病理改变为IgA介导的毛细血管炎[13],为非特异性的炎性反应。同时,细胞因子也发挥着重要作用,如白细胞介素-17、基质金属蛋白酶-9均参与HSP的发病过程[14]。约 50%的 HSP 患儿血清中存在较高水平的 IgA 循环免疫复合物[15]。它包括IgA1和IgA2两个亚类,均由成熟B细胞产生,在本病的发病中IgA(尤其是IgA1)起重要作用,IgAl是一种高度糖基化的免疫球蛋白,占血清中IgA的90%。致敏因素作用于具有遗传背景的个体,激发B细胞多克隆扩增,导致IgA生成异常而介导了系统性小血管炎[16]。免疫复合物沉积于小血管,进而导致胃肠道广泛性毛细血管炎,甚至出现水肿和出血,从而引起肠蠕动增强或痉挛,临床上出现腹痛、呕吐、消化道出血等胃肠道症状,甚至发生肠坏死及穿孔[17]。Farah等[18]曾报道对腹型HSP患儿胃肠道组织活检发现,其病理改变为白细胞破裂性血管炎且毛细血管内可见IgA的沉积。皮光环等[19]研究发血清 IgA水平增高联合血清淀粉酶水平的变化对于以腹痛起病的儿童HSP的早期诊断有参考价值。本研究通过分析对比腹型HSP以及合并消化道出血组与无消化道出血组患儿血清IgA水平的变化,探讨其在早期诊断及在预警消化道出血方面的价值。本组资料数据显示,100例腹型HSP患儿中血清 IgA 水平增高病例占46%,其中腹型HSP合并消化道出血组IgA增高27例(50%),与未消化道出血组患儿相比较,差异无统计学意义(χ2=0.756,P=0.385)。但在腹型HSP急性期近一半儿患儿的IgA水平明显增高;提示我们在发病早期,尤其是以胃肠道症状起病的患儿,通过测定腹型HSP患儿血清IgA水平并结合相应的临床表现,如腹痛、呕吐、便血等,对疾病的早期诊断有一定的参考价值,但在判断及预测消化道出血的风险方面无明显优势。
胃肠道黏膜是由黏膜层、黏膜下层、肌层、浆膜层组成。腹型HSP急性期病变时,广泛的毛细血管、小动脉和小静脉呈急性炎性反应,血管周围中性粒细胞和嗜酸性粒细胞浸润、红细胞渗出,血管壁纤维素样坏死,间质水肿,肠壁黏膜充血水肿,大部分甚至发生出血性糜烂。声像图下所见:病变局部肠管扩张,肠管壁不均匀增厚约为6~9 mm,最厚处达11 mm。回声增强或减低,肠管结构清晰,各层清晰可辨,受累肠管黏膜及浆膜层多粗糙;管腔呈向心性或偏心性狭窄;肠蠕动明显减弱,有僵硬感[20];还可伴腹腔淋巴结肿大、腹腔积液等。腹型HSP的主要病变部位分布于小肠,考虑与小肠是消化吸收的主要部位,且与食糜或相关刺激物的接触面积最大而且毛细血管分布丰富有关[21]。Esaki等[22]认为小儿腹型HSP肠管病变具有节段性特点,主要是集中于一些比较小的、容易缺血的肠管,比如十二指肠球部。Nchimi等[7]报道对腹型HSP患儿超声诊断的敏感度为86%,特异度为100%,且超声显示增厚肠壁的形态越失常,腹部症状持续时间越长。儿童腹型HSP的超声表现有一定的特异性,且能早期发现肠管病变而且无放射性辐射,重复性及耐受性好,对受累肠管细致观察及时随诊,有助于早期提示该病,并可以观察并发症及临床疗效,可作为儿童腹型HSP的首选常规检查[23]。如果消化道症状明显,但临床缺乏典型皮疹时,超声图像上可发现异常[24]。本文通过对腹型HSP合并消化道出血及未合并消化道出血患儿的胃肠道超声所显示的肠管壁厚度进行分析,本组资料为100例腹型HSP患儿,其中有消化道出血组54例,无消化道出血组46例,肠管壁增厚患儿49例,有消化道出血组肠管壁增厚32例(59%),无消化道出血组肠管壁增厚17例(37%),可以发现有消化道出血组患儿肠管壁增厚的比例明显高于无消化道出血组;腹部超声检查在腹型HSP患儿的急性期有特异性的表现,其中淋巴结肿大和腹腔积液在2组间差异无统计学意义(Pgt;0.05);但肠管壁厚度的变化2组差异有统计学意义(Plt;0.05),提示我们肠管壁增厚可能是消化道出血出现的另一个重要的先兆,在临床工作中,对于腹型HSP患儿应早期行肠道超声检查,尤其需仔细观察肠管壁厚度;对于出现肠管壁增厚的患儿,应给予严密观察,加强抗炎、保护胃肠黏膜等积极的治疗措施;合理安排饮食,防止消化道出血的发生和发展;对于临床上单纯表现为无诱因腹痛的学龄前及学龄儿童,更应该早期行肠道超声的检查,结合其他化验指标,以早期发现胃肠道病变,为诊断、治疗赢取时间。
HSP的确切发病机制尚未得到完全明确,并不是由单一病机所致,而是多种病机的结果,尚需要更深一步的临床观察及实验研究得到明确。且其临床表现多样,腹型HSP中的部分患儿以胃肠道症状起病,早期诊断很困难。消化道出血作为其严重并发症,对儿童的身体健康带来了很大威胁。因此,在临床工作中,在腹型HSP发病率较高的秋冬季节,针对以腹痛为首发症状的学龄儿童,临床医生不能只专注于胃肠炎等常见疾病,应特别注意除外腹型HSP,早期行腹部超声检查,并结合相应的临床表现,以便早期诊断、积极治疗。
1 Rigante D.Clinical overview of Vasculitic syndromes in the pediatric age.Eur Rev Med Pharmacol Sci,2006,10:337-345.
2 Jennette JC,Falk RJ,Bacon PA,et al.2012 Revised International Chapel Hill Consensus Conference No-menclature of Vasculitides.Arthritis Rheum,2013,65:1-11.
3 胡亚美,江载芳主编.诸福棠实用儿科学.第8版.北京:人民卫生出版社,2015.773-775.
4 周卓康,孙莉颖.小儿消化道出血83 例病因分析.中国基层医药,2006,13:474-475.
5 Mattesson EL.Notes on the history of eponymic idiopathic vasculitis:the diseases of henoch and schoenlein,wegener’churg and strauss,horton,takayasu,bethet,and kawasaki.Arthritis Care Res,2000,13:237-245.
6 程涵蓉,文飞球,吴本清.过敏性紫癜患儿单个核细胞凋亡与细胞因子:IGF-1的关系探讨.中国儿童保健杂志,2011,19:172-174.
7 Nchimi A,Khamis J,Paquot I,et al.Significance of bowel wall abnormalities aat ultrasound in henoch-schonlein purpura.J Pediatr Gastroenterol Nutr,2008,46:48-53.
8 Changw L,Yang YH,Lin YT,et al.Gastrointestinal manifestation in Henoch -Schonle in purpura:a review of 261 patients.Acta Padiatr,2004,93:1427-1431.
9 曾华松.小儿过敏变态反应性疾病的临床诊治要点.中国实用儿科杂志,2009,24:817-820.
10 Chen MJ,Wang TE,Chang H,et al.Endoscopic find ingsin a patient with Henoch- Schonlein purpura.World J Gastroenterol,2005,11:2354-2356.
11 马国瑞,杨慧敏,郭春燕.儿童过敏性紫癜103例分析.医学综述,2008,14:1278-1279.
12 胡旭,鹿玲,韦红,等.儿童腹型过敏性紫癜合并消化道出血临床分.安徽医学,2012,33:664-665.
13 Saulsbury FT.Clinical update:Henoch Schonlein purpura.Lancet,2007,369:976-978.
14 徐丽娟,刘玲,杨艳君,等.过敏性紫癜患儿血清IL-17与MMP-9的变化及意义.国际儿科学杂志,2014,41:431-433.
15 Zurada JM,Ward KM,Grossman ME.Henoch-Schonlein purpura associated with malignancy in adults.J Am Acad Dermatol,2006,55:S65-70.
16 Hamdan JM,Barqawi MA.Henoeh-Sehonlein purpura in children.Influence of age on the incidence of nephritis and arthritis.Saudi Med J,2008,29:549-552.
17 Gibson KL,Amamoo MA,Primack WA.Corticostcroid chcraov for Henoch Schonlein purpurn.Pediatrics,2008,121:870-871.
18 Farah R,Shay M.Gastrointestinal involvement in Henoch Schonlein purpura.Minerva Gastroenterol Dietol,2007,53:295-299.
19 皮光环,田小兵,马涛,等.血清淀粉酶及血清IgA检测在儿童腹型过敏性紫癜诊断中的价值.中国循证医学杂志,2009,9:1031-1032.
20 朱晓萍,李艳娜,曾淑华,等.彩色多普勒超声对儿童腹型过敏性紫癜的诊断价值.临床超声医学杂志,2015,7:496-497.
21 Menon P,SinghS,Ahuja N,et al.Gastrointestinal manifestations of Henoch-Schoenlein purpura.Dig Dis Sci,2013,58:42-45.
22 Esaki M,Matsumoto T,Nakamura S,et al.GI involvement inHenoch-Schonlein purpura.Gastrointest Endosc,2002,56:920-923.
23 王宁,钱林学,贾立群,等.儿童腹型过敏性紫癜的超声表现.生物医学工程与临床,2010,14:432-434.
24 曹海玮,郭爱玲,李聪.儿童腹型过敏性紫癜彩色多普勒超声诊断分析.中国超声医学杂志,2008,24:95-97.
10.3969/j.issn.1002-7386.2017.22.032
050030 石家庄市,河北省儿童医院
张东风,050030 石家庄市,河北省儿童医院;
E-mail:zdf7812@sina.cn
R 725.546
A
1002-7386(2017)22-3476-05
2017-06-13)

