侧脑室注射瘦素对大鼠迷走复合体阿黑皮素原的影响
赵艳军 马立新 吴瑞芹 宋成军 李炳庆
·论著·
侧脑室注射瘦素对大鼠迷走复合体阿黑皮素原的影响
赵艳军 马立新 吴瑞芹 宋成军 李炳庆
目的研究侧脑室注射瘦素对大鼠迷走复合体阿黑皮素原的影响,探讨瘦素是否同下丘脑弓状核一样也在迷走复合体对阿黑皮素原进行调节,从而发现瘦素在迷走复合体上发挥作用的可能路径。方法SD大鼠36只,随机分为试验组和对照组,每组18只,试验组根据注射后处死的时间(1、3、5 h)分成3个亚组,每组6只。大鼠侧脑室留置不锈钢导管1周,自由恢复及驯养,实验动物在清醒状态下于侧脑室注射瘦素3.5 μg/μl,对照组注射3.5 μg/μl 0.9%氯化钠溶液。苏木精-伊红染色定位迷走复合体,测定阿黑皮素原在该处的表达。结果中枢注射瘦素组大鼠侧脑室注射瘦素后1、3、5 h采用免疫组化检测迷走复合体上阿黑皮素原的表达阳性细胞计数、表达阳性细胞积分光密度与生理盐水和对照组比较,差异均无统计学意义(Pgt;0.05),中枢注射瘦素组1、3、5 h亚组组间迷走复合体上阿黑皮素原的表达阳性细胞计数、表达阳性细胞积分光密度比较,差异无统计学意义(Pgt;0.05)。结论侧脑室注射瘦素后不能引起迷走复合体上阿黑皮素原的增多。
瘦素;阿黑皮素原;迷走复合体;中枢注射;大鼠
1994年成功克隆出肥胖基因(瘦素基因),同时发现其表达产物瘦素(leptin)。瘦素是蛋白质类激素,由脂肪细胞产生,瘦素基因的组成:2个内含子和3个外显子,瘦素基因产物的分子量为16 kD,由167个氨基酸残基组成,N-端的21个氨基酸残基,以信号肽于单链蛋白分泌入血,随后被切除而形成瘦素,由此功能性瘦素的分子结构有146个氨基酸的残基。人类瘦素基因是位于第7号染色体的长臂,人类和小鼠瘦素基因的同源性为高度同源,氨基酸序列84%相同,这一结果为动物实验的进一步研究提供基因基础。瘦素由脂肪组织来合成的,它的分泌呈昼夜节律性,为脉冲式的分泌,尤以夜间分泌的水平最高,随后迅速下降,约80%由肾脏代谢[1,2]。瘦素的主要作用部位是中枢神经系统,血清中的瘦素是通过血脑屏障,进入脑内来发挥作用。胰岛素、去甲肾上腺素、类固醇激素能促进瘦素的分泌,将类固醇激素作用于脂肪组织,能够显著地促进瘦素的分泌与合成,花生四烯酸和前列腺素E2同样能促进瘦素的分泌。瘦素在中枢主要通过下丘脑,其中最重要的部位是位于基底部的弓状核,弓状核被认为是整合摄食的重要部位,因为弓状核的众多神经元能生成增加进食量的信号,如强啡肽、β-内啡肽、γ-氨基丁酸、谷氨酸等,同时也生成抑制进食信号,如前阿黑皮素、可卡因、安非他明调节的转录肽的[3]。我们于2016年1月至2017年6月通过侧脑室注射瘦素对大鼠迷走复合体阿黑皮素原的影响,探讨瘦素是否同下丘脑弓状核一样也在迷走复合体对阿黑皮素原进行调节,从而发现瘦素在迷走复合体上发挥作用的可能路径。
1 材料与方法
1.1 材料 淮北正华生物仪器设备公司生产大鼠用脑立体定位仪,上海光正医疗仪器公司生产微计量注射器,大鼠脑室置管装置,Peprotech公司瘦素,上海斯信生物科技有限公司瘦素受体,上海拜力生物科技有限公司阿黑皮素原,北京中山生物公司免疫组化二抗,苏木素染液,3,3-二氨基苯联胺,乙醇,多聚甲醛、镊子、手术剪、包埋模具、恒温箱、冰箱、光学显微镜、盖玻片、载玻片、染色缸、超薄切片机、微量可调加样器、Motic计算机图像分析系统。
1.2 方法 SD大鼠购买于河北医科大学实验动物中心,合格证编号:1407012,按照“实验动物质量管理办法”饲养实验动物,雌雄各半,共36只,每笼饲育大鼠1只,实验前1周给予大鼠侧脑室置管,置管方法:10%水合氯醛腹腔注射麻醉大鼠,用脑立体定位仪将大鼠固定,依据大鼠脑图,在十字缝旁开1.5 mm,后移0.8 mm,3.5 mm深度,在颅骨上打洞,直径2 mm,留置不锈钢导管,插入不锈钢制导丝封闭导管。置管后大鼠恢复1周,每日对大鼠进行驯养,每次驯养时间不少于10 min。将大鼠随机分为中枢注射瘦素组和生理盐水对照组,每组18只。根据给药的时间下分为3个亚组,中枢注射瘦素1 h组、中枢注射瘦素3 h组、中枢注射瘦素5 h组,每组6只。大鼠在禁食24 h以后,于无麻醉、清醒状态下给药,给药前拔掉导丝,将注射针在大鼠稍微限制活动情况下插入留置的不锈钢导管内,缓慢持续注射,给药时间4 min,给药后将针头留置1 min,给药剂量3.5 μg/μl,最后注入美蓝0.5 μl(20 g/L),以确定注射位置,注射美蓝溶液不在脑室的给予剔除。
1.3 脑室内固定、染色定位 完成实验后麻醉大鼠(过量水合氯醛),开胸经升主动脉插管后给予心脏灌注,0.9%氯化钠溶液100 ml快速冲洗干净血液,然后用4%的多聚甲醛溶液40 ml进行灌注,快灌注200 ml,剩余200 ml给予缓慢灌注,甲醛灌注固定后取脑组织,再于甲醛固定液固定24 h。先暴露第四脑室的底部,迷走复合体位于脑干背侧,中脑导水管旁,应从中间往下取。将标本再固定12 h,倒掉固定液,随后3次蒸馏水冲洗,2次50%乙醇给予冲洗后,再依据乙醇浓度逐级脱水,包括70%乙醇脱水1 d,80%乙醇脱水过夜后,95%乙醇脱水3 h,无水乙醇Ⅰ、Ⅱ分别脱水2 h,二甲苯透明,石蜡包埋。苏木精-伊红染色法进行染色定位迷走复合体:二甲苯中脱蜡,无水乙醇、90%乙醇、80%乙醇、70%乙醇各2 min浸泡,用自来水再冲洗5 min,苏木精液中浸泡染色15 min,最后伊红染色3 min,脱水透明封片。首先找到中脑导水管,中脑导水管上通间脑的第三脑室,下通第四脑室、背侧是四叠体下丘、上丘,腹侧是中脑被盖以及大脑脚,然后进行迷走复合体定位。见图1。
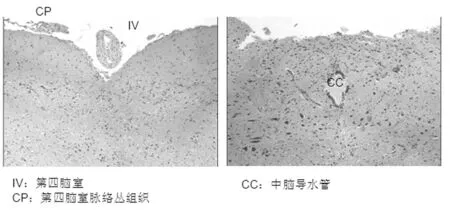
图1 定位中脑导水管
1.4 免疫组化检测迷走复合体上阿黑皮素原的表达 免疫组化方法:二甲苯中脱蜡,无水乙醇、90%乙醇、80%乙醇、70%乙醇各2 min浸泡,自来水冲洗、PBS冲洗、修复组织抗原、阻断内源性过氧化物酶活性、滴加正常非免疫动物血清、滴加抗体,3,3-二氨基苯联胺显色至阳性细胞出现,封片,镜下观察。免疫组化阳性结果判断:阳性细胞呈棕色变化。随机取阳性切片的5个视野,计数阳性细胞数,取平均值。另外再随机选5个视野,互不重叠,运用图像分析系统,算出每个视野阳性细胞积分光密度,取平均值作为阿黑皮素原定量指标。
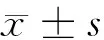
2 结果
2.1 免疫组化检测迷走复合体上阿黑皮素原的表达阳性细胞计数结果 大鼠侧脑室置管自由恢复1周,清醒无麻醉状态下中枢注射瘦素后,免疫组化检测迷走复合体上阿黑皮素原的表达阳性细胞计数结果:注射瘦素1 h后测迷走复合体上阿黑皮素原的阳性细胞数,与生理盐水对照组比较,差异无统计学意义(Pgt;0.05)。中枢注射瘦素组检测迷走复合体上阿黑皮素原的表达3 h、5 h后测阳性细胞数,与生理盐水对照组中枢侧脑室注射瘦素组1、3、5 h各亚组比较,差异无统计学意义(Pgt;0.05)。见表1,图2、3。
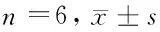

组别1h3h5h中枢注射瘦素组16.83±2.5516.90±3.6116.62±2.66生理盐水对照组17.09±1.9117.08±1.917.06±1.89
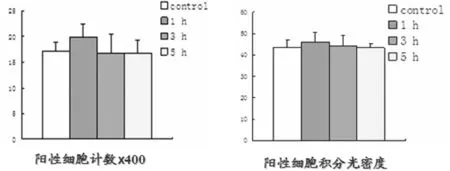
图2 迷走复合体上阿黑皮素原表达比较

图3 迷走复合体上阿黑皮素原的表达
2.2 免疫组化检测迷走复合体上阿黑皮素原的表达阳性细胞积分光密度结果 大鼠侧脑室置管,清醒无麻醉状态下侧脑室注射瘦素后,免疫组化检测迷走复合体上阿黑皮素原的表达阳性细胞积分光密度结果:阳性细胞积分光密度1、3、5 h亚组分别与与生理盐水对照组比较,差异无统计学意义(Pgt;0.05),中枢注射瘦素组中1、3、5 h亚组,组间比较,差异无统计学意义(Pgt;0.05)。见表2,图2、3。
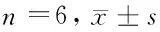

组别1h3h5h中枢注射瘦素组46.72±4.6844.21±4.7543.20±1.96生理盐水对照组43.54±3.3843.51±3.3943.49±3.40
3 讨论
瘦素在弓状核,通过与瘦素受体结合,激活阿黑皮素原(POMC),抑制神经肽Y而发挥作用[4,5]。迷走神经支配了整个胃肠系统,实施全部副交感神经对胃的调控,占迷走神经80%构成的传入纤维,终止于孤束核,占迷走神经20%构成的传出纤维,是由迷走运动背核发出的,孤束核和迷走运动背核位于第四脑室底部,脑干背侧,两个核团腹背相连,统称迷走复合体。迷走神经传入纤维将饱感的信号传到位于后脑的孤束核(位于脑干的尾端),孤束核整合来自腹腔内脏、胃肠道、口腔味觉等的信号,产生了饱感,同时与前脑的室旁核双向联系,对接收的信号进行整合。孤束核上具有与进食有关的神经肽类相关受体,如前阿黑皮素受体的表达,将相关受体的拮抗剂、激动剂注入第四脑室(临近孤束核),可以产生摄食反应。孤束核上也存在瘦素和前阿黑皮素受体,提示前脑、后脑共同处理来自传入纤维的信号,孤束核可能如脑干其他部位如弓状核那样,对瘦素产生生物学反应[6]。迷走复合体是迷走神经的运动及感觉中枢,其上也存在阿黑皮素原。
瘦素通过与功能受体结合来发挥生物学作用。瘦素生物学作用广泛,其中最重要的是调节摄食[7],通过影响下丘脑的食欲中枢,与下丘脑上瘦素受体的结合,抑制神经肽Y合成与释放,减少摄食量,从而使产热减少,实现对体质量和体质的调控,从而达到调节体重下降的目的,电生理学方法同样证明,瘦素通过影响下丘脑弓状核上神经肽Y神经元的信号转导,引起食欲下降,从而降低体重,瘦素还增加下丘脑上的促黑激素(MSH)分泌,促黑激素可以使食欲减退。瘦素还参与对生殖的调节,瘦素在发育与生殖的信号传递中有重要的作用,可作用在下丘脑-垂体-性腺轴各个层次,瘦素通过与下丘脑瘦素长型受体结合调节促性腺激素释放激素的释放和性行为,中枢注射瘦素可使卵泡刺激素、促黄体激素和催乳素分泌减少[8]。另外,瘦素还参创伤的修复,参与促进血细胞的生成,促进血管的新生,近来的研究还显示,瘦素在免疫应答和炎性反应中也有重要的调节作用,瘦素及瘦素受体与骨肉瘤的发生关系密切,与对神经内分泌、血压等的调节[9-17]。
瘦素在中枢作用的靶器官是下丘脑,下丘脑上有丰富瘦素受体存在,主要是弓状核瘦素受体表达最丰富,将瘦素微量通过中枢注入,可抑制大鼠摄食行为。瘦素的这些作用,是通过影响单胺类、神经肽和一些细胞因子完成的。阿黑皮素原是一类神经肽,265个氨基酸组成,基因在小鼠上定位于12-4,人染色体上定位于2p23.2,删除动物阿黑皮素原基因,动物肾上腺皮质激素减少分泌,再次注射后可逐渐恢复。阿黑皮素原经水解后形成多种肽,包括促黑激素、促肾上腺皮质激素、β-内啡肽等,在垂体、弓状核、胰腺、皮肤、睾丸等发现其表达。阿黑皮素原在弓状核的表达受瘦素的影响,与血液循环中的瘦素浓度成正比,瘦素浓度低,阿黑皮素原表达少,瘦素浓度高,阿黑皮素表达多[6]。瘦素与瘦素受体作用,通过细胞内信号转导,引起阿黑皮素表达。
阿黑皮素原和瘦素受体共同存在于弓状核,给大鼠注入瘦素,阿黑皮素原会增加,同时表现为动物的摄食量减少,即瘦素发挥生物学作用可能部分依赖阿黑皮素原的变化。迷走复合体上也有瘦素受体的表达,其上也存在阿黑皮素原,瘦素是否同下丘脑弓状核一样也在迷走复合体对阿黑皮素原进行调节呢。本实验通过在实验前1周给大鼠于侧脑室留置不锈钢制导管,并用导丝封闭导管,让实验用SD大鼠恢复1周,恢复期间每日进行驯养,实验当日在大鼠清醒没有麻醉状态下侧脑室注射瘦素,此法避免了应激因素的干扰以及麻药的影响,得出的结果非常接近正常生理状态,是神经生物学可靠的实验方法,相较于体外细胞培养,具备明显优势,实验结果可信。本研究通过中枢注射瘦素后监测迷走复合体上的阿黑皮素原的表达,通过免疫组化检测迷走复合体上阿黑皮素原的表达阳性细胞计数结果:注射瘦素1、3、5 h后测得阳性细胞数分别是(16.83±2.55)、(16.90±3.61)、(16.62±2.66),与生理盐水组比较,差异无统计学意义(Pgt;0.05)。注射瘦素1、3、5 h后测得阳性细胞积分光密度的结果分别是(46.72±4.68)、(44.21±4.75)、(43.20±1.96),与生理盐水对照组比较,差异无统计学意义(Pgt;0.05)。1、3、5 h亚组,各亚组间比较,无论是阳性细胞计数结果,还是阳性细胞积分光密度结果,差异无统计学意义(Pgt;0.05)。两种实验方法,所得结果一致,均没有统计学意义,这一结果与Huo等[18]的研究成果一致,不同于以往研究证实的同弓状核一样也在迷走复合体对阿黑皮素原进行调节。因此推测对大鼠侧脑室给予瘦素不能引起迷走复合体上阿黑皮素原表达的增多。
胰岛素是由β胰岛细胞来分泌的一种因子,它作用在脂肪、肝脏、肌肉等器官组织,能够调节血糖水平,同时也可作用在阿黑皮素原和NPY神经元,但既往的观点认为胰岛素和瘦素作用在不同的阿黑皮素原神经元亚群而发挥调节能量平衡作用,但Dodd等[19]的研究证实阿黑皮素原神经元可以整合胰岛素和瘦素的信号,促进白色脂肪组织棕色化以维持能量平衡。另外迷走复合体生成胰高血糖素-1的神经元上含瘦素受体,胰高血糖素-1是瘦素作用的靶细胞,使用胰高血糖素-1的拮抗剂,会阻断瘦素抑制摄食的作用[20]。因此推测在迷走复合体上,不同于下丘脑弓状核,引发阿黑皮素原的基因表达,瘦素发挥生物学活性,是通过与瘦素受体的结合,或是其他一些多肽,但是具体的作用机制还依靠进一步的研究来证实。
1 Zhang Y,Proenca R,Maffei M,et al.Positional cloning of the mouse obese gene and its human homologue.Nature,1994,372:425-432.
2 Park HK,Ahima RS.Physiology of leptin:energy homeostasis,neuroendocrine function and metabolism.Metabolism,2015,64:24-34.
3 希龙夫,薛荣泉,夏医君.瘦素与普通外科相关疾病.中国现代普通外科进展,2016,19:921-924.
4 Sominsky L,Ziko I,Nguyen TX,et al.Hypothalamic effects of neonatal diet:reversible and only partially leptin dependent.J Endocrinol,2017,234:41-56.
5 Dodd G,Worth A,Nunn N,et al.The thermogenic effect of leptin Is dependent on a distinct population of prolactin-releasing peptide neurons in the dorsomedial hypothalamus.Cell Metabolism,2014,20:639-649.
6 Yeo GSH,Farooqi IS,Challis BG,et al.The role of melanocortin signalling in the control of body weight:evidence from human and murine genetic models.Q J Med,2000,93:7-14.
7 Swieten MM,Pandit R,Adan RA,et al.The neuroanatomical function of leptin in the hypothalamus.J Chem Neuroanat,2014,61/62:207-220.
8 Hausman GJ,Barb CR,Lents CA.Letin and reproductive function.Biochimie,2012,94:2075-2081.
9 Moon HS,Dalamaga M,Kim SY,et al.Leptin’s role in lipodystrophic and nonlipodystrophic insulin-resistant and diabetic individuals.Endocr Rev,2013,34:377-412.
10 Dalamaga M,Chou SH,Shields K,et al.Leptin at the intersection of neuroendocrinology and metabolism:current evidence and therapeutic perspectives.Cell Metab,2013,18:29-42.
11 Alix PM,Guebre-Egziabher F,Soulage CO.Leptin as an uremic toxin:Deleterious role of in chronic kidney disease.Biochimie,2014,105:12-21.
12 顾海伦,刘亚莉,王维,等.瘦素对IL-1β诱导大鼠骨性关节炎软骨胞MMP-13mRNA表达的影响.东南大学学报(医学版),2015,34:870-875.
13 刘柱,范清,郑莉,等.瘦素在肿瘤坏死因子-α介导的软骨细胞死亡中的效应.临床和实验医学杂志,2016,15:642-628.
14 杨朝菊,霍丽静,王树松,等.高脂血症、糖尿病患者血清摄食抑制因子-1、脂联素水平及其相关性.中国老年医学杂志,2017,37:1374-1376.
15 朱冰,曲伸,等.瘦素调节糖代谢的机制研究进展.中国糖尿病杂志,2016,24:1040-1043.
16 丁玉静,邱丽君,徐晨,等.sLOX-1瘦素水平与代谢综合征的相关性.实用医学杂志,2017,33:813-815.
17 张志宁,赵亚恒,郑丽华,等.瘦素及瘦素受体与乳腺癌浸润、转移关系的研究.中国肿瘤外科杂志,2014,6:378-381.
18 Huo L,Grill HJ,Bjөrbaek C.Divergent regulation of proopiomelanocortin neurons by leptin in the nucleus of the solitary tract and in the arcuate hypothalamic nucleus.Diabetes.2006,55:567-573.
19 Dodd GT,Decherf S,Loh K,et al.Leptin and insulin act on POMC neurons to promote the browing of white fat.Cell,2015,160:88-104.
20 Mercer J,Moar KM Hoggard N.Localization of leptin receptor(OB-R) messenger ribonucleic acid in the rodent brain.Endocrinology,1998,139:29-34.
Effectsofleptinbymeansoflateralventricleinjectiononproopiomelanocortinindorsalvagalcomplexinofrats
ZHAOYanjun*,MALixin,WURuiqin,etal.
*DepartmentofEmergency,TheAffiliatedHospitalofChengdeMedicalUniversity,Hebei,Chengde067000,China
ObjectiveTo investigate the effects of leptin by means of lateral ventricle injection on proopiomelanocortin in dorsal vagal complexin of rats,and to explore whether the leptin can adjust proopiomelanocortin in dorsal vagal complex like hypothalamic arcuate nucleus,so as to find a possible path that leptin plays a role in vagal complex.MethodsThirty-six SD rats were randomly divided into experimental group and control group,with 18 rats in each group,moreover,the experimental group was redivided into 3 subgroups according to the death time after injection (1h,3h,5h),with 6 rats in each subgroup. The stainless steel catheter was detained in lateral ventricle of rats for 1 week,then the rats were free to resume and domesticated,then the rats in experimental group were given leptin 3.5μg/μl by lateral ventricle injection,however,the rats in control group were given 0.9% sodium chloride solution 3.5μg/μl.Finally the dorsal vagal complex was located by Hematoxylin-eosin dyeing,and the expression of proopiomelanocortin was detected.ResultsOn 1,3,5h after giving leptin by intracerebroventricular injection,there were no significant differences in the positive expression cell count and positive expression cell integral optical density of proopiomelanocortin in dorsal vagal complex between experimental group and control group (Pgt;0.05). Moreover there were no significant differences in the positive expression cell count and positive expression cell integral optical density of proopiomelanocortin in dorsal vagal complex among the three subgroups (Pgt;0.05).ConclusionInjecting leptin into lateral ventricle of rats can not result in the increase of proopiomelanocortin in dorsal vagal complex.
leptin; proopiomelanocortin; dorsal vagal complex; intracerebroventricular injection;rats
10.3969/j.issn.1002-7386.2017.22.006
项目来源:河北省重点科技研究计划(编号:20110546)
067000 河北省承德市,承德医学院附属医院急诊科(赵艳军),消化内科(马立新、吴瑞芹、李炳庆);承德医学院科研处(宋成军)
李炳庆,067000 河北省承德市,承德医学院附属医院消化内科;
E-mail:727102164@qq.com
R 589.2
A
1002-7386(2017)22-3388-04
2017-06-21)

