伊立替康辅助化疗对结肠癌患者血清IL-6、IL-10和生存预后的影响研究
董媛 魏刚 孙泽群 吴军 师贞宗
·论著·
伊立替康辅助化疗对结肠癌患者血清IL-6、IL-10和生存预后的影响研究
董媛 魏刚 孙泽群 吴军 师贞宗
目的探讨伊立替康辅助化疗对结肠癌患者血清白细胞介素-6(Interleukin-6,IL-6)、白细胞介素-10(Interleukin-10,IL-10)与生存预后的影响。方法选取2014年1月至2015年1月肿瘤科住院部结肠癌患者116例,随机分为2组,每组58例。对照组术后采用FOLFOX6方案化疗联合贝伐单抗治疗;观察组在对照组基础上采用伊立替康治疗。采用酶联免疫吸附测定(enzyme-linked immuno sorbent assay,ELISA )检测血清IL-6 、IL-10水平,比较2组临床疗效、血清指标与生存预后状况的差异。结果观察组总缓解率与临床获益率均明显高于对照组,2组比较差异有统计学意义(Plt;0.05)。2组药物不良反应发生率比较差异无统计学意义(Pgt;0.05)。治疗前,2组血清IL-6、IL-10水平比较差异无统计学意义(Pgt;0.05),治疗后,2组上述指标均明显低于治疗前(Plt;0.05),其中观察组上述指标明显低于对照组(Plt;0.05)。随访2年后,失访率0,观察组生存率明显高于对照组,复发率明显低于对照组(Plt;0.05)。治疗前,2组生存质量评分比较差异无统计学意义(Pgt;0.05),治疗后,全部患者上述评分均明显高于治疗前(Plt;0.05),其中观察组上述评分明显高于对照组(Plt;0.05)。结论伊立替康辅助化疗有助于明显改善结肠癌患者的临床疗效,通过降低血清IL-6、IL-10水平,从而改善生存预后状况,值得临床推广应用。
伊立替康;化疗;结肠癌;白细胞介素;生存预后
目前,全世界结肠癌的患病率与病死率均处于增高的倾向,但由于结肠癌患病隐匿,早期缺乏典型的临床症状,因而当结肠癌初诊时均处于进展期[1]。大部分结肠癌患者在诊断时均已具有明显的转移而无法实施手术切除治疗[2]。伊立替康是新型抗癌药物,是强效的拓扑异构酶Ⅰ拮抗剂,通过拮抗拓扑异构酶Ⅰ的活性,阻断癌细胞中脱氧核糖核酸(deoxyribonucleic acid,DNA)链重组的过程,破坏DNA长链,从而达到杀灭癌细胞的最终目的[3]。相关文献显示,伊立替康辅助化疗有助于明显改善结肠癌治疗的临床缓解率,延长无瘤生存时间,成为了结肠癌患者的主要治疗方案[4]。本研究通过探讨伊立替康辅助化疗对结肠癌患者血清白细胞介素-6(Interleukin-6,IL-6)、白细胞介素-10(Interleukin-10,IL-10)与生存预后的影响,旨在明确伊立替康辅助化疗用于结肠癌患者的有效性与安全性,报道如下。
1 资料与方法
1.1 一般资料 选取2014年1月至2015年1月期间本院住院部结肠癌患者116例,其中男71例,占61.21%,女45例,占38.79%;年龄31~65岁,平均年龄(45.67±8.98)岁;原发肿瘤-区域淋巴结-远处转移(tumor node metastasis,TNM)分期:Ⅲ期47例,占40.52%,Ⅳ期69例,占59.48%;肝脏转移25例,肺脏转移25例,锁骨上淋巴结转移7例,骨转移3例,脑3例;疾病类型:低分化腺癌62例,占53.45%,中分化腺癌33例,占28.45%,黏液腺癌21例,占18.10%;发病部位:左半结肠72例,占62.07%,右半结肠44例,占37.93%;淋巴结转移:N0(未见局部淋巴结受累)44例,占37.93%,N1(附近少数淋巴结受累)44例,占37.93%,N2(附近淋巴结受到累及)28例,占24.14%;病理分级:高级22例,占18.97%,中级69例,占59.48%,低级25例,占21.55%。采用随机数字表法将患者分为观察组与对照组,每组58例,2组患者在性别比、年龄、TNM分期、转移部位等一般资料之间的比较差异无统计学意义(Pgt;0.05),具有可比性。本研究经医院医学伦理委员会批准。见表1。
1.2 纳入与排除标准
1.2.1 纳入标准:全部患者符合美国癌症联合会(American joint committee on Cancer,AJCC)与国际抗癌联盟(union for international cancer control,UICC)第7版TNM分期标准符合结肠癌Ⅲ~Ⅳ期的患者[5],卡氏(Karnofsky performance score,KPS)评分[6]≥70分,预计生存时间gt;3个月,治疗前完善血常规、心电图、全身骨发射型计算机断层扫描(Emission Computed Tomography,ECT)、腹部计算机断层扫描(Computed Tomography,CT)与肝肾功能检查,且上述检查结果无异常。全部患者自愿参加本研究试验,且患者及其家属均签署知情同意书与伦理志愿书。
1.2.2 排除标准:合并严重心肺功能障碍、肝肾功能障碍、造血系统疾病、其他恶性肿瘤、肌肉骨骼系统疾病、肠梗阻、内分泌系统疾病、外周感觉神经疾病与精神性疾病等患者,孕妇或哺乳期女性,不能配合完成本次试验研究。
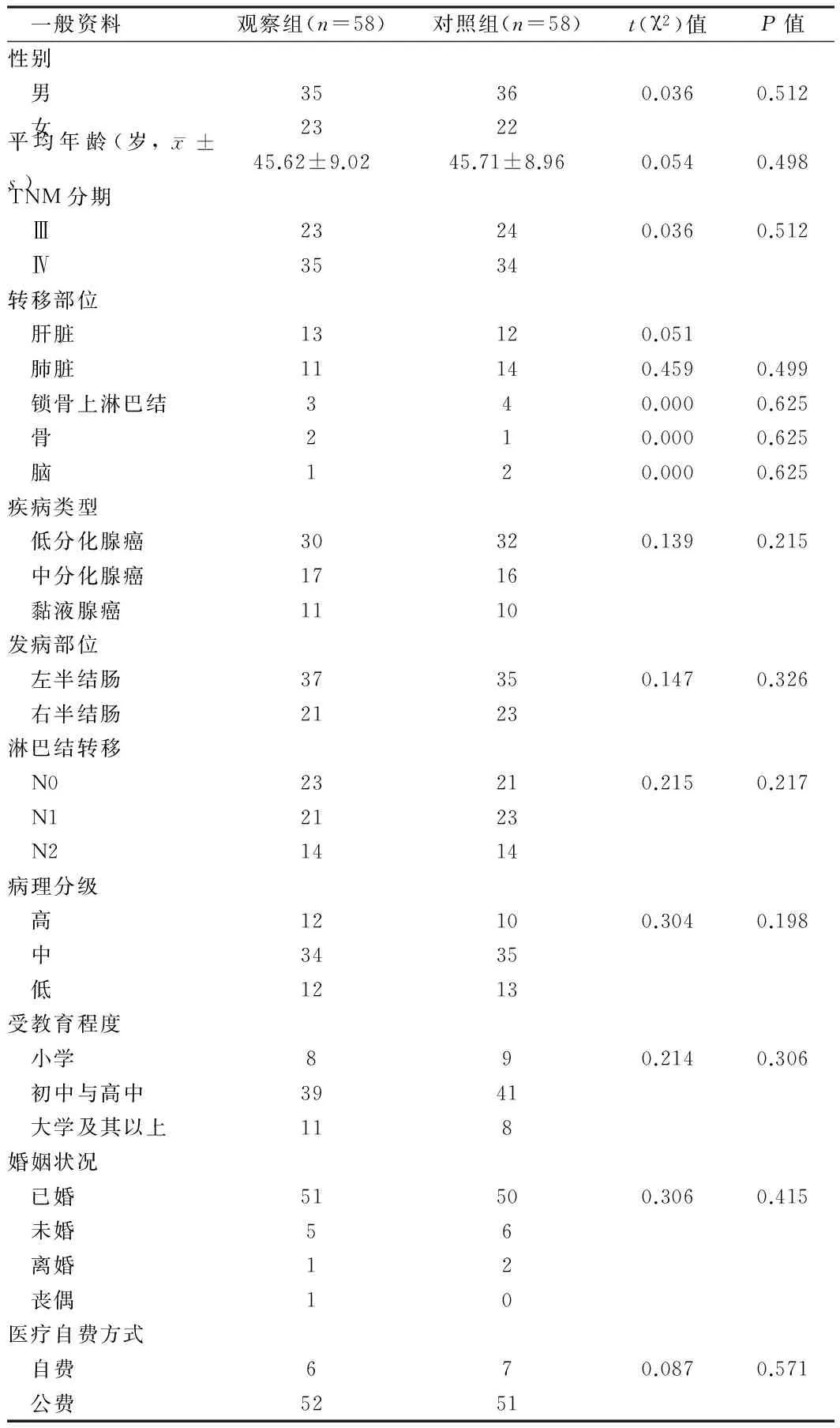
表1 2组患者一般资料之间的对比结果 例
1.3 方法
1.3.1 化疗方案:对照组患者术后采用FOLFOX6方案化疗联合贝伐单抗治疗;观察组患者在对照组患者的基础上加用伊立替康,具体用药方法如下:①FOLFOX6方案化疗:5-氟尿嘧啶(5-fluorouracil,5-Fu),由通化茂祥制药有限公司生产,国药准字:H22023469,规格:250 mg:10 ml×5支,用法:2 400~3 000 mg/m2,持续泵入48 h,每2周作为1个周期,术后辅助12个周期,总疗程6个月;亚叶酸钙(江苏恒瑞医药股份有限公司,国药准字H20000584)400 mg/m2,静脉滴注,d1;奥沙利铂(齐鲁制药有限公司生产,批准文号:国药准字H20093168,规格50 mg/支)100 mg/m2,持续静脉滴注2 h,d1,化疗4~6个周期。化疗期间注意保暖,避免接触冰冷物品,饮用冷饮等。②贝伐单抗 7.5 mg/kg,静滴30~90 min,卡培他滨1 000 mg/m2,2次/d,口服,持续2周。③盐酸伊立替康注射液(商品名:伊立替康,Pfizer Perth Pty Limited公司生产,批准文号:国药准字H20090659,规格:0.3 g∶15 ml;×5支)160 mg·m-2·d-1,匀速静脉滴注,滴注时间控制于1 h连续4周为1个疗程,其中前3周为化疗,第4周停药休息,总疗程12周。治疗期间定期复查腹部增强CT、肿瘤标记物、肝肾功能与血常规等,必要实施射线计算机体层扫描(positron-emission tomography-computed tomography,PET-CT)检查,了解肿瘤转移与肿瘤复发情况。
1.3.2 检测方法:①主要仪器与试剂:COBE Spectra 血液成分分离机(美国Gambro BCT公司),酶联免疫酶标仪(丹麦Denkey Dragon),IL-6、IL-10酶联免疫吸附测定(enzyme-linked immuno sorbent assay,ELISA)试剂盒(上海森雄科技有限公司)。②操作方法:采用ELISA 方法检测血清IL-6、IL-10水平,严格按照试剂盒说明书操作。
1.4 观察指标
1.4.1 有效性与安全性:①临床疗效:参照临床疗效评价标准[7],其中对于病灶彻底清除则评定为为完全缓解(complete remission,CR),病灶体积减小≥50%则评定为部分缓解(partial remission,PR),病灶体积减小≤50%则评定为疾病稳定(stable disease,SD),病灶体积无改变或新发病灶则评定为疾病进展(progressive disease,PD),总缓解率(overall response rate,ORR)=(CR+PR)/研究例数×100%,临床获益率(clinical benefit rate,CBR)=(CR+PR+SD)/研究例数×100%。②药物安全性:参照不良反应严重程度标准[8],其中对于无不良反应则评定为0级,对于轻度不良反应则评定为Ⅰ级,对于中度不良反应但可耐受则评定为Ⅱ级,对于中度不良反应且不可耐受则评定为Ⅲ级,对于重度不良反应,完全不耐受则评定为Ⅳ级。
1.4.2 血清指标:比较2组患者血清IL-6、IL-10水平的差异。
1.4.3 预后状况:采用电话随访与门诊复查方式随访2组患者的生存状况与复发情况。
1.4.4 生存质量:参照欧洲癌症研究治疗组织的生存质量核心问卷(European organization for research and treatment cancer quality of life questionnaire-core 30,EORTCQLQ-C30)评分量表标准[9],评定内容包括社会功能、情绪功能、认知功能、角色功能、躯体功能等五个维度共30个项目,分值越高提示生存质量越佳。
1.4.5 质量监控:由经严格培训的肿瘤科主治医师填写与评定临床疗效、药物安全性、复发与生存质量等情况,由非参与本研究试验的资深医师录入与核对相关数据,避免研究试验参与者个人原因对研究结果产生的偏倚,提高研究客观性。
2 结果
2.1 2组患者临床疗效比较 观察组部分缓解率、总缓解率与临床获益率均明显高于对照组,疾病进展率明显低于对照组,2组患者比较差异有统计学意义(Plt;0.05)。见表2。
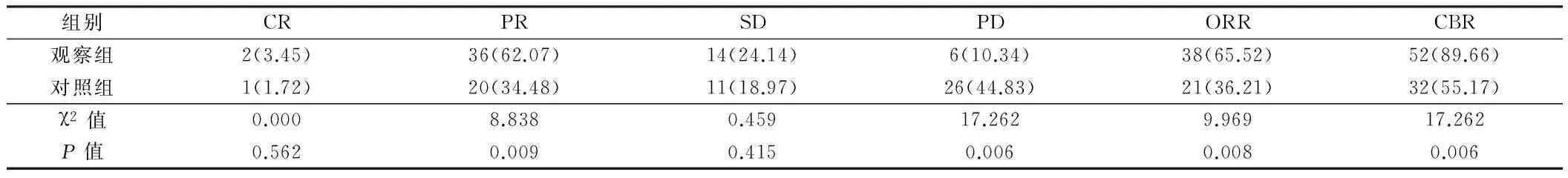
表2 2组患者临床疗效比较 n=58,例(%)
2.2 2组患者药物安全性比较 2组患者贫血、血小板减少、乙酰胆碱综合征、中性粒细胞减少与消化道反应等药物不良反应发生率比较差异无统计学意义(χ2=0.263,0.063,0.753,0.862,1.243,Pgt;0.05)。见表3。
2.3 2组患者血清指标比较 治疗前,2组患者血清IL-6、IL-10水平比较差异无统计学意义(Pgt;0.05),治疗后,2组患者上述指标均明显低于治疗前,治疗前后比较差异有统计学意义(Plt;0.05),其中观察组患者上述指标明显低于对照组患者,2组患者比较差异有统计学意义(Plt;0.05)。见表4。
2.4 2组患者预后状况比较 随访2年后,失访率为0,观察组患者生存率明显高于对照组患者,复发率明显低于对照组患者,2组患者比较差异有统计学意义(Plt;0.05)。见表5。
2.5 2组患者生存质量比较 治疗前,2组患者社会功能、情绪功能、认知功能、角色功能、躯体功能共五个维度的生存质量评分比较差异无统计学意义(Pgt;0.05),治疗后,全部患者上述评分均明显高于治疗前,治疗前后比较差异有统计学意义(Plt;0.05),其中观察组上述评分明显高于对照组,2组患者比较差异有统计学意义(t=6.964,9.392,5.921,12.206,10.930,Plt;0.05)。见表6。

表3 2组患者药物安全性比较 n=58,例(%)
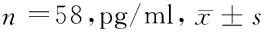
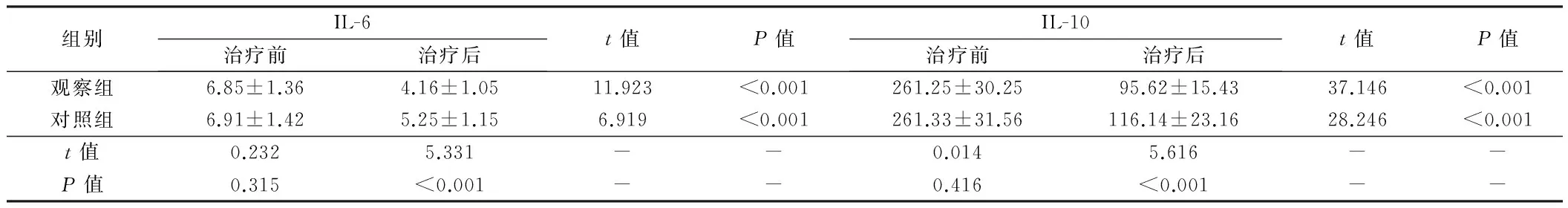
组别IL-6治疗前治疗后t值P值IL-10治疗前治疗后t值P值观察组6.85±1.364.16±1.0511.923lt;0.001261.25±30.2595.62±15.4337.146lt;0.001对照组6.91±1.425.25±1.156.919lt;0.001261.33±31.56116.14±23.1628.246lt;0.001t值0.2325.331--0.0145.616--P值0.315lt;0.001--0.416lt;0.001--
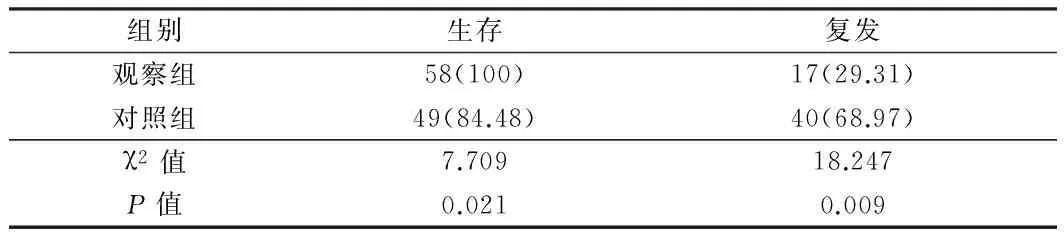
表5 2组患者预后状况比较 n=58,例(%)
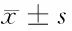
表6 2组患者生存质量比较 n=58,分,
注:与对照组比较,*Plt;0.01
3 讨论
3.1 伊立替康辅助化疗改善结肠癌患者临床疗效的重要性 目前,我国结肠癌的患病率与病死率呈增高的倾向,化疗是结肠癌患者治疗的主要手段,但化疗局限性、化疗不良反应、肿瘤耐药性常常导致癌症复发与生存质量低下,甚至治疗失败[10]。本研究结果显示,与FOLFOX6方案化疗联合贝伐单抗治疗患者比较,伊立替康辅助化疗患者总缓解率与临床获益率均明显增高,两者比较差异具有显著性。同时,两者药物不良反应发生率比较差异无显著性,揭示了伊立替康辅助化疗在改善结肠癌患者临床疗效中发挥重要的意义,且不增加药物不良反应的发生风险。进一步究其原因为:FOLFOX6方案是最为常见的用于结肠癌术后辅助化疗方案之一,本化疗方案的临床效果满意,但化疗容易导致消化道反应、骨髓抑制(贫血、血小板减少、中性粒细胞减少)等,部分患者由于不能耐受化疗不良反应,严重影响临床疗效[11]。同时,FOLFOX6方案中的化疗药物(5-Fu、亚叶酸钙、奥沙利铂)只能杀灭部分的结肠癌细胞,难以彻底清除微小残留的病灶组织。大量文献证实,结肠癌患者在接受多周期化疗期间联合采用贝伐单抗有助于改善临床疗效,成为了结肠癌患者的一线治疗方案[12]。另有相关文献显示,伊立替康单药抗肿瘤有效率约为30%~40%,提示该药仅可作为辅助治疗药物之一[13]。且伊立替康抑制癌细胞核酸重组的效果与贝伐单抗、奥沙利铂、5-Fu、亚叶酸钙的效果具有相互协同作用,三者联用有助于达到更好的抗肿瘤效果,结合本研究结果伊立替康辅助化疗可将CBR提高至89.66%,与相关文献[14]相一致。因此,伊立替康辅助化疗改善结肠癌患者临床疗效的作用显著。
3.2 伊立替康辅助化疗改善结肠癌患者血清IL-6、IL-10水平的重要性 治疗前,两种治疗方案患者血清IL-6、IL-10水平比较差异无显著性,治疗后,两种治疗方案患者上述指标均明显低于治疗前,其中伊立替康辅助化疗患者上述指标明显低于FOLFOX6方案化疗加分子靶向治疗患者。揭示了伊立替康辅助化疗有助于明显降低结肠癌患者血清IL-6、IL-10水平。进一步究其原因为:(1)相关文献显示,癌症患者血清IL-6、IL-10水平明显高于健康体检者,提示了血清IL-6、IL-10水平在一定程度上对肿瘤发生发展的评定中提供一定的参考依据[15]。(2)IL-6是多功能细胞因子之一,源自单核/巨噬细胞,具有促进B细胞增生分化与分泌抗体的功能,在炎症急性期反应与免疫应答中发挥重要的作用[16]。结肠癌患者的疾病转归与血清IL-6水平具有紧密的关系,其机制可能为:结肠癌细胞刺激机体免疫细胞分泌IL-6,有助于加强对机体免疫功能的防护和对肿瘤细胞的免疫监视作用,促进T细胞的抗肿瘤活性与自然杀伤细胞的活性。因此,血清IL-6水平与结肠癌病情发生与发展具有紧密的关系,通过加强对IL-6水平的检测有助于准确评定结肠癌患者的预后转归情况。(3)IL-10亦被称为细胞因子合成抑制因子。作为内源性抗炎因子,IL-10主要由B细胞激活,其具有抑制多种炎性因子、生长因子、巨噬细胞与T细胞等细胞因子的合成,且具有促进抗炎因子的分泌。治疗前结肠癌患者血清IL-10明显升高的机制为结肠癌细胞通过刺激机体免疫系统,造成结肠癌患者机体大量生成巨噬细胞与T细胞,从而形成自身免疫,诱发生成大量IL-10。因此,IL-10的异常升高常常提示结肠癌病情程度的加重。反之,经治疗后伊立替康辅助化疗患者血清IL-10水平明显降低则提示该方案用于结肠癌患者的治疗期间发挥更显著的优势。因此,血清IL-6、IL-10对结肠癌化疗疗效与预后评定具有指导意义。
3.3 伊立替康辅助化疗改善结肠癌患者生存预后状况的重要性 本研究结果显示,随访2年后,失访率0,伊立替康辅助化疗患者生存率明显高于FOLFOX6方案化疗加分子靶向治疗患者,复发率明显低于FOLFOX6方案化疗加分子靶向治疗患者。治疗前,两种治疗方案患者生存质量评分比较差异无显著性,治疗后,全部患者上述评分均明显高于治疗前,其中伊立替康辅助化疗患者上述评分明显高于FOLFOX6方案化疗加分子靶向治疗患者,揭示了伊立替康辅助化疗有助于改善结肠癌患者生存预后状况,与相关文献[17,18]一致。因此,伊立替康辅助化疗是一种有效安全的抗结肠癌治疗手段之一,值得临床广泛应用。但由于本研究仅可作为初步结果报告,研究病例尚需进一步观察与长期随访。同时,研究者需逐渐增加病例样本数量,延长随访时间,完善临床资料的完整性,进一步探讨伊立替康辅助化疗用于改善临床疗效与生存预后状况的详尽机制。
综上所述,伊立替康辅助化疗有助于明显改善结肠癌患者的临床疗效,通过降低血清IL-6、IL-10水平,从而改善生存预后状况,具有良好的应用价值与治疗前景,值得临床推广应用。
1 陈芬,江千秋,焦兰,等.DC-CIK联合化疗加靶向治疗对晚期结肠癌的临床疗效观察.现代肿瘤医学,2015,23:1686-1690.
2 Mika A,Kobiela J,Czumaj A,et al.Hyper-Elongation in Colorectal Cancer Tissue-Cerotic Acid is a Potential Novel Serum Metabolic Marker of Colorectal Malignancies.Cellular Physiology and Biochemistry,2017,41:33-39.
3 王建军,刘大晗.伊立替康联合5-氟尿嘧啶治疗对5-氟尿嘧啶耐药晚期大肠癌的临床效果.现代肿瘤医学,2015,2:2341-2345.
4 Palshof JA,Hgdall EV,Poulsen TS,et al.Topoisomerase I copy number alterations as biomarker for irinotecan efficacy in metastatic colorectal cancer.Bmc Cancer,2017,17:58-61.
5 李贵新,刘锦, 李肖燕,等.结肠癌患者术后化疗联合自体级联诱发免疫细胞治疗近期疗效和生活质量观察.中华肿瘤防治杂志,2014,21:1548-1552.
6 Kösmann L,Janssen S,Rades D.Karnofsky Performance Score,Radiation Dose and Nodal Status Predict Survival of Elderly Patients Irradiated for Limited-disease Small-cell Lung Cancer,2016,36:4177-4180.
7 石力夫,雷振.不同疗效评价标准对结肠癌肝转移瘤疗效评价的一致性研究.解放军医学院学报,2014,35:25-27.
8 穆晓攀,杜晓明,张泽群,等.吉西他滨联合顺铂与紫杉醇联合顺铂方案治疗晚期肺鳞癌的临床疗效及不良反应观察.癌症进展,2016,14:384-386.
9 Leppert W,Majkowicz M.Validation of the polish version of the european organization for research and treatment of cancer quality of life questionnaire-core 15-palliative care in patients with advanced cancer.Palliative Medicine,2013,27:470.
10 丁寿亮.对结肠癌化疗药物的毒性评估.中国普外基础与临床杂志,2016,23:291-291.
11 3Rd B A,Kiss I,Bridgewater J,et al.BATON-CRC:A Phase II Randomized Trial Comparing Tivozanib Plus mFOLFOX6 with Bevacizumab Plus mFOLFOX6 in Stage IV Metastatic Colorectal Cancer.Clinical Cancer Research An Official Journal of the American Association for Cancer Research,2016,22:50-58.
12 罗聪,应杰儿,徐琦,等.不同剂量贝伐单抗联合伊立替康对荷人结肠癌DLD-1裸鼠皮下移植瘤生长的影响.肿瘤学杂志,2013,19:42-45.
13 章群,钱晓萍,聂春兰.83例结直肠癌体外药物敏感性及临床病理参数相关性.现代肿瘤医学,2017,25:252-256.
14 张夏兰,王湛,黄立峰,等.依据基因多态性优化伊立替康对结肠癌治疗剂量的药学监护.中国临床药理学杂志,2016,32:740-741.
15 殷勇,张小康.全胸腔镜肺叶切除术与传统开胸手术治疗早期非小细胞肺癌的疗效分析.实用癌症杂志,2016,31:1137-1139.
16 唐甜,安东建,曹建国.癌症中IL-6信号通路研究进展.现代肿瘤医学,2016,24:1470-1472.
17 Ozawa H,Kotake K,Hosaka M,et al.Incorporation of serum carcinoembryonic antigen levels into the prognostic grouping system of colon cancer,2017,25:25-29.
18 张宝昕,赵军,潘宏达,等.102例老年结肠癌患者预后因素分析.肿瘤学杂志,2016,22:365-368.
EffectsofcamptoadjuvantchemotherapyonserumlevelsofIL-6,IL-10andsurvivalprognosisofpatientswithcoloncancer
DONGYuan,WEIGang,SUNZequn,etal.
DepartmentofDigestiveDiseases,People’sHospitalAffiliatedtoHubeiMedicineCollege,Hubei,Shiyan442000,China
ObjectiveTo investigate the effects of campto adjuvant chemotherapy on serum levels of interleukin-6 (IL-6), interleukin-10 (IL-10) and survival prognosis of patients with colon cancer.MethodsA total of 116 patients with colon cancer who were admitted and treated in Department of Oncology of our hospital from January 2014 to January 2015 were randomly divided control group and observation group,with 58 patients in each group. The patients in control group were treated by postoperative FOLFOX6 chemotherapy combined with bevacizumab,however,the patients in observation group, on the basis of control group, were given oral campto.The serum levels of IL-6,IL-10 were detected by enzyme-linked immunosorbent assay (ELISA) ,moreover, the clinical curative effects,serum parameters and survival prognosis were observed and compared between two groups.ResultsThe overall remission rate and clinical benefit rate in observation group were significantly higher than those in control group (Plt;0.05).However there were no significant differences in incidence rates of drug adverse reactions between the two groups (Pgt;0.05).Before treatment, there were no significant differences in the serum levels of IL-6,IL-10 between two groups (Pgt;0.05),however, after treatment, the serum levels of IL-6,IL-10 in both groups were obviously lower than those before treatment (Plt;0.05), moreover,which in observation group were significantly lower than those in control group (Plt;0.05). After 2-year follow up,the lost follow-up rate was 0,and the survival rate in observation group was obviously higher than that in control group,however, the relapse rate in observation group was obviously lower than that in control group (Plt;0.05).Before treatment, there were no significant differences in the life quality scores between two groups (Pgt;0.05),however, after treatment, the life quality scores in both groups were significantly higher than those before treatment (Plt;0.05),moreover, the scores in observation group were obviously higher than those in control group (Plt;0.05).ConclusionThe campto adjuvant chemotherapy can help to improve clinical curative effects obviously on colon cancer,which can lower the serum levels IL-6,IL-10 to improve survival prognosis of patients, thus,which is worthy using widely in clinical practice.
campto;chemotherapy;colon cancer;interleukins;survival prognosis
10.3969/j.issn.1002-7386.2017.22.005
442000 湖北省十堰市,湖北医药学院附属人民医院消化科(董媛、魏刚、孙泽群、吴军),甲状腺乳腺血管外科(师贞宗)
师贞宗,442000 湖北医药学院附属人民医院甲状腺乳腺血管外科;
E-mail:szz254@163.com
R 735.35
A
1002-7386(2017)22-3383-05
2017-05-22)

