轻度认知损害患者空间导航能力相关皮质下核团体积研究
李卫萍 张冰 赵辉 尹震宇 刘任远 陆加明 吴思楚 武文博 朱斌 徐运
·临床研究·
轻度认知损害患者空间导航能力相关皮质下核团体积研究
李卫萍 张冰 赵辉 尹震宇 刘任远 陆加明 吴思楚 武文博 朱斌 徐运
目的 探讨轻度认知损害患者皮质下核团体积与空间导航能力之间的关系。方法 采用计算机空间导航障碍测试系统测试30例轻度认知损害患者和性别、年龄、受教育程度相匹配的28例正常对照者空间导航能力,FreeSurfer 5.3.0软件对三维T1WI图像进行结构分割,计算皮质下核团(双侧丘脑、尾状核、壳核、苍白球、海马、杏仁体和伏隔核)体积以及全脑体积。Pearson相关分析分析空间导航能力与皮质下核团体积的相关性。结果 轻度认知损害患者混合(环境参照和自我参照)导航(P=0.034)、自我参照导航(P=0.004)、环境参照导航(P=0.011)误差距离均大于正常对照者,而双侧丘脑(P=0.953,0.250)、尾状核(P=0.938,0.672)、壳核(P=0.421,0.912)、苍白球(P=0.446,0.360)、海马(P=0.545,0.647)、杏仁体(P=0.565,0.993)、伏隔核(P=0.271,0.796)和全脑(P=0.567)体积组间差异无统计学意义。Pearson相关分析显示,轻度认知损害患者混合(环境参照和自我参照)导航误差距离与左侧苍白球(r=⁃0.284,P=0.034)和左侧海马(r=⁃0.265,P=0.048)体积呈负相关,环境参照导航误差距离与左侧壳核体积呈负相关(r=⁃0.305,P=0.022)。结论 轻度认知损害患者空间导航能力与皮质下核团体积相关,对进一步研究空间导航障碍的发生机制具有重要意义。
认知障碍; 神经导航; 基底神经节; 磁共振成像
空间导航能力是基于自身和环境线索判断路径的神经功能,包括执行功能、计划能力、注意力、空间记忆力、路径学习能力、方向感等[1],根据神经结构基础和参考系的不同可以分为自我参照导航能力、环境参照导航能力、线索导航能力和路径整合导航能力,其中尤以自我参照导航能力和环境参照导航能力最为重要[2]。轻度认知损害(MCI)和阿尔茨海默病(AD)患者空间导航能力较正常老龄化有不同程度损害。有50%~89%的阿尔茨海默病患者在熟悉的环境中迷路,甚至在轻度认知损害阶段即有25%患者在陌生环境中失去方向感[3]。阿尔茨海默病相关神经退行性变可以出现海马结构和功能改变,既往研究显示,尾状核和楔前叶体积与路径整合导航能力和空间记忆力有关[4⁃6]。然而关于轻度认知损害患者其他皮质下核团与自我参照导航能力和环境参照导航能力的关系较少见诸报道。本研究对30例轻度认知损害患者皮质下核团体积进行分割,联合空间导航能力测验,以探讨轻度认知损害患者皮质下核团体积与空间导航能力之间的关系。
资料与方法
一、临床资料
1.纳入标准 (1)轻度认知损害的诊断参照Petersen标准[7]:①主诉记忆障碍且有知情者证实。②有记忆损害的客观证据。③总体认知功能轻度异常:简易智能状态检查量表(MMSE)评分为25~26分,蒙特利尔认知评价量表(MoCA)评分为19~25分。④日常生活活动能力(ADL)正常。(2)本研究经南京大学医学院附属鼓楼医院道德伦理委员会审核批准,所有受试者或其家属均知情同意并签署知情同意书。
3.一般资料 (1)轻度认知损害组(MCI组):选择2015年5月-2016年5月在南京大学医学院附属鼓楼医院神经内科记忆障碍门诊就诊的轻度认知损害患者共30例,男性15例,女性15例;年龄45~82岁,平均(65.91±11.33)岁;受教育程度8~17年,平均(13.88±2.89)年;MMSE评分23~28分,平均为(25.97±2.25)分;MoCA评分 20~25分,平均为(21.81±2.13)分。(2)正常对照组(对照组):选择同期在我院进行体格检查的无认知功能障碍的健康志愿者共28例,均无痴呆家族史。男性19例,女性9例;年龄49~81岁,平均(69.68±10.79)岁;受教育程度7~18年,平均为(13.36±2.31)年;MMSE评分27~30分,平均为(28.93±0.97)分;MoCA评分21~30分,平均(27.43±2.36)分。两组患者性别(χ2=1.927,P=0.196)、年龄(t=1.315,P=0.194)和受教育程度(t=⁃0.758,P=0.451)差异均无统计学意义;而 MCI组 MMSE评分(t=6.442,P=0.000)和 MoCA评分(t=9.677,P=0.000)低于对照组。
二、研究方法
1.空间导航能力测验 采用计算机空间导航障碍测试系统(AMUNET,奥地利NeuroScios公司)进行空间导航能力测验。该测试系统基于人类水迷宫试验,通过计算机模拟空间导航评价空间导航能力。测试方法为隐藏目标测验,参照文献[8]方法,要求受试者在计算机虚拟环境中寻找到隐藏的目标(通过鼠标在计算机屏幕上定位),分为3项子任务,即混合(环境参照和自我参照)导航、自我参照导航和环境参照导航,每项子任务包括8项测试以评价受试者学习能力,计算机自动生成学习曲线,记录每项测试中鼠标停留位置与真实目标位置之间的误差距离,取8次测试的平均值作为空间导航能力评分。误差距离越大、受试者偏离真实目标位置越远、空间导航能力越差。
2.头部MRI检查 采用荷兰Philips公司生产的Achieva 3.0T TXMRI系统,8通道头部相控阵线圈。通过三维快速场回波(3D⁃TFE)获得矢状位 T1WI图像,选取胼胝体最清晰层面,定位框中线平行于胼
胝体体部,覆盖全部脑组织。扫描参数:重复时间(TR)为 9.80 ms、回波时间(TE)为4.60 ms,翻转角(FA)为8°,体素1 mm ×1 mm×1 mm,扫描视野(FOV)256 mm×256 mm,矩阵 256×256,激励次数(NEX)为1次,扫描层厚1 mm、层间距0 mm,扫描时间403 s,共扫描192层。
3.图像处理 采用FreeSurfer 5.3.0软件(http://surfer.nmr.mgh.harvard.edu/fswiki/FreeSurferWiki)对 3D⁃T1WI图像进行结构分割和体积计算。(1)数据预处理:①将原始DICOM格式的3D⁃T1WI数据转化为NIFIT格式。②剔除每例受试者的非脑组织。③进行涡流校正。(2)根据FreeSurferColor LUT模板对灰质和白质结构进行分割。(3)由同一位具有丰富图像处理经验的影像科医师对分割结果进行质量控制,如果得出的皮质下核团分割数据异常,则手工修正。(4)最终通过FreeSurferColor LUT模板获得皮质下核团(双侧丘脑、尾状核、壳核、苍白球、海马、杏仁体和伏隔核)体积以及全脑体积。
三、统计分析方法
采用SPSS 18.0统计软件进行数据处理与分析。计数资料以相对数构成比(%)或率(%)表示,采用χ2检验。计量资料以均数±标准差(x±s)表示,采用两独立样本的t检验。空间导航能力与皮质下核团体积的相关性采用Pearson相关分析。以P≤0.05为差异具有统计学意义。
结 果
一、空间导航能力和皮质下核团体积的比较
MCI组患者混合(环境参照和自我参照)导航(P=0.034)、自我参照导航(P=0.004)、环境参照导航(P=0.011)误差距离均大于对照组,表明轻度认知损害患者存在空间导航能力障碍(表1)。两组患者双侧丘脑(P=0.953,0.250)、尾状核(P=0.938,0.672)、壳核(P=0.421,0.912)、苍白球(P=0.446,0.360)、海马(P=0.545,0.647)、杏仁体(P=0.565,0.993)和伏隔核(P=0.271,0.796)体积以及全脑体积(P=0.567)差异均无统计学意义,表明轻度认知损害患者皮质下核团(双侧丘脑、尾状核、壳核、苍白球、海马、杏仁体和伏隔核)体积以及全脑体积无明显变化(表1)。
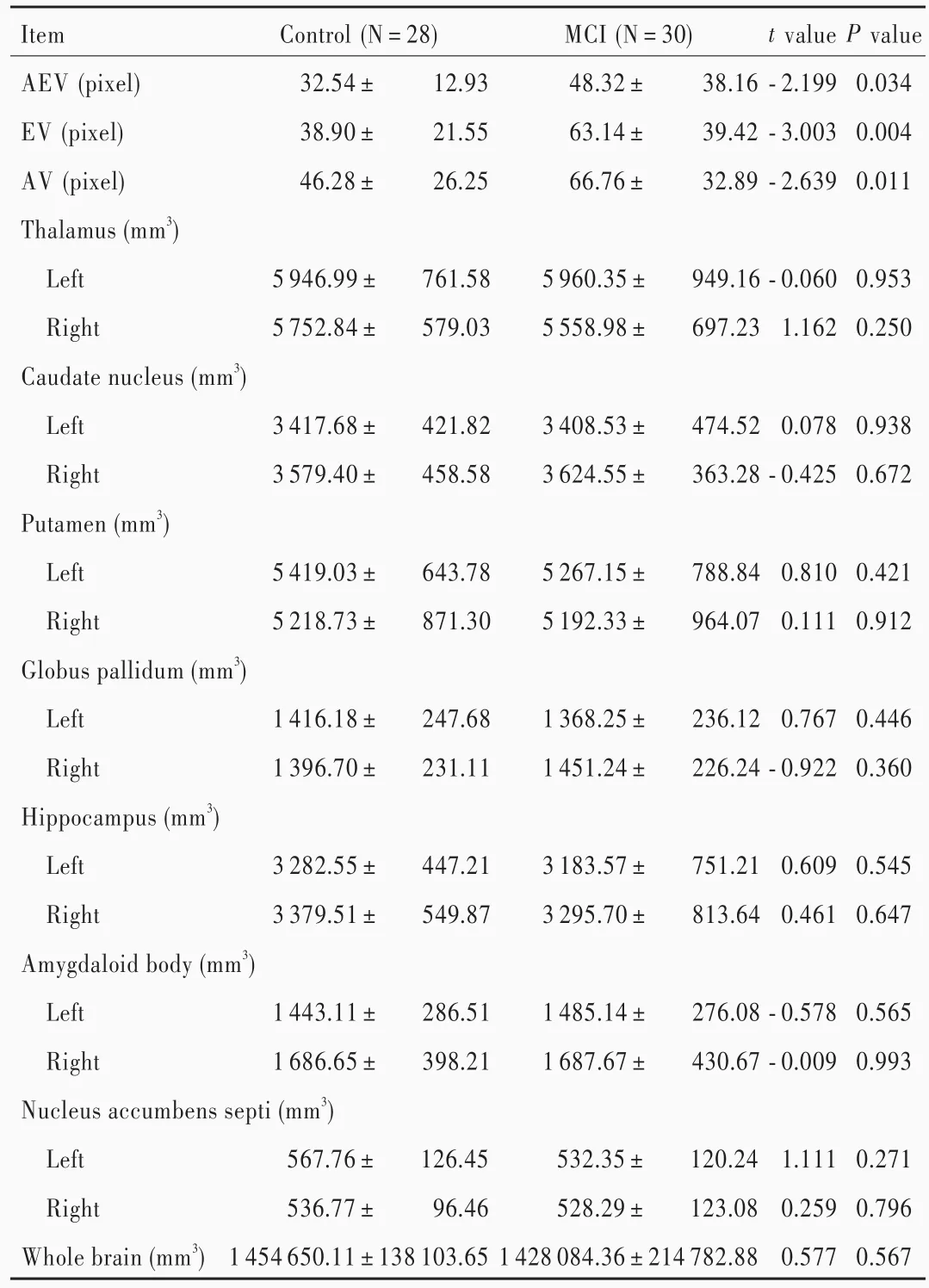
表1 两组受试者空间导航能力和皮质下核团体积的比较(x±s)Table 1. Comparison of subcortical nuclei volume and spatial navigation performance between 2 group(x±s)
二、空间导航能力与皮质下核团体积的相关性
Pearson相关分析结果显示,轻度认知损害患者混合(环境参照和自我参照)导航误差距离与左侧苍白球体积(r=⁃0.284,P=0.034)和左侧海马体积(r=⁃0.265,P=0.048)呈负相关,而与其他皮质下核团体积无关联性(均P>0.05);环境参照导航误差距离与左侧壳核体积呈负相关(r=⁃0.305,P=0.022),而与其他皮质下核团体积无关联性(均P>0.05);自我参照导航误差距离与皮质下核团体积均无关联性(P>0.05),表明轻度认知损害患者左侧苍白球和海马体积越小、混合导航能力越差,左侧壳核体积越小、环境参照导航能力越差(表2)。
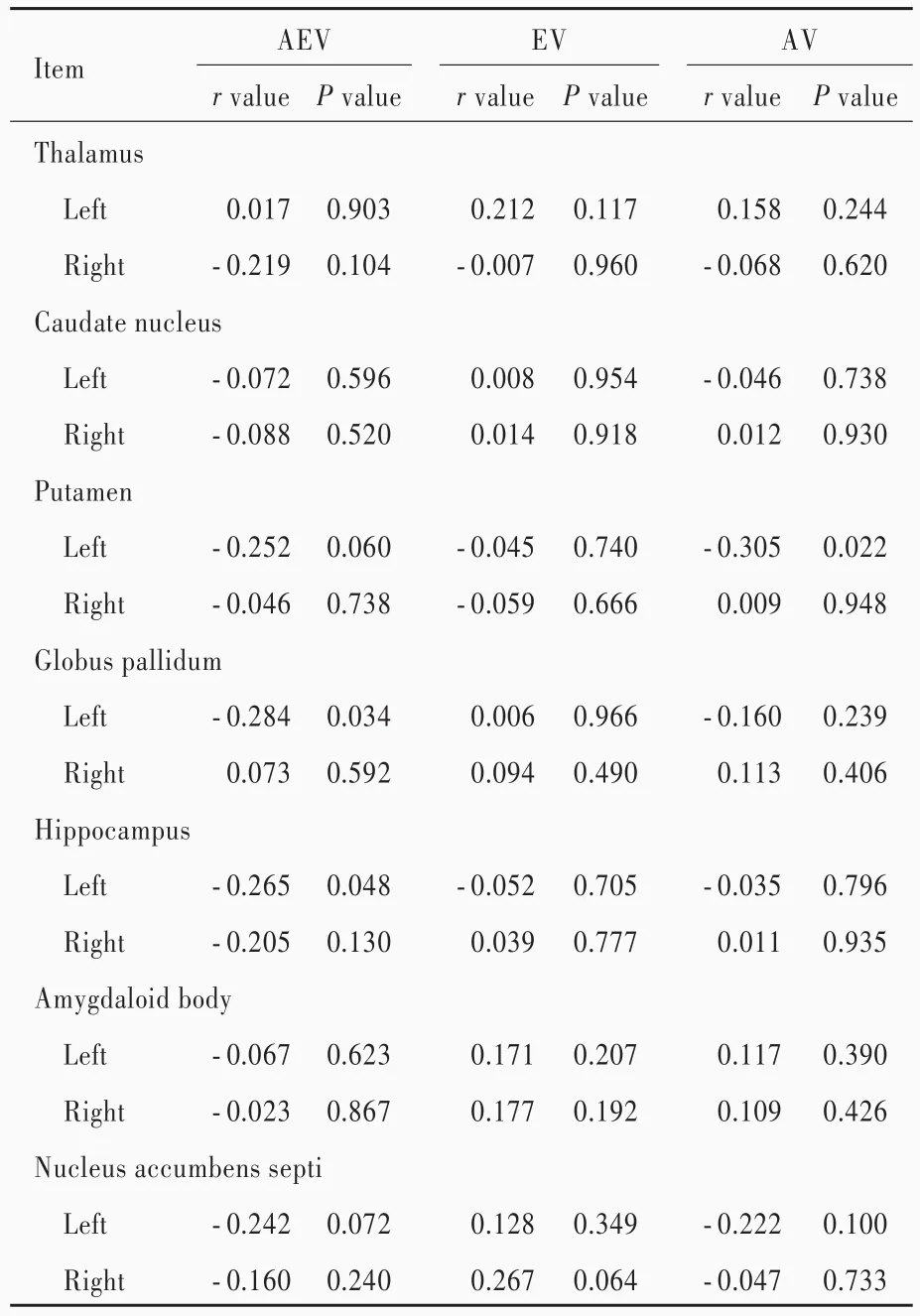
表2 空间导航能力与皮质下核团体积的相关性分析Table2. The correlation analysis between subcortical nuclei volume and spatial navigation performance
讨 论
自我参照导航以自身位置信息解码空间信息以确保受试者移动时的方向感,其结构基础主要位于顶下小叶和尾状核等部位[9]。环境参照导航则依赖认知地图,要求受试者以探索性视角记忆并分析整个环境信息,包括地标位置、起点与目标位置距离与方向等,主要由海马、海马旁回和内嗅皮质(EC)等负责[10⁃13]。导航过程中神经环路之间相互协调,各种导航策略密不可分,受试者可以利用不同空间信息在自我参照和环境参照之间转换,更倾向于混合导航。业已证实计算机空间导航障碍测试系统可以合理模拟真实空间中的导航,提供一种实用、廉价、可靠的工具[2]。
本研究结果显示,轻度认知损害患者左侧苍白球体积与混合导航能力具有相关性,左侧苍白球体积越小、混合(环境参照和自我参照)导航误差距离越大、混合导航能力越差。纹状体包括尾状核、壳核和苍白球等神经核团,可以分为以下功能区:背内侧区域(主要是尾状核),背外侧区域(主要是壳核)和腹侧区[14],其中,背外侧区域接受感觉和运动皮质信息,可以预测特定的执行功能和运动功能;背内侧区域接受前扣带回信息且与认知功能相关;腹侧区接受来自海马的投射[15]。纹状体与所有皮质区域存在结构和功能联系,相当于中心点,因此,该结构对神经退行性变的病理改变十分敏感[16]。相关研究显示,认知功能正常的老年人群纹状体即有β⁃淀粉样蛋白(Aβ)沉积,轻度认知损害和阿尔茨海默病患者纹状体与多个脑区的结构和功能连接改变[17⁃18]。皮质⁃基底神经节环路对刺激反应和程序性记忆具有重要作用,是路径学习和地标导航的生理学基础。该环路连接特定皮质与纹状体亚区,如苍白球。Ren等[19]发现,与认知功能正常者相比,轻度认知损害患者壳核低频振幅(ALFF)降低与Aβ沉积有关;Alexopoulos等[20]认为,此时壳核表现为高灌注,而尾状核无明显变化。de Jong等[21]研究显示,阿尔茨海默病患者壳核萎缩与认知功能障碍显著相关。本研究结果显示,轻度认知损害患者壳核体积与环境参照导航能力具有相关性,左侧壳核体积越小、环境参照导航误差距离越大、环境参照导航能力越差。既往研究显示,在工作记忆和学习任务中,轻度认知损害患者壳核激活[22]。因此,壳核体积缩小可能从结构和功能方面共同影响空间导航能力。
fMRI研究显示,受试者进行迷宫内地标相关目标点定位时,可见纹状体激活,表明海马激活与辨认迷宫边界周围地标位置有关[23]。动物实验显示,大鼠海马和背外侧纹状体在空间导航学习和记忆中协同发挥作用[24]。在重复性导航任务中,目标性导航和习惯性导航可以相互转换,海马主要参与初始阶段的学习,背侧纹状体主要与自我习惯有关,背外侧和背内侧纹状体在目标性导航和习惯性导航的交互使用中发挥重要作用[23]。本研究结果显示,左侧海马体积越小、混合(环境参照和自我参照)导航误差距离越大、混合导航能力越差。
本研究轻度认知损害与正常对照者皮质下核团体积和全脑体积无明显差异,究其原因可能是:(1)所纳入的轻度认知损害患者均处于疾病早期,病程较短,仅存在轻度记忆障碍,尚未累及神经核团。(2)未对轻度认知损害进行亚型分析,轻度认知损害具有显著异质性,部分患者进展为阿尔茨海默病,即进展型轻度认知损害;部分患者不进展为痴呆,即稳定型轻度认知损害。根据轻度认知损害是否累及记忆功能,又分为遗忘型轻度认知损害(aMCI)和非遗忘型轻度认知损害(naMCI),其中遗忘型轻度认知损害根据是否伴海马萎缩进一步分为海马型和非海马型。不同亚型轻度认知损害潜在病因不同,其向阿尔茨海默病进展的风险不同,累及的神经核团亦不同,例如,约80%的遗忘型轻度认知损害患者5年内进展为阿尔茨海默病,主要累及记忆认知域。
综上所述,本研究探讨轻度认知损害患者空间导航能力与皮质下核团体积的相关性,左侧苍白球和海马体积越小、混合导航能力越差,左侧壳核体积越小、环境参照导航能力越差。然而本研究样本量较小,且未对轻度认知损害进行亚型分析,尚待进一步深入研究。
[1]Lithfous S,Dufour A,Després O.Spatial navigation in normal aging and the prodromal stage of Alzheimer's disease:insights from imaging and behavioral studies.Ageing Res Rev,2013,12:201⁃213.
[2]Nedelska Z,Andel R,Laczó J,Vlcek K,Horinek D,Lisy J,Sheardova K,Bures J,Hort J.Spatial navigation impairment is proportional to right hippocampal volume.Proc Natl Acad Sci USA,2012,109:2590⁃2594.
[3]Pai MC,Jacobs WJ.Topographical disorientation in community⁃residing patients with Alzheimer's disease.Int J Geriatr Psychiatry,2004,19:250⁃255.
[4]Weniger G,Ruhleder M,Lange C,Wolf S,Irle E.Egocentric and allocentric memory as assessed by virtualreality in individuals with amnestic mild cognitive impairment.Neuropsychologia,2011,49:518⁃527.
[5]deIpolyi AR,Rankin KP,Mucke L,Miller BL,Gorno⁃Tempini ML.Spatial cognition and the human navigation network in AD and MCI.Neurology,2007,69:986⁃997.
[6]Wegman J,Fonteijn HM,van Ekert J,Tyborowska A,Jansen C,Janzen G.Gray and white matter correlates of navigational ability in humans.Hum Brain Mapp,2014,35:2561⁃2572.
[7]Petersen RC.Mild cognitive impairment as a diagnostic entity.J Intern Med,2004,256:183⁃194.
[8]Wu WB,Liu RY,Zhou F,Zhu B,Zhang B,Xu Y.The study of spatial navigation in different cognitive level and ages:based on Chinese population.Zhongguo Lin Chuang Shen Jing Ke Xue,2015,23:316⁃320[.武文博,刘任远,周飞,朱斌,张冰,徐运.中国人群不同认知状态下空间导航能力的初步研究.中国临床神经科学,2015,23:316⁃320.]
[9]Weniger G,Ruhleder M,Wolf S,Lange C,Irle E.Egocentric memory impaired and allocentric memory intact as assessed by virtual reality in subjects with unilateral parietal cortex lesions.Neuropsychologia,2009,47:59⁃69.
[10]Bohbot VD,Kalina M,Stepankova K,Spackova N,Petrides M,Nadel L.Spatial memory deficits in patients with lesions to the right hippocampus and to the right parahippocampal cortex.Neuropsychologia,1998,36:1217⁃1238.
[11]Bohbot VD,Iaria G,Petrides M.Hippocampal function and spatialmemory:evidence from functionalneuroimaging in healthy participants and performance of patients with medial temporal lobe resections.Neuropsychology,2004,18:418⁃425.
[12]Doeller CF,Barry C,Burgess N.Evidence for grid cells in a human memory network.Nature,2010,463:657⁃661.
[13]Moser EI,Roudi Y,Witter MP,Kentros C,Bonhoeffer T,Moser MB.Grid cells and cortical representation.Nat Rev Neurosci,2014,15:466⁃481.
[14]Voorn P,Vanderschuren LJ,Groenewegen HJ,Robbins TW,Pennartz CM.Putting a spin on the dorsal⁃ventral divide of the striatum.Trends Neurosci,2004,27:468⁃474.
[15]van der Meer MA,Ito R,Lansink C, Pennartz CM.Hippocampal projections to the ventral striatum:from spatial memory to motivated behavior//Derdikman D,Knierim JJ.Space,time and memory in the hippocampal formation.Vienna:Springer,2014:497⁃516.
[16]Cole MW,Pathak S,Schneider W.Identifying the brain's most globally connected regions.Neuroimage,2010,49:3132⁃3148.
[17]Rodriguez⁃Vieitez E,Saint⁃Aubert L,Carter SF,Almkvist O,Farid K,Schöll M,Chiotis K,Thordardottir S,Graff C,Wall A,Långström B,Nordberg A.Diverging longitudinal changes in astrocytosis and amyloid PET in autosomal dominant Alzheimer's disease.Brain,2016,139:922⁃936.
[18]Han SD,Arfanakis K,Fleischman DA,Leurgans SE,Tuminello ER, Edmonds EC, Bennett DA. Functional connectivity variations in mild cognitive impairment:associations with cognitive function.J Int Neuropsychol Soc,2012,18:39⁃48.
[19]Ren P,Lo RY,Chapman BP,Mapstone M,Porsteinsson A,Lin F;Alzheimer's Disease Neuroimaging Initiative.Longitudinal alteration of intrinsic brain activity in the striatum in mild cognitive impairment.J Alzheimers Dis,2016,54:69⁃78.
[20]Alexopoulos P,Sorg C,Förschler A,Grimmer T,Skokou M,Wohlschläger A,Perneczky R,Zimmer C,Kurz A,Preibisch C.Perfusion abnormalites in mild cognitive impairment and mild dementia in Alzheimer's disease measured by pulsed arterial spin labeling MRI.Eur Arch Psychiatry Clin Neurosci,2012,262:69⁃77.
[21]de Jong LW,van derHiele K,VeerIM,Houwing JJ,Westendorp RG,Bollen EL,de Bruin PW,Middelkoop HA,van Buchem MA,van der Grond J.Strongly reduced volumes of putamen and thalamus in Alzheimer's disease:an MRI study.Brain,2008,131:3277⁃3285.
[22]Erickson KI,Boot WR,Basak C,Neider MB,Prakash RS,Voss MW,Graybiel AM,Simons DJ,Fabiani M,Gratton G,Kramer AF. Striatal volume predicts level of video game skill acquisition.Cereb Cortex,2010,20:2522⁃2530.
[23]Regier PS,Amemiya S,Redish AD.Hippocampus and subregions ofthe dorsalstriatum respond differently to a behavioralstrategy change on a spatialnavigation task.J Neurophysiol,2015,114:1399⁃1416.
[24]Rice JP, Wallace DG, Hamilton DA. Lesions of the hippocampus or dorsolateral striatum disrupt distinct aspects of spatialnavigation strategies based on proximaland distal information in a cued variant of the Morris water task.Behav Brain Res,2015,289:105⁃117.
Study on relationship between subcortical nuclei volume and spatial navigation performance in patients with mild cognitive impairment
LI Wei⁃ping1,ZHANG Bing1,ZHAO Hui2,YIN Zhen⁃yu3,LIU Ren⁃yuan2,LU Jia⁃ming1,WU Si⁃chu1,WU Wen⁃bo1,ZHU Bin1,XU Yun21Department of Radiology,2Department of Neurology,3Department of Geriatrics,Nanjing Drum Tower the Affiliated Hospital of Nanjing University Medical School,Nanjing 210008,Jiangsu,China
Objective To evaluate the correlation between subcortical nuclei volume and spatial navigation performance in patients with mild cognitive impairment(MCI).Methods Thirty MCI subjects and 28 healthy controls matched in gender,age and education were enrolled in this study,and all of them underwent 3.0T MRI scan and computer version spatial navigation test.The three⁃dimensional turbo fast echo(3D⁃TFE)T1WI structures were segmented by FreeSurfer 5.3.0 software.The volume of bilateral thalami,caudate nuclei,putamen,globus pallidi,hippocampi,amygdaloid bodies,nuclei accumbens septi and whole brain were calculated.Pearson correlation analysis was performed to investigate the correlation between spatial navigation performance and subcortical nuclei volume. Results MCI patients showed longer allocentric⁃egocentric virtual distance error(P=0.034),egocentric virtual distance error(P=0.004)and allocentric virtual distance error(P=0.011)than control subjects,while the volume of bilateral thalami(P=0.953,0.250),caudate nuclei(P=0.938,0.672),putamen(P=0.421,0.912),globus pallidi(P=0.446,0.360),hippocampi(P=0.545,0.647),amygdaloid bodies(P=0.565,0.993),nuclei accumbens septi(P=0.271,0.796)and whole brain(P=0.567)showed no significant differences between 2 groups.Pearson correlation analysis showed allocentric⁃egocentric virtual distance error was negatively related to the volume of left globus pallidum(r= ⁃0.284,P=0.034)and left hippocampus(r= ⁃0.265,P=0.048),and allocentric virtual distance error was negatively related to the volume of left putamen(r=⁃0.305,P=0.022)in MCI subjects. Conclusions There are correlations between spatial navigation performance and subcortical nuclei volume in MCI patients,and it is significant in further study of the mechanisms of human spatial navigation disturbance.
Cognition disorders; Neuronavigation; Basal ganglia; Magnetic resonance imaging
ZHANG Bing(Email:zhangbing_nanjing@vip.163.com)
This study was supported by the Major Research Project of National Natural Science Foundation of China(No.91649116),the National Natural Science Foundation of China(No.81571040),and Science and Technology Development Plan Project of Jiangsu Province,China(No.BK20131085).
10.3969/j.issn.1672⁃6731.2017.05.009
国家自然科学基金重大研究计划项目(项目编号:91649116);国家自然科学基金资助项目(项目编号:81571040);江苏省科技发展计划项目(项目编号:BK20131085)
210008 南京大学医学院附属鼓楼医院医学影像科(李卫萍、张冰、陆加明、吴思楚、武文博、朱斌),神经内科(赵辉、刘任远、徐运),老年医学科(尹震宇)
张冰(Email:zhangbing_nanjing@vip.163.com)
2017⁃04⁃06)

