凝结芽孢杆菌13002高密度培养
, ,,,,,*
(1.华南理工大学食品科学与工程学院,广东广州 510640; 2.浙江大学生物系统工程与食品科学学院,浙江杭州 310058)
凝结芽孢杆菌13002高密度培养
孙丽娜1,金迅1,2,周全兴1,周劲松1,刘冬梅1,*
(1.华南理工大学食品科学与工程学院,广东广州 510640; 2.浙江大学生物系统工程与食品科学学院,浙江杭州 310058)
本实验旨在通过优化培养条件提高凝结芽孢杆菌13002发酵培养液中的菌体浓度,为生产高光学纯度L-乳酸奠定基础。通过单因素实验,最陡爬坡实验,Box-Behnken响应面实验确定凝结芽孢杆菌13002的最优培养基配方和最佳培养条件,并于自动发酵罐中进行高密度分批补料培养。结果表明,最优培养基配方为:葡萄糖20 g/L、细菌学蛋白胨10 g/L、酵母提取粉25 g/L、NaCl 10 g/L,初始pH6.5。在此优化条件下,以6%的接种量,培养温度45 ℃,培养至16 h,以0.5 g/(L·h)速率添加补料至结束,最大菌体浓度达5.399 g/L,活菌总数为3.095×109CFU/mL,最终冻干后达0.730×1011CFU/g。
凝结芽孢杆菌13002,高密度培养,响应面,分批补料培养
凝结芽孢杆菌(Bacilluscoagulans)[1]为革兰氏阳性菌,兼性厌氧,菌体呈杆状,芽孢端生,无鞭毛。最适生长温度为40~50 ℃,最适生长pH为6.6~7.0,具备耐高温、耐胆盐、耐酸等抗逆性[2],发酵产L-乳酸。L-乳酸可用于食品、轻化工行业、生物医学材料[3-5],应用前景广阔。微生物发酵法生产乳酸工艺简单,产物低廉,毒副产物少,是L-乳酸生产的主要方法[6-9]。
近年来,国内外对于凝结芽孢杆菌的研究重点在于如何用低廉易获得的培养基获得高密度培养的凝结芽孢杆菌菌体。高密度培养技术(HCDC,high cell density culture)[10-11]指的是模拟人体生长环境,使细胞在特定细胞生物反应器中快速增长,从而充分提高菌体的发酵密度和生物量,或增加特定代谢产物的比生长率的一种培养技术。其中,分批补料培养(fed-batch culture)指在培养的某些阶段中,不定期地添加物料,使菌体及其代谢产物能够持续增长的培养技术;这是目前针对益生菌进行高密度培养最完善、最常用的方式[12]。
课题组前期筛选分离得到的一株芽孢杆菌13002,经鉴定为凝结芽孢杆菌;经急性毒理实验证实安全无毒;经手性柱分析其代谢的乳酸,其中L-乳酸的光学纯度达99%[13]。在此基础上,本研究对凝结芽孢杆菌13002进行高密度培养,有利于该菌的深入研究及L-乳酸的生产,具有良好的工业化生产前景。
1 材料与方法
1.1材料与仪器
凝结芽孢杆菌(Bacillussp.)13002 由华南理工大学食品质量与安全实验室从豆瓣酱中分离筛选得到,并于2013年4月12日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC NO.7431。
种子培养基:细菌学蛋白胨10.0 g,酵母提取粉5.0 g,葡萄糖20.0 g,NaCl 10.0 g,蒸馏水1000 mL,混合均匀后,调节pH至6.5,再于121 ℃下灭菌15 min。
计数培养基:种子培养基添加2%的琼脂,121 ℃高温灭菌15 min后冷却备用。
JJ200Y型电子天平 美国双杰兄弟有限公司;KDC-40型生化培养箱 安徽科大有限公司;MK3型超净工作台 上海日岛有限公司;JW-3021HR型高速冷冻离心机 安徽嘉文有限公司;pHS-3C型精密pH计 上海仪电有限公司;752S型紫外可见分光光度计 上海棱光技术有限公司;Biostat Aplus 5L自动发酵罐系统 德国布朗有限公司。
1.2实验方法
1.2.1 菌种活化 将在斜面培养基上低温保存的菌种接种到基础培养基中,45 ℃、180 r/min下摇瓶培养24 h;再进行二级活化,接种浓度为6%(v/v);活化后得到种子液,于45 ℃静置备用。
1.2.2 分析方法
1.2.2.1 菌体浓度的测定 参考文献[14]中的方法,建立标准曲线:取2.5 mL菌液于离心管中,6000 r/min离心10 min,用生理盐水将菌体沉淀洗涤2次;将菌体稀释适当倍数后,以生理盐水为空白对照,测定OD600 nm,使所测吸光值在0.2~0.8之间,将OD600 nm,作为横坐标,菌体浓度(g/L)为纵坐标,绘制标准曲线。
菌体浓度测定:取5 mL发酵培养液,其它处理同标准曲线,根据标准曲线回归方程计算得到样品菌体浓度。
1.2.2.2 活菌总数(CFU/mL)测定 参考文献[14]中的方法,建立标准曲线:取活化好的种子液,使用无菌生理盐水梯度稀释后取100 μL于计数培养基上涂布;45 ℃培养48 h,进行菌落计数;取活化好的种子液,使用无菌生理盐水梯度稀释,取不同稀释倍数的的菌液,以生理盐水为空白对照,测OD600 nm。以OD600 nm为横坐标,与之对应的菌落总数(CFU/mL)为纵坐标,绘制标准曲线。
活菌总数测定:取5 mL发酵培养液,其它处理同标准曲线,根据标准曲线回归方程计算得样品活菌总数(CFU/mL)。
1.2.3 实验设计
1.2.3.1 生长曲线建立 取活化好的种子液,6%(v/v)接种后于45 ℃、180 r/min摇瓶培养;测定初始菌体浓度所对应的吸光值,每间隔2 h测定一次,至24 h培养结束,以时间(h)为横坐标,菌体浓度(g/L)为纵坐标,绘制生长曲线。
1.2.3.2 培养基优化 碳源、氮源、无机盐优化:选取葡萄糖、蔗糖、乳糖、可溶性淀粉作为实验碳源,设定浓度值均为20 g/L;细菌学蛋白胨、酵母提取粉、牛肉浸膏、NH4Cl、(NH4)2SO4作为实验氮源,设定浓度值均为10 g/L;将活化好的种子液分别接种到不同种类的碳源、氮源基础培养基中;按照1.2.3.1中条件培养24 h,测OD600 nm,计算菌体浓度。选取NaCl作为实验无机盐,在无机盐基础培养基中,分别使NaCl浓度达 5、10、15 g/L;按照1.2.3.1中条件培养24 h,测OD600 nm,计算菌体浓度。
碳氮比优化:根据不同种类碳源、氮源的单因素实验结果,确定最陡爬坡实验的方向和步长,设计最陡爬坡实验[15],如表2~表5所示;根据确定的实验显著因素和中心点,采用Design-Expert 8.0.5软件设计3因素3水平的响应面实验,如表1所示,将得到的实验数据进行二次多项回归拟合,得到响应变量与自变量之间的关系模型,找出利于菌种生长最优碳氮比例。
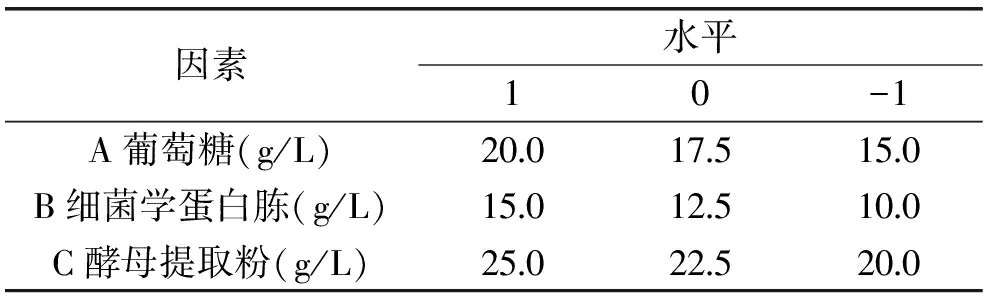
表1 Box-Behnken Design因素水平表Table 1 The factors and levels table of Box-Behnken Design
1.2.3.3 培养条件优化 pH优化:选用Na2HPO4-NaH2PO4缓冲液,设置pH为6.2、6.5、6.7、6.9、7.2;将活化好的种子液分别接种到不同pH的培养基中;按照1.2.3.1中条件培养24 h,测OD600 nm,选择利于菌种增长的最优pH。
培养温度优化:选取30、35、40、45、50 ℃作为实验培养温度;按照1.2.3.1中条件培养24 h,测OD600 nm,选用利于菌种增长的最优培养温度。
1.2.3.4 培养优化验证 对优化后菌种建立生长曲线,并与优化前的进行比较。
1.2.3.5 分批补料培养 摇瓶分批补料培养:根据菌种生长曲线确定其对数生长期及稳定期;用优化后的培养基培养菌种到其对数生长末期,采用最优碳氮比进行恒速流加[16]补料;分别以0.5、1.0、1.5 g/(L·h)(以葡萄糖计)3种补料速率向培养液中添加补料液,自16 h开始,每4 h添加补料一次,培养至28 h结束,于每次补料前和发酵结束时测定OD值,计算菌体浓度,比较不同补料速率对菌种生长的影响,选用利于菌种增长的最优补料速率。
自动发酵罐分批补料培养:在4 L自动发酵罐中,以最优条件进行培养至菌种对数生长末期,以最优补料速率向培养液中添加补料液,计算菌体浓度;比较摇瓶和自动发酵罐分批补料培养对菌种增长影响和区别。
1.2.3.6 凝结芽孢杆菌13002菌粉制备 取上述发酵罐培养所得的培养液;再经离心、添加保护剂、真空冷冻干燥等步骤得冻干菌粉,最后进行活菌数测定[17]。
冻干菌粉活菌数测定步骤为:取待测样品冻干菌粉0.1 g,放置于超净工作台上进行操作,添加10 mL无菌生理盐水,静置20 min使其复水,然后再采用稀释涂布平板法测定菌粉中活菌总数,单位质量活菌数(CFU/g)=干燥后的活菌数/添加菌粉质量。
1.2.4 数据处理 采用Design-Expert 8.0.5软件进行响应面分析;采用Microsoft Excel 2007进行数据计算及绘图。
2 结果与分析
2.1凝结芽孢杆菌13002的生长曲线
凝结芽孢杆菌13002的生长曲线如图1所示。
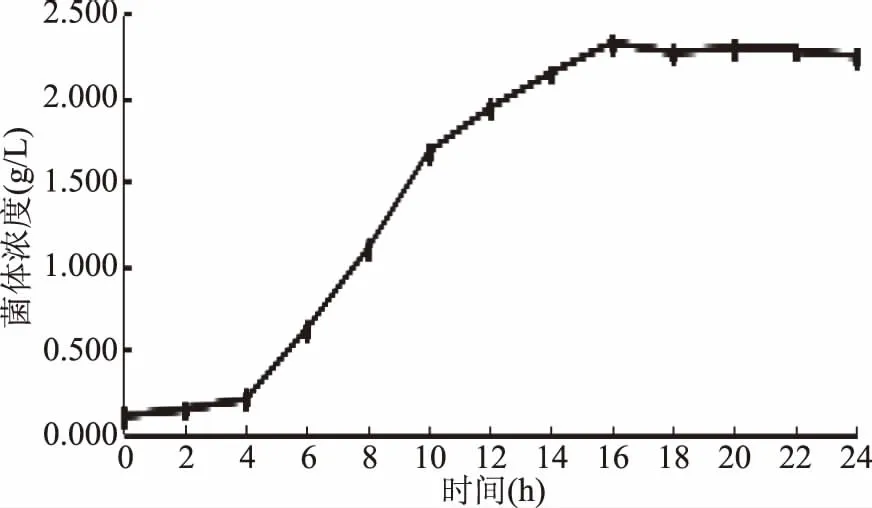
图1 凝结芽孢杆菌13002生长曲线Fig.1 The growth curve of Bacillus 13002
由图1可以看出,从0~4 h,菌体浓度上升缓慢,处于调整期,是培养基接种之后的一个适应期,生长迟缓;从4~16 h,菌体浓度迅速上升,从0.202 g/L骤增到2.333 g/L,该阶段菌种处于对数期,细胞高速生长繁殖;从16 h开始,菌体浓度波动减缓至趋于平稳,至24 h实验结束,该阶段菌种处于稳定期,细胞分裂速率明显降低,持续了较长一段时间,可能原因是营养物质的消耗造成菌体活力下降。
2.2培养基优化
2.2.1 不同碳源、氮源、无机盐浓度的影响 选取葡萄糖、蔗糖、乳糖、可溶性淀粉四种典型的碳源进行研究,结果如图2所示。由图2可知,当葡萄糖、蔗糖、乳糖、可溶性淀粉作为单一碳源时,活菌总数从高到低排序依次为:葡萄糖、可溶性淀粉、蔗糖、乳糖。可见,蔗糖和乳糖对菌种的促生长效果相对较差,葡萄糖和可溶性淀粉对菌种的促生长效果较为显著,其中葡萄糖最优。选择葡萄糖作为单一碳源,用于凝结芽孢杆菌13002培养增殖。

图2 不同碳源对凝结芽孢杆菌13002生长的影响Fig.2 Effect of different carbon sources on the growth of Bacillus 13002
选取细菌学蛋白胨、酵母提取粉、牛肉浸膏三种有机氮,氯化铵、硫酸铵两种无机氮进行研究,结果如图3所示。

图3 不同氮源对凝结芽孢杆菌13002生长的影响Fig.3 Effect of different nitrogen sources on the growth of Bacillus 13002
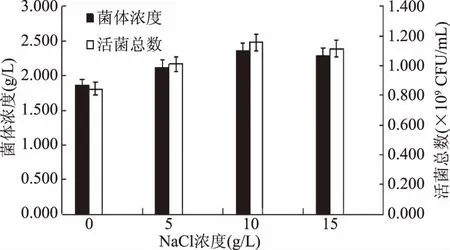
图4 不同NaCl浓度对凝结芽孢杆菌13002生长的影响Fig.4 Effect of different NaCl concentration on the growth of Bacillus 13002
由图3可知,对凝结芽孢杆菌生长有明显促进作用的氮源为酵母提取粉。相比无机氮源,有机氮源使菌种生长更好。其原因可能是:无机氮源虽能迅速被菌体利用,但其利用会造成体系pH的变化,对菌体生长产生影响;而有机氮源不仅能给菌体生长提供氮源,还能提供大量的无机盐和生长因子。有机氮源中,酵母提取粉的促生长效果最佳,可能是因为酵母提取粉来源于食用酵母,富含氨基酸、维生素等多种生长因子,但总氮含量较低;细菌学蛋白胨效果虽然不如酵母提取粉,但总氮含量较高,同样具备使用价值。综合考虑经济效益和实际作用,选取细菌学蛋白胨、酵母提取粉作为复合氮源,用于凝结芽孢杆菌13002的培养增殖。
选取NaCl的4个浓度进行研究,结果如图4所示。由图4可知,随NaCl浓度的上升,菌体浓度及活菌总数先增后减。NaCl的添加对凝结芽孢杆菌13002有促生长效果;其中,浓度为10 g/L时达到最大值,浓度继续增加反而效果相反,这可能因为NaCl浓度过高导致菌悬液渗透压过高,不利于细胞增长。选取浓度为10 g/L的NaCl作为无机盐,用于凝结芽孢杆菌13002的培养增殖。
2.2.2 不同碳氮比的影响 筛选出最优的碳源和氮源后,对碳氮比做进一步的确定。由于实验因素只有3个,选用单因素分析法确定显著性因素的效应大小,分别就每个因素设置3个水平进行研究,结果如表2~表4所示。

表2 不同浓度葡萄糖实验结果Table 2 The design and results of glucose concentration

表3 不同浓度细菌学蛋白胨实验结果Table 3 The design and results of bacterial peptone concentration

表4 不同浓度酵母提取粉实验结果Table 4 The design and results of yeast extract powder concentration
由表2~表4可知,随葡萄糖浓度升高,菌体浓度及活菌总数呈下降趋势,则该因素为负效应,最优浓度为20 g/L;随酵母提取粉浓度升高,菌体浓度及活菌总数呈上升趋势,则该因素为正效应,最优浓度为20 g/L;随着细菌学蛋白胨浓度变化,菌体浓度及活菌总数先上升再下降,最优浓度是10 g/L。
依据单因素分析结果,按照显著性因素产生的效应大小确定最陡爬坡实验的方向和梯度,浓度设计及结果如表5所示。

表5 最陡爬坡实验设计及结果Table 5 The design and results of steepest ascent experiment
由表5可知,随葡萄糖浓度升高,细菌学蛋白胨和酵母提取粉浓度下降,菌体浓度及活菌总数呈先上升后下降趋势。菌体浓度及活菌总数最大的响应值为第4组实验,对应的浓度为葡萄糖17.5 g/L,细菌学蛋白胨12.5 g/L,酵母提取粉22.5 g/L,所以确定该点作为后续响应面设计因素的中心点。
根据最陡爬坡实验确定的响应面设计中心点,采用Design-Expert软件进行3因素3水平响应面设计,浓度设计及结果如表6~表8,图5所示。
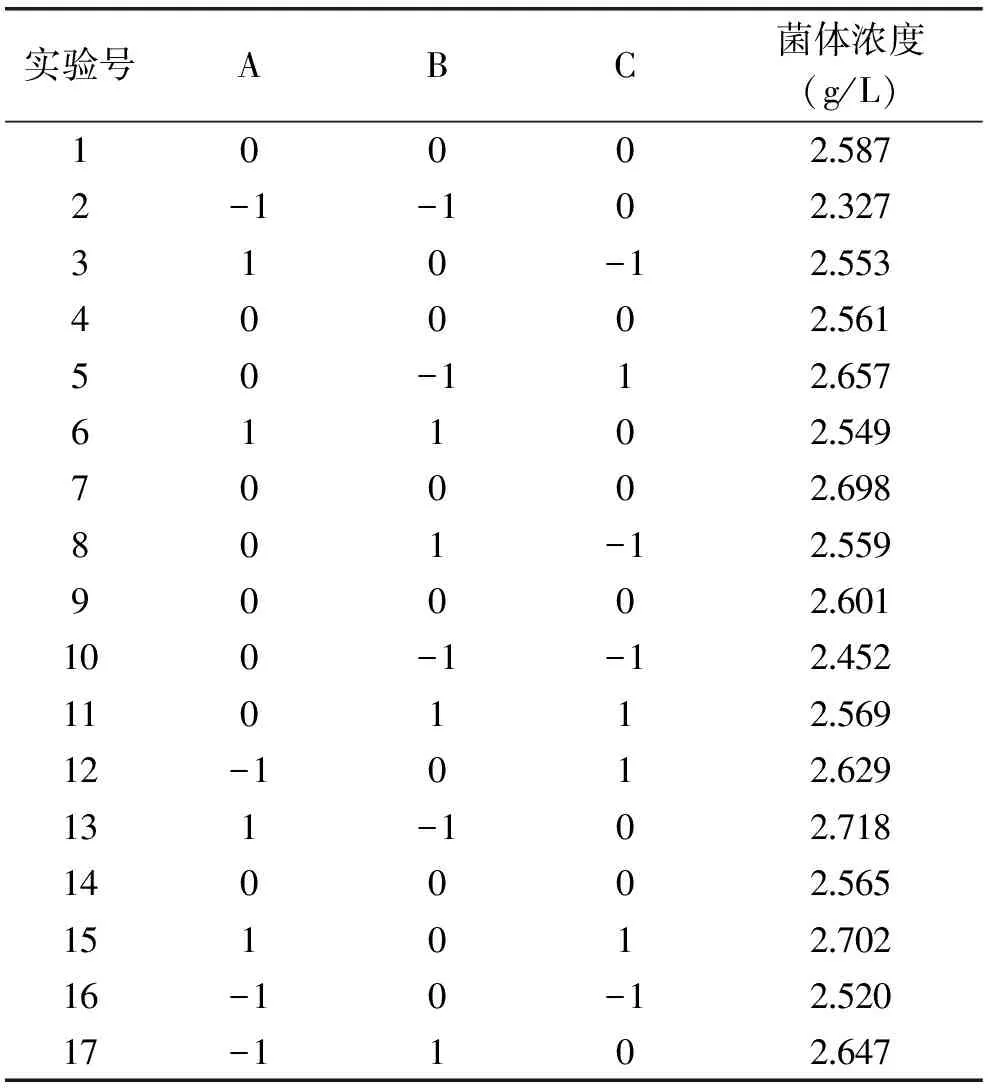
表6 Box-Behnken Design实验设计及结果Table 6 The design and results of Box-Behnken Design
由表6可知,经Design-Expert软件处理[8],确定该响应面回归方程为:
Y=2.60+0.05A+0.021B+0.059C-0.12AB+0.01AC-0.049BC-0.0002A2-0.042B2-0.0012C2
由图5及响应面模型分析可知,存在最大值。根据Design-Expert 8.0.5软件得到的回归方程可计算得到Y的最大值为2.828 g/L,对应的浓度值为葡萄糖20 g/L,细菌学蛋白胨10 g/L,酵母提取粉25 g/L。
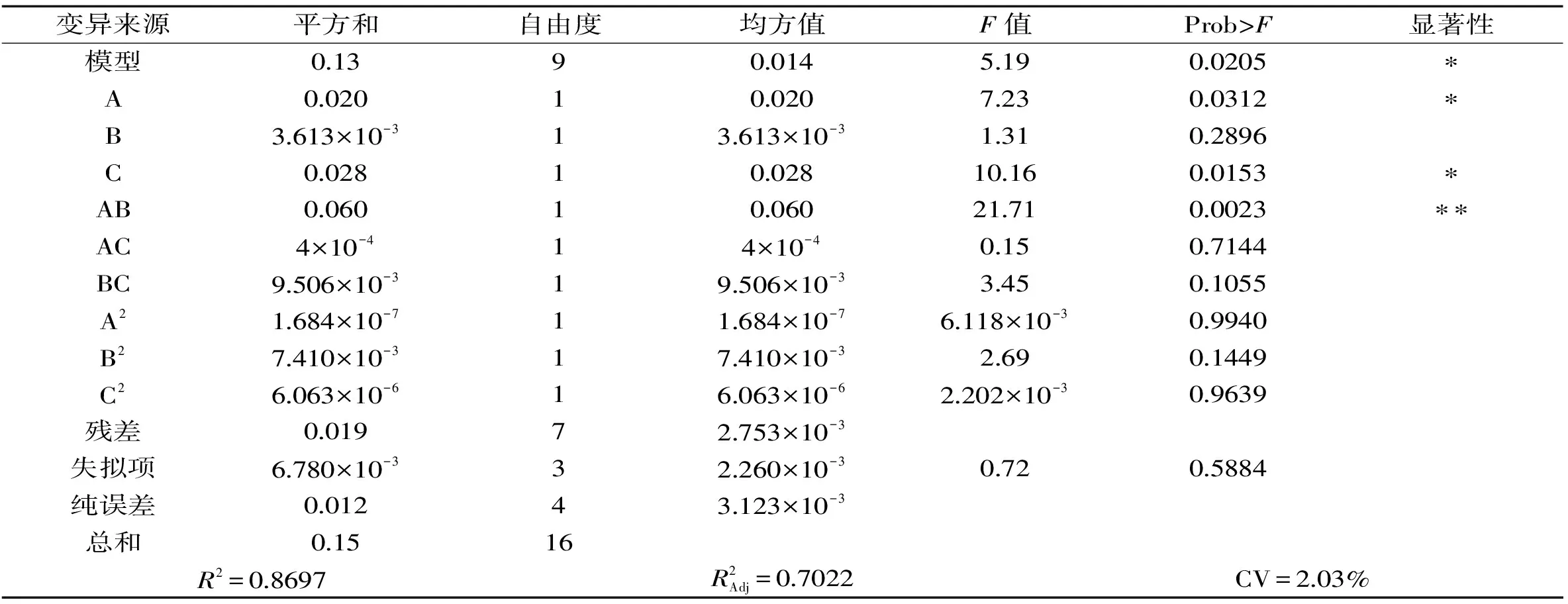
表7 响应面模型分析Table 7 The response surface model analysis
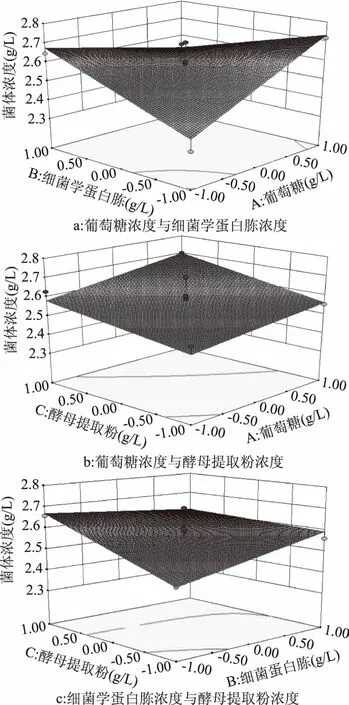
图5 响应面立体图Fig.5 Response surface stereogram
注:*:差异性显著;**:差异性极显著。
最优培养基配方为:葡萄糖20 g/L;细菌学蛋白胨10 g/L,酵母提取粉25 g/L作为复合氮源;NaCl浓度10 g/L;对凝结芽孢杆菌13002的培养优化进行验证实验,最大菌体浓度可达2.623 g/L。
2.3培养条件优化结果
2.3.1 不同pH的影响 不同菌种由于性质差异,其最适增长pH不同。同时,微生物代谢活动会改变所处环境初始pH,需要在培养基中添加中和剂或缓冲剂,以维持pH相对稳定。在Na2HPO4-NaH2PO4缓冲体系下,选取不同pH进行研究,结果如图6所示。24 h内,随时间延长,5组pH培养下菌体浓度均有增加。随着pH上升,菌体浓度及活菌总数先上升后下降;较其它4组pH,pH为6.5对凝结芽孢杆菌13002的促生长效果最明显。最大菌体浓度、活菌总数、最大比生长率各自达到3.775 g/L、2.138×109CFU/mL、0.371。其它4组pH对凝结芽孢杆菌13002生长促进作用相对较小,菌体浓度均未超过3 g/L。选取pH6.5,用于凝结芽孢杆菌13002的培养增殖。

图6 不同pH对凝结芽孢杆菌13002生长的影响Fig.6 Effect of different pH on the growth of Bacillus 13002
2.3.2 不同培养温度的影响 在一定温度范围内,菌种代谢会随温度升高而加快,超过该限度则会出现细胞功能下降,蛋白质变性,甚至死亡等。选取30、35、40、45、50 ℃共5组培养温度进行研究,结果如图7所示。24 h内,随时间延长,5组温度培养下菌体浓度均有增加。随着培养温度的上升,菌体浓度及活菌总数呈先上升后下降的趋势。培养温度为30、35 ℃时,对菌种的促生长效果相对较差,最大菌体浓度均未超过2.5 g/L;45 ℃条件下菌种生长情况最佳,最大菌体浓度、活菌总数、最大比生长率分别达到2.643 g/L、1.342×109CFU/mL、0.425。50 ℃条件对菌种也有较好的促生长作用,说明该菌种能在较高温度下进行培养,大大降低了培养过程污染杂菌可能性,具备较好的生产和工业化前景。综合考虑,选取培养温度45 ℃,用于凝结芽孢杆菌13002培养增殖。

图7 不同培养温度对凝结芽孢杆菌13002生长的影响Fig.7 Effect of different culture temperatures on the growth of Bacillus 13002
2.3.3 培养优化前后生长曲线对比 经过优化后,建立凝结芽孢杆菌13002优化后生长曲线,并与原始曲线进行比较,结果如图8所示。

图8 凝结芽孢杆菌13002生长曲线Fig.8 The growth curve of Bacillus 13002
由图8可知,经优化后,凝结芽孢杆菌13002的菌体浓度增加。其中,经培养基及培养条件优化得到的最大菌体浓度由原来的2.250 g/L提高到3.890 g/L,为原来的1.7倍。实际值与优化的理论值2.828 g/L非常相近,这说明通过响应面优化的最佳实验条件是可靠的。
2.3.4 分批补料培养研究 经确定凝结芽孢杆菌13002生长周期,培养基、培养条件优化后,采用分批补料培养法对菌种进行高密度培养,即在对数末期通过添加补料液来促进菌种的持续增长,分别在摇瓶和自动发酵罐两种容器中进行高密度培养,并相互比较。
2.3.4.1 摇瓶分批补料培养影响 以最优培养基作为补料液,并选取恒速流加作为补料流加方式,控制补料速率分别为0.5、1.0、1.5 g/(L·h)(以葡萄糖计),研究其对菌种生长的影响。
结果如图9所示,以不添加补料摇瓶培养作为对照,16~28 h内,随时间延长,补料速率0.5 g/(L·h)条件培养下菌体浓度会随之增加;补料速率1.0 g/(L·h)、1.5 g/(L·h)条件培养下菌体浓度均先上升后下降。其中,补料速率0.5 g/(L·h)条件对凝结芽孢杆菌13002有明显的促生长效果,最大菌体浓度由原来的3.255 g/L提高到4.003 g/L,为原来的1.2倍。补料速率1.0 g/(L·h)条件下,前期生长较快,后期菌体浓度反而下降,可能是因为代谢产物迅速积累,抑制菌种生长;补料速率1.5 g/(L·h)条件下,高浓度底物和代谢物对菌种增长出现更明显抑制。因而选取补料速率0.5 g/(L·h),用于培养凝结芽孢杆菌13002。
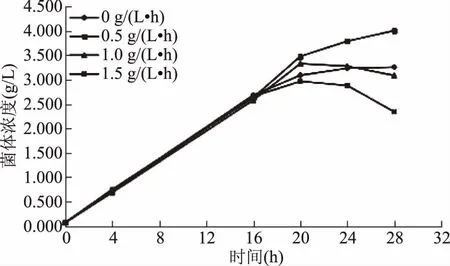
图9 不同补料速率对凝结芽孢杆菌13002生长的影响Fig.9 Effect of different feed rate on the growth of Bacillus 13002
2.3.4.2 摇瓶发酵与自动发酵罐分批补料培养结果比较 在自动发酵罐中进行高密度培养,采用分批补料培养法并在对数末期选用0.5 g/(L·h)的补料速率添加补料液,研究其对菌种生长的影响。
结果如图10所示,16~28 h内,随时间延长,摇瓶培养条件菌体浓度会随之增加,而发酵罐培养条件下,菌体浓度先上升后下降,但在同一时间点,菌体浓度均明显高于摇瓶培养。其中发酵罐培养最大菌体浓度达5.399 g/L,是摇瓶培养条件的1.4倍。发酵罐培养培养至24 h后,出现了菌体浓度的下降,可能是因为菌种生长代谢活性已到达瓶颈阶段,继续添加补料液并无法促使菌种持续生长,相反却起到了稀释和抑制作用。

图10 摇瓶和自动发酵罐培养 对凝结芽孢杆菌13002生长的影响Fig.10 Effect of shake flask and fermentation tank culture on the growth of Bacillus 13002
综合考虑,选用最优培养基及最优培养条件,采用分批补料培养法并以0.5 g/(L·h)的补料速率在发酵罐中进行凝结芽孢杆菌13002的高密度培养,培养时间最好不超过24 h。
2.3.5 凝结芽孢杆菌13002菌粉测定结果 选取2.3.4中自动发酵罐培养所得培养液,采用真空冷冻干燥法制备凝结芽孢杆菌13002菌粉,通过保护剂使菌体尽量保持较高存活率,再测定计算冻干后活菌数量,结果如表8所示。

表8 发酵罐培养及菌粉测定结果Table 8 Results of fermentation tank culture and bacterial powder determination
由表8可知,凝结芽孢杆菌13002高密度培养后最大菌体浓度为5.399 g/L,较未经优化的原始菌体浓度2.333 g/L,提高到了原来的2.3倍。测得活菌总数是3.095×109CFU/mL,冻干后为7.300×1010CFU/g,达到高密度培养目标。
3 结论
3.1通过对凝结芽孢杆菌13002的培养优化,确定最优培养基配方为:葡萄糖20 g/L;细菌学蛋白胨10 g/L,酵母提取粉25 g/L作为复合氮源;NaCl浓度10 g/L;此时最大菌体浓度可达2.623 g/L。
3.2在Na2HPO4-NaH2PO4缓冲体系下,调节pH至6.5,活菌数达2.138×109CFU/mL;培养温度45 ℃条件时活菌数达1.342×109CFU/mL;摇瓶培养条件时为1.331×109CFU/mL。经分批补料培养,于16~28 h,在摇瓶中以0.5 g/(L·h)的速率添加补料时菌体浓度达4.003 g/L;最后经发酵罐培养优化,菌种最大菌体浓度达5.399 g/L,为摇瓶时的1.4倍,测得其活菌总数为3.095×109CFU/mL,经真空冷冻干燥后达7.300×1010CFU/g。结果表明,上述最优条件下,可通过低廉易获得的培养基获得高密度培养的凝结凝结芽孢杆菌菌体。
3.3通过对凝结芽孢杆菌13002培养基、培养条件进行优化,为工业化生产高活菌数凝结芽孢杆菌13002及L-乳酸提供理论支持。
[1]董惠钧,姜俊云,郑立军,等. 新型微生态益生菌凝结凝结芽孢杆菌研究进展[J].食品科学,2010(1):292-294.
[2]王金果,莫云,张玳华,等. 产乳酸凝结芽胞杆菌N001的抗逆性研究[J].中国微生态学杂志,2007(6):489-491.
[3]钱志良,胡军,雷肇祖. 乳酸的工业化生产、应用和市场[J]. 工业微生物,2001(2):49-53.
[4]Ranjbar-Mohammadi M,Prabhakaran M P,Hajir B S,et al. Corrigendum to “Gum tragacanth/poly(l-lactic acid)nanofibrous scaffolds for application in regeneration of peripheral nerve damage”[Carbohydr. Polym. J. 140(2016)104-112][J]. Carbohydrate Polymers,2017,160:212.
[5]Nafary A,Seyedjafari E,Salimi A. Electrospun Poly-L-Lactic Acid Coated with Silicate Bioceramic Nanoparticles Enhance Osteogenic Differentiation of Adipose Tissue Derived Mesenchymal Stem Cells[J]. Journal of Biomaterials & Tissue Engineering,2017.
[6]田康明,周丽,陈献忠,等. L-乳酸的发酵生产和聚L-乳酸的化学加工[J]. 中国生物工程杂志,2011(2):102-115.
[7]Mussatto S I,Fernandes M,Mancilha I M,et al. Effects of medium supplementation and pH control on lactic acid production from brewer’s spent grain[J]. Biochemical Engineering Journal,2008,40(3):437-444.
[8]Wang Q,Narita J Y,Xie W,et al. Effects of anaerobic/aerobic incubation and storage temperature on preservation and deodorization of kitchen garbage.[J]. Bioresource Technology,2002,84(3):213-220.
[9]Glaser R,Venus J. Model-based characterisation of growth performance and L-lactic acid production with high optical purity by thermophilic Bacillus coagulans in a lignin-supplemented mixed substrate medium.[J]. New Biotechnology,2017,37:180-193.
[10]齐士朋,徐尔尼,罗玉芬,等. 细胞高密度培养技术的应用研究进展[J].食品与发酵工业,2011,37(2):139-143.
[11]Riesenberg D,Guthke R. High-cell-density cultivation of microorganisms[J]. Applied Microbiology and Biotechnology,1999,51:422-430.
[12]罗艳霞. 益生菌补料分批培养工艺优化和活细胞量在线测定方法研究[D].上海:华东理工大学,2012.
[13]周全兴. BCS 13002的鉴定、同步糖化发酵高光学纯度L-乳酸及相关蛋白质组学的研究[D].上海:华南理工大学,2017.
[14]刘馨磊. 凝结凝结芽孢杆菌TQ33的高密度培养[D].天津:天津科技大学,2002.
[15]闫天文,满朝新,刘泳麟,等. 一株植物乳杆菌高密度培养的研究[J].中国乳品工业,2014,42(4):33-37.
[16]靳志强,李平兰. 补料分批法高密度培养德氏乳杆菌保加利亚亚种S-1[J].中国乳品工业,2007,35(1):4-9.
[17]邢蕾,吴晖,刘冬梅,等.干酪乳杆菌鼠李糖亚种冻干保护剂的研究[J].中国乳品工业,2009,27(11):15-17.
HighcelldensitycultureofBacillus13002
SUNLi-na1,JINXun1,2,ZHOUQuan-xing1,ZHOUJin-song1,LIUDong-mei1,*
(1.Institute of Food Science and Engineering,South China University of Technology,Guangzhou 510640,China; 2.College of Biosystems Engineering and Food Science,Zhejiang University,Hangzhou 310058,China)
This experiment aimed to improve the concentration of bacteria inBacillus13002 fermentation medium by improving the culture conditions,and to lay the foundation for the production of high optical purity L-lactic acid. The single factor test,steep climbing test and Box-Behnken response surface test were used to confirm the optimum culture medium and optimum culture conditions ofBacillus13002 and high density batch feeding was carried out in automatic fermentation tank. Results showed that the optimal medium was glucose 20 g/L,bacterial peptone 10 g/L,yeast extract powder 25 g/L,NaCl 10 g/L,initial pH6.5. Under the optimum condition,when 6%Bacillus13002 and nutrients were added at the rate of 0.5 g/(L·h)from the 16th hour to the terminal at 45 ℃,the maximal cell concentration was 5.399 g/L.The total number of bacteria was 3.095×109CFU/mL,and reached the level of 0.730×1011CFU/g after lyophilization.
Bacillus13002;high cell density culture;response surface design;fed-batch culture
2017-04-14
孙丽娜(1995-),女,硕士研究生,主要从事食品微生物的利用和控制方面的研究,E-mail:sunlina199541@163.com。
*
刘冬梅(1972-),女,博士,教授,主要从事食品微生物利用与控制方面的研究,E-mail:liudm@scut.edu.cn。
国家自然科学基金资助项目(31101254);广东省科技计划项目(2013B020312002,2014A020208019)。
TS201.3
A
1002-0306(2017)21-0114-07
10.13386/j.issn1002-0306.2017.21.024

