胃肠道消化过程中脂质氧化的影响因素、健康危害及控制研究进展
,,,,,,,,, ,,,,*
(1.郑州轻工业学院食品与生物工程学院,河南郑州 450002; 2.河南省食品生产与安全协同创新中心,河南郑州 450002)
胃肠道消化过程中脂质氧化的影响因素、健康危害及控制研究进展
刘秀妨1,2,刘胜男1,2,马云芳1,2,申瑞玲1,2,白艳红1,2,张华1,2,相启森1,2,*
(1.郑州轻工业学院食品与生物工程学院,河南郑州 450002; 2.河南省食品生产与安全协同创新中心,河南郑州 450002)
研究证实,油脂和富含脂质的食品极易在胃肠道消化过程中发生氧化反应,产生的丙二醛、4-羟基-2-己烯醛(4-HHE)等氧化产物能够对机体造成健康危害。本文对胃肠道消化过程中脂质氧化反应的影响因素、健康危害及植物多酚、类黑精等食品组分干预作用等方面的研究进展进行综述,以期为通过改善膳食结构等途径减少胃肠道消化过程中脂质氧化反应造成的健康危害提供参考。
胃肠道,消化,脂质氧化,健康危害
作为食品的重要组成成分,脂类物质极易在食品加工和贮藏过程中发生氧化。脂质氧化不仅对食品的色泽、风味和质地等感官品质带来不良影响,而且还会降低其营养价值[1-2]。研究表明,大量摄入氧化脂质能够破坏机体正常生理生化功能,并参与心血管疾病、糖尿病、肿瘤等多种疾病的发生、发展过程及机体衰老过程[3-4]。近年来,脂质氧化产物的产生及其对机体健康的危害已成为食品科学和营养学领域研究的热点问题。目前,对食品脂质氧化的相关研究多集中于食品加工、运输、储存和销售环节。然而,研究表明,脂类物质和高脂食品在胃肠道消化过程极易发生氧化。由于对食物营养价值和机体健康的影响不易被察觉,胃肠道消化过程中发生的脂质氧化直至近几年才引起广泛关注[5-6]。鉴于脂质氧化对机体带来潜在危害,控制胃肠道消化过程中食物脂质氧化产物的生成对维护机体健康具有重要意义。
本文总结了近年来关于胃肠道消化过程中脂质氧化反应影响因素、健康危害及植物多酚、类黑精等食品组分干预作用等方面的研究进展,以期为通过改善膳食结构等途径减少胃肠道消化过程中脂质氧化反应造成的健康危害提供参考。
1 食品在胃肠道消化过程中极易发生脂质氧化反应
大量体外实验和动物实验均证实,油脂(植物油、鱼肝油等)及肉类(牛肉、猪肉、鸡肉等)、鱼类、禽蛋等高脂食品极易在胃肠道消化过程中发生氧化反应[7-16],相关研究进展见表1。
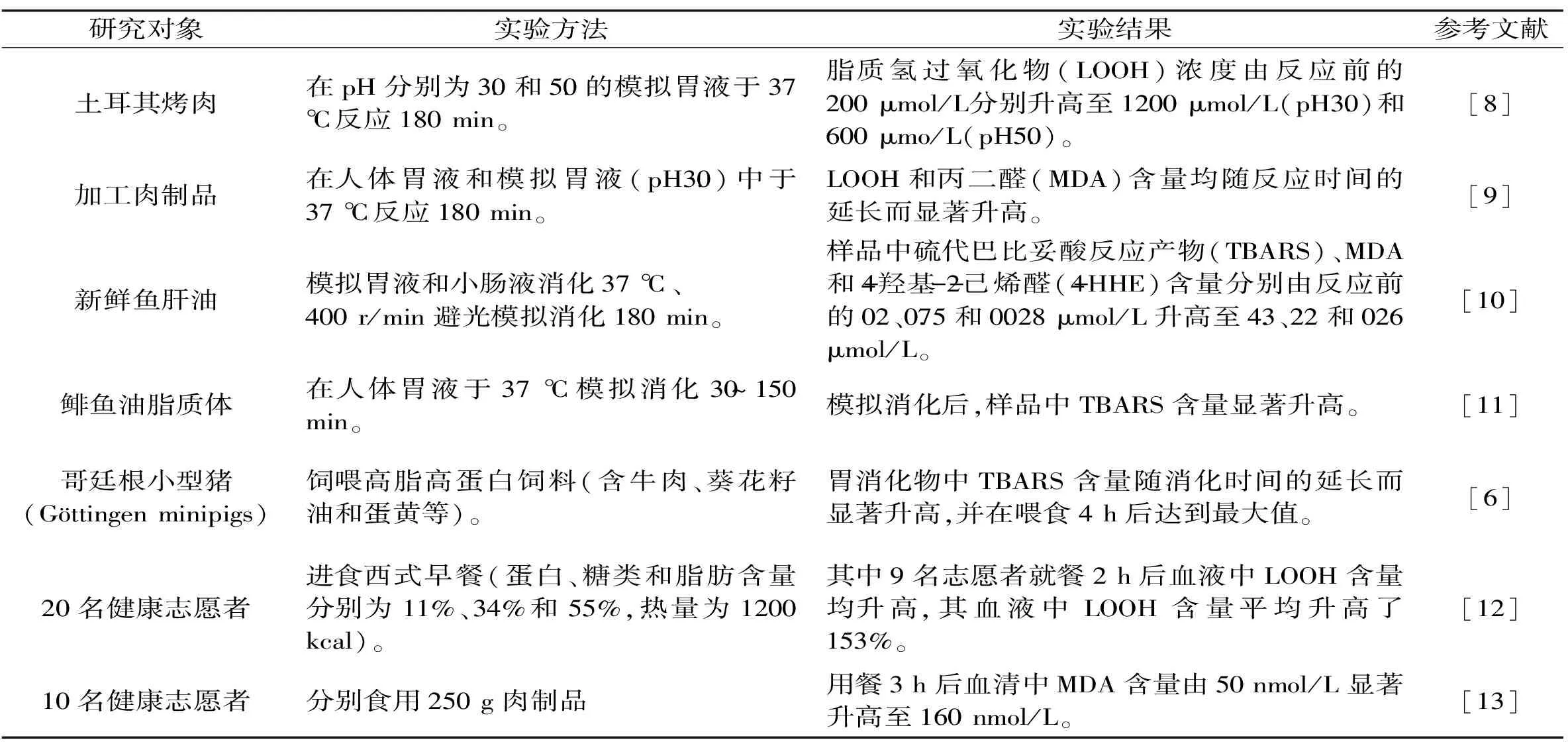
表1 胃肠道消化过程中脂质氧化研究进展Table 1 Research finding in lipid oxidation during gastrointestinal digestion
以上体外实验、动物实验和人体实验的研究结果均表明,胃肠道是食物组分发生脂质氧化反应的重要场所,其生成的初级和次级代谢产物能够被机体吸收,从而对机体健康造成潜在危害。
2 胃肠道消化过程中脂质氧化的影响因素
食物组分在胃肠道消化过程发生脂质氧化的机制较为复杂,其影响因素主要包括活性氧、食物脂质氧化程度、食物中含有的促氧化物质及pH等。
2.1活性氧
活性氧(Reactive oxygen species,ROS)是胃肠道消化过程中脂质氧化反应的重要原因。ROS一方面来源于胃肠道细胞的代谢活动,如肠道内皮细胞能够通过NADPH氧化酶等产生大量的超氧阴离子自由基和H2O2;另一方面,进入胃部的各类型食团中均存在不同浓度的氧气和促氧化因子(Fe2+、Cu2+、血红素等),上述物质能够在胃肠道通过一系列化学反应产生大量ROS[17-18]。例如,进入胃肠道的Fe2+、Cu2+等能够与VC通过类Fenton反应产生羟自由基(OH·)。
2.2食物中脂质氧化程度
研究证实,食物中脂质氧化程度是影响其在消化过程中进一步发生脂质过氧化反应的重要因素[18-19]。在热加工、紫外线、脂氧合酶等因素的作用下,食品中的脂质在进入胃肠道消化之前已经发生不同程度的氧化并生成大量初级和次级氧化产物。Awada等证实,与氧化程度较低的n-3多不饱和脂肪酸(PUFA)处理组C57BL/6小鼠相比,氧化PUFA饲喂组小鼠血浆中4-羟基-2-己烯醛(4-HHE)含量显著升高,其氧化损伤更大[19]。其可能原因是在Fe2+等过渡金属离子催化作用下,摄入的脂质氧化产物在胃肠道中形成过氧自由基和烷氧自由基并引发自由基链式反应,从而加速脂质氧化[18]。
2.3促氧化物质
食品中含有大量的促氧化物质,如铁离子、铜离子、血红素、羟高铁血红素、肌红蛋白等是影响胃肠道脂质氧化的重要因素[18,20-22]。食物中含有的还原性物质能够在胃部酸性条件下将Fe3+还原成Fe2+,Fe2+进而能够与VC反应生成OH·[18]。Tagliazucchi等发现,添加金属螯合剂EDTA(0.4 mmol/L)后,加工肉制品在模拟胃液消化过程中生成的LOOH浓度显著降低(p<0.05)[20],表明存在于食物中的Fe3+、Fe2+等过渡金属离子是引发胃肠道脂质氧化反应的重要因素。此外,大量研究证实肉制品等更容易在消化过程中发生氧化,这与其富含血红素、羟高铁血红素、肌红蛋白、Fe2+等密切相关[8,21-22],因为Fe2+、高铁肌红蛋白等均能够催化脂质氢过氧化物分解而产生大量自由基,从而加速脂质氧化反应[8]。
2.4pH
pH是影响模拟胃肠道消化过程中脂质氧化反应的另一个重要因素[8,23]。Lapidot等证实,烤肉经pH为3.0的模拟胃液于37 ℃反应180 min后生成的LOOH约是相同反应条件下pH为5.0的模拟胃液处理组样品中LOOH含量的2.5倍[8]。一方面,pH影响肌红蛋白对脂质氢过氧化物、H2O2等的分解速率[24-25],另一方面,较低的pH更容易造成过渡金属离子从食品体系中释放出来,进而通过引发Fenton反应产生羟自由基(OH·)或催化脂质氢过氧化物分解产生烷氧自由基(LO·)、醛类物质等,从而加速胃肠道消化过程中的脂质氧化反应[5]。此外,研究证实,铁离子和胆汁酸之间存在协同促氧化作用[5]。
除上述影响因素以外,食物中所添加乳化剂的类型等因素也显著影响模拟消化过程中的脂质氧化反应[26]。
3 胃肠道消化过程中脂质氧化造成的健康危害
在胃肠道消化过程,脂质通过氧化反应产生的一系列初级和次级氧化产物,如LOOH、MDA、4-羟基壬烯醛(4-HNE)、4-HHE、α,β-不饱和醛等能够被小肠吸收并进入血液循环,并在脂蛋白的作用下运输到肝脏等组织进行代谢或蓄积,损伤正常的细胞功能并造成健康危害[4,21,27]。

图1 胃肠道消化过程中发生的 脂质氧化反应造成潜在健康危害Fig.1 Lipid oxidation in gastrointestinal digestion results in potential health risks
3.1细胞毒性
已有研究证实,LOOH、4-HNE、4-HHE等脂质氧化产物具有潜在的细胞毒性和致突变性,能够破坏细胞正常生理生化功能[28-29]。例如,鱼肝油模拟胃肠道消化产物能够显著升高酿酒酵母(Saccharomycescerevisiae)胞内ROS及能量代谢水平[10],而从氧化低密度脂蛋白(oxLDL)分离得到的氧化脂质和油酸氢过氧化物均能够诱导Caco-2肠上皮细胞发生损伤[30-31]。
3.2引发炎症
大量研究证实4-HNE、MDA等脂质氧化产物与一些炎症的发生密切相关[32]。Larsson等研究发现,鱼肝油模拟胃肠道消化产物能够显著抑制单核细胞来源树突状细胞(MDDC)成熟及抗炎性细胞因子白细胞介素10(IL-10)的分泌,表明鱼肝油经模拟胃肠道消化后形成的氧化产物具有较强的促炎作用[10]。体内实验表明,摄食氧化PUFA可造成C57BL/6小鼠血浆中4-HHE及白细胞介素-6(IL-6)、单核细胞趋化蛋白1(MCP-1)等促炎性细胞因子浓度的显著升高,同时通过激活小肠组织中的核因子-κB(Nuclear factor-kappa B,NF-κB)信号通路、降低十二指肠中潘氏细胞(Paneth cell)数量等途径引发肠道氧化应激[19]。
3.3引发多种疾病
类似于机体产生的脂质氧化产物,胃肠道消化过程中产生的脂质氧化产物(如 MDA、4-HNE、4-HHE等)在体内能够破坏DNA、酶、蛋白质等生物功能分子的结构与功能,从而影响机体细胞的正常生理代谢,最终引发多种疾病。研究证实,MDA、4-HNE等脂质氧化产物参与了动脉粥样硬化、结肠癌等疾病的发生[33-35]。
4 一些食品组分对胃肠道消化过程中脂质氧化反应的影响
鉴于食品消化过程中发生的脂质氧化对机体造成的健康危害,如何通过改善膳食结构来抑制在食物消化过程中发生的脂质氧化反应对于维护机体健康具有重要意义。国内外学者进行了大量相关研究,发现植物多酚、类黑精等物质能够有效抑制胃肠道消化过程中发生的脂质氧化反应。
4.1植物多酚
植物多酚是一类广泛存在于天然植物体内重要的次生代谢产物,也是果蔬感官品质和营养品质的主要决定因素。大量研究表明,植物多酚具有抗氧化、抗癌、抗菌、调节肠道菌群等多种生理活性功能[36-37]。Kanner和Lapidot研究发现,大豆油和烤肉在模拟胃液消化3 h后LOOH均显著升高(p<0.05),而在上述反应体系中添加红酒多酚则能够显著抑制模拟消化过程中LOOH的生成[23]。与上述研究结果类似,Gorelik等分别在加工肉制品人体胃液和模拟胃液消化反应体系中添加红酒多酚并于37 ℃反应180 min后,发现其消化产物中LOOH和MDA含量均显著降低(p<0.05)[9]。除红酒多酚以外,来源于迷迭香的鼠尾草酸[38]、富含多酚类物质的葡萄籽提取物[39]和刺山柑(CapparisspinosaL.)提取物[40]也被证实能够显著抑制模拟消化过程中发生的脂质氧化反应。
在动物和人体实验方面,Gobert等[6]发现在膳食中补充果蔬(苹果、紫李子、洋蓟)或其提取物均能够显著降低哥廷根小型猪在摄食牛肉、葵花籽油和蛋黄后造成的胃消化物中TBARS含量升高(p<0.05)。同时,Gorelik等研究发现,在肉制品中添加红酒多酚(3 μmol/g)能够显著抑制大鼠胃部LOOH和MDA水平的升高[41]。人体实验结果表明,在肉制品热加工前或加工后添加红酒浸泡均能够显著降低志愿者血清和尿液中MDA含量。对于食用热加工后添加红酒多酚的肉制品的志愿者,其血清MDA与对照组相比降低了75%,而食用热加工前添加红酒的肉制品的志愿者,其血清中MDA含量的升高几乎完全被抑制[13]。上述研究表明,植物多酚能够显著抑制食物在消化过程中脂质氧化产物的生成和吸收,这可能与其阻断自由基链反应、还原LOOH等氧化产物、螯合Fe2+等过渡金属离子等作用机制有关。
4.2类黑精类物质
类黑精是食品在热加工过程中经美拉德反应生成的一类棕褐色的、结构复杂的大分子化合物,已被证实具有抗氧化、抑菌等多种生理活性功能[42]。胃肠道被认为是食物来源的类黑精类物质发挥其生物活性的重要部位[43]。Tagliazucchi等研究证实,来源于咖啡、咖啡豆和黑啤酒的类黑精类物质能够显著抑制烤肉在模拟胃液消化过程中氢过氧化物和TBARS的生成[44]。与上述研究结论类似,Verzelloni等发现香醋中含有的类黑精类物质也能够以浓度依赖的方式显著抑制肉制品在模拟消化过程中发生的氧化反应[45]。上述研究同时证实,来源于咖啡等和香醋的类黑精类物质能够有效结合Fe2+和游离血红素,并有效清除自由基,这可能是其发挥作用的重要机制[20,44]。
4.3其他物质
除植物多酚和类黑精外,Kenmogne-Domguia等研究证实菜籽油中维生素E含量是影响其在模拟胃肠道消化过程中氢过氧化物和MDA生成的重要因素[21]。与维生素E含量低于2 mg/kg的精炼菜籽油相比,外源添加维生素E(533 mg/kg)的菜籽油在模拟胃肠道消化过程中氢过氧化物和MDA生成量均显著降低[21]。此外,Tirosh等人的研究结果表明,添加橄榄油能够显著抑制火鸡肉在模拟胃液中反应生成的MDA和LOOH[45]。
5 结论与展望
鉴于食物消化过程中产生的脂质氧化产物能够被机体吸收并对机体健康造成潜在危害,研究如何通过改善膳食结构来减少胃肠道消化过程中脂质氧化反应造成的健康危害具有重要意义。近年来,国内外学者围绕食物组分在胃肠道发生的脂质氧化反应及其控制技术进行了大量研究,并取得了重要进展。目前的研究主要存在以下两个方面的问题:一是在实验方法方面,鉴于动物实验的复杂性,目前多采用体外模拟消化系统研究食物在消化过程中发生的脂质过氧化。然而目前所采用的体外模拟消化系统种类很多,其研究结果均存在较大偏差。例如,目前所普遍采用的体外模拟消化装置很难真实模拟消化道中O2的真实浓度,而O2又是影响脂质氧化的重要因素之一;二是鉴于胃肠道消化过程中脂质氧化反应机制的复杂性和食品组分的多样性,不同膳食结构对食物消化过程中脂质氧化反应的影响及机制尚不明确,如何通过改善膳食结构等途径降低脂质氧化对机体所造成的健康危害还需进行大量深入研究。因此,在今后的研究工作中,应首先优化人体胃肠道仿生消化相关实验装置,最大程度模拟食物在机体内的消化过程;同时应该系统研究不同膳食结构对食物消化过程中脂质氧化反应的影响,并从生物化学、分子生物学等方面揭示其相关作用机制,以期为通过改善饮食结构等途径维护机体健康提供科学理论依据。
[1]Ganesan B,Brothersen C,McMahon DJ. Fortification of foods with omega-3 polyunsaturated fatty acids[J]. Critical Reviews in Food Science and Nutrition,2014,54(1):98-114.
[2]Barriuso B,Astiasarán I,Ansorena D. A review of analytical methods measuring lipid oxidation status in foods:a challenging task[J]. European Food Research and Technology,2013,236(1):1-15.
[3]Ringseis R,Eder K. Regulation of genes involved in lipid metabolism by dietary oxidized fat[J]. Molecular Nutrition & Food Research,2011,55(1):109-121.
[4]Kanner J. Dietary advanced lipid oxidation endproducts are risk factors to human health[J]. Molecular Nutrition & Food Research,2007,51(9):1094-1101.
[5]Larsson K,Cavonius L,Alminger M,et al. Oxidation of cod liver oil during gastrointestinalinvitrodigestion[J]. Journal of Agricultural and Food Chemistry,2012,60(30):7556-7564.
[6]Gobert M,Rémond D,Loonis M,et al. Fruits,vegetables and their polyphenols protect dietary lipids from oxidation during gastric digestion[J]. Food & Function,2014,5(9):2166-2174.
[7]Steppeler C,Haugen JE,Rødbotten R,et al. Formation of malondialdehyde,4-hydroxynonenal,and 4-hydroxyhexenal duringinvitrodigestion of cooked beef,pork,chicken,and salmon[J]. Journal of Agricultural and Food Chemistry,2016,64(2):487-496.
[8]Lapidot T,Granit R,Kanner J. Lipid peroxidation by “free” lron ions and myoglobin as affected by dietary antioxidants in simulated gastric fluids[J]. Journal of Agricultural and Food Chemistry,2005,53(9):3383-3390.
[9]Gorelik S,Lapidot T,Shaham I,et al. Lipid peroxidation and coupled vitamin oxidation in simulated and human gastric fluid inhibited by dietary polyphenols:health implications[J]. Journal of Agricultural and Food Chemistry,2005,53(9):3397-3402.

[11]Kristinova V,Storrø I,Rustad T. Influence of human gastric juice on oxidation of marine lipids-invitrostudy[J]. Food Chemistry,2013,141(4):3859-3871.
[12]Zamburlini A,Maiorino M,Barbera P,et al. Direct measurement by single photon counting of lipid hydroperoxides in human plasma and lipoproteins[J]. Analytical Biochemistry,1995,232(1):107-113.
[13]Gorelik S,Ligumsky M,Kohen R,et al. A novel function of red wine polyphenols in humans:prevention of absorption of cytotoxic lipid peroxidation products[J]. FASEB Journal,2008,22(1):41-46.
[14]Larsson K,Harrysson H,Havenaar R,et al. Formation of malondialdehyde(MDA),4-hydroxy-2-hexenal(HHE)and 4-hydroxy-2-nonenal(HNE)in fish and fish oil during dynamic gastrointestinalinvitrodigestion[J]. Food & Function,2016,7(2):1176-1187.
[15]Larsson K,Tullberg C,Alminger M,et al. Malondialdehyde and 4-hydroxy-2-hexenal are formed during dynamic gastrointestinalinvitrodigestion of cod liver oils[J]. Food & Function,2016,7(8):3458-3467.
[16]Sun JH,Lim BO,Decker EA,et al.Invitrohuman digestion models for food applications[J]. Food Chemistry,2011,125(1):1-12.
[17]Akagawa M,Shigemitsu T,Suyama K. Production of hydrogen peroxide by polyphenols and polyphenol-rich beverages under quasi-physiological conditions[J]. Bioscience,Biotechnology,and Biochemistry,2003,67(12):2632-2640.
[18]Halliwell B. Dietary polyphenols:good,bad,or indifferent for your health?[J]. Cardiovascular Research,2007,73(2):341-347.
[19]Awada M,Soulage CO,Meynier A,et al. Dietary oxidized n-3 PUFA induce oxidative stress and inflammation:role of intestinal absorption of 4-HHE and reactivity in intestinal cells[J]. Journal of Lipid Research,2012,53(10):2069-2080.
[20]Tagliazucchi D,Verzelloni E,Conte A. Effect of dietary melanoidins on lipid peroxidation during simulated gastric digestion:their possible role in the prevention of oxidative damage[J]. Journal of Agricultural and Food Chemistry,2010,58(4):2513-2519.
[21]Kenmogne-Domguia HB,Meynier A,Boulanger C,et al. Lipid oxidation in food emulsions under gastrointestinal-simulated conditions:the key role of endogenous tocopherols and initiator[J]. Food Digestion,2012,3(1):46-52.
[22]Lorrain B,Dangles O,Loonis M,et al. Dietary iron-initiated lipid oxidation and its inhibition by polyphenols in gastric conditions[J]. Journal of Agricultural and Food Chemistry,2012,60(36):9074-9081.
[23]Kanner J,Lapidot T. The stomach as a bioreactor:dietary lipid peroxidation in the gastric fluid and the effects of plant-derived antioxidants[J]. Free Radical Biology & Medicine,2001,31(11):1388-1395.
[24]Reeder BJ,Wilson MT. The effects of pH on the mechanism of hydrogen peroxide and lipid hydroperoxide consumption by myoglobin:a role for the protonated ferryl species[J]. Free Radical Biology & Medicine,2001,30(11):1311-1318.
[25]Kröger-Ohlsen MV,Andersen ML,Skibsted LH. Acid-catalysed autoreduction of ferrylmyoblobin in aqueous solution studied by freeze quenching and ESR spectroscopy[J]. Free Radical Research,1999,30(4):305-314.
[26]Kenmogne-Domguia HB,Moisan S,Viau M,et al. The initial characteristics of marine oil emulsions and the composition of the media inflect lipid oxidation duringinvitrogastrointestinal digestion[J]. Food Chemistry,2014,152:146-154.
[27]Del Rio D,Stewart AJ,Pellegrini N. A review of recent studies on malondialdehyde as toxic molecule and biological marker of oxidative stress[J]. Nutrition,Metabolism and Cardiovascular Diseases,2005,15(4):316-328.
[28]Schaur RJ,Siems W,Bresgen N,et al. 4-Hydroxy-nonenal-a bioactive lipid peroxidation product[J]. Biomolecules,2015,5(4):2247-2337.
[29]Spickett CM. The lipid peroxidation product 4-hydroxy-2-nonenal:Advances in chemistry and analysis[J]. Redox Biology,2013,1(1):145.
[30]Giovannini C,Scazzocchio B,Matarrese P,et al. Apoptosis induced by oxidized lipids is associated with up-regulation of p66Shc in intestinal Caco-2 cells:protective effects of phenolic compounds[J]. Journal of Nutritional Biochemistry,2008,19(2):118-128.
[31]Wijeratne SS,Cuppett SL. Lipid hydroperoxide induced oxidative stress damage and antioxidant enzyme response in Caco-2 human colon cells[J]. Journal of Agricultural and Food Chemistry,2006,54(12):4476-4481.
[32]Kumagai T,Matsukawa N,Kaneko Y,et al. A lipid peroxidation-derived inflammatory mediator:identification of 4-hydroxy-2-nonenal as a potential inducer of cyclooxygenase-2 in macrophages[J]. Journal of Biological Chemistry,2004,279(46):48389-48396.
[33]Uchida K. Role of reactive aldehyde in cardiovascular diseases[J]. Free Radical Biology and Medicine,2000,28(12):1685-1696.
[34]Staprans I,Pan XM,Rapp JH,et al. The role of dietary oxidized cholesterol and oxidized fatty acids in the development of atherosclerosis[J]. Molecular Nutrition & Food Research,2005,49(11):1075-1082.
[35]Sawa T,Akaike T,Kida K,et al. Lipid peroxyl radicals from oxidized oils and heme-iron:implication of a high-fat diet in colon carcinogenesis[J]. Cancer Epidemiology,Biomarkers & Prevention,1998,7(11):1007-1012.
[36]Cirillo G,Curcio M,Vittorio O,et al. Polyphenol conjugates and human health:A perspective review[J]. Critical Reviews in Food Science and Nutrition,2016,56(2):326-337.
[37]Etxeberria U,Fernández-Quintela A,Milagro FI,et al. Impact of polyphenols and polyphenol-rich dietary sources on gut microbiota composition[J]. Journal of Agricultural and Food Chemistry,2013,61(40):9517-9533.
[38]Raes K,Doolaege EH,Deman S,et al. Effect of carnosic acid,quercetin andα-tocopherol on lipid and protein oxidation in aninvitrosimulated gastric digestion model[J]. International Journal of Food Sciences and Nutrition,2015,66(2):216-221.
[39]KuffaM,Priesbe TJ,Krueger CG,et al. Ability of dietary antioxidants to affect lipid oxidation of cooked turkey meat in a simulated stomach and blood lipids after a meal[J]. Journal of Functional Foods,2009,1(2):208-216.
[40]Tesoriere L,Butera D,Gentile C,et al. Bioactive components of caper(CapparisspinosaL.)from Sicily and antioxidant effects in a red meat simulated gastric digestion[J]. Journal of Agricultural and Food Chemistry,2007,55(21):8465-8471.
[41]Gorelik S,Ligumsky M,Kohen R,et al. The stomach as a “bioreactor”:when red meat meets red wine[J]. Journal of Agricultural and Food Chemistry,2008,56(13):5002-5007.
[42]Langner E,Rzeski W. Biological properties of melanoidins:a review[J]. International Journal of Food Properties,2014,17(2):344-353.
[43]Tagliazucchi D,Bellesia A. The gastro-intestinal tract as the major site of biological action of dietary melanoidins[J]. Amino Acids,2015,47(6):1077-1089.
[44]Verzelloni E,Tagliazucchi D,Conte A. From balsamic to healthy:Traditional balsamic vinegar melanoidins inhibit lipid peroxidation during simulated gastric digestion of meat[J]. Food and Chemical Toxicology,2010,48(8-9):2097-2102.
[45]Tirosh O,Shpaizer A,Kanner J. Lipid peroxidation in a stomach medium is affected by dietary oils(olive/fish)and antioxidants:the mediterranean versus western diet[J]. Journal of Agricultural and Food Chemistry,2015,63(31):7016-7023.
Researchprogressontheinfluencingfactors,healthhazards,andcontroloflipidoxidationduringgastrointestinaldigestion
LIUXiu-fang1,2,LIUSheng-nan1,2,MAYun-fang1,2,SHENRui-ling1,2,BAIYan-hong1,2,ZHANGHua1,2,XIANGQi-sen1,2,*
(1.College of Food and Biological Engineering,Zhengzhou University of Light Industry,Zhengzhou 450002,China; 2.Henan Collaborative Innovation Center for Food Production and Safety,Zhengzhou 450002,China)
Many studies have indicated that the oxidation of lipid and high-fat foods may occur during the gastrointestinal(GI)digestion itself and the lipid oxidation products,such as malondialdehyde,4-hydroxy-2-hexenal,and so on,can lead to serious health problems. Research progress on the influencing factors and health hazards of lipid oxidation in GI digestion were systematically reviewed in this article,the inhibitory effects of food component including plant polyphenols and melanoidins were also discussed. This paper will provide theoretical basis for further research on controlling the health hazards of lipid oxidation in GI digestion by diet optimization.
gastrointestinal tract;digestion;lipid oxidation;health hazards
2017-03-29
刘秀妨(1992-),硕士研究生,研究方向:食品化学与营养,E-mail:liuxiufang2016@126.com。
*
相启森(1984-),男,博士,副教授,研究方向:食品化学与营养,E-mail:xiangqisen2006@163.com。
国家自然科学基金(31501491);河南省科技厅重大专项(141100110800);郑州轻工业学院博士科研基金资助项目(2013BSJJ079)。
TS202.1
A
1002-0306(2017)21-0330-06
10.13386/j.issn1002-0306.2017.21.064

