姜黄素超分子包合物的结构鉴定 及其抗氧化活性
,,,,,
(1.广东海洋大学食品科技学院,广东湛江 524088; 2.广东省天然产物绿色加工与产品安全重点实验室,广东广州 510640; 3. 广东海洋大学农学院,广东湛江 524088)
姜黄素超分子包合物的结构鉴定 及其抗氧化活性
陈建平1,2,彭莞仪1,秦小明1,谌素华1,钟赛意1,刘颖3,*
(1.广东海洋大学食品科技学院,广东湛江 524088; 2.广东省天然产物绿色加工与产品安全重点实验室,广东广州 510640; 3. 广东海洋大学农学院,广东湛江 524088)
采用β-环糊精聚合物制备姜黄素超分子包合物并对其抗氧化活性进行测定。应用高效液相色谱法(HPLC)检测包合物中姜黄素的含量,并运用差示扫描量热仪(DSC)、傅立叶红外光谱仪(FT-IR)和X-射线衍射仪(XRD)对包合物进行结构鉴定。运用分光光度法测定包合物对 ABTS 和 DPPH自由基的清除能力。研究表明,所制备的包合物得率和包合率分别为63.5%和34.5%。经DSC、FT-IR和XRD鉴定包合物已形成。抗氧化活性实验表明,包合物对ABTS自由基和 DPPH自由基具有较好的清除能力,呈浓度和时间依赖性。实验结果表明,采用本实验方法可以成功获得具有一定抗氧化活性的姜黄素超分子包合物,这为姜黄素的剂型改善及其应用提供了新的技术手段和理论参考数据。
姜黄素,β-环糊精聚合物,包合物制备,抗氧化活性
姜黄是姜科姜黄属多年生草本植物,也是一种常用的药食两用植物。姜黄中含有大量的化学植物物质,其中姜黄素是其主要成分[1]。姜黄素是一种多酚类化合物,在食品工业中是一种常用的调味品、色素和抗氧化剂[2]。除此之外,大量实验事实证明,姜黄素对多种肿瘤细胞具有抑制作用,并且在许多动物实验中得到反复证实,目前已被美国国立肿瘤研究所列为第三代肿瘤治疗药[3]。然而,由于姜黄色素难溶于水,姜黄素被人体食用后不但不易吸收,而且极易在消化道内发生降解,其生物利用度极低,难以发挥它在食品工业中的抗氧化和防癌作用。
环糊精是用嗜碱性芽孢杆菌所产生的环糊精葡萄糖转移酶与淀粉作用生成的环状低聚糖化合物[4]。环糊精有多种同系物,按结构可分为α-环糊精、β-环糊精和γ-环糊精[5]。其中β-环糊精由7个椅式构像的葡萄糖所组成,外端具有良好亲水性,内部具有疏水性,有类似表面活性剂的性质,为包合物的制备提供了有利条件,因而被广泛地应用于食品领域[6]。研究表明,采用环糊精包合姜黄素可以使其水溶性提高约100倍并且其抗炎和抗血管生成的活性都得到了显著提高[7]。然而,考虑到如果直接采用环糊精作为药物载体又存在其自身水溶性低的问题,因此,本文基于超分子化学的理论,采用聚合反应把环糊精合成为具有水溶性良好的环糊精聚合物作为药物载体来制备姜黄素超分子包合物,并对其进行抗氧化活性研究,为姜黄素在食品工业中的应用开发提供新的技术手段和科学依据。
1 材料与方法
1.1材料与仪器
姜黄素 美国Sigma公司,标准品;β-环糊精 山东新大精细化工有限公司,化学纯;环氧氯丙烷和无水乙醇 国药集团化学试剂有限公司,分析纯;氢氧化钠 南京化学试剂有限公司,分析纯;1,1-二苯基-2-三硝基苯肼(DPPH)和2,2′-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS) 均购于美国Sigma公司,分析纯。
Waters 2695型高效液相色谱仪 美国Waters公司;AUW120电子天平 日本岛津公司;Tensor 27型傅里叶红外光谱仪 德国Bruker公司;STA449F3型同步热分析仪 德国耐驰公司;XRDKQ-500DB型数控超声波清洗机 昆山市超声仪器有限公司;D8 Advance X射线衍射仪 德国Bruker公司;Varioskan Flash 多功能酶标仪 美国Thermo Fisher Scientific公司;DZF-6050真空干燥箱 上海一恒科学有限公司。
1.2实验方法
1.2.1 姜黄素超分子包合物的制备
1.2.1.1 环糊精聚合物(β-cyclodextrin polymer,CDP)的制备 称取15.76 g NaOH于三口烧瓶中,加32 mL H2O,搅拌溶解。再称取20 gβ-环糊精,加入三口烧瓶,搅拌全溶至澄清,在30 ℃下缓慢加入环氧氯丙烷(EPC)9.64 mL,搅拌24 h,冷却至室温。将反应液倒入锥形瓶中,超声5 min。将溶液倒入透析袋中(先用水润湿清洗,再用蒸馆水洗潘两次),放入盛有蒸烟水的大烧杯中透析,开始时每小时换一次蒸馏水,之后延长时间更换水,透析至中性。将透析袋中溶液抽滤,滤去不溶物,然后用0.45 μm的纤维素膜过滤,过滤后进行旋蒸,蒸至粘稠状,加入无水乙醇析出白色固体,过滤,真空干燥,得环糊精聚合物。
1.2.1.2 姜黄素超分子包合物的制备 将姜黄素和环糊精聚合物按质量比1∶4混匀,加入研钵中研磨,研磨均匀后倒入锥形瓶中,加入50 mL水,超声5 min。将锥形瓶放磁力搅拌器上搅拌2 d后,将包合物溶液抽滤,除去未溶解的姜黄素,再将溶液进行旋蒸,真空干燥,即得水溶性姜黄素超分子包合物。按照1.2.2方法测定包合物中的姜黄素含量,根据如下公式计算出包合物的包合率和得率。
包合率(%)=包合物中姜黄素含量/姜黄素投入量×100
式(1)
得率(%)=包合物收得量/(环糊精聚合物投入量+姜黄素投入量)×100
式(2)
1.2.2 高效液相色谱检测姜黄素超分子包合物中姜黄素含量
1.2.2.1 色谱条件 色谱柱为Scienhome Kromasil C18柱(150 mm×4.6 mm,5 μm),室温(25~30 ℃),流动相为甲醇-1%柠檬酸(70∶30)体积流量1 mL/min,检测波长425 nm,进样量10 μL。
1.2.2.2 线性关系考察 精密称取姜黄素标准品12.25 mg,用甲醇溶解并定容于100 mL 容量瓶中,得到质量浓度为122.5 μg/mL的母液。分别从母液中移取0.2、0.4、0.6、0.8、1.6、2.4、3.2、5.0 mL置于10 mL容量瓶中,流动相定容至刻度,得到质量浓度分别为2.45、4.90、9.80、19.60、29.40、39.20、49.00 μg/mL系列对照品溶液,取上述对照品溶液10 μL注入高效液相色谱仪中进行测定。
1.2.2.3 供试品溶液的制备 称取包合物样品适量(约相当于姜黄素5 mg),置于棕色容量瓶中,加入蒸馏水适量溶解,再加95%乙醇定容至刻度,振动混匀后,经0.45 μm微孔滤膜过滤,滤液经适当稀释后即得。
1.2.2.4 精密度实验 精密吸取同一包合物供试品溶液10 μL,连续进样5批,测定姜黄素的峰面积,计算其RSD值。
1.2.2.5 重现性实验 精密称取同一包合物样品5份,按照1.2.2.3的方法制备5份供试品溶液,进样,测定姜黄素的峰面积,计算其RSD值。
1.2.2.6 加样回收率实验 取5份含姜黄素107.2 mg/g的包合物样品约100 mg,精密称定,分别加入姜黄素对照品10 mg,制备供试品溶液,进样,测定姜黄素的峰面积,计算加样回收率和RSD值。
1.2.2.7 样品测定 取10 μL供试品溶液注入高效液相色谱中,测定,根据线性方程计算出包合物中姜黄素的含量。
1.2.3 姜黄素超分子包合物的鉴定
1.2.3.1 DSC测试条件 气氛为N2,流速为30 mL/min,铝质坩埚,升温速率为 10.0 ℃/min,扫描范围为80~220 ℃。取姜黄素、β-环糊精聚合物、两者的物理混合物(与投料比一致)以及包合物各适量,按上述条件在同步热分析仪下进行测试。
1.2.3.2 FT-IR 取β-环糊精、姜黄素、β-环糊精聚合物、两者的物理混合物(与投料比一致)以及包合物各适量,与KBr混合,在玛瑙研钵中研磨至粉末并混合均匀,压片,在相同条件下分别置于傅立叶红外光谱仪下测定,扫描波数范围为4000~400 cm-1。
1.2.3.3 XRD测试条件 Cu-Ka 辐射,LynxExe阵列探测器,管电压40 kV,管电流40 mA,扫描步长0.02°,扫描速度17.7 s/步,扫描范围5~55°。取姜黄素、β-环糊精聚合物、两者的物理混合物(与投料比一致)以及包合物各适量,按上述条件,在X-射线粉末衍射仪中测定。
1.2.4 ABTS和DPPH自由基清除能力测定 自由基清除能力的测定参考Chen等[8]方法。用pH7.4的PBS配制5 mmol/L ABTS储备液,与过量的二氧化锰(MnO2)反应后经 0.2 μm的PVDF微孔滤膜,再用pH7.4的PBS稀释到734 nm处吸光值为0.70±0.02,得到ABTS工作液。在96孔板的200 μL反应体系中,加入20 μL不同浓度的姜黄素超分子包合物溶液,然后加入180 μL的ABTS工作液,振荡混合后在734 nm处用酶标仪测定,每隔5 min测一次,持续30 min。以上操作均在室温下避光进行。反应体系中混合液在734 nm处的吸光值代表ABTS自由基的含量。
取一定量的DPPH粉末,用甲醇溶解,配成6 mmol/L的DPPH储备液。将DPPH储备液用甲醇稀释为60 μmol/L的DPPH工作液。在96孔板中200 μL反应体系中,加入20 μL不同浓度的姜黄素超分子包合物溶液,然后加入180 μL的DPPH工作液,振荡混合后在515 nm处用酶标仪进行测定,每隔5 min测一次,持续30 min。以上操作均在室温下避光进行。反应体系中混合液在515 nm处的吸光值代表DPPH自由基的含量。
1.3数据统计分析
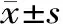
2 结果与分析
2.1环糊精聚合物的鉴定
红外光谱鉴定结果如下图1所示。对a和b谱图分析可知,在3388 cm-1附近有一强而宽的吸收峰,归属于-OH伸缩振动吸收峰。在2926 cm-1附近出现了C-H伸缩振动吸收峰,归属于CH2反对称伸缩振动峰。在750 cm-1附近出现了-CH2的面内摇摆振动峰。通过对比a、b谱图,可以发现环糊精聚合物中保留了β-环糊精的空腔结构[9]。而在650~800 cm-1却没有出现C-Cl键强的特征吸收峰,且环氧氯丙烷中环氧基在1328 cm-1的特征吸收峰也没有出现,由此说明环氧氯丙烷成功交联在环糊精上,这与刘凤萍[10]等人的报道基本一致。

图1 环糊精聚合物(a)和β-环糊精(b)的红外光谱图Fig.1 FTIR spectra of CDP(a)and β-CD(b)
2.2姜黄素标准曲线的建立
为了测定包合物中姜黄素的含量,需要建立姜黄素的标准曲线,根据1.3.1.2的方法进行实验,所得的数据以姜黄素标准品的浓度为横坐标,姜黄素标准品的峰面积为纵坐标,得线性回归方程:Y=102211X-256580,r=0.9940,表明姜黄素的峰面积在浓度为2.45~49.00 μg/mL范围内线性关系良好。并进一步通过精密度实验、重现性实验和加样回收率实验得出其RSD值分别为0.49%、0.36%和1.36%,加样回收率为106.2%,表明采用该方法测定姜黄素含量准确、可靠。
2.3姜黄素超分子包合物的制备
按照1.2.2方法测定包合物中的姜黄素含量,根据公式(1)和(2)计算出包合物的包合率和得率分别为34.5%和63.5%。
2.4姜黄素超分子包合物的鉴定
2.4.1 DSC 实验结果如图2所示。由图2可知,姜黄素在185.7 ℃下出现一个吸热峰,为其熔融峰。而环糊精聚合物在扫描范围内没有熔融峰出现,说明其稳定性比较好。而混合物在184.1 ℃中出现了相似于姜黄素的强吸收峰,说明混合物中姜黄素的晶型和熔点没有发生改变。而包合物在181.9 ℃出现了一个新的弱吸热峰,这可能是由于姜黄素嵌入环糊精聚合物的空腔中,其吸收峰被环糊精聚合物屏蔽,表明包合物确已形成。
2.4.2 FT-IR 实验结果如图3所示。由图3可知,姜黄素在3427 cm-1处出现了-OH伸缩振动吸收峰,1510 cm-1归属于C=O的伸缩振动特征峰。环糊精聚合物在3390 cm-1处出现了一个强吸收峰,为-OH伸缩振动吸收峰,在2920 cm-1左右处的强吸收峰归属于-CH2的反对称伸缩振动吸收峰。在1035 cm-1左右处的强吸收峰归属于C-O的伸缩振动吸收峰。在混合物中由于环糊精聚合物和姜黄素的存在,使得姜黄素和环糊精聚合物中原有的特征峰出现了偏移,混合物的谱图实为两者的叠加。而包合物在3390、2920和1035 cm-1处均出现了与环糊精聚合物一致的特征吸收峰,而姜黄素的2个特征吸收峰在包合物中均消失,表明姜黄素的羟基和碳氧双键可能被包埋在环糊精聚合物的空腔中,形成了新的物相。
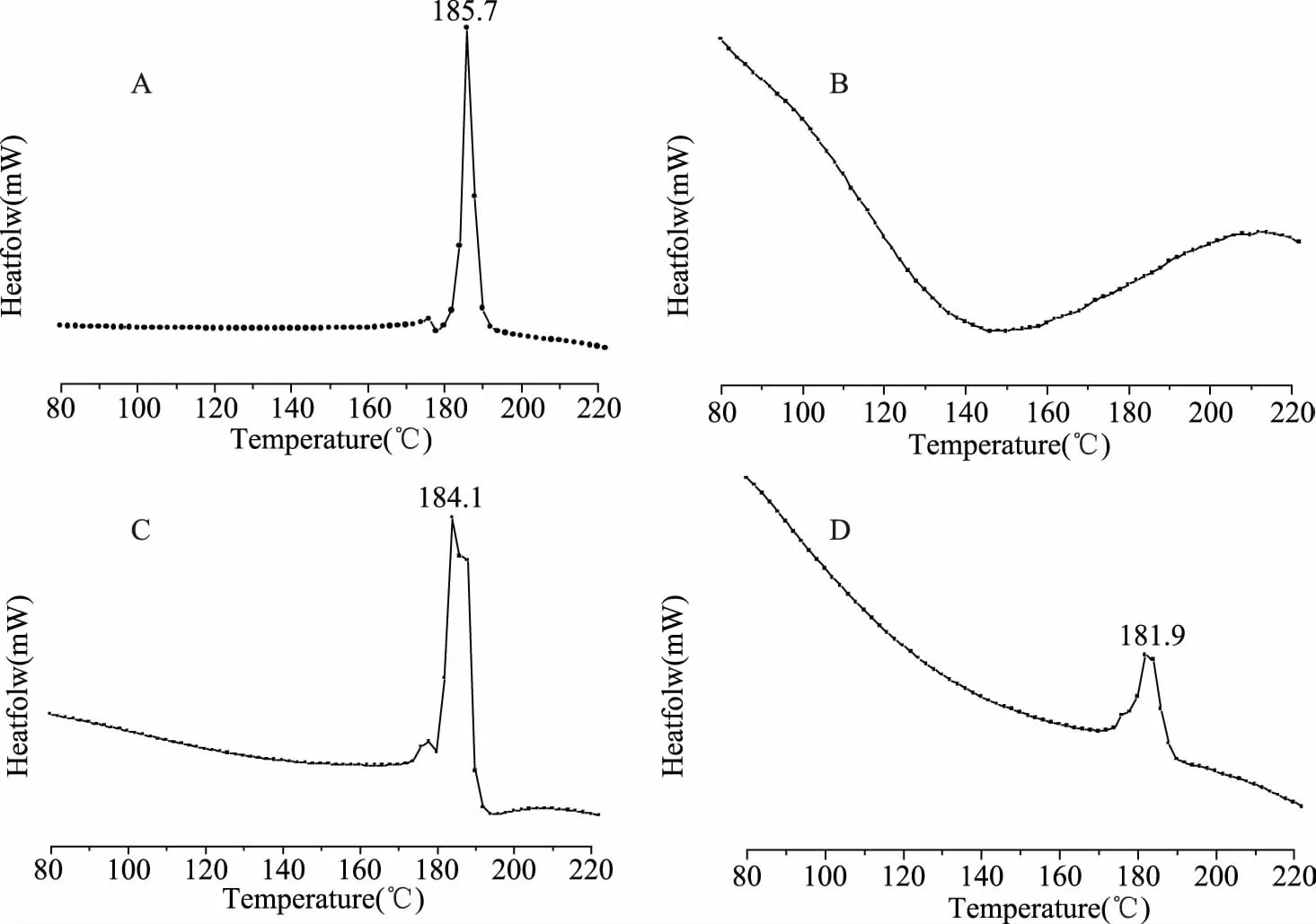
图2 姜黄素、环糊精聚合物、两者的物理混合物和包合物的差示扫描量热图Fig.2 DSC curves of curcumin,cyclodextrin polymer,physical mixture and inclusion complex of curcumin and cyclodextrin polymer
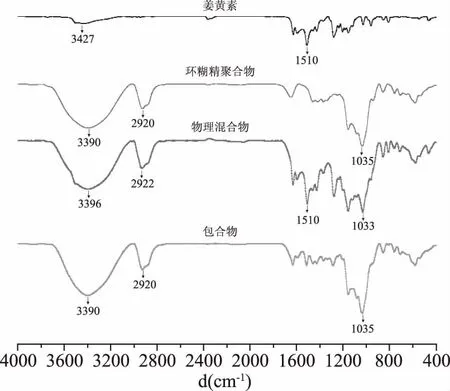
图3 姜黄素、环糊精聚合物、两者的 物理混合物和包合物的红外光谱图Fig.3 FT-IR spectra of curcumin,cyclodextrin polymer, physical mixture and inclusion complex of curcumin and cyclodextrin polymer
2.4.3 XRD 实验结果如图4所示。由图4可知,姜黄素在2θ=7.83°、8.78°、11.99°、13.76°、15.79°、17.13°、21.01°处出现特异性的结晶衍射峰,表明姜黄素是一种结晶态物质。而环糊精聚合物在2θ为10~15°和15~22.5°处出现两个宽的衍射峰,表明环糊精聚合物是一种无定型粉末。混合物的峰形是姜黄素和环糊精聚合物两者峰形的叠加,但姜黄素的特征吸收峰强度有所减弱,这可能是由于β-环糊精聚合物的屏蔽作用所致。姜黄素与β-环糊精聚合物混合后,其晶型没有发生改变,仍保留各自的晶型特点,未构成新的晶体。而包合物不再是两者图谱的简单叠加,而是显示新的谱形,姜黄素与β-环糊精聚合物的衍射峰在包合物中消失或减弱,证明姜黄素与环糊精聚合物之间形成了包合物,且晶型发生了明显改变,表明形成了新的物相,而不是物理混合。
图4 姜黄素、环糊精聚合物、两者的 物理混合物和包合物的XRD谱图Fig.4 XRD patterns of curcumin,cyclodextrin polymer, physical mixture and inclusion complex of curcumin and cyclodextrin polymer
2.5不同浓度姜黄素超分子包合物清除ABTS自由基和DPPH自由基的能力
不同浓度姜黄素超分子包合物对ABTS和DPPH自由基清除能力的实验结果如图5A和5B所示。由图5A可知,在反应时间5 min内,不同浓度姜黄素超分子包合物处理ABTS自由基体系后的吸光度A734 nm下降显著。随后继续增加反应时间,A734 nm有所降低,但降低幅度不大。而由5B可知,不同浓度的姜黄素超分子包合物处理DPPH自由基体系后,其A515 nm随着反应时间的增加而降低。上述结果表明,包合物对ABTS和DPPH自由基的清除能力呈现出时间依赖性。同时,在实验浓度范围内,随着姜黄素超分子包合物浓度的增大,A734 nm和A515 nm逐渐减小,表明包合物对ABTS和DPPH自由基的清除能力呈现出浓度依赖性。当姜黄素超分子包合物的浓度为320 μg/mL时,A734 nm和A515 nm达到最小分别为0.269和0.0418,表明在该浓度下,包合物对ABTS和DPPH自由基的清除能力达到最强。综上所述,姜黄素超分子包合物对ABTS和DPPH均具有较好的清除能力,并呈现出浓度和时间依赖性。
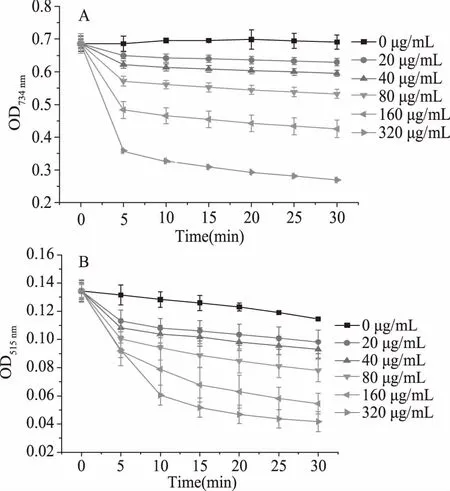
图5 不同浓度的姜黄素超分子包合物 对ABTS(A)和DPPH(B)自由基清除率的影响Fig.5 Scavenging effects of different concentrations of curcumin/β-cyclodextrin polymer inclusion complex on ABTS(A)and DPPH(B)
3 结论
本文采用高效液相色谱测定包合物中姜黄素的含量,经精密度实验、重复性实验和加样回收率实验表明此方法准确度良好。经DSC、FT-IR和XRD鉴定了本方法所制备的包合物已形成,证明了姜黄素被环糊精聚合物包合。并且,抗氧化实验表明,姜黄素超分子包合物对ABTS和DPPH自由基具有较好的清除能力,说明姜黄素经环糊精聚合物包合后仍保留了姜黄素的抗氧化活性。虽然采用本方法制备的包合物得率和包合率仅有63.5%和34.5%,但是通过本研究可知该制备方法是可行的。下一步的研究方向是进一步优化制备包合物的工艺参数,提高包合物的得率和包合率。
[1]陈建平. 右旋龙脑促进姜黄素类化合物抑制 HepG2肝癌细胞增殖的分子机制研究[D]. 广州:华南理工大学,2015.
[2]袁鹏,陈莹,肖发,等. 姜黄素的生物活性及在食品中的应用[J]. 食品工业科技,2012,33(14):371-375.
[3]潘文合,汪小珍. 姜黄素药物代谢动力学研究进展[J]. 中国药业,2012,21(10):95-96.
[4]Yallapu M M,Jaggi M,Chauhan S C.β-Cyclodextrin-curcumin self-assembly enhances curcumin delivery in prostate cancer cells[J]. Colloids and Surfaces B:Biointerfaces,2010,79:113-125.
[5]Gidwani B,Vyas A. Synthesis,characterization and application of epichlorohydrin-β-cyclodextrin polymer[J]. Colloids and Surfaces B:Biointerfaces,2014,114:130-137.
[6]Liu C,Zhang W,Yang H,et al. A water-inclusion complex of pedunculoside with the polymer-β-cyclodextrin:a novel anti-inflammation agent with low toxicity[J]. Plos One,2014,9(7):e101761.
[7]Yadav V R,Suresh S,Devi K,et al. Effect of cyclodextrin complexation of curcumin on its solubility and antiangiogenic and anti-inflammatory activity in rat colitis model[J]. AAPS Pharm Sci Tech,2009,10(3):752-762.
[8]Chen T F,Wong Y S.Invitroantioxidant and antiproliferative activities of selenium-containing phycocyanin from selenium-enriched spirulina platensis[J]. Journal of Agricultural and Food Chemistry,2008,56:4352-4358.
[9]金文英,刘海玲.β-环糊精交联聚合物的合成及表征[J]. 桂林工学院学报,2005,25(3):339-341.
[10]刘凤萍,罗春花.β-环糊精交联聚合物的合成及红外光谱研究[J]. 光谱实验室,2002,19(4):505-507.
Structuralidentificationofcurcumin/β-cyclodextrinpolymerinclusioncomplexanditsantioxidantactivity
CHENJian-ping1,2,PENGGuan-yi1,QINXiao-ming1,CHENSu-hua1,ZHONGSai-yi1,LIUYing3,*
(1.College of Food and Technology,Guangdong Ocean University,Zhanjiang 524088,China; 2.Guangdong Province Key Laboratory for Green Processing of Natural Products and Product Safety,Guangzhou 510640,China; 3.Faculty of Agricultural Science,Guangdong Ocean University,Zhanjiang 524088,China)
In this study,curcumin/β-cyclodextrin polymer inclusion complex were prepared byβ-cyclodextrin polymer materials and its antioxidant activity was also studied. The content of curcumin in inclusion complex was detected by HPLC method and the structure of inclusion complex was identified by differential scanning calorimetry(DSC),X-ray diffractometry(XRD)and Fourier transform infrared spectroscopy(FT-IR). Moreover,the spectrophotometric method was used to investigate the ability of inclusion complex to scavenge 2,2-azinobis-3-ethylbenzothiazoline-6-sulfonic acid(ABTS)and 1,1-diphenyl-2-picrylhydrazyl(DPPH)radicals. The experimental results showed that the yield and the encapsulation efficiency of inclusion complex was 63.5% and 34.5%,respectively. The formation of inclusion complex was proved by DSC,FT-IR,and XRD. Antioxidant activity assay analysis showed that inclusion complex exhibited strong scavenging effects on ABTS and DPPH free radicals in a dose-and time-dependent manner. The results demonstrated that inclusion complex with certain antioxidant activity could be obtained using the method reported in this paper,which provided the new technology method and theory reference data for the formulation improvement and application of curcumin.
curcumin;β-cyclodextrin polymer;inclusion complex preparation;anti-oxidant activity
2017-04-11
陈建平(1986-),男,博士,讲师,研究方向:天然产物活性物质及其生物利用,E-mail:cjp516555989@126.com。
*
刘颖(1985-),男,博士,讲师,研究方向:能源植物遗传改良,E-mail:liuying85168@126.com。
国家自然科学基金青年科学基金项目(21602034);广东省自然科学基金博士启动项目(2016A30310332);广东省天然产物绿色加工与产品安全重点实验室开放基金(201617);广东海洋大学科研启动项目(R17034)。
TS201.2
A
1002-0306(2017)21-0021-05
10.13386/j.issn1002-0306.2017.21.005

