冷冻南极磷虾(Euphausia superba)肌肉的 理化性质及蛋白的加工特性
,,,, ,长湖,*,
(1.中国海洋大学食品科学与工程学院,山东青岛 266003; 2.中国科学院理化技术研究所低温工程学重点实验室,北京 100190)
冷冻南极磷虾(Euphausiasuperba)肌肉的 理化性质及蛋白的加工特性
徐蓓蓓1,胡玲萍1,姜晓明1,尹利昂1,薛勇1,薛长湖1,*,杨俊玲2
(1.中国海洋大学食品科学与工程学院,山东青岛 266003; 2.中国科学院理化技术研究所低温工程学重点实验室,北京 100190)
本文以冷冻南极磷虾为原料,对肌肉的理化性质和蛋白质的加工特性进行研究。结果表明,磷虾蛋白氨基酸组成均衡,必需氨基酸总量达到485.9 mg/g蛋白;肌原纤维蛋白由于在冻藏期间发生降解,只占冻藏后蛋白质的20%左右;蛋白质的二级结构以α螺旋和无规则卷曲为主;蛋白与脂质的结合呈紧密的规律性分布。蛋白的加工特性(结构性质、溶解性、乳化性和起泡性等)研究表明,与大豆分离蛋白相对比,南极磷虾蛋白的乳化活性较高而起泡性较低且在0.6 mol/L的盐溶液中溶解性较好;与鲜虾能形成粘弹性的凝胶性能相对比,冷冻磷虾蛋白则失去凝胶性能。内源蛋白酶具有类胰蛋白酶属性,在45 ℃,pH8.0时,活性最高;内源脂肪酶属于低温酶,在5~50 ℃范围内具有较高的酶活。建立了冷冻南极磷虾作为合格工业原料的参考标准,即TVB-N≤30 mg N/100 g,碱溶性蛋白≤5.00%,FFA≤5.00%脂质,LPC≤4.00%脂质。本文的研究为南极磷虾蛋白质的利用提供了基础性数据,对南极磷虾的高值化利用具有理论和实践上的借鉴意义。
南极磷虾,蛋白,加工特性,理化性质,TVB-N,Folin-酚法
南极磷虾肌肉鲜样含有粗蛋白16.31%,粗脂肪1.30%,粗灰分2.76%,无氮浸出物4.94%,水分74.69%[1]。南极磷虾蛋白质含有全部的人体必需氨基酸,整只南极磷虾中必需氨基酸占总氨基酸的比例达到40.2%[2];氨基酸总量(TAA)和必需氨基酸总量(EAA)分别是57.21%和25.88%,构成比例符合FAO/WHO的标准[1,3]。南极磷虾肌肉中赖氨酸的含量很高,占总氨基酸的比例达到8.93%,这对于以谷物食品为主的膳食者来说,可以弥补谷物食品中赖氨酸的不足,从而提高人体对蛋白质的利用率[4]。南极磷虾蛋白质的生物效价高于其它肉类蛋白质和牛乳蛋白质(如酪蛋白)[5];动物实验结果表明,南极磷虾蛋白可供人体食用,无安全性问题[6]。
南极磷虾是目前人类所发现的生物中含蛋白质量最高的一种,为了满足日益增长的蛋白质需求,充分利用南极磷虾开发蛋白类食品是一项重要任务。针对这一现象,实验对冷冻南极磷虾肌肉的理化性质及蛋白质的加工特性展开了研究,以期对南极磷虾以及南极磷虾蛋白产品的生产与应用提供一定的理论依据和参考价值。
1 材料与方法
1.1材料与仪器
冷冻南极磷虾(E.superba,捕捞于南极FAO 48.1海域,2014年6月,2014年7月,2014年8月,2015年1月,2015年2月,2015年3月六个批次) 中国水产有限公司提供;TP酶测试盒、蛋白测定试剂盒、甘油三酯和胆固醇测定试剂盒 南京建成生物工程研究所;Tritox X-100、福林-酚乙液、三羟甲基氨基甲烷(Tris)Solarbio;磷酸氢二钠(Na2HPO4·12 H2O)、磷酸二氢钠(NaH2PO4·7H2O)、十二烷基硫酸钠(SDS)、氯仿、异丙醇、苯甲酰-L-精氨酰-对硝基苯胺(BApNA)、对硝基苯酚(p-NP)、4-硝基苯丁酸酯(p-NPB)等 上海国药集团;所用试剂 均为分析纯。
AL204电子天平 梅特勒-托利多仪器有限公司;WFZ UV2100型紫外可见分光光度计 龙尼柯仪器有限公司;Biochrom 30 Ltd型氨基酸自动分析仪 英国Biochrom公司;PF-1型氟电极、PHS-3C型精密酸度计 上海雷磁精密仪器有限公司;Nicolet 6700 FT-IR傅立叶变换红外光谱仪 美国Thermo Fisher公司;NETZSCH DSC 200PC 差示热扫描仪 德国NETZSCH公司;BRUKER AV500核磁共振波谱仪 德国布鲁克公司;T860自动电位滴定仪 济南海能仪器股份有限公司;5973型质谱仪 美国安捷伦公司;Leica Tcs Sp2型激光共聚焦显微镜 德国Leica公司。
1.2实验方法
1.2.1 冷冻南极磷虾的基本成分分析 由于南极磷虾生长海域和自身成分经常伴随季节变化,本实验选取了6个不同生产日期的磷虾为样品,测定各自的基本成分,取其平均值。

图1 冷冻南极磷虾虾块图片Fig.1 Photograph of frozen Antarctic krill block
水分含量:采用直接干燥法测定,参照国标GB/T 5009.3-2010[7];蛋白质含量:采用凯氏定氮法测定,参照国标GB/T 5009.5-2010[8];总脂含量:采用氯仿/甲醇抽提法,参照Folch的方法[9],提取的总脂-18 ℃于贮存,用于甘油酯、磷脂、虾青素等含量的测定及分析;灰分含量:参照国标GB/T 5009.4-2010[10];氟含量:采用高温灰化-氟离子选择电极法测定,参照李红艳[11]的方法,并加以修改,以0.1 mol/L HClO4为氟的提取试剂;氨基酸组成:参照国标GB/T 5009.124-2003[12]和Adeyeye[13]的方法,样品在6 mol/L HCl溶液中于110 ℃条件下消化24 h后上机测。
1.2.2 虾肉组成蛋白质的种类及含量 冷冻磷虾手动剥壳采肉,参考Kanehisa等[14]的方法并进行部分改进。精确称取20 g虾肉与10倍体积的磷酸盐缓冲液A(I=0.05,15.5 mmol/L Na2HPO4·12 H2O,3.38 mmol/L KH2PO4,pH7.5)混合;8000 r/min分散3 min;分散液于4 ℃下离心(5000 r/min,15 min);在所得沉淀中加入与上述相同数量的磷酸盐缓冲液A,重复上述操作。将两次离心后的上清液合并,得到上清a和沉淀a;向上清a中加入TCA,使TCA终浓度达到5%;离心,得到上清b(含氮非蛋白化合物)和沉淀b(肌浆蛋白);向沉淀a加入10倍体积的磷酸盐缓冲液B(0.5 mol/L KCl,15.5 mmol/L Na2HPO4·12H2O,3.38 mmol/L KH2PO4,pH7.5)混匀,离心;沉淀中再加入缓冲液B,重复一次,将两侧离心后的上清液混合,得到上清c(肌原纤维蛋白)和沉淀c;将沉淀c用0.1 mol/L的NaOH过夜搅拌10 h,然后离心,得到上清d(碱溶性蛋白)和沉淀d(肌基质蛋白)。
所提取蛋白质的定量方法:肌原纤维蛋白c和碱溶性蛋白d采用Folin-酚法[15],肌浆蛋白b和肌基质蛋白d采用凯氏定氮法[14]。
1.2.3 南极磷虾蛋白的SDS-PAGE分析 参照Laemmli的电泳方法[16]。电泳条件:分离胶浓度为12%,浓缩胶浓度为5%。电泳电压为浓缩胶80 V,分离胶100 V,同时以阿拉斯加鳕鱼(Theragra chalcogramma)鱼糜对应的两种蛋白组分作为对照进行分析。
1.2.4 南极磷虾蛋白的双向二维电泳分析 参照O’Farrell的双向二维电泳方法[17],提取和纯化冷冻南极磷虾蛋白,采用双向二维电泳(2-DE)分析其分布特征。条件:一向等电聚焦电泳(IEF):pH3~10;二向垂直电泳(SDS-PAGE):15~170 kDa;染色:银染。以 ImageMaster 2D platinum 5.0 进行图像分析。
1.2.5 南极磷虾蛋白等电点(pI)的测定 以0.1 mol/L的柠檬酸(C6H8O7·H2O)溶液和0.2 mol/L的磷酸二氢钠(NaH2PO4·7H2O)溶液配制pH4.0~4.9的缓冲溶液。
将虾肉充分斩碎混匀,各取0.5 g虾肉于离心管,加入2 mL不同pH的缓冲溶液,20000 g离心30 min(4 ℃),离心物分3层:上层脂质,中层水相和下层沉淀,中间层水相的蛋白含量用Folin-酚法测定,蛋白含量最低的离心管对应的pH即pI。
1.2.6 冷冻南极磷虾脂质的基本组成分析 甘油三酯和胆固醇含量测定:采用试剂盒测定。将总脂用氯仿溶解,定容,取一定体积的氯仿溶液,氮气吹干,按照试剂盒使用说明测定总脂中甘油三酯和胆固醇的含量。
磷脂含量测定:采用核磁共振法(31P NMR)。以三氯甲烷∶氘代甲醇(2∶1)溶剂为溶剂,磷酸三苯酯(TPP)为内标物进行核磁共振分析。
游离脂肪酸含量测定:采用自动电位滴定法。取0.5 g左右虾油,用石油醚-乙醇(2∶1)混合溶剂充分溶解,以0.1 mol/L NaOH溶液为滴定试剂进行电位滴定。
虾青素含量测定:取1.2.1中所提总脂以LC/MS进行虾青素含量的测定[18]。
1.2.7 南极磷虾肌肉的共聚焦激光扫描显微镜观察 参照Donato等[19]的方法。将罗丹明B加入到少量试样中,以荧光标记蛋白质,振荡5 min,把多余的荧光剂洗去。取适量的样品均匀涂抹于载玻片,缓慢按压盖玻片以防气泡产生。以共聚焦激光扫描显微镜(Confocal Laser Scanning Microscope,CLSM)断层扫描得到稳定的共聚焦图片,发射波长543 nm,避光操作。
1.2.8 南极磷虾肌肉的红外光谱分析 将南极磷虾肌肉冻干样品与光谱纯KBr混合压片,以傅里叶红外光谱仪进行红外光谱测试。条件:扫描范围4000~400 cm-1;扫描数64;分辨率4 cm-1;测试温度25 ℃。
1.2.9 南极磷虾肌肉的差示扫描量热(DSC)分析 参数设定:氮气保护,温度条件0~120 ℃,升温速率5 ℃/min,保护气流速为60~70 mL/min,吹扫气20~30 mL/min。
1.3冷冻南极磷虾蛋白的加工特性分析
1.3.1 溶解性、盐析性和起泡性质
1.3.1.1 溶解性 在不同pH溶液中的溶解情况:取10 g冷冻南极磷虾粉碎匀浆,加入1∶1的不同pH(1~12)的磷酸盐缓冲溶液,用高速分散机进行分散,分散后进行离心(4500 r/min,10 min)。取离心的上清液进行蛋白质含量测定(Folin-酚法)。
在不同离子强度溶液中的溶解情况:取10 g冷冻南极磷虾粉碎匀浆,加入1∶1的不同离子强度(0.1~0.6 mol/L)的NaCl溶液,操作同前。
1.3.1.2 盐析性 取一定质量的虾肉,加入去离子水,分散、离心,加入不同浓度硫酸铵溶液(20%~65%)使磷虾蛋白质发生沉淀,测定使磷虾可溶性蛋白质析出的硫酸铵的最高盐浓度。
1.3.1.3 起泡性 配制1%的南极磷虾蛋白溶液100 mL,记录起始溶液体积为V0,用高速均质机以12000 r/min均质1 min,测量蛋白溶液和泡沫的总体积,计为V1[20],
起泡性(%)=[(V1-V0)/V0]×100
式(1)
均质停止30 min后,再次测量蛋白溶液和泡沫的总体积,计为V2,
起泡稳定性(%)=[(V2-V0)/(V1-V0)]×100
式(2)
1.3.2 结构性质 以Ca2+-ATPase活性为代表,分析南极磷虾蛋白在冻藏一定时间后和等电点处沉淀蛋白的结构属性。
取冷冻磷虾,冰水解冻5 min,手动脱壳得到磷虾肌肉。取部分磷虾肌肉,加入3倍质量的冰水,均质,调节至pH4.5,静置15 min,离心(5000 r/min,10 min,4 ℃),沉淀即为等电点沉淀蛋白。将磷虾肌肉和沉淀蛋白按照试剂盒说明书进行其Ca2+-ATPase活性的测定。取冷冻磷虾,冰水解冻后用清水冲洗15 min,沥干水分,重复两次后,手动脱壳得到虾糜,其性能测定同上。
凝胶性能:为验证冷冻南极磷虾肌肉的凝胶性能与其新鲜度的相关性,在磷虾捕捞作业船上和陆上实验室分别以鲜捕磷虾和冷冻磷虾为原料,按以下流程进行凝胶实验:
新鲜/冷冻磷虾→手动去壳→研碎→加2倍水,充分搅拌→过滤脱水→空擂→盐擂(3%食盐)→成型。
1.3.3 表面性质 以乳化活性为代表对南极磷虾蛋白在冻藏一定时间后的表面属性。
采用浊度法进行乳化活性的测定[21],配制质量浓度为1 mg/mL蛋白溶液,记为P,调节溶液的pH至7. 0。取25 mL该溶液加入10 mL大豆油,室温条件下在10000 r/min下乳化1 min,用移液枪迅速从底部吸取0. 1 mL乳化液,用20 mL 0. 1%(m/v)十二烷基硫酸钠(SDS)溶液定容,涡流混合后摇匀,以0.1% SDS溶液为空白参比。用分光光度测定溶液在500 nm时的吸光度,计为A1,静置10 min后,再次按上述方法测定吸光度,计为A2。
乳化活性=[(2×2. 303×A1×N)/(P×l×(1-φ)×103)]×100
式(3)
N为稀释倍数,L为光学路径1 cm,φ为乳化液中油的体积分数
乳化稳定性=[A1/(A2-A1)]×t
式(4)
t为静置时间(10 min)
1.4南极磷虾自溶酶相对酶活力的测定
1.4.1 粗酶液的制备 收集冷冻南极磷虾虾头,加入2倍质量的Tris-HCl缓冲液(0.05 mol/L,pH7.5,4 ℃),高速匀浆后,匀浆液离心(10000 r/min,4 ℃,30 min),收集上清液,得南极磷虾粗酶液[22]。将粗酶液放于-20 ℃保存,用于测定脂肪酶和蛋白酶相对酶活的变化。
1.4.2 不同温度条件下相对酶活的变化 参考王琨[23]测定胰蛋白酶活性的方法,以苯甲酰-L精氨酰-对硝基苯胺(BApNA)为底物,以吸光值最高的pH所对应的酶活力为100%,对不同温度条件(20~55 ℃)下蛋白酶的相对活力进行测定;脂肪酶活力的测定[24],以对硝基苯酚丁酸酯(p-NPB)为底物,以吸光值最高的pH所对应的酶活力为100%,对不同温度条件(5~70 ℃)下的脂肪酶的相对酶活进行测定。
1.4.3 不同pH条件下相对酶活的变化 以37 ℃为最佳反应温度,以BApNA为底物,以吸光值最高的pH所对应的酶活力为100%,对不同pH(3~11)下的蛋白酶活进行测定;以p-NPB为底物,以吸光值最高的pH所对应的酶活力为100%,对不同pH(pH3~11)下的脂肪酶活进行测定。
1.5冷冻南极磷虾蛋白质品质分析
以冷冻整虾TVB-N含量水平和碱溶性蛋白的含量水平来评价冷冻南极磷虾蛋白质的品质。
碱溶性蛋白含量的测定:Folin-酚法[15]。
TVB-N含量的测定:取匀浆后的冻虾虾浆约4 g置于50 mL离心管,加入40 mL 7% 的高氯酸溶液,间歇振荡,浸渍30 min后离心、过滤。取10 mL滤液于消化管中,加入10 mL 1% MgO混悬液,以自动凯氏定氮仪进行蒸馏滴定。
1.6数据处理
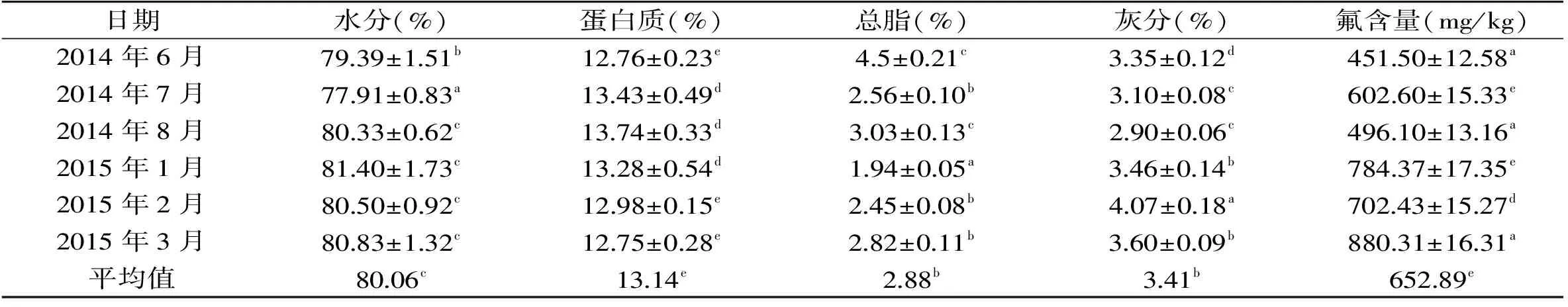
表1 冷冻南极磷虾整虾的基本组成Table 1 Basic composition of the whole frozen Antarctic krill
注:同列上标不同字母表示差异显著(p<0.05);表3、表5、表7同。2结果与讨论
2.1冷冻南极磷虾基本组成分析
南极磷虾整虾含有77.9%~83.1%的水分、0.4%~3.6%的脂质、11.9%~15.4%的蛋白质[24],由表1可以看出,实验所得数据与报道内容较为一致。单从组成成分上,这6个不同月份批次的磷虾间有小幅波动,这与磷虾生长的水域以及捕捞的季节不同有关,2014年6、7、8月磷虾的总脂水平稍高于2015年1、2、3月的磷虾,且灰分含量则略微低于后者;就氟含量来看,2014年捕捞的磷虾的均低于2015年的磷虾,这可能与磷虾在不同季节时外骨骼的代谢特点有关。
由表2可知,南极磷虾肌肉蛋白质有平衡合理的氨基酸组成,总必需氨基酸含量达到485.9 mg/g蛋白,超过FAO/WHO/UNU对成人及婴儿食品中必需氨基酸的含量要求(277(292.6) mg/g蛋白),其中Lys含量为88.3 mg/g蛋白,标志着南极磷虾蛋白是一种营养极其丰富的蛋白质。

表2 南极磷虾肌肉蛋白质的氨基酸组成Table 2 Amino acid composition of protein from Antarctic krill muscle
注:Lys,赖氨酸;Trp,色氨酸;Phe,苯丙氨酸;Tyr,酪氨酸;Met,甲硫氨酸;Cys,半胱氨酸;Thr,苏氨酸;Ile,异亮氨酸;Leu,亮氨酸;Val,缬氨酸;His,组氨酸;Glu,谷氨酸;Asp,天冬氨酸;Ala,丙氨酸;Arg,精氨酸;Ser,丝氨酸;Gly,甘氨酸;Pro,脯氨酸;T-EAA,总必需氨基酸;T-NEAA,总非必需氨基酸;-,FAO/WHO/UNU(2007)中无具体参考数值。
2.2南极磷虾肌肉蛋白质的种类及含量

表3 南极磷虾肌肉蛋白质的构成Table 3 Protein composition of Antarctic krill muscle

表4 南极磷虾脂质的组成及含量Table 4 Antarctic krill lipid compositions and contents
注:占总脂的百分比。
由表3可以看出,冷冻南极磷虾的肌浆蛋白占蛋白的比例为33.74%,因其溶于I<0.05的溶液中,增加了南极磷虾加工中蛋白质回收的难度和成本;肌原纤维蛋白在很大程度上决定蛋白质的功能特性,Suzuki[5]测定新鲜虾肉中,水溶及盐溶蛋白各占5.0%、9.4%,盐溶性蛋白占二者的比例为65%。表3数据显示,冷冻磷虾肌原纤维蛋白只占蛋白质的20%左右,远低于鱼类肌原纤维蛋白50%~70%的比例[26],这应该是冷冻磷虾在加工中难以形成弹性凝胶的主要原因之一;碱溶性蛋白(alkali-soluble protein),是一种于贮藏过程产生,不溶于水和高离子强度的溶液,但在碱性条件下可溶出的蛋白质,一般认为是蛋白质受环境影响的降解产物[24]。可见,南极磷虾蛋白质在捕捞、冻结、贮藏和运输过程中的降解比较严重。
2.3南极磷虾蛋白的SDS-PAGE分析
由图2可知,冷冻南极磷虾水、盐溶性蛋白的组成,包含肌球蛋白重链(MHC,210 kDa)、肌球蛋白轻链(MLC,17~23 kDa)、肌动蛋白(Actin,43 kDa)和原肌球蛋白(TM,38 kDa),以及一条不明条带组成(70~100 kDa)组成。该不明条带可能是肌原纤维蛋白降解的产物,南极磷虾体内含丰富的内源酶,其中的蛋白酶在某些条件下可降解磷虾肌原纤维蛋白,Sun等[27]研究发现在自溶过程中,肌球蛋白和肌动蛋白更易受到蛋白酶作用。磷虾MHC的条带较弱,MHC是肌球蛋白性质的决定性组分,很大程度上决定了虾肉蛋白的凝胶能力的强弱。
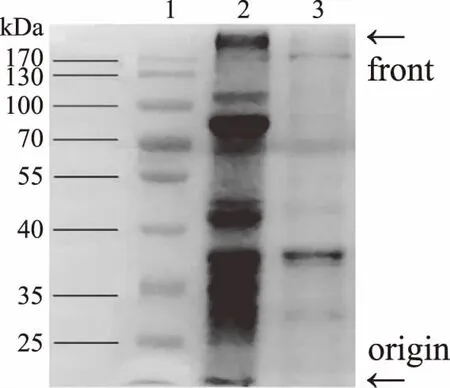
图2 南极磷虾蛋白的SDS-PAGE电泳图谱Fig.2 SDS-PAGE profile of protein isolate from Antarctic krill muscle注:1:分子量标准品;2:南极磷虾盐溶性蛋白; 3:南极磷虾水溶性蛋白。
2.4南极磷虾蛋白的双向二维电泳分析
据图3分析,蛋白斑点集中于pH4~5,说明其蛋白质的等电点可能在pH4~5。蛋白的组成方面,肌球蛋白轻链(17~23 kDa)、肌动蛋白(43 kDa)和原肌球蛋白(38 kDa)比较显著,而作为肌原纤维蛋白主要组成的肌球蛋白重链(210 kDa)很弱。

图3 南极磷虾蛋白的双向二维电泳图谱Fig.3 2-DE spectrum of Antarctic krill muscle protein
2.5南极磷虾蛋白等电点的测定
由图4可知,南极磷虾蛋白在pH4.0~4.9范围内的溶解性呈“U”型,溶解蛋白浓度先降低后升高,在pH4.5处最低,因此推断pH4.5为南极磷虾蛋白的等电点,这与王灵昭等[28]测定的南极磷虾等电点pH4.6相符合。
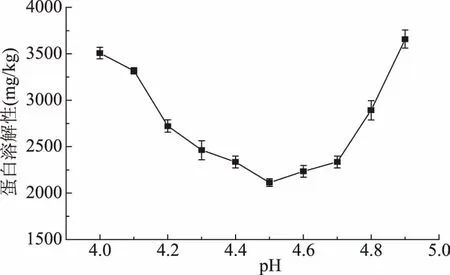
图4 南极磷虾蛋白在不同pH(4.0~4.9)下溶解性的变化Fig.4 Changes in solubility of krill muscle protein at different pH values(4.0~4.9)
2.6南极磷虾脂质的基本组成
南极磷虾脂质的平均组成见表4,由表4可知,南极磷虾脂质富含磷脂(41.37%),磷脂型脂质被认为在人体内的吸收效率和安全性更高[29]。水产品磷脂有富含EPA和DHA的特点,楼乔明等[30]报道的南极磷虾中EPA和DHA占脂肪酸总量的40.64%,高于一般海洋虾类。虾青素含量较其他虾类较高(占总脂的0.15%),且动物源的虾青素更容易被人体吸收利用,而南极磷虾资源丰富。因此,从磷虾中提取虾青素具有潜在的经济效益。
2.7南极磷虾肌肉的共聚焦激光扫描图分析

图5 南极磷虾肌肉的共聚焦激光扫描图Fig.5 Confocal laser scanning map of Antarctic krill muscle
南极磷虾肌肉的共聚焦激光扫描图见图5,可以清晰的看出,经罗丹明B染色的南极磷虾蛋白与暗色的条带状物质均匀交叉分布,暗色的条带状物质推断为南极磷虾的脂质成分,由此可以分析南极磷虾蛋白与脂质结合非常紧密,呈现规律性的分布,这一特征将有利于南极磷虾体内磷脂存在形式的揭示。
2.8南极磷虾肌肉的红外光谱分析
南极磷虾肌肉的红外光谱吸收见图6,酰胺Ⅰ带(主要为C=O伸缩振动)的特征吸收峰与蛋白质的二级结构存在对应关系,即1650~1660、1600~1640、1660~1695 cm-1和1640~1650 cm-1分别为α螺旋、β-折叠、β-转角及无规则卷曲[31]。由图6可以看出,南极磷虾肌肉的酰胺Ⅰ带特征峰出现在1650 cm-1附近,因此,南极磷虾蛋白的二级结构可能是以α螺旋和无规则卷曲为主。

图6 南极磷虾肌肉的红外光谱图Fig.6 Infrared spectra of Antarctic krill muscle
2.9南极磷虾肌肉的DSC分析
南极磷虾肌肉的DSC曲线如图7所示。样品表现出两个热相变温度:26.3 ℃和110.3 ℃。前一个对应着肌球蛋白的变性和交联,后一个对应着肌球蛋白和肌动蛋白的变性和交联。相关研究认为,热相变温度可以反映出氢键的断裂和蛋白之间的疏水聚集[32]。因此可以看出,南极磷虾蛋白的肌球蛋白的变性温度较低(26.3 ℃),说明其肌原纤维蛋白易受外界作用而失去活性。

图7 南极磷虾肌肉的差示热量扫描分析Fig.7 Differential scanning calorimetry thermograms of Antarctic krill muscle

图8 南极磷虾蛋白在不同pH溶液中的溶解曲线Fig.8 Dissolving curve of Antarctic krill protein in varying pH values
2.10冷冻南极磷虾蛋白的加工特性分析
2.10.1 水合性质
2.10.1.1 溶解性 由图8可以看出,南极磷虾蛋白的溶出,在不同pH条件下(pH1~12)呈现先降低后升高的趋势,最低和最高的溶出分别出现在pH4和pH11附近,这与碱溶酸沉法制备南极磷虾分离蛋白中的溶出规律相一致,该溶出曲线对研究冷冻南极磷虾蛋白的加工利用有重要作用。
南极磷虾蛋白在不同离子强度条件下的溶出情况见图9,随着离子强度的提高,蛋白溶出量先线性增加,中间增加缓慢,后直线上升,这是因为,南极磷虾蛋白含有高比例的肌浆蛋白(33.74%),肌浆蛋白很快溶解在0.1 mol/L NaCl溶液中,而直到盐浓度在0.4 mol/L以上时,肌原纤维蛋白才开始溶出,因此在溶出曲线上呈现出先上升后缓慢上升然后急速上升的趋势;由张辉[33]论文数据可知,随着离子强度的增加,大豆分离蛋白表现出显著的盐析效应,溶解性曲线表现出的盐析现象开始于低盐浓度( 图9 南极磷虾蛋白在不同离子强度溶液中的溶解曲线Fig.9 Dissolving curve of Antarctic krill protein in varying ionic strength 表5 南极磷虾蛋白的起泡性和乳化性Table 5 Foaming and emulsification properties of Antarctic krill protein 表6 不同磷虾产品中蛋白的Ca2+-ATPase活性Table 6 ATPase activity of the protein in different krill products 2.10.1.2 盐析性 从图10可以看出,随着硫酸铵饱和度的不断增加,沉淀中的蛋白质含量不断增加,硫酸铵饱和浓度达到50%时,可沉淀大部分的水溶性蛋白质,当饱和度继续增加时,沉淀中的水溶性蛋白质含量反而降低。因此实际应用中,可采用<65%的硫酸铵饱和度沉淀水溶性蛋白质。 图10 南极磷虾蛋白的盐析曲线Fig.10 Salting-out curve of Antarctic krill protein 2.10.1.3 起泡性与乳化性 从表5中可以看出,南极磷虾起泡性的平均值为3.91%,起泡性低于大豆分离蛋白,而其泡沫稳定性平均值为56.77%,与大豆蛋白的泡沫稳定性差别不大。南极磷虾蛋白的溶解性比较好,在一定条件下能促进蛋白的起泡性,但起泡性不利于南极磷虾蛋白质的加工利用,在实际加工中可以综合盐分、脂质等影响因素加以控制。磷虾蛋白的乳化活性(EAI)为15.67 m2/g,高于大豆分离蛋白的9.21 m2/g,这是因为冷冻磷虾蛋白易与脂质,尤其是双亲性的磷脂发生乳化作用。乳化稳定性(ESI)为26.37 min,与大豆分离蛋白(32.72 min)相近。 2.10.2 结构性质 由表6可知,冷冻磷虾虾肉蛋白和等电处理后的蛋白的Ca2+-ATPase活性平均值分别为0.038、0.021 μmol Pi/mg prot/min,低于新鲜南极磷虾肉蛋白的Ca2+-ATPase活性(0.158 μmol Pi/mg prot/min)。 经实验验证,新鲜捕捞的磷虾在去除水溶性蛋白、加盐擂溃后,能形成具备一定粘弹性的凝胶,而与此对应的冷冻南极磷虾制备的虾肠,虽然可以借助外力成型,但不能形成弹性凝胶。这表明南极磷虾肌原纤维蛋白经冷冻贮存后,发生了严重的变性,失去了形成弹性凝胶的能力,这与较低的Ca2+-ATPase活性存在着重要关联。 2.11冷冻南极磷虾自溶酶相对酶活的测定 南极磷虾引起自溶的酶系主要是蛋白酶和脂肪酶,Osnes等[34]提出磷虾自溶酶中起着决定性作用是类胰蛋白酶,其活性约占磷虾内源酶活性的40%,整体自溶酶活性在中性至弱碱性条件下最强。因此,实验主要探究了这两种酶系在不同温度和pH条件下相对活性的变化。如图11所示,蛋白酶系在45 ℃、pH为8.0时具有最高相对活性,但在pH6.0~11.0范围内具有较高的相对酶活,体现了胰蛋白酶的相似性质;在40 ℃、pH为8.0时,脂肪酶系具有最高相对活性,且在5~50 ℃范围内具有较高的相对酶活,属于低温酶,但其活性易受pH的影响;南极磷虾自溶的最佳反应 pH为8.0 左右,有文献推测其脂肪酶的适低温的特性可能与其生活环境相关。 2.12冷冻南极磷虾的品质评价 冷冻南极磷虾作为一种潜在的大宗原料,有必要针对其品质建立参考标准,为原料的质量控制提供依据。6个不同批次的冷冻南极磷虾蛋白质品质指标(TVB-N、碱溶性蛋白含量)和脂质品质指标(FFA、LPC含量)见表7。 如表7所示,不同批次的冷冻南极磷虾的蛋白质品质指标和脂质品质指标之间有所变化差异,2015年的三个批次磷虾的TVB-N、碱溶性蛋白含量FFA、LPC含量均高于2014年的三个批次,2014年8月的南极磷虾各指标含量均最低,新鲜度最好。根据南极磷虾6批样品的品质分析,建立了冷冻南极磷虾作为合格工业原料的参考标准,即TVB-N≤30 mg N/100 g,碱溶性蛋白≤5.00%,FFA≤5.00%脂质,LPC≤4.00%脂质。 图11 冷冻南极磷虾自溶酶的相对活性Fig.11 Relative activity of autoenzyme from frozen Antarctic krill注:a、b:不同温度、pH对脂肪酶活的影响;c、d:不同温度、pH对蛋白酶活的影响。 表7 冷冻南极磷虾的品质评价指标Table 7 Quality evaluation index of frozen Antarctic krill 注:平均值1,2014年3个批次的平均值;平均值2,2015年3个批次的平均值;平均值3,全部6个批次的平均值。 南极磷虾蛋白质有均衡的氨基酸组成,且必需氨基酸总量达到485.9 mg/g,满足人体对必需氨基酸的摄入量,可考虑作为人类膳食的蛋白原料。南极磷虾蛋白质等电点及溶解性的研究结果表明碱溶酸沉法可作为蛋白提取的有效方法。南极磷虾形成弹性凝胶的能力,与Ca2+-ATPase活性存在重要关联。磷虾蛋白的乳化活性优于大豆分离蛋白,可考虑其作为乳化剂的成分以及乳化产品中的添加物。内源酶系及蛋白的组成与结构的研究分析对于磷虾的储藏和利用具有重要意义。南极磷虾6批样品的品质分析结果可作为冷冻磷虾工业原料是否合格的质量参考标准,为南极磷虾的工业化应用提供数据支持。 总之,南极磷虾蛋白的加工特性的研究,可对南极磷虾蛋白及其制品的加工利用提供重要的理论依据和方向参考,以使磷虾蛋白资源得到更科学、合理的利用。 [1]孙雷,周德庆,盛晓风.南极磷虾营养评价与安全性研究[J].海洋水产研究,2008,29(2):57-64. [2]Chen Y C,Tou J C,Jaczynski J. Amino acid and mineral composition of protein and other components and their recovery yields from whole Antarctic krill(Euphausia superba)using isoelectric solubilization/precipitation[J]. Journal of Food Science,2009,74(2):31-39. [3]Charalambous G,Inglett G E. Chemistry of Foods and Beverages:Recent Developments[J]. 1982. [4]严安生,熊传喜,钱健旺,等. 鳜鱼含肉率及鱼肉营养价值的研究[J]. 华中农业大学学报,1995(1):80-84. [5]Taneko Suzuki,Nobukazu Shibata. The utilization of Antarctic krill for human food[J]. Food Reviews International,1990,6(1):119-147. [6]Gigliotti J C,Jaczynski J,Tou J C. Determination of the nutritional value,protein quality and safety of krill protein concentrate isolated using an isoelectric solubilization/precipitation technique[J]. Food Chemistry,2007,111(1):209-214. [7]中华人民共和国卫生部. GB/T 5009.3-2010 食品中水分的测定[S]. 北京:中国标准出版社,2010. [8]中华人民共和国卫生部. GB/T 5009.5-2010 食品中蛋白质的测定[S]. 北京:中国标准出版社,2010. [9]Folch J,Lees M,Stanley G H S. A simple method for the isolation and purification of total lipides from animal tissues[J]. Journal of Biological Chemistry,1957,226(1):497-509. [10]中华人民共和国卫生部. GB/T 5009.4-2010 食品中灰分的测定[S]. 北京:中国标准出版社,2010. [11]李红艳. 南极磷虾酶解液脱氟技术的研究[D]. 青岛:中国海洋大学,2011. [12]中华人民共和国卫生部. GB/T 5009.124-2003 食品中氨基酸的测定[S]. 北京:中国标准出版社,2003. [13]Adeyeye E I. Amino acid composition of three species of Nigerian fish:Clarias anguillaris,Oreochromis niloticus,and Cynoglossus senegalensis[J]. Food Chemistry,2009,113(1):43-46. [14]Hashimoto K,Watabe S,Kono M,et al. Muscle protein composition of sardine and mackerel[J]. Nsugaf,1979,45(11):1435-1441. [15]史卓维,孙珍,郑璐侠,等. 蛋白质含量测定方法对乌司他丁比活的影响[J]. 中国临床药学杂志,2015(2):110-112. [16]Laemmli U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature,1970,227(5259):680-685. [17]O’Farrell P H. High resolution two-dimensional electrophoresis of proteins[J]. Journal of Biological Chemistry,1975,250(10):4007-4021. [18]杨澍. 南美白对虾中虾青素类化合物在贮藏及加工过程中变化规律的研究[D]. 青岛:中国海洋大学,2015. [19]Donato L,Garnier C,Novales B,et al. Gelation of globular protein in presence of low methoxyl pectin:effect of Na+and/or Ca2+ions on rheology and microstructure of the systems[J]. Food Hydrocolloids,2005,19(3):549-556. [20]Sathe S K,Salunkhe D K. Functional Properties of the Great Northern Bean(PhaseolusvulgarisL.)Proteins:Emulsion,Foaming,Viscosity,and Gelation Properties[J]. Journal of Food Science,1981,46(1):71-81. [21]Pearce K N,Kinsella J E. Emulsifying properties of proteins:evaluation of a turbidimetric technique[J]. Journal of Agricultural & Food Chemistry,1978,26(3):716-723. [22]杭虞杰,李学英,杨宪时,等. 南极磷虾蛋白酶分离纯化及部分性质研究[J]. 食品与发酵工业,2011,37(10):92-95. [23]王琨. 南极磷虾胰蛋白酶的分离纯化及酶学性质研究[D]. 大连:大连理工大学,2013:20-26. [25]朱国平. 南极磷虾种群生物学研究进展Ⅰ-年龄、生长与死亡[J]. 水生生物学报,2011,35(5):862-868. [26]潘锦锋,沈彗星,宋永令,等. 鱼蛋白冷冻变性及其抗冻剂的研究综述[J]. 肉类研究,2009(6):9-15. [27]Sun L C,Chen Y L,Zhong C,et al. Autolysis of krill protein from North Pacific krill Euphausia pacifica,during protein recovery via isoelectric solubilization/precipitation[J]. Fisheries Science,2014,80(4):839-847. [28]王灵昭. 南极磷虾(Euphausiasuperba)蛋白质深加工新技术研究[D]. 青岛:中国海洋大学,2013. [29]Gigliotti J C,Davenport M P,Beamer S K,et al. Extraction and characterization of lipids from Antarctic krill(Euphausiasuperba)[M]. Food Chemistry,2011,125(3):1028-1036. [30]楼乔明,王玉明,刘小芳,等.南极磷虾脂肪酸组成及多不饱和脂肪酸质朴特征分析[J]. 中国水产科学,2011,18(2):929-935. [31]张莉莉. 高温(100~120 ℃)处理对鱼糜及其复合凝胶热稳定性的影响[D]. 青岛:中国海洋大学,2013. [32]Arntfield S D,Murray E D. The Influence of Processing Parameters on Food Protein Functionality I. Differential Scanning Calorimetry as an Indicator of Protein Denaturation[J]. Canadian Institute of Food Science & Technology Journal,1981,14(4):289-294. [33]张辉. 离子强度对大豆分离蛋白结构及表面疏水性的影响[J]. 食品工业科技,2016,37(8):145-149,154. [34]Osnes K K,Mohr V. On the purification and characterization of three anionic,serine-type peptide hydrolases from antarctic krill,EuphausiaSuperba[J]. Comparative Biochemistry & Physiology Part B Comparative Biochemistry,1985,82(4):607-619. PhysicochemicalpropertiesandprocessingcharacteristicsofAntarctickrill(Euphausiasuperba)muscle XUBei-bei1,HULing-ping1,JIANGXiao-ming1,YINLi-ang1,XUEYong1,XUEChang-hu1,*,YANGJun-ling2 (1.College of Food Science and Technology,Ocean University of China,Qingdao 266003,China; 2.Key Laboratory of Cryogenics,Technical Institute of Physics and Chemistry,Chinese Academy of Sciences,Beijing 100190,China) The physical and chemical properties of the muscle and the processing characteristics of the protein were studied with frozen Antarctic krill as raw material. Antarctic krill protein has a balanced amino acid composition and the total amount of essential amino acids reached 485.9 mg/g protein. The content of myofibrillar protein account for only about 20% of the frozen protein due to the degradation during the freezing period. The secondary structure of the protein was mainly composed ofα-helix and irregular curl,the bind of protein and lipid was closely distributed regularly. Studies on the processing properties(structural properties,solubility,emulsifying properties,foaming properties and so on)of the protein showed that Antarctic krill protein has higher emulsifying activity,lower foaming activity and better solubility in 0.6 mol/L salt solution,compared with soy isolate protein,frozen krill protein is lost gel performance compared with the ability of forming viscoelastic gel properties of shrimp. Endogenous protease have tryptase properties and possess the highest activity,at 45 ℃,pH8.0. Endogenous lipase belongs to low temperature enzyme,which has relatively high activity in the range of 5~50 ℃. The reference standard of frozen Antarctic krill as industrial raw materials has been established,namely TVB-N≤30 mg N/100 g,alkali-soluble protein≤5.00%,FFA≤5.00% lipid,LPC≤4.00% lipid. The study of this paper provides the basic data for the utilization of Antarctic krill protein,which is of theoretical and practical significance for the high value utilization of Antarctic krill. Antarctic krill;protein;processing characteristics;physicochemical properties;TVB-N;Folin-phenol 2017-03-29 徐蓓蓓(1992-),女,硕士研究生,研究方向:食品化学与营养支持,E-mail:xubeibei2017@163.com。 * 薛长湖(1964-),男,博士,教授,研究方向:水产品加工,E-mail:xuech@ouc.edu.cn。 山东省科技重大专项 海洋食品现代加工与产业链质量控制体系研究(2015ZDZX05003);国家自然科学基金 鱼肉蛋白/多糖复合凝胶过程及高温热稳定性机理与调控(31571865);“中国科学院低温工程学重点实验室”开放课题资助。 TS254.4 A 1002-0306(2017)21-0056-09 10.13386/j.issn1002-0306.2017.21.012





3 结论

