生防菌成团泛菌XM2抗菌蛋白抗真菌特性研究
张晓宇, 高振峰, 张宝俊, 王 亮, 赵迎丽, 张立新
(1.山西省农业科学院农产品贮藏保鲜研究所,山西 太原 030031; 2.山西农业大学农学院,山西 太谷 030801)
生防菌成团泛菌XM2抗菌蛋白抗真菌特性研究
张晓宇1, 高振峰2, 张宝俊2, 王 亮1, 赵迎丽1, 张立新1
(1.山西省农业科学院农产品贮藏保鲜研究所,山西 太原 030031; 2.山西农业大学农学院,山西 太谷 030801)
以成团泛菌XM2为研究对象,采用硫酸铵分级沉淀和生长速率法对其次级代谢产物中抗菌蛋白的最佳硫酸铵沉淀质量浓度和抗真菌特性进行了研究。结果表明,该抗菌蛋白最佳硫酸铵沉淀质量浓度为209.4 g·L-1;具有较好的抑菌广谱性,对梨黑斑病菌、辣椒疫病菌、西瓜枯萎病病菌以及辣椒枯萎病菌具有90%以上的抑菌活性;在温度低于80 ℃、pH值为4~9.5、紫外照射24 h以及蛋白酶K和胰蛋白酶处理后均可保持85%以上的抑菌活性。
成团泛菌XM2;抗菌蛋白;抗真菌特性
植物病害作为制约农业生产的主要因素之一,主要表现为阻碍农作物生长发育,降低农产品产量和品质,病害发生严重时导致农作物死亡甚至绝收,给农户造成巨大经济损失。化学农药在植物病害防治中发挥着重要作用,到目前为止,依然是农业生产中植物病害防治的主要手段,但是近年来由于人们对化学农药的不合理使用,导致负面问题层出不穷,如病原菌抗药性增强[1-4]、环境污染严重[5-6]、产生药害[7]、破坏生物多样性[8]以及残留超标[9-12]等。另外,随着人们环保意识以及农产品安全意识的不断增强,绿色、无污染农产品以及生态农业和农业可持续发展成为中国农业发展的新趋势。生物农药作为一类以天然产物或者生命体为有效成分的非化学合成农药,同化学农药相比具有选择性强,对人畜无害、易降解、低毒或无毒以及不易产生抗药性等特点[13-14],成为解决化学农药负面问题的重要途径和农药产业发展的新方向。生防细菌作为生物农药的开发源之一,同其他生防微生物相比具有存在广泛、群体庞大和繁殖迅速等特点,成为微生物源生物农药开发的1个热点。目前研究者已从不同来源分离并鉴定出多种具有抗植物病原真菌活性的生防细菌,主要包括芽孢杆菌属、假单胞菌属、沙雷氏菌属、伯克氏菌属和类芽孢杆菌属等,其中以芽孢杆菌属和假单胞菌属生防细菌研究最多。成团泛菌作为泛菌属的一类主要物种,常附生植物表面[15],在发现部分非致病性菌株具有有益特性之前,常被人们定性为致病细菌[16-18],在一定程度上限制了该类有益微生物的开发。近年来随着非致病性成团泛菌具有解磷[19]、固氮[20]、抗植物病害[21-23]、抗病毒病[24]、定殖能力强[25]、抗逆性好[26]、产氢[27]和低分子脂多糖丰富[28]等有益特性报道的出现,开始引起人们的广泛关注。虽然目前非致病性成团泛菌具有抗菌活性已有相关报道[21-23],但相对较少,特别是对非致病性成团泛菌可产生抗植物病原真菌蛋白的研究还未见相关报道。因此,本研究以项目组前期筛选出的生防细菌成团泛菌XM2抗菌活性物质(初步鉴定为蛋白)[29-30]为研究对象,重点对其抗菌蛋白的抗真菌特性进行研究,以提高人们对成团泛菌抗真菌特性的认识,为生物农药开发提供新的微生物开发源,为成团泛菌XM2后续抗菌蛋白生物农药及保鲜剂的开发奠定基础。
1 材料与方法
1.1供试菌株
拮抗细菌:成团泛菌XM2,采用体积分数为20%甘油于-80 ℃冷冻保藏。
病原指示菌:梨黑斑病菌(Alternariaalternate),由山西农科院农产品贮藏保鲜研究所采集,病理研究室分离保存;辣椒枯萎病菌(Fusariumoxysporumf. sp.vasinfectum)、番茄灰霉病菌(Botrytiscinerea)、番茄早疫病菌(Alternariasolani)、黄瓜枯萎病菌(Fusariumoxysporiumf. sp.cucumerinum)、西瓜枯萎病菌(Fusariumoxysporumf.sp.niveum)、小麦赤霉病菌 (Fusariumgraminearum)、辣椒疫病菌(Phytophthoracapsici)和茄子枯萎病菌(Fusariumoxysporumf. sp.schlecht)均由山西农业大学农药学实验室提供。
1.2供试培养基
NA培养基:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂20 g,pH值8.4,定容到1 000 mL。PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,pH值8.4,定容到1 000 mL。NB培养液:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,pH值8.4,定容到1 000 mL。
1.3XM2抗菌蛋白的提取
1.3.1 菌株活化及发酵培养 取-80 ℃保藏菌株XM2 10 μL,采用平板涂布法涂布于新鲜NA平板,置于26 ℃恒温培养24 h后,挑取单菌落用划线法转接至新鲜NA平板,并于26 ℃恒温培养24 h。菌株活化后,采用平板对峙法以梨黑斑病菌为病原指示菌进行活性验证。
确定菌株活性后,用接种环挑取1环菌种接种至装有300 mL NB发酵液的500 mL三角瓶中,26 ℃,180 r·min-1恒温震荡培养12 h后获得种子发酵液,并以1%的接种量接种至新鲜NB培养液中,继续发酵培养(发酵条件与种子发酵液制备相同)72 h后终止发酵。随后4 ℃,12 000 r·min-1离心10 min去除菌体,收集上清液,并经0.22 μm微孔滤膜过滤后获得无菌发酵液,用于抗菌蛋白的提取。
1.3.2 抗菌蛋白提取 采用硫酸铵分级盐析法对1.3.1中获得的无菌发酵液中的抗菌蛋白进行提取,流程如下:1)取1.3.1中制备好的无菌发酵液2 000 mL,冰浴条件下缓慢加入固体硫酸铵,并不断搅拌,使质量浓度达到104.7 g·L-1;2)待固体硫酸铵完全溶解后,4 ℃下静置过夜;3)取加入硫酸铵并过夜沉淀后的发酵液于4 ℃下、10 000 r·min-1离心10 min,收集沉淀和上清液;4)将3)中收集的沉淀用10 mL浓度为10 mmol·L-1、pH值为8.4 Tris-HCl缓冲液充分溶解后,装入透析袋,并于10 mmol·L-1、pH值为8.4 Tris-HCl缓冲液中进行透析除盐,除盐过程中每隔4 h更换1次透析液;5)蛋白溶液除盐结束后经真空冷冻干燥机进行冷冻干燥,制成粗蛋白干粉,并于-20 ℃冰箱保存备用;6)将3)中所收集的上清液中再次加入固体硫酸铵,并按照上述方法分别提取硫酸铵质量浓度为209.4、314.2、418.9、471.2 g·L-1时的粗蛋白。
1.4XM2抗菌蛋白抑菌活性测定
获得的各级沉淀蛋白干粉用无菌水配制成质量浓度为10 g·L-1的粗蛋白液后,采用生长速率法将粗蛋白液与PDA培养基按体积比1∶9在培养皿中充分混匀,制备含药平板,待混合液完全凝固后,将直径为5 mm的新鲜梨黑斑病菌菌饼接入平板中央,并置于28 ℃恒温培养,待对照长满培养皿时,采用十字交叉法测定处理组病斑菌块直径,并计算各处理的抑菌率,抑菌率最大的即为硫酸铵分级盐析提取蛋白的最适浓度。以等体积无菌水为对照,各处理及试验均重复3次。

1.5XM2抗菌蛋白抗真菌谱测定
用无菌水将XM2粗蛋白干粉配制成10 g·L-1的粗蛋白液,将粗蛋白液与PDA培养基按体积比1∶9在培养皿中充分混匀,待培养基平板冷却后,将直径为5 mm的辣椒枯萎病菌等8种病原真菌菌饼分别接入平板中央,对照为加入等体积无菌水的PDA平板。28 ℃恒温培养,待对照即将长满培养皿时,用十字交叉法测定处理组病斑直径,并计算各处理的抑菌率,计算方法同1.4。各处理及试验重复3次。
1.6XM2抗菌蛋白抗真菌稳定性测定
1.6.1 抗菌蛋白热稳定性[31]用无菌水将XM2粗蛋白干粉配制成10 g·L-1的粗蛋白液,将粗蛋白液分别在40、60、80、100 ℃水浴锅和121 ℃灭菌锅高温高压各处理30 min,冷却至室温后将不同热处理粗蛋白液分别与PDA培养基按体积比1∶9在培养皿中充分混匀,待培养基平板凝固后,将直径为5 mm的新鲜梨链格孢菌菌饼接入平板中央。以未加粗蛋白液(加入等量无菌水)的平板为对照1(CK1),以加入室温(20 ℃)粗蛋白液的平板为对照2(CK2)。28 ℃恒温培养,待对照1长满平板时,用十字交叉法处理平板菌落直径,计算各处理的抑菌率,各处理及试验重复3次。
1.6.2 抗菌蛋白酸碱稳定性[32]将XM2粗蛋白干粉用无菌水配制成10 g·L-1的粗蛋白液,用1 mol·L-1HCl和1 mol·L-1NaOH溶液调节粗蛋白液的pH值至4.0、5.5、7.0、9.5,4 ℃下放置24 h后调回原pH值(8.4)。以未加粗蛋白液(加入等量无菌水)的平板为对照1(CK1),以加入未调节pH粗蛋白液的平板为对照2(CK2)。测定方法同1.6.1,各处理及试验重复3次。
1.6.3 抗菌蛋白紫外稳定性 将XM2粗蛋白干粉用无菌水配制成10 g·L-1的粗蛋白液,将粗蛋白液在20 W紫外灯30 cm处分别照射8、16、24 h。以未加粗蛋白液(加入等量无菌水)的平板为对照1(CK1),以加入未经紫外灯照射粗蛋白液的平板为对照2(CK2)。测定方法同1.6.1,各处理及试验重复3次。
1.6.4 抗菌蛋白蛋白酶稳定性 将胰蛋白酶和蛋白酶K分别与XM2粗蛋白液混合,使蛋白酶终质量浓度为10 mg·L-1,分别在37 ℃水浴锅中加热1 h。以未加粗蛋白液(加入等量无菌水)的平板为对照1(CK1),以只加入粗蛋白液的平板为对照2(CK2)。测定方法同1.6.1,各处理及试验重复3次。
2 结果与分析
2.1XM2抗菌蛋白最佳硫酸铵沉淀质量浓度
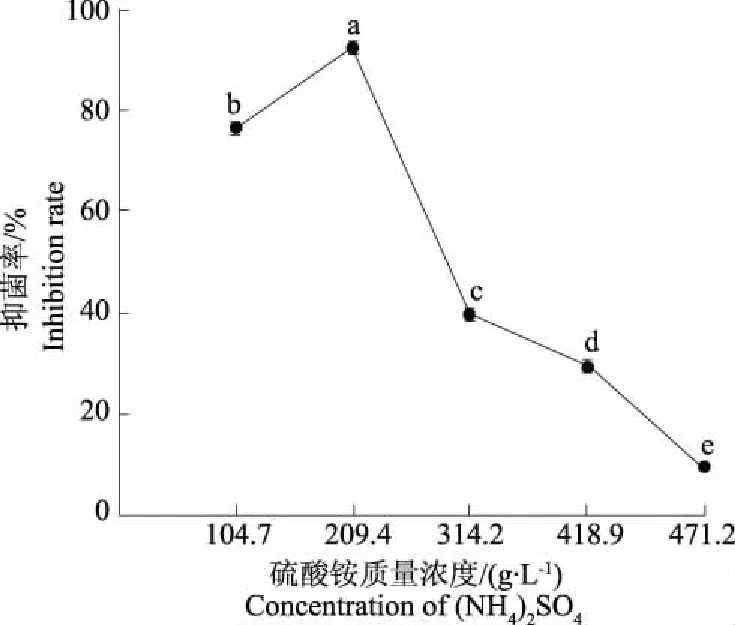
采用生长速率法,以梨黑斑病菌为病原指示菌对菌株XM2各级蛋白沉淀液抑菌活性进行检测后发现,不同硫酸铵质量浓度下获得的蛋白沉淀的抑菌活性存在明显差异(图1)。当硫酸铵质量浓度为209.4 g·L-1时,菌株XM2粗蛋白液的抑制率最大,达到92.54%;当硫酸铵质量浓度大于209.4 g·L-1时,虽然仍有蛋白沉淀但对梨链格孢菌的抑菌率明显降低,说明成团泛菌XM2次生代谢产物中的抗菌蛋白在硫酸铵沉淀质量浓度为209.4 g·L-1。
注:图中不同字母表示在P<0.05水平上差异显著。下同。
Note: Different lowercase letters in figure mean significant difference at 0.05 level. The same as below.
图1不同硫酸铵浓度下抗菌蛋白对梨黑斑病菌的抑菌活性的影响
Fig.1InhibitingactivityofantibioticproteinagainstA.alternateatdifferentconcentrationof(NH4)2SO4
2.2XM2抗菌蛋白抑菌广谱性
XM2抗菌粗蛋白液(10 g·L-1)对辣椒枯萎病菌等8种病原菌的抑菌效果表明,XM2粗蛋白液对8种病原菌均有一定的抑制作用(图2),其中对辣椒疫病菌、西瓜枯萎病菌、辣椒枯萎病菌、番茄早疫病菌和番茄灰霉病菌的抑制效果较好,抑菌率分别为91.76%、93.53%、90%、88.82%和86.47%;对茄子枯萎病菌抑菌效果次之,抑菌率为72.33%;对黄瓜枯萎病菌和小麦赤霉病菌的抑制率相对较差,但抑菌率仍保持在42.35%和50.3%。说明成团泛菌XM2抗菌蛋白具有较广的抑菌谱,除对链格孢属病原真菌具有较好抑菌活性外,还对部分尖孢镰刀菌和灰葡萄属病菌具有较好的抑菌活性,在生物农药开发中具有较好的应用前景。
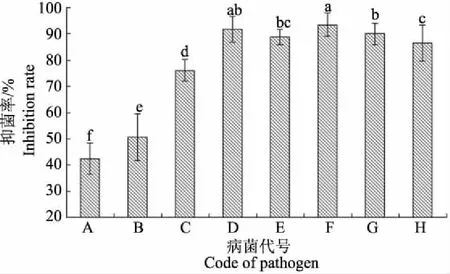
A:黄瓜枯萎病菌;B:小麦赤霉病菌;C:茄子枯萎病菌;D:辣椒疫病菌;E:番茄早疫病菌;F:西瓜枯萎病菌;G:辣椒枯萎病菌;H:番茄灰霉病菌。
A:Fusariumoxysporiumf. sp.Cucumerinum; B:Fusariumgraminearum; C:Fusarumoxysporumf. sp.Schlecht; D:Phytophthoracapsici; E:Alternariasolani; F:Fusariumoxysporumf.sp.niveum; G:Fusariumoxysporiumf. sp.Vasinfectum; H:Botrytiscinerea.
图2XM2抗菌蛋白的抑真菌谱
Fig.2TheantifungalspectrumoftheantifungalproteinfromthestrainXM2
2.3XM2抗菌蛋白抑菌稳定性
2.3.1 抗菌蛋白热稳定性 XM2抗菌粗蛋白液(10 g·L-1)经不同温度处理后,抑菌活性存在一定差异(表1)。当处理温度为40、60和80 ℃时,抗菌蛋白对梨链格孢菌的抑制率与对照2在P<0.05水平上差异不显著,但抑菌率仍保持在92.13%、92.41%和91.32%;当处理温度为100 ℃和121 ℃时,抗菌蛋白抑菌活性则完全丧失。说明菌株XM2抗菌蛋白具有一定热稳定性,在温度低于80 ℃时可保持较好的抑菌活性,为其田间应用效果保持奠定了基础。
2.3.2 抗菌蛋白酸碱稳定性 XM2抗菌粗蛋白液(10 g·L-1)经pH值为4、5.5、7和9.5不同酸碱处理后,抑菌率变化不大,仍保持在91.68%、92.56%、90.34%和88.45%(表1),说明菌株XM2抗菌蛋白抑菌活性稳定,具有较强的耐酸、碱能力。
2.3.3 抗菌蛋白紫外稳定性 XM2抗菌粗蛋白液(10 g·L-1)经紫外灯照射8、16和24 h后,抑菌率仍保持在89.43%、85.46%和86.75%,说明菌株XM2抗菌蛋白对紫外辐射不敏感,在田间自然光照射下可保持较好抑菌活性(表1)。
2.3.4 抗菌蛋白蛋白酶稳定性 XM2抗菌粗蛋白液(10 mg·L-1)经胰蛋白酶和蛋白酶K处理后,抑菌率仍保持在91.56%和90.78%(表1),说明菌株XM2抗菌蛋白对胰蛋白酶和蛋白酶K不敏感,且抗菌蛋白结构中无胰蛋白酶作用位点(赖氨酸或精氨酸的羧基所构成的肽链)和蛋白酶K作用位点(脂族氨基酸和芳香族氨基酸的羧基端肽键)存在。
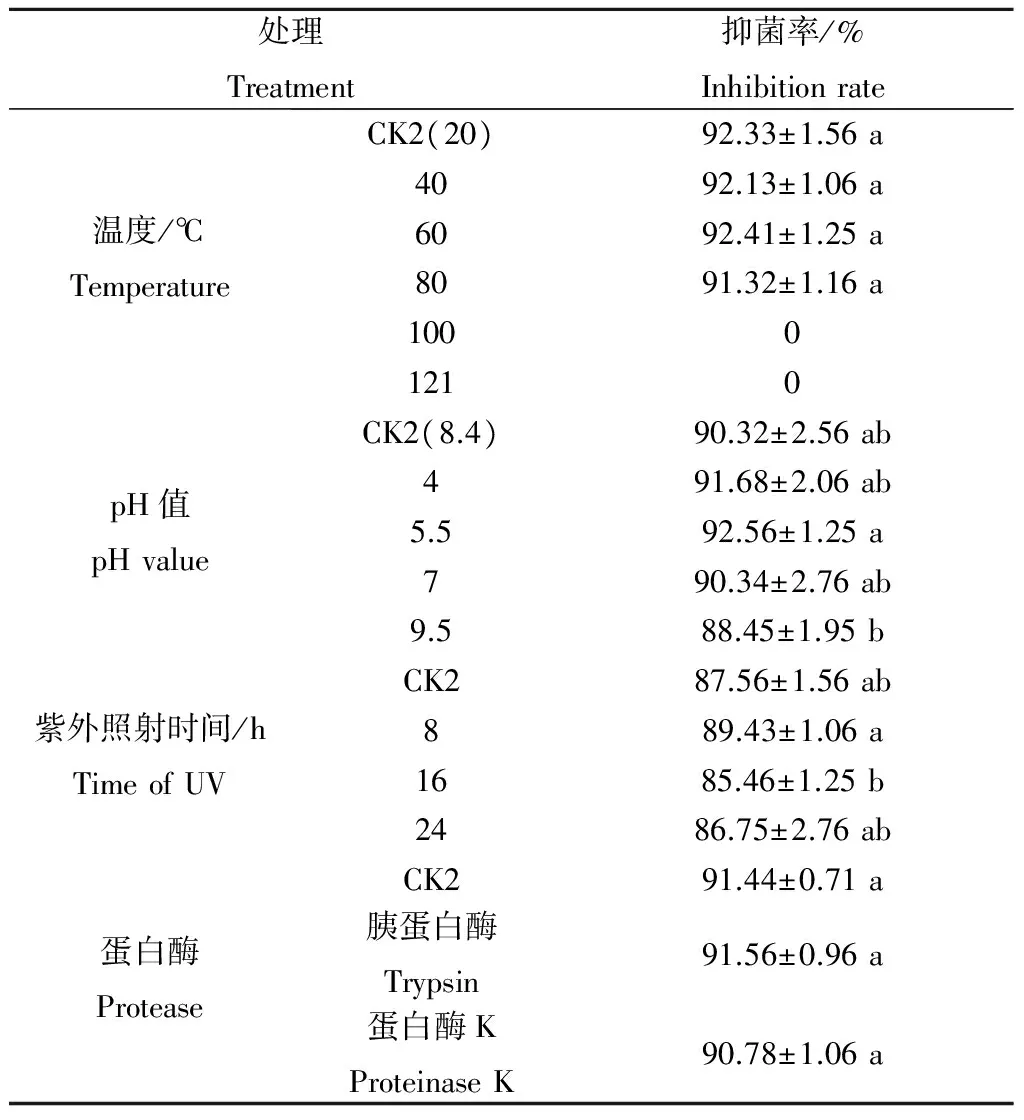
表1 不同处理下XM2抗菌蛋白对梨黑斑病菌的抑菌稳定性的影响Table 1 Antifungal stability of antibiotic protein fromXM2 against A. solani at different treatments
注:表中不同字母表示在P<0.05水平上差异显著。
Note: Different lowercase letters in table mean significant difference at 0.05 level.
3 结论与讨论
抗菌蛋白作为生防细菌产生的抗菌物质之一,目前已在多种生防细菌的代谢产物中被发现,虽然不同生防细菌产生的抗菌蛋白在稳定性及抗菌特性方面存在一定差异,但较好的酸碱稳定性、热稳定性以及紫外稳定性是该类抗菌蛋白的共性,这为其在生物农药开发以及田间应用方面奠定了基础。
前期的研究发现,成团泛菌XM2代谢产物具有较好的抑菌活性,并初步推断其为抗菌蛋白[29-30],因此本研究采用生防细菌抗菌蛋白常用沉淀法—硫酸铵沉淀对其抗菌蛋白进行了提取,并对其抗菌特性进行了较为系统的研究,结果发现,成团泛菌XM2代谢产物在不同硫酸质量浓度下均可出现蛋白沉淀,但抑菌效果差异显著,其中以硫酸铵质量浓度为209.4 g·L-1时蛋白沉淀抑菌活性最好,说明209.4 g·L-1为成团泛菌XM2胞外抗菌蛋白的最佳硫酸铵沉淀质量浓度,且采用硫酸铵分级沉淀可以去除一些成团泛菌XM2代谢产物中不具有抗菌活性的杂蛋白,可为该抗菌蛋白后期分离、纯化奠定基础。这一结果同其他生防细菌存在一定差异,如:解淀粉芽孢杆菌X-278[33]、枯草芽孢杆菌B25[34]和海洋假单胞菌GY-1[35],进一步说明不同类型生防细菌可能会产生不同性质的抗菌蛋白。在明确成团泛菌XM2提取方法后,以8种不同植物病原真菌为靶标,采用生长速率法对该抗菌蛋白的抑菌谱进行了测定,结果发现:该抗菌蛋白对辣椒疫病菌、番茄早疫病菌、西瓜枯萎病菌和辣椒枯萎病菌均具有较好的抑菌活性,抑菌率分别为91.76%、93.53%、92.67%和90%,研究结果不仅进一步证明了赵立平等[36]的研究结果(成团泛菌对链格孢病原真菌具有较好的抑菌活性),而且新发现成团泛菌XM2还对尖孢镰刀菌(西瓜枯萎病菌和辣椒枯萎病菌)具有较好的抑菌效果,说明成团泛菌XM2抗菌蛋白在植物病害防治中具有较好的应用潜力。另外,抗菌蛋白的稳定性对其后期的开发应用具有很大影响,因此为明确成团泛菌XM2抗菌蛋白的稳定性,本研究重点对其酸碱稳定性、热稳定性、紫外稳定性以及蛋白酶稳定性进行了测定,结果发现该抗菌蛋白在温度低于80 ℃、pH值4~9.5、紫外照射24 h以及蛋白酶K和胰蛋白酶处理后都具有较好的稳定性,该研究结果同其他研究人员的研究存在一定差异,如:解淀粉芽孢杆菌LP-5[37]、枯草芽孢杆菌B25[34]、枯草芽孢杆菌G87[38]以及海洋假单胞菌GY-1[35]等。造成差异的原因可能和生防菌的属、种以及生存环境差异有关。另外,从稳定性结果来看,成团泛菌XM2抗菌蛋白不仅具有其他属生防细菌抗菌蛋白类似的稳定性,而且其稳定性还优于部分其他生防细菌,说明其在生物农药研发方面同样具有一定的开发潜力。
虽然本研究重点对成团泛菌XM2次级代谢产物中抗菌蛋白的抗真菌特性进行了研究,提高了人们对成团泛菌XM2生防作用的认识,为成团泛菌XM2后续生物农药开发奠定了基础,但有关成团泛菌XM2抗菌蛋白的种类、最佳发酵条件、田间效果以及生物农药开发还需进一步研究。
[1] 甘林, 代玉立, 滕振勇, 等. 福建省玉米小斑病菌对丙环唑、烯唑醇和咪鲜胺的敏感性[J]. 农药学学报, 2016, 18(2): 194-200.
[2] 王智. 辽宁省不同地区番茄灰霉病菌抗药性研究[D]. 沈阳: 沈阳农业大学, 2016.
[3] 钱恒伟, 迟梦宇, 黄金光. 小麦赤霉病病菌抗药性研究进展[J]. 中国植保导刊, 2016, 36(4): 19-25.
[4] 梁延坡, 谢圣华, 符尚娇, 等. 海南地区小菜蛾对氯虫苯甲酰胺和乙基多杀菌素的抗药性变化趋势[J]. 应用昆虫学报, 2016, 53(2): 273-278.
[5] 卜元卿, 孔源, 智勇, 等. 化学农药对环境的污染及其防控对策建议[J]. 中国农业科技导报, 2014, 16(2): 19-25.
[6] 张小平. 化学农药对农业生态环境的污染及防治[J]. 生态经济, 2003(10): 166-168.
[7] 刘宇. 化学制剂危害对水稻生长发育的影响[D]. 沈阳: 沈阳农业大学, 2016.
[8] 李晓强, 孙跃先, 叶光祎, 等. 使用化学农药对农业生物多样性的影响[J]. 云南大学学报(自然科学版), 2008, 30(S2): 365-369.
[9] 刘永明, 葛娜, 崔宗岩, 等. 2012—2014年青岛、深圳、大连三口岸282份进口水果和蔬菜中农药残留监测[J]. 中国食品卫生杂志, 2016, 28(4): 511-515.
[10] 麻耀君. 山西省芹菜农药残留情况检测与分析[J]. 山西农业科学, 2016, 44(8): 1181-1183.
[11] 高云华, 周波, 李欢欢, 等. 衡东县近十年蔬菜农药残留变化规律分析及控制对策[J]. 南方农业学报, 2016, 47(7): 1135-1139.
[12] 张静静. 吉林省主要城市城郊土壤—蔬菜系统中有机氯农药残留及风险研究[D]. 长春:中国科学院研究生院(东北地理与农业生态研究所), 2016.
[13] 纪明山, 谷祖敏, 张杨. 生物农药研究与应用现状及发展前景[J]. 沈阳农业大学学报, 2006, 37(4): 545-550.
[14] 邱德文. 生物农药与生物防治发展战略浅谈[J]. 中国农业科技导报, 2011, 13(5): 88-92.
[15] 王静. 成团泛菌甘露聚糖酶的体外定向进化[D]. 武汉: 华中农业大学, 2013.
[16] 曹慧英, 张力群, 朱振东, 等. 成团泛菌对玉米自交系PS056致病性基因yhfK的克隆[J]. 中国农业科学, 2011, 44(2): 299-306.
[17] 刘雅琴, 杨丽, 李国英, 等. 成团泛菌引起的棉花烂铃病对棉花产量因子和品质的影响[J]. 植物保护, 2008, 34(5): 103-106.
[18] 曹慧英, 李洪杰, 朱振东, 等. 玉米细菌干茎腐病菌成团泛菌的种子传播[J]. 植物保护学报, 2011, 38(1): 31-36.
[19] 陈倩, 刘善江, 白杨, 等. 山西矿区复垦土壤中解磷细菌的筛选及鉴定[J]. 植物营养与肥料学报, 2014, 20(6): 1505-1516.
[20] 李星洪, 李大捷, 李薇, 等. 对从甘蔗根部分离的固氮成团泛菌的研究[J]. 北京大学学报(自然科学版), 1998, 34(6): 35-39.
[21] 张飞官, 高雅慧, 任慧爽, 等. 桑疫病病原拮抗菌的分离、鉴定及发酵条件优化[J].微生物学报, 2013, 53(12): 1285-1294.
[22] 黎起秦, 焦成, 农倩, 等. 广西水稻内生细菌的动态分布及其对水稻纹枯病菌的拮抗作用[J]. 中国生物防治, 2010, 26(3):312-319.
[23] NUNES C, USALL J, TEIXIDN, et al. Post-harvest biological control byPantoeaagglomerans(CPA-2) on golden delicious apples [J]. J.Appl.Microbiol., 2002, 92:247-255.
[24] 柯红娇, 王勇, 卫甜, 等. 成团泛菌 Ljb-2 对番茄黄化曲叶病毒病的田间防效初步研究[J]. 园艺学报, 2014,41(5): 985-993.
[25] 冯永君. 水稻内生优势成团泛菌YS19对宿主侵染和定殖机制的研究[D]. 北京: 中国农业科学院, 2001.
[26] 张巍波, 缪煜轩, 冯永君. 成团泛菌YS19 symplasmata结构对菌体抵抗逆境的作用[J]. 微生物学杂志, 2009, 29(1): 12-17.
[27] 刘洪艳, 朱大玲, 王文磊. 一株耐酸产氢突变株Pantoeaagglomerans的筛选与产氢特性[J]. 中国环境科学, 2012, 32(1): 125-129.
[28] 冷静, 叶峻, 黎肇炎, 等. 成团泛菌低分子脂多糖的分离纯化和鉴定[J]. 广西医科大学学报, 2003, 20(6): 840-842.
[29] 张晓宇, 张永杰, 张则君, 等. 拮抗细菌XM2的鉴定及其对梨采后黑斑病的生防作用[J]. 微生物学报, 2014, 54(6): 648-655.
[30] 张晓宇. 黄金梨采后病害生防菌的分离筛选及抗菌蛋白研究[D]. 太谷: 山西农业大学, 2014.
[31] 纪兆林, 唐丽娟, 张清霞, 等. 地衣芽孢杆菌W10抗菌蛋白的分离纯化及其理化性质研究[J]. 植物病理学报, 2007, 37(3): 260-264.
[32] 王雅平, 刘伊强, 潘乃穟, 等. 抗菌蛋白产生菌 TG26的筛选及其培养条件[J]. 植物学报, 1993, 35(3): 222-228.
[33] 黎波, 魏学军, 李亚宁, 等. 解淀粉芽孢杆菌X278菌株抗菌蛋白初步分析[J].河南农业科学, 2013, 42(7): 68-71, 83.
[34] 于杰, 张荣意, 谭志琼, 等. 枯草芽孢杆菌B25抗真菌作用及抗菌蛋白的分离纯化[J]. 基因组学与应用生物学, 2016, 35(3): 629-634.
[35] 王淑芳, 暴增海, 马桂珍, 等. 海洋假单胞菌GY-1菌株的抗菌作用及其胞外抗菌蛋白的分离纯化[J]. 食品科学, 2012, 33(21): 221-225.
[36] 赵立平, 申泉, 李艳琴, 等. 产harpin的成团泛菌工程菌的构建[J]. 植物病理学报, 1999, 29(2): 142-146.
[37] 张宝俊, 张家榕, 韩巨才, 等. 内生解淀粉芽孢杆菌LP-5抗菌蛋白的分离纯化及特性[J]. 植物保护学报, 2010, 37(2): 143-147.
[38] 陈夕军, 李娟, 孙启利, 等. 水稻内生枯草芽孢杆菌G87抗菌蛋白的分离纯化及理化特性[J]. 微生物学报, 2010, 50(10): 1353-1357.
(责任编辑:朱秀英)
StudyonantifungalactivityofantifungalproteinofbacteriumbiocontrolstrainPantoeaagglomeransXM2
ZHANG Xiaoyu1, GAO Zhenfeng2, ZHANG Baojun2, WANG Liang1, ZHAO Yingli1, ZHANG Lixin1
(1.Farm Product Storage and Freshening Institute, Shanxi Academy of Agricultural Sciences, Taiyuan 030031, China; 2.College of Agronomy, Shanxi Agricultural University, Taigu 030801, China)
In this study, ammonium sulfate precipitation and growth rate method were used to study the optimal ammonium sulfate concentration and antifungal activity of antifungal protein ofPantoeaagglomeransXM2. The results showed that the optimal ammonium sulfate concentration was 209.4 g·L-1. In addition, the protein not only had a good antifungal broad spectrum, but also showed significant antifungal activity againstAlternariaalternate,Phytophthoracapsici,Fusariumoxysporumf.sp.niveumandFusariumoxysporiumf. sp.Vasinfectum, and the inhibition rate was above 90%. Besides, the inhibition rate of antifungal protein could still maintain the level of more than 85% at below 80 °C, pH 4~9.5, UV irradiation 24 h, Trypsin and Proteinase K.
PantoeaagglomeransXM2; antifungal protein; antifungal activity
2017-02-20
山西省农业科学院博士研究基金项目(YBSJJ1505);山西省科技基础条件平台项目(201605D121024);山西农业大学科技创新项目(2014YZ2-7);山西省农业科学院特色农业技术攻关项目(YGG17002);山西省重点研发计划(一般)项目(201703D221026-1)
张晓宇(1979-),女,山西原平人,副研究员,博士,从事果蔬采后生理、病理及病害生物防治方面的研究。
张宝俊(1979-),男,山西新绛人,副教授,博士。
1000-2340(2017)05-0693-06
S 432.4+4
A

