麦长管蚜重要基因的RNA干扰
白福强, 谢 纳, 夏 晴, 董振杰, 麦艳娜, 刘文轩
(河南农业大学生命科学学院,河南 郑州450002)
麦长管蚜重要基因的RNA干扰
白福强, 谢 纳, 夏 晴, 董振杰, 麦艳娜, 刘文轩
(河南农业大学生命科学学院,河南 郑州450002)
选用12个蚜虫生长发育的关键基因,利用喂食的方法将其双链RNA(dsRNA)引入麦长管蚜体内,以死亡率为评价指标,对基因RNA干扰(RNAi)沉默效应进行分析。结果表明,水通道蛋白基因(Wsa)、ATP合酶基因(vAd1-78)的RNA干涉能够显著提高蚜虫死亡率,而葡萄糖脱氢酶编码基因(GlD-17)的RNA干涉则使蚜虫死亡率明显降低。基因表达荧光定量PCR分析结果显示,喂食dsRNA后5 d内,水通道蛋白基因(Wsa)和ATP合酶基因(vAd1-78)表达水平分别下降了74.8%和44.6%;而葡萄糖脱氢酶编码基因(GlD-17)表达水平则上调了209.0%,基因表达水平变化规律与蚜虫死亡率变化趋势一致。在所有供试基因中,水通道蛋白基因(Wsa)的RNA干涉沉默效应效果最突出,导致蚜虫死亡率提高到37.5%,基因表达量下调74.8%,可以作为利用RNAi技术培育抗蚜虫小麦新品种有效的靶基因。
麦长管蚜;RNA干扰(RNAi);dsRNA饲喂;基因沉默效应
麦蚜属同翅目(Homoptera)蚜科(Aphidoidea)昆虫,是影响小麦高产稳产的最重要虫害之一[1]。在中国危害小麦的蚜虫主要有麦长管蚜Sitobionavenae、麦二叉蚜Schizaphisgraminum、黍缢管蚜Rhopalosiphumpadi和无网长管蚜Metopolophiumdirhodum[2],其中以麦长管蚜和麦二叉蚜发生数量最多,危害最重。小麦整个生育期都会受到麦蚜的危害,麦蚜主要集中在受害株叶片和穗部并刺吸韧皮部汁液,导致受害株生长缓慢,分蘖减少,千粒重下降[3]。此外,麦蚜还是小麦黄矮病毒等麦类病毒的传播媒介,使小麦叶片黄化、植株矮化,严重影响小麦产量和品质[4]。因此,控制蚜虫的数量、减少蚜虫危害对小麦产量的提高与稳定具有重要意义。目前,生产上主要通过杀虫剂和种植抗蚜小麦优良品种控制蚜虫危害。杀虫剂的大量使用不仅污染环境,还对生物多样性产生威胁[5]。因此,培育和利用抗蚜小麦新品种是目前防治蚜虫危害的首选途径[6]。目前,全世界只有11个正式定名的抗小麦蚜虫基因,由于缺乏有效抗源以及杂交后代蚜虫抗性鉴定与选择难度大等不利因素,抗蚜虫小麦育种一直没有突破性进展。近年来,一种基于RNA干涉的新技术——寄主诱导的基因沉默(Host-Induced Gene Silencing,HIGS)技术,为培育植物抗病虫害新品种开辟了新途径[7]。RNA干涉(RNA interference,RNAi)是一种由双链RNA(double-strand RNA,dsRNA)介导的由特定Dicer酶参与的特异干扰靶基因mRNA表达的技术,通过向受体引入与靶基因序列同源的dsRNA,能够诱导受体靶基因的mRNA特异性降解,使目标基因表现出转录后沉默现象[8]。RNA干扰技术具有基因沉默效应高、特异性强、快速且经济的特点,并且能够根据基因家族保守同源区段设计dsRNA,同时对多个基因进行转录后沉默。目前,向生物体导入dsRNA的主要有浸泡,喂食,注射等方法。HIGS技术可以在转基因宿主植物中产生病原物特异基因的dsRNA,dsRNA进入感染转基因植物的病原菌体内,通过RNAi沉默病原菌内源性基因的表达,从而达到防止或减轻病虫害危害的目的。HIGS技术可以打破病虫害抗源单一匮乏的限制,在防治植物病虫害方面有巨大的应用潜力[9-10]。HIGS技术的成功取决于RNAi靶基因(病原菌内源性基因)的正确选择。因此,对病原物致病基因或生长发育关键基因的研究对利用HIGS技术防治病虫害具有十分重要的意义。本研究选用12个蚜虫生长发育的关键基因,利用喂食方法将其dsRNA引入麦长管蚜体内,以死亡率为评价指标,利用RNAi技术从中筛选转录后沉默对麦长管蚜生长影响最大的基因,为进一步利用HIGS技术培育抗蚜小麦新品种提供有效的RNAi靶基因。
1 材料与方法
1.1材料与试剂
麦长管蚜由河南省农业科学院植物保护研究所提供。在中国春(Chinese Spring)小麦品种幼苗上连续饲养,饲养条件为温度23~26℃,相对湿度30%~50%,光周期16h∶8h(L∶D)。RNA提取、cDNA合成、dsRNA合成试剂盒和质粒提取试剂盒购自Thermo公司;内切酶及T7 体外转录试剂盒购自 NEB 公司;荧光定量试剂盒购自Promega公司;各种氨基酸、维生素购自上海生工;其他试剂均为国产分析纯。
1.2引物设计与同源克隆
从NCBI数据库中寻找麦长管蚜及其他蚜虫(桃蚜、棉蚜、豆蚜等)与生长发育密切相关的mRNA序列,用Primer-BLAST设计引物,引物长度为18~20 bp,PCR扩增产物长度范围为400~600 bp,每个引物的5’端加T7序列:5’-TAATACGACTCACTATAGGG-3’。
1.3dsRNA的合成与纯化
提取麦长管蚜总RNA合成cDNA,用带有T7序列的引物通过PCR合成目标基因dsRNA的模板。按照T7体外转录试剂盒HiScribe T7 In Vitro Transcription Kit说明书准备反应体系,37 ℃孵育2~4 h。转录产物加核酸酶消化以除去DNA 和单链RNA (ssRNA),并用 MinElute PCR Cleaning Kit 纯化反应产物,操作过程参考试剂盒说明书。将纯化的dsRNA加DEPC处理水稀释10 倍,用仪器Nano-Drop2000测定dsRNA浓度,-20 ℃储存。
1.4dsRNA饲喂麦长管蚜
在全纯饲料[11]的基础上添加dsRNA使其终质量浓度为10 mg·L-1。共选用了12个候选基因进行RNAi沉默效应研究。蚜虫饲养采用24孔细胞培养板,每孔接入8头4龄麦长管蚜,饥饿处理5 h后用双层石蜡膜夹饲料饲喂,每孔加入80 μL添加dsRNA的饲料,每2 d 更换饲料,直至第9天。统计蚜虫死亡情况,新产若蚜不计入统计,并清理若蚜,蜕皮及死蚜。以不含dsRNA的全纯饲料为对照,每处理重复4次。以麦长管蚜相对死亡率作为基因沉默效应的评价指标。相对死亡率=处理死亡率-对照死亡率。
1.5实时荧光定量检测
利用实时荧光定量PCR技术(qRT-PCR)检测RNAi沉默靶基因的效应。以纯饲料组以及GFP(绿色荧光蛋白)为对照,选取死亡率比对照差异显著的1号(水通道蛋白基因Wsa)、52号(ATP合酶基因vAd1-78)和24号(葡萄糖脱氢酶基因GlD-17),死亡率不显著的50号(染色体驱动蛋白基因KIF4-66)进行定量PCR检测。RNAi处理取样时间分别为喂食dsRNA后0、1、2、3、4、5 d。饲喂方式同前,dsRNA质量浓度均为10 mg·L-1。对照组以actin为内参基因。结果分析采用2-△△Ct法。荧光定量引物如表1。
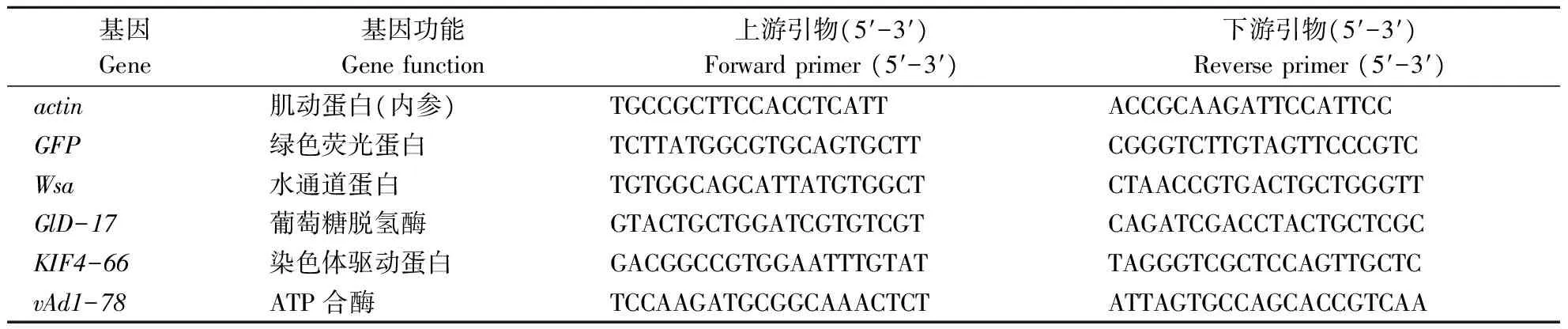
表1 荧光定量的引物Table 1 Primers sequences used for qRT-PCR
2 结果与分析
2.112种候选基因RNAi对麦长管蚜相对死亡率的影响
12种候选基因及其RNAi引起的蚜虫相对死亡率见表2。
从表2可以看出,编码水通道蛋白的基因Wsa经RNA干涉后麦长管蚜相对死亡率最高,达37.5%,与对照差异达到显著水平。其次是ATP合酶基因vAd1-78,相对死亡率达24.25%,与对照差异显著。葡萄糖脱氢酶基因GlD-17经RNA干涉后,蚜虫相对死亡率则明显低于对照。用其他基因的dsRNA饲喂后,麦长管蚜的相对死亡率与对照则没有明显差异。
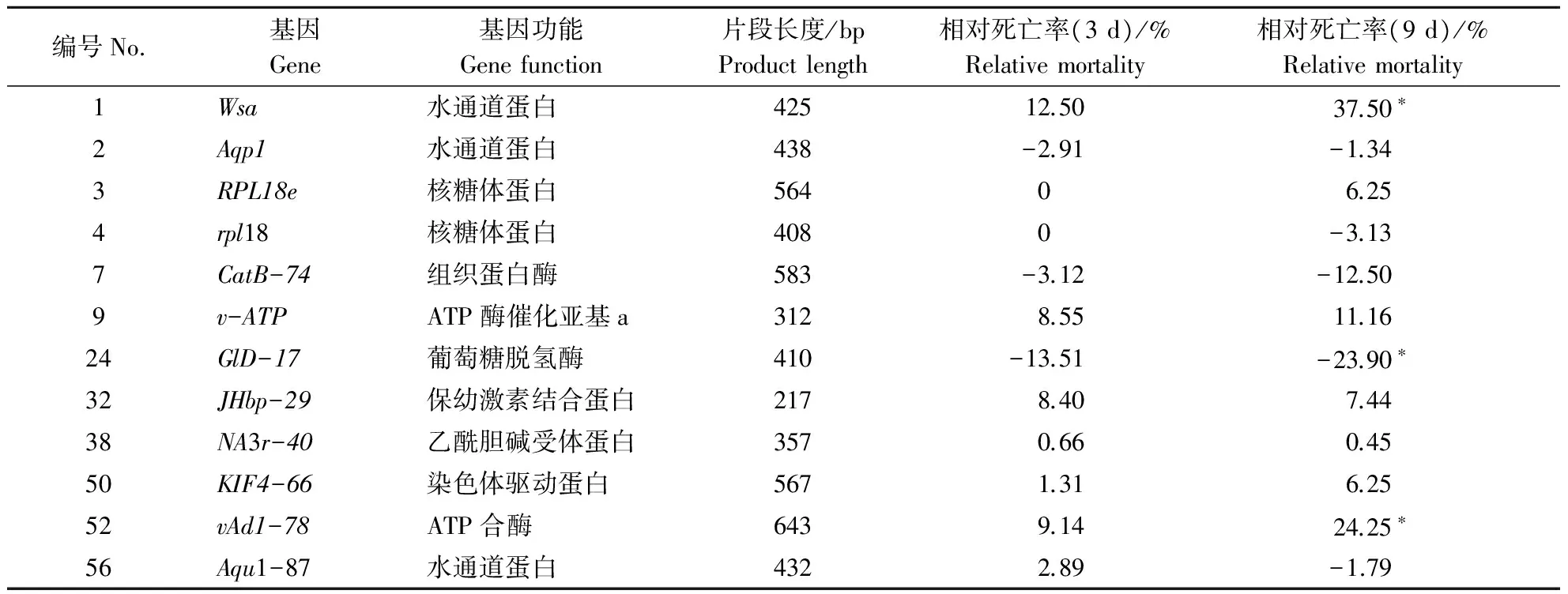
表2 纯饲料添加dsRNA饲喂沉默的候选基因Table 2 Candidate genes and RNAi affection by artificial diet delivery of dsRNA in Sitobion avenae
注:*:经最小显著差数法(LSD)测验,与对照差异达到5%显著水平。
Note: *:The LSD test showed a significant difference of 5% with the control.
此外,本研究所用Wsa,Aqp1和Aqu1-87基因都属于水通道蛋白的编码基因,但基因的沉默效应有明显不同。其中,喂食Wsa基因的dsRNA 5~9 d后,引起的蚜虫相对死亡率达到37.5%~43.75%,远远大于Aqp1和Aqu1-87基因(图1)。
2.2荧光定量检测
挑选相对死亡率与对照有显著性差异的水通
道蛋白基因Wsa,ATP合酶基因vAd1-78、葡萄糖脱氢酶基因GlD-17以及沉默效应不显著的染色体驱动蛋白基因KIF4-66,检测麦长管蚜经dsRNA饲喂后基因表达水平的变化情况。检测片段长度均小于150 bp,选取actin作为内参基因。荧光定量检测结果见图2。
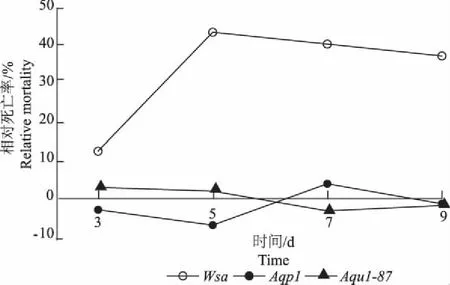
图1 不同水通道蛋白编码基因沉默对蚜虫的影响Fig.1 The relative mortality of the aphids after feedingon artificial diet added with dsRNA of differentaquaporins coded genes
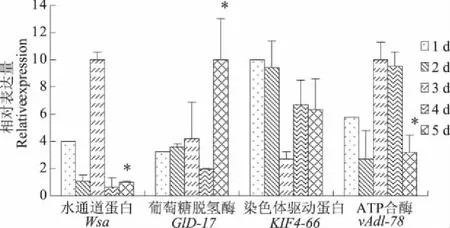
注:纯饲料中dsRNA的质量浓度为10 mg·L-1,实时荧光定量PCR检测的模板为存活蚜虫总RNA,4种基因dsRNA持续饲喂时间为5 d(*为t检验,n=3,P<0.05)。
Note: The dsRNAs were supplied to the artificial diet at concentration of 10 mg·L-1. qRT-PCRs were performed using the total RNA from the survived instars. The relative expression levels of 4 genes were monitored at indicated time point in a 5 d period. (*Student’st-test,n=3,P<0.05).
图2dsRNA饲喂后4种麦长管蚜基因的相对表达水平
Fig.2Therelativeexpressionlevelsof4RNAitargetgenesafterfeedingonartificialdietcontainingdsRNAs
如图2所示,在经过质量浓度为10 mg·L-1dsRNA添加饲料饲喂后,水通道蛋白基因Wsa第2 天的表达水平与第1 天相比被抑制了73%,但第3 天基因表达水平急剧升高,比第1 天的表达水平高出2.5倍。喂食第4 天和第5 天基因表达水平又被显著抑制。
ATP合酶基因vAd1-78经dsRNA喂食后蚜虫死亡率明显高于对照。dsRNA喂食后其基因的表达水平在第2天下降,但到第3天和第4天时均高于第1天,到第5天又急剧下降。
染色体驱动蛋白基因KIF4-66 RNA干涉后蚜虫相对死亡率有所提高,但未达到差异显著水平(表2)。dsRNA喂食后该基因的表达量虽然均比第1 天有所下降,但一直保持了较高的表达水平。
与上述3个基因不同,喂食葡萄糖脱氢酶基因GlD-17的dsRNA后,葡萄糖脱氢酶基因表达量总体呈上升趋势。前3 d的表达水平都略有增加,第4 天相对于第1 天的基因表达量则下降了39%,而第5 天基因表达量又急剧攀升,达到第1 天表达量的3倍。经葡萄糖脱氢酶基因dsRNA饲喂后,第3天和第9天蚜虫相对死亡率比对照下降了13.51%和23.9%,蚜虫相对死亡率变化趋势与基因表达量总体有所提高的趋势相吻合。
3 结论与讨论
本研究通过NCBI数据库搜寻,选用了12个小麦蚜虫或其他蚜虫生长发育关键基因,利用dsRNA喂食方法,以蚜虫相对死亡率为指标,对基因的沉默效应进行了分析。结果表明,水通道蛋白基因Wsa,ATP合酶基因vAd1-78的RNA干涉可明显导致蚜虫相对死亡率升高。其中以水通道蛋白基因Wsa的RNA干涉效应最为明显,相对死亡率可达到37.5%。水通道蛋白基因Wsa第3天基因表达水平的升高,可能是麦长管蚜吸食dsRNA初期体内产生了应激反应,加大了体内水通道蛋白基因的转录。水通道蛋白是生物膜上的水通道开关,利用RNAi技术沉默该基因会关闭膜上的水通道开关,引起蚜虫生理缺水而死亡。本结果与SHAKESBY等[12]在非洲爪蟾卵母细胞中进行水通道蛋白RNAi研究结果相符合。本研究为下一步利用HIGS技术培育抗蚜虫小麦新品种奠定了基础。
本研究发现,喂食葡萄糖脱氢酶基因GlD-17的dsRNA反而会诱发该基因的表达水平上调,蚜虫相对死亡率降低,其促进蚜虫生长的原因尚待进一步深入研究。ZHANG等[13]的研究也发现,蚜虫表皮蛋白基因CPG12在dsRNA饲喂后基因表达上调。RNAi引起基因表达水平上调有可能与设计dsRNA所选取靶基因序列区段有关,也可能是进入蚜虫体内的dsRNA浓度过低,反而诱发了目标基因表达水平的上升所致,但确切原因还需继续深入研究。
[1] 武予清, 李素娟, 刘爱芝, 等. 小麦抗蚜育种研究进展[J]. 河南农业科学, 2002(2): 19-20.
[2] 周海波, 程登发, 陈巨莲. 小麦蚜虫田间调查及监测技术[J]. 应用昆虫学报, 2014, 51(3): 853-858.
[3] 王美芳, 雷振生, 张学斌, 等. 黄淮冬麦区小麦品种(系)品质遗传组成及其效应分析[J]. 河南农业科学, 2010(10): 8-13.
[4] 郑爱泉, 张宝林. 小麦抗麦蚜基因工程的研究进展[J]. 贵州农业科学, 2015, 43(9): 11-14.
[5] 徐滔明, 孙书娥, 谭新球, 等. RNA干扰技术在防治农业害虫中的应用研究进展[J]. 湖南农业科学, 2014(7): 45-48.
[6] 朱麟, 杨振德, 赵博光, 等. 植食性昆虫诱导的植物抗性最新研究进展[J]. 林业科学, 2005(1): 165-173.
[7] 张河山, 胡亚亚, 张娜, 等. 寄主诱导的基因沉默(HIGS)技术研究进展[J]. 农业生物技术学报, 2013, 21(5): 604-611.
[8] FIRE A, XU S Q, MONTGOMERY M K, et al. Potent and specific genetic interference by double-stranded RNA inCaenorhabditiselegans[J]. Nature, 1998, 391: 806-811.
[9] MAO Y B, CAI W J, WANG J W, et al. Silencing a cotton bollwormP450 monooxygenase gene by plant-mediated RNAi impairs larval tolerance ofgossypol[J]. Nature Biotechnology, 2007, 25(11): 1307-1313.
[10] LI J, TODD T C, OAKLEY T R, et al. Host-derived suppression of nematode reproductive and fitness genes decreases fecundity ofHeteroderaglycinesichinohe[J]. Planta, 2010, 232(3): 775-785.
[11] 陈巨莲. 小麦抗蚜生化机理和G蛋白在离体昆虫细胞中表达、纯化及活性测定[D].北京: 中国农业科学院. 2001.
[12] SHAKESBY A J, WALLACE I S, ISAACS H V, et al. A water-specific aquaporin involved in aphid osmoregulation [J]. Insect Biochemistry and Molecular Biology, 2009, 39(1): 1-10.
[13] ZHANG M, ZHOU Y, WANG H, et al. Identifying potential RNAi targets in grain aphid (SitobionavenaeF.) based on transcriptome profiling of its alimentary canal after feeding on wheat plants [J]. BMC Genomics, 2013, 14(1): 560-569.
(责任编辑:蒋国良)
RNAinterferenceofimportantgenesinSitobionavenae
BAI Fuqiang, XIE Na, XIA Qing, DONG Zhenjie, MAI Yanna, LIU Wenxuan
(College of Life Sciences,Henan Agricultural University, Zhenzhou 450002, China)
In this study RNA interference (RNAi) technology was applied to analyze the effect of RNAi silencing of tweleve important genes of wheat aphids by feeding aphids with double stranded RNA (dsRNA) of the target genes. The results showed that the mortality of wheat aphids significantly increased after RNAi silencing of water channel protein gene (Wsa) and ATP synthase gene (vAd1-78); whereas glucose dehydrogenase encoding gene (GlD-17) RNAi led to a significantly reduced mortality. Quantitative analysis of gene expression level during 5 days after RNAi showed that the expression level of geneWsaandvAd1-78 was decreased by 74.8% and 44.6%, respectively. Whereas the expression level of geneGlD-17 was increased by up to 209%. Variance on mortality of wheat aphids was in accordance with gene expression level changes after gene silencing by RNAi. Among the twelve targeted genes, RNA interference ofWsaled to most significant gene silence effect, increasing mortality to 37.5% and down-regulating gene expression level to 74.8%. Thus water channel protein gene (Wsa) could be used as a candidate targeted gene of RNA interference for further development of wheat varieties of aphids resistance.
Sitobionavenae; RNA interference (RNAi); double stranded RNA feeding; gene silencing effect
2017-02-10
国家自然科学基金项目(31571658);河南省重大科技专项(161100110400);省部共建小麦玉米作物学国家重点实验室开放课题基金项目(39990022)
白福强(1990-),男,河南辉县人,硕士研究生,从事植物遗传学方面的研究。
刘文轩(1964-),男,河南巩义人,教授,硕士生导师。
1000-2340(2017)05-0657-05
S435.1
A

