构建韧带组织工程脱细胞支架的可行性研究
王倩 王帅 徐仲阳 李咸周 邢宝华
(山东省济宁市第一人民医院骨科,山东济宁 272011)
构建韧带组织工程脱细胞支架的可行性研究
王倩 王帅 徐仲阳 李咸周 邢宝华*
(山东省济宁市第一人民医院骨科,山东济宁 272011)
背景:十二烷基磺酸钠脱细胞在脱细胞的同时对支架结构存在一定的损伤,降低了支架的生物学性能;胰酶等脱细胞方法较为温和,虽最大程度保留支架结构与生物学性能,但脱细胞效果并不彻底。目的:制备并分析脱细胞牛肌腱作为组织工程韧带支架的可行性。方法:取新鲜小牛跟腱,通过物理法去除肌腱表面腱膜、滑膜及软组织,制备50个跟腱,随机分为两组,均行冻干处理。实验组以Triton X-100行脱细胞处理,对照组不予脱细胞处理。两组均以PBS冲洗后室温干燥备用。行组织学、DNA含量、细胞增殖、生物力学(最大应力、弹性模量以及刚度)检测,比较两组的差异。结果:对照组和实验组的DNA残留量分别为(0.34±0.15)μg/mg和(0.7±0.03)μg/mg,实验组显著低于对照组,差异有统计学意义(p<0.05)。实验组与对照组支架DNA含量对比显示,支架脱细胞效果彻底,无显著的免疫原性。两组在组织形态结构上无明显差异。细胞增殖显示脱细胞支架对细胞增殖无明显影响。实验组的最大应力小于对照组,弹性模量无统计学差异,刚度试验显示两组无明显差异。结论:脱细胞支架在保留天然支架生物学性能的基础上可作为组织工程支架的选择。
组织工程韧带;免疫原性;组织相容性;脱细胞;肌腱
脱细胞技术能保留韧带良好的生物力学特性,仿生三维结构,使得宿主对异体、异种韧带支架的免疫排斥显著降低[1,2]。脱细胞支架实质是细胞分泌的产物,组织或器官在其基础上形成。理想的脱细胞支架制备方法应既能有效去除组织中的细胞成分,最大程度降低材料的免疫原性,又能保留相对完整的三维支架结构,保持足够的生物力学强度,以满足组织修复重建的需要[3]。由于肌腱韧带的特殊性质及其高强度的工作环境,使得该方面的组织工程研究变得异常困难。
脱细胞处理的典型方法包括在低渗盐水中广泛漂洗,用稀释的过氧乙酸(0.1%)处理或在Triton 100×中培育,然后用环氧乙烷或γ辐照消毒。这些方法已被证明可完全去除细胞成分,降解<300 bp的核酸碎片且保留生长因子如碱性成纤维细胞生长因子和血管内皮生长因子的生物活性[4-6]。除此之外,尚有胰酶、SDS、Triton X-100等脱细胞方法。胰酶脱细胞较为温和,但脱除腱膜等能力较弱,脱细胞不够彻底;SDS在脱除细胞的同时,对支架结构的破坏较多,显著降低支架的生物学性能,不能满足韧带力学特征需求。故而,本研究选用能实现脱细胞又能将对支架的损伤降到最低的Triton X-100。脱细胞处理前,利用反复冻融处理,能最大程度地破坏支架内细胞的结构,利于在不损伤细胞外基质的情况下较为彻底的脱除细胞。本实验研究比较经过特殊方式处理的牛肌腱,从肌腱的生物力学、脱细胞情况、细胞相容性等方面探讨其在临床应用上的前景。
1 材料与方法
1.1 原料
牛肌腱纤维,由屠宰场提供,-20℃保存。Triton X-100(聚乙二醇辛基苯基醚)购自Sigma。以上原料使用时均不再需要纯化。DNA含量定量检测试剂盒Quant-iTTMPicoGreen®dsDNA Assay Kit(Invitrogen 公司,美国);DAPI(Vector公司,美国)。冰冻切片机、偏振光显微镜、荧光酶标仪(Leica公司,德国);扫描电镜(JEOL公司,日本);荧光生物显微镜(Nikon公司,日本);冷冻干燥机(Christ公司,德国);球磨仪(Retsch公司,德国);生物力学试验机(Instron公司,美国);游标卡尺(精确度0.02 mm;上海三圈公司)。
1.2 支架制备
自冷冻冰箱取出小牛跟腱,37℃水浴箱内快速解冻。清除牛肌腱表面筋膜、滑膜及软组织,PBS缓冲液冲洗肌腱组织,物理方法制备小牛跟腱50根,长度约为5 cm,直径5 mm[7],随机分为两组,每组25根。A组为对照组,未做处置;B组为实验组,经脱细胞及反复冻融处理:将肌腱装入橡胶盒内,密封后于液氮、37℃恒温水浴箱反复冻融:液氮1 min→恒温水浴5 min,循环6次。将冻融处理后的肌腱放入含有0.5%Triton X-100的离心管内,密封:37℃恒温摇床24 h→PBS缓冲液反复冲洗5次→37℃恒温摇床24 h→PBS缓冲液反复冲洗5次,共循环5次。脱细胞后PBS反复清晰30 min后于-20℃保存备用。
1.3 支架内DNA含量残留的检测
各组随机取3根跟腱,冻干,剪碎,称重,球磨,0.5 mg/ml木瓜蛋白酶60℃消化48 h,4℃以5000×g离心5 min,取上清液。采用Quant-iT™PicoGreen™dsD⁃NA Assay Kit进行检测,具体方法如下。①配制样本稀释液。取2 ml×TE加入38 ml双蒸水,混匀得40 ml 20×TE。PicoGreen试剂制备:取 100 μl PicoGreen,加入19.9 ml稀释液混匀后避光保存。②配制标准品。高浓度组:1、0.1、0.01、0.001、0 μg/ml各180 μl;低浓度组:50、5、0.5、0.05、0 ng/ml各180 μl;检测吸光度(A)值。各样本和标准品中均加入180 μl PicoGreen试剂。于96孔板分别设置空白孔、标准孔和样本孔(各设4个复孔)。各加入50 μl空白液、标准品溶液和待测样本上清液(5 min内加完)。散射波长为485 nm,放射波长为538 nm,于荧光酶标仪检测A值。③计算样本浓度。根据标准品浓度和对应的A值,分别绘制高浓度和低浓度标准曲线,结合各样本的A值计算样本浓度。
1.4 脱细胞韧带的拉伸力学测试
各组随机取8根跟腱,修剪成长4 cm的肌腱节段,于冰冻切片机上沿肌腱纵向切成600 μm薄片,PBS清洗3次,每次5 min,游标卡尺测量各切片宽度(0.4~0.6 cm)。用砂纸包住肌腱切片两端,固定至生物力学试验机的夹具上,游标卡尺测量拉伸前样本的初始长度(两夹具之间的长度)。以5 mm/min加载速度进行单轴拉伸试验,直至载荷值下降至最大值的50%时终止。根据系统采集的拉伸载荷、位移、应力和应变的数值,计算各样本的最大拉力、弹性模量和刚度。
1.5 细胞-支架复合
在脱细胞韧带支架上种植并培养骨髓间充质干细胞(mesenchymal stem cells,MSCs),参考相关学者[8-10]描述的方法,提取原代SD大鼠的MSCs。将2种支架分别裁剪成1.2 cm×1.2 cm大小的方形。裁剪后的支架材料通过紫外线照射2 h进行消毒,并将支架浸没于70%的酒精溶液4 h中,增加支架的亲水性。消毒处理后的支架置于24孔板中使用干细胞专用培养基(美国Sciencell公司)孵育过夜。每个支架表面种植MSCs的数目为5×104,置于37℃,5%二氧化碳细胞培养箱中培养7 d,培养基隔天换液。
1.6 细胞增殖实验
使用细胞计数试剂盒(MTT)对MSCs在2种支架上的增殖情况进行评估。细胞增殖测试选择接种细胞的第1天和第7天进行。分别提取24孔板中的细胞培养液,并加入MTT溶液20 μl,避光孵育2 h后,使用Model550型酶标仪(美国Bio-Rad公司)于450 nm进行度数。根据前期绘制的标准曲线推算出每个支架上的细胞量。
1.7 细胞外机基质分泌的检测
基因表达的检测:每个时间点取3个细胞支架复合体标本(实验组)放入液氮中,使用时各切取100 mg,于麻醉下切取3只健康3月龄新西兰大白兔正常椎间盘纤维环(共3个)放入液氮中,使用时各标本切取100 mg设为正常纤维环组。RT-PCR检测Ⅰ、Ⅱ型胶原基因表达。组织总RNA抽提:常规Tripure法提取总RNA,贮存于70%乙醇并保存于-80℃。
1.8 统计学方法
使用统计软件SPSS 20.0(美国IBM公司)对本实验的数据进行统计分析。实验结果的计量资料结果采用均数±标注差表示,均数间比较采用方差分析,p<0.05时为差异有统计学意义。
2 结果
2.1 脱细胞支架DNA含量的检测
对照组、实验组的DNA残留量分别为(0.70±0.03)μg/mg和(0.34±0.15)μg/mg,实验组显著低于对照组,差异有统计学意义(p<0.05)。
2.2 脱细胞韧带支架的拉伸力学结果
实验组的最大应力显著小于对照组(p<0.05),而弹性模量和刚度试验结果无统计学差异(P>0.05,表1)。结果表明,脱细胞支架在保留天然支架生物学性能的基础上可作为组织工程支架的选择。
表1 两组生物力学试验结果比较(

表1 两组生物力学试验结果比较(
组别对照组实验组P值最大拉力(N)62.73±8.27 55.80±7.03<0.05弹性模量(MPa)186.55±58.29 157.72±20.76>0.05刚度(N/m)39.41±16.39 37.48±8.56>0.05
2.3 细胞增殖情况
MTT试剂盒检测细胞增殖情况的结果显示(图1),在第1和7天,两种支架表面的MSCs均快速增殖,两种支架上第7天的细胞数目均较第1天时明显增加,但是2种支架上的细胞数目在每个时间点上差异均无统计学意义(P>0.05)。
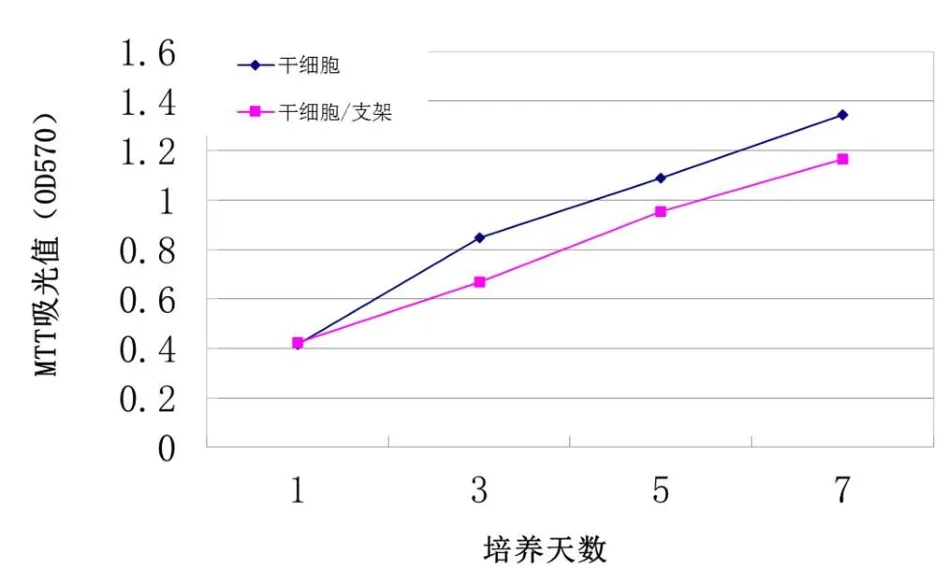
图1 两种支架表面的MSCs均快速增殖
2.4 细胞外基质的检测
负压吸附法进行支架复合培养,分别于1、2、3周时,对干细胞-支架复合物取3个样本,正常新鲜脱细胞支架作为对照组。RT-PCR检测Ⅰ、Ⅱ型胶原基因表达,观察细胞-支架复合后Ⅰ、Ⅱ型胶原分泌情况。
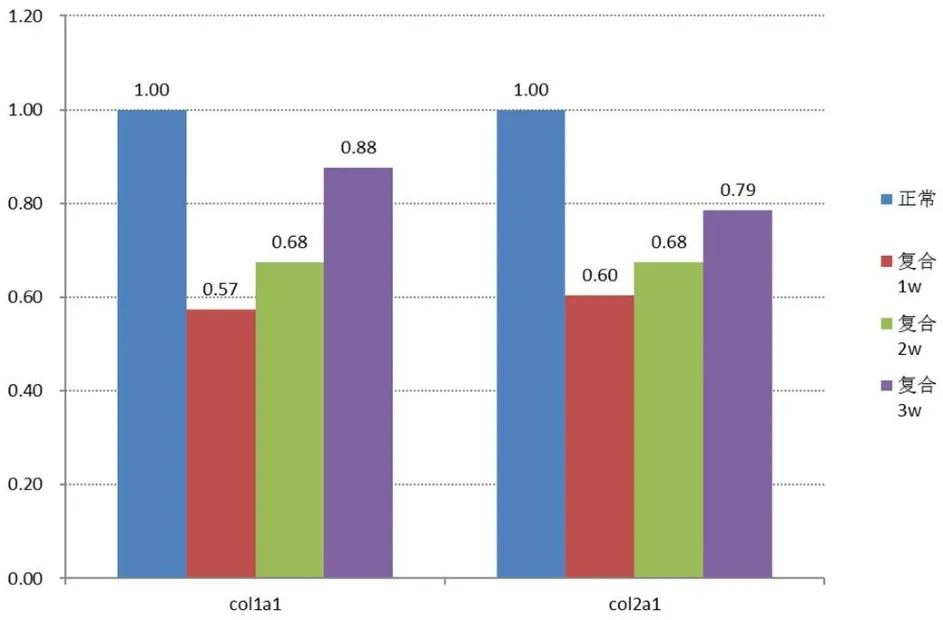
图2 细胞外基质的检测
3 讨论
3.1 胶原纤维的脱细胞
去除肌腱组织抗原性是本研究的重点,而脱细胞方法的选择难点。首先,分离制作肌腱脱细胞支架,再经冻融循环处理,冻融循环在保留肌腱生物学活性的基础上能最大限度促进肌腱纤维的分离[11-13]。再选用Triton X-100洗涤剂对肌腱纤维进行脱细胞处理,既能去除肌腱表面的纤维膜,又能最大限度的保留胶原纤维蛋白,经Triton X-100脱细胞处理后,肌腱纤维支架的结构、长度和干重均未出现明显改变,这可能与牛肌腱纤维结构坚韧以及Triton X-100试剂相对温和有关。传统的十二烷基硫酸钠(SDS)、TBP等对肌腱纤维的损伤较大,胶原纤维有一定程度的损伤。SDS、TnBP均是通过溶解细胞质及细胞核,破坏蛋白质之间相互作用从而降低材料抗原性。Vavken等研究表明,SDS、Trypsin处理时肌腱细胞外基质中的糖胺聚糖显著减少;Deeken等发现采用TnBP处理会显著破坏肌腱的力学性能。而胰酶和EDTA的组合因牛肌腱结构坚韧,却不能有效地清除肌腱纤维中的抗原成分,体内植入更易产生明显的免疫排斥反映。Whitlock等发现单纯采用DNase/RNase处理肌腱脱细胞效果并不十分理想。生物力学研究表明脱细胞方法处理前后肌腱纤维支架的力学性能出现明显差异,但能满足人体膝关节交叉韧带损伤修复的力学需求。脱细胞处理后最大应力与弹性模量的下降说明该脱细胞方法可能对肌腱纤维间的弹性纤维造成了损伤,针对该方面不足,结合非生物材料合成办法,可结合相关化学物理办法来弥足该方面不足。
3.2 脱细胞韧带支架的生物力学性能
DNA残留量检测结果显示脱细胞处理后DNA含量降低了约80%。结果表明反复冻融结合核酸酶处理是一种对于完整小牛跟腱组织较为有效的脱细胞方法。且反复冻融结合核酸酶处理是一种较温和的脱细胞方法,对胶原及其他细胞外基质成分影响较小。Qin等[14]研究表明,成年犬肌腱组织承受拉伸载荷最小的力学单元是直径约为300 μm纤维束,因此当肌腱切片厚度在300 μm以上时,其强度能基本反映完整肌腱的生物力学特性。本研究采用了600 μm厚度的切片作为拉伸试样,并计算其强度值以反映完整小牛跟腱的力学特性。实验测得脱细胞处理后小牛跟腱的拉伸强度为(23.00±6.01)MPa,约保留了原始强度值的90%,虽然与待修复肌腱/韧带组织真实的力学强度值存在较大差异,但较SIS、真皮、羊膜等脱细胞材料在力学性能方面仍具有较大优势,因而探究脱细胞小牛跟腱支架修复韧带或肌腱缺损是一个有潜在应用前景的研究方向。
人体各个部位肌腱的弹性模量均不相同,主要原因在于人体各个部位肌腱所承担的功能不同,对肌腱形变的要求均不相同,所以真正的人工肌腱需高度与正常肌腱的弹性模量相吻合。本次实验结果显示,脱细胞支架在经过处理后弹性模量并未出现显著下降,这表明了经过脱细胞处理的肌腱能够在一定程度上模仿正常肌腱的运动功能。课题组前期进行了有关异体兔膑韧带脱细胞支架材料生物相容性的初步研究,结果也提示脱细胞支架的免疫原性和生物相容性能够适应机体损伤的修复。
综上所述,本研究结果表明,反复冻融结合Tri⁃ton X-100处理小牛肌腱可有效脱去细胞成分,同时较好地保留组织天然形态、结构、细胞外基质组分以及生物力学特性。后期我们将进一步定量探究小牛肌腱脱细胞处理后糖胺聚糖、纤维连接蛋白以及部分生长因子等细胞外基质成分的保留情况,并通过体外细胞实验验证其生物活性,皮下植入实验观察其炎性反应和免疫排斥反应,进一步研究脱细胞小牛肌腱用于修复肌腱/韧带缺损的可能性。
[1]Hoshiba T,Lu H,Kawazoe N,et al.Decellularized matrices for tissue engineering.Expert Opin Biol Ther,2010,10(12):1717-1728.
[2]Caruso AB,Dunn MG.Changes in mechanical properties and cellularity during long-term culture of collagen fiber ACL reconstruction scaffolds.J Biomed Mater Res A,2005,73(4):388-397.
[3]Ivanov AN,Norkin IA,Puchin'ian DM.The possibilities and perspectives of using scaffold technology for bone regeneration.Tsitologiia,2014,56(8):543-548.
[4]McDevitt CA,Wildey GM,Cutrone RM.Transforming growth factor-beta1 in a sterilized tissue derived from the pig small intestine submucosa.J Biomed Mater Res A,2003,67(2):637-640.
[5]Meyer W.Subdermal Tissue Regeneration.Springer Vienna,2013:161-172.
[6]Yu YX,Xiu YL,Chen X,et al.Transforming growth factorbeta 1 involved in the pathogenesis of endometriosis through regulating expression ofvascularendothelial growth factor under hypoxia.Chin Med J(Engl),2017,130(8):950-956.
[7]江燕林,张忆,杨洁亮.脱细胞小牛肌腱组织形态学和生物力学特性研究.中国修复重建外科杂志,2013,(5):565-570.
[8]Tan Q,Lui PP,Rui YF,et al.Comparison of potentials of stem cells isolated from tendon and bone marrow for musculoskeletal tissue engineering.Tissue Eng Part A,2012,18(7-8):840-851.
[9]Kowalski TJ,Leong NL,Dar A,et al.Hypoxic culture conditions induce increased metabolic rate and collagen gene expression in ACL‐derived cells.J Orthop Res,2016,34(6):985-994.
[10]Wang H,Zhou Y,Chu TW,et al.Distinguishing characteristics of stem cells derived from different anatomical regions of human degenerated intervertebral discs.Eur Spine J,2016,25(9):2691-2704.
[11]Gentleman E,Lay AN,Dickerson DA,et al.Mechanical characterization of collagen fibers and scaffolds for tissue engineering.Biomaterials,2003,24(21):3805-3813.
[12]Coelho RCG,Marques ALP,Oliveira SM,et al.Extraction and characterization of collagen from Antarctic and Sub-Antarctic squid and its potential application in hybrid scaffolds for tissue engineering.Mater Sci Eng C Mater Biol Appl,2017,78:787-795.
[13]Padmanabhan SK,Salvatore L,Gervaso F,et al.Synthesis and characterization of collagen scaffolds reinforced by eggshell derived hydroxyapatite for tissue engineering.J Nanosci Nanotechnol,2015,15(1):504-509.
[14]Qin TW,Chen Q,Sun YL,et al.Mechanical characteristics of native tendon slices for tissue engineering scaffold.J Biomed Mater Res B Appl Biomater,2012,100(3):752-758.
Construction of acellular tendon scaffold for ligament tissue engineering
WANG Qian,WANG Shuai,XU Zhongyang,LI Xianzhou,XING Baohua*
(Department of Orthopaedics,Jining First People′s Hospital,Jining 272011,Shandong,China)
Background:The cells can be removed completely by sodium dodecyl sulfate(SDS),but the scaffold structure may be damaged and result in decreased biological characteristics.The scaffold structure and biological characteristics can be maximally preserved by pancreatic enzyme,while the cells couldn't be removed completely because the pancreatic enzyme are relatively mild.Objective:To prepare and analyze the feasibility of acellular bovine tendon as scaffold of tissue engineered ligament.Methods:Fifty fresh bovine tendons were obtained.Their tendon membrane,synovial membrane and soft tissue were removed by physical method.Then the tendons were randomly divided into two groups and the freeze-drying was used for them.The experimental group was decellullarised with Triton X-100,and control group was not decellullarised.All the cells in both groups were dried up at room temperature after PBS flushed.Then histological slices were performed.DNA content,cell proliferation,and biomechanics(maximum stress,elastic modulus and stiffness)were measured and compared between the two groups.Results:The residual amount of DNA was(0.34±0.15)μg/mg and(0.7±0.03)μg/mg in the control group and experimental group,respectively(p<0.05).The significant difference of DNA residual amount between the two groups showed that the cells could be removed completely with no significant immunogenicity.There was no significant difference in morphological structure between the two groups.The decellularized scaffold did not affect the cell proliferation.The maximal stress of the experimental group was significantly lower than that of the control group,while no significant difference was found in the elastic modulus or the stiffness between the two groups.Conclusions:The acellular tendon can be used as the scaffold of tissue engineering ligament based on biological properties of natural scaffolds.
Tissue Engineering Ligament;Immunogenicity;Histocompatibility;Decellullarised;Tendon
2095-9958(2017)08-0 347-04
10.3969/j.issn.2095-9958.2017.04-16
*通信作者:邢宝华,E-mail:xingbhspine@163.com

