基因工程单纯疱疹病毒-1 KTR27治疗骨肉瘤的实验研究
王迪凡徐立辉吴杰*
(1.首都医科大学附属北京友谊医院骨科,北京100050;2.北京大学第四临床医学院北京积水潭医院骨肿瘤科,北京100035)
基因工程单纯疱疹病毒-1 KTR27治疗骨肉瘤的实验研究
王迪凡1徐立辉2吴杰1*
(1.首都医科大学附属北京友谊医院骨科,北京100050;2.北京大学第四临床医学院北京积水潭医院骨肿瘤科,北京100035)
背景:近年来,骨肉瘤的治疗处于一个平台期,探索新的治疗方式成为广泛的共识。随着肿瘤分子生物学和基因工程学的发展,使用溶瘤病毒治疗恶性肿瘤成为一个热点。目的:探讨基因工程单纯疱疹病毒-1(herpes simplex virus 1,HSV-1)KTR27对骨肉瘤细胞系U2OS的体外作用以及裸鼠骨肉瘤模型局部原发肿瘤的作用。方法:采用体外实验观察KTR27对U2OS细胞系的细胞致病作用。裸鼠皮下注射人骨肉瘤细胞株U2OS,建立骨肉瘤裸鼠模型,在此基础上将动物模型随机分为6组,2组为空白对照,分别喂饲普通鼠粮和含强力霉素的鼠粮;2组瘤内注射KTR27(1×107PFU/50 μl),喂饲普通鼠粮和含强力霉素的鼠粮;2组瘤内注射DMEM 50 μl,喂饲普通鼠粮和含强力霉素的鼠粮。计算肿瘤体积并绘制肿瘤生长曲线,同时行组织学检查。结果:体外实验显示KTR27对U2OS有明显的致病作用,形成空斑。成功建立U2OS细胞系的骨肉瘤裸鼠模型并得到肿瘤生长曲线,注射KTR27后测量各组肿瘤体积大小,显示各组肿瘤体积无显著性差异(P>0.05)。各组肿瘤体积时间变化曲线分析显示,各组的时间趋势不同,相比较有统计学差异(p<0.05)。可见注射KTR27的肿瘤生长趋势受到抑制,与加用强力霉素后没有显著性差异(P>0.05)。注射KTR27后24 h病理切片显示肿瘤坏死增加,但7 d后肿瘤局部恢复增长。结论:基因工程HSV-1 KTR27对U2OS细胞有明显的细胞致病作用。使用U2OS细胞系建立裸鼠皮下骨肉瘤模型,然后局部瘤内注射基因工程HSV-1 KTR27,肿瘤的生长趋势受到了抑制,加用强力霉素后这种抑制没有明显区别。
骨肉瘤;裸鼠;溶瘤病毒;单纯疱疹病毒
基因工程单纯疱疹病毒-1(herpes simplex virus 1,HSV-1)是溶瘤病毒家族中的一员,其第一个增殖型载体dlsptk被用于恶性胶质瘤的治疗[1]。近年来多个HSV-1来源的载体在胶质瘤、黑色素瘤、卵巢癌等许多肿瘤动物实验和临床试验中显示出一定的肿瘤特异性和肿瘤控制作用。这些载体都是通过删减HSV-1上的一些基因达到控制其在正常细胞上的转染能力。基因工程HSV-1 KTR27是一个新的控制增殖型HSV-1载体,它是通过删减HSV-1的ICP0基因,并通过嵌入四环素基因调控器控制ICP27基因的表达,通过2个基因的控制来进一步提高其安全性[2]。
本研究在体外实验中检测了KTR27在U2OS细胞内的增殖和细胞致病作用。进而使用U2OS细胞系建立裸鼠皮下骨肉瘤模型,并在此基础上研究基因工程HSV-1 KTR27对骨肉瘤的治疗作用。
1 材料与方法
1.1 实验材料和设备
细胞系为人骨肉瘤细胞系U2OS,由北京大学肿瘤学院遗传室提供。实验动物为BALB/c,nu/nu裸小鼠,由北京肿瘤防治研究所中心实验室提供,鼠龄4~6周,均为雄性。饲养于北京肿瘤防治研究所中心实验室裸鼠间SPF环境中,生长良好。鼠粮由中国医学科学院动物研究所提供,分为普通鼠粮和含盐酸强力霉素的特殊鼠粮两种。其中特殊鼠粮盐酸强力霉素含量为200 mg/kg。基因工程HSV-1 KTR27由哈佛大学医学院提供。KTR27为复制受强力霉素调控的基因工程HSV-1载体,浓度为2.3×108PFU/ml。DMEM培养基,胎牛血清(天津血液研究所产品),1%中性红溶液,甲基纤维素(MTC)覆盖培养基。CO2细胞培养箱(Hereus Instruments),倒置相差显微镜(Nikon Co.)。
1.2 基因工程HSV-1 KTR27的扩增
第0天,培养瓶中放置2×106个U2OS细胞。第3天使用KTR27原液转染U2OS细胞,MOI值为0.005 PFU/细胞。37℃孵育1.5 h,更换培养液,加入10 ml含5 μg强力霉素(浓度0.5 μg/ml)的DMEM培养基。第7天,收集转染细胞离心15 min,将细胞团悬浮放置于培养基中-80℃储存。第8~10天,冰冻和融化3次上述细胞株,每次于37℃融化后立刻将细胞株重新悬浮于培养基中。低速离心15 min,使大的细胞碎片沉至底部。将上清液-80℃储存。使用暴露于强力霉素环境下的U2OS细胞测定上述病毒原液的浓度。
1.3 基因工程HSV-1 KTR27在U2OS细胞内增殖及细胞致病作用的观察
于培养皿中放置7.5×105个U2OS细胞,3 d后使用病毒原液转染培养皿。转染后培养皿中加入含12.5 μg强力霉素(浓度2.5 μg/ml)的培养基。加入含强力霉素培养基3 h后,倒掉培养基,加入含10 μg强力霉素(浓度10 μg/ml)的培养基。使用甲基纤维素培养基覆盖单细胞层,存放于37℃细胞培养箱。每日于普通光学倒置显微镜下观察细胞形态及空斑形成单位的情况。
1.4 建立U2OS裸鼠皮下骨肉瘤模型
将U2OS细胞复苏,培养,传代,经计数制成1×106个/0.2 ml DMEM和1×105个/0.2 ml DMEM的细胞悬液。分别取8只裸鼠,把细胞悬液接种于裸鼠双侧腹股沟区皮下。隔日观察接种部位有无感染。饲养3周,每隔2~3 d测量体重。
1.5 测量肿瘤大小
接种8 d后,每隔2~3 d以游标卡尺测量皮下肿瘤的长径a与短径b,计算肿瘤体积V=ab2/2[3]。根据肿瘤体积测绘肿瘤生长曲线,测量裸鼠体重。
1.6 组织学检查
接种后2周颈椎脱位处死裸鼠,局部切除肿瘤组织,多聚甲醛固定后行石蜡包埋切片,以5 μm层厚切片,苏木精—伊红染色观察。
1.7 皮下瘤内注射KTR27治疗效果的观察与评估
33只裸鼠,随机分6组,每组5~6只。无菌条件下把1×106个/0.2 ml DMEM的U2OS细胞悬液接种于裸鼠左侧腹股沟区皮下。隔日观察接种部位有无感染。饲养3周,每隔2~3 d测量体重。分组与给药情况见表1。
接种8 d后,每隔2~3 d以游标卡尺测量皮下肿瘤的长径a与短径b,计算肿瘤体积V=ab2/2。根据肿瘤体积测绘肿瘤生长曲线,测量裸鼠体重。
第3次注射处理后7 d,切取肿瘤组织,多聚甲醛固定后行石蜡包埋切片,以5 μm层厚连续切片,苏木精—伊红染色观察。对照组按相应时间做相同处理。
1.8 统计学方法
采用SPSS 20.0软件进行统计学分析,行重复测量数据的方差分析检验,p<0.05为有统计学差异。
2 结果
2.1 基因工程HSV-1 KTR27在U2OS细胞中的转染
可见U2OS细胞皱缩、变圆,并有空斑形成(图1)。
2.2 U2OS肿瘤细胞皮下接种后肿瘤生长曲线的建立
1×106个细胞/0.2 ml种植组8只中有6点出现了生长,其体积变化生长曲线如图2。裸鼠未出现消瘦或死亡。而1×105个细胞/0.2 ml种植组在8个点仅有2点出现生长。

表1 瘤内注射KTR27疗效观察的分组与给药
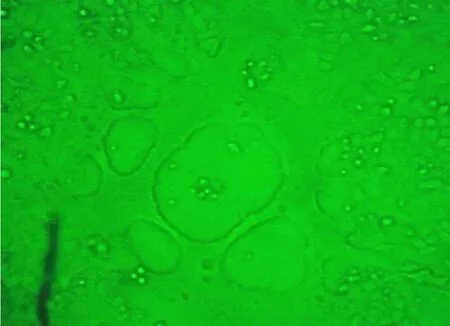
图1 KTR27转染U2OS细胞后第3天
可见1×106个细胞/0.2 ml种植组肿瘤在观测期内均呈加速生长趋势。统计学显示在肿瘤生长初期,方差较大,而后期肿瘤平均值>2倍方差,表明肿瘤大小变化基本符合正态分布(图2)。
2.3 动物模型肿瘤组织学检查
大体标本:瘤体质韧,隆起于皮下,瘤体断面可见鱼肉样改变。镜下组织病理:可见成骨,肿瘤细胞类圆形,核仁明显,2~3个核仁/细胞,伴病理核分裂像,>20个/10个高倍视野。肿瘤组织侵润骨骼肌,伴坏死灶,局部呈凝固性坏死(图3),符合成骨肉瘤。
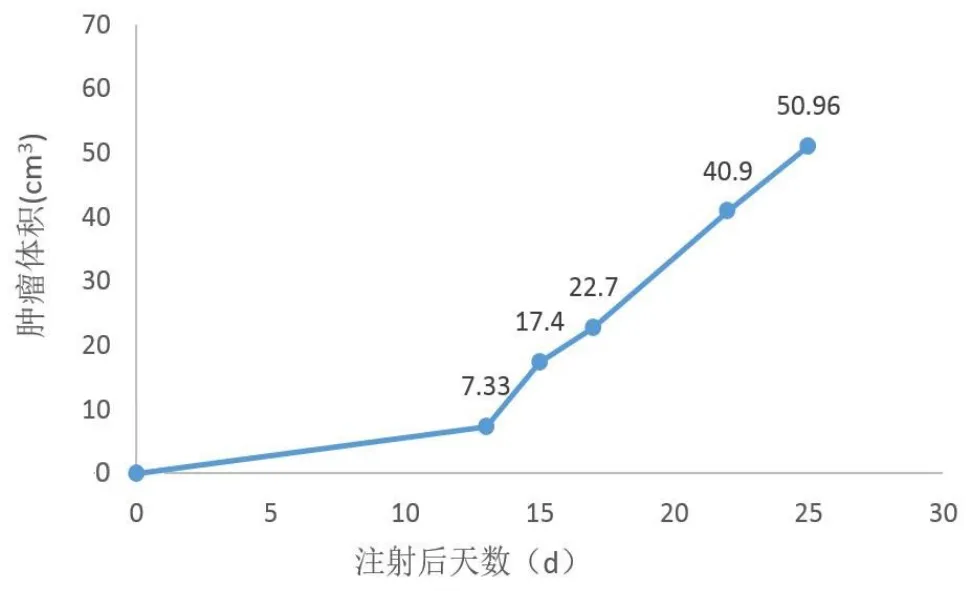
图2 1×106个细胞/0.2 μl种植组肿瘤生长曲线
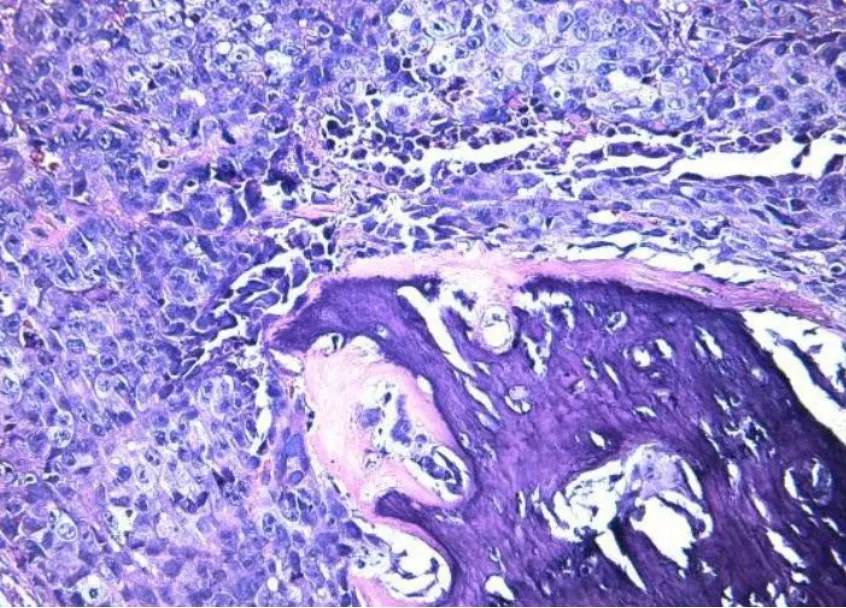
图3 皮下肿瘤镜下组织病理(HE染色,40×),可见成骨(紫色),细胞明显异型性,伴异常核分裂
2.4 分组治疗及对照组的肿瘤局部观察
在第3次注射处理后10 d测量各组肿瘤体积大小,A组(73.13±22.01)cm3,B组(50.47±22.38)cm3,C组(84.40±28.41)cm3,D 组(53.24±20.35)cm3,E 组(41.00±23.49)cm3,F组(105.88±29.66)cm3。各组肿瘤体积无统计学差异(P>0.05)。
各组肿瘤体积时间变化曲线(图4)分析显示,各组的时间趋势不同,有统计学差异(p<0.05)。可见注射KTR27的两组肿瘤体积出现缩小,肿瘤生长趋势受到抑制。
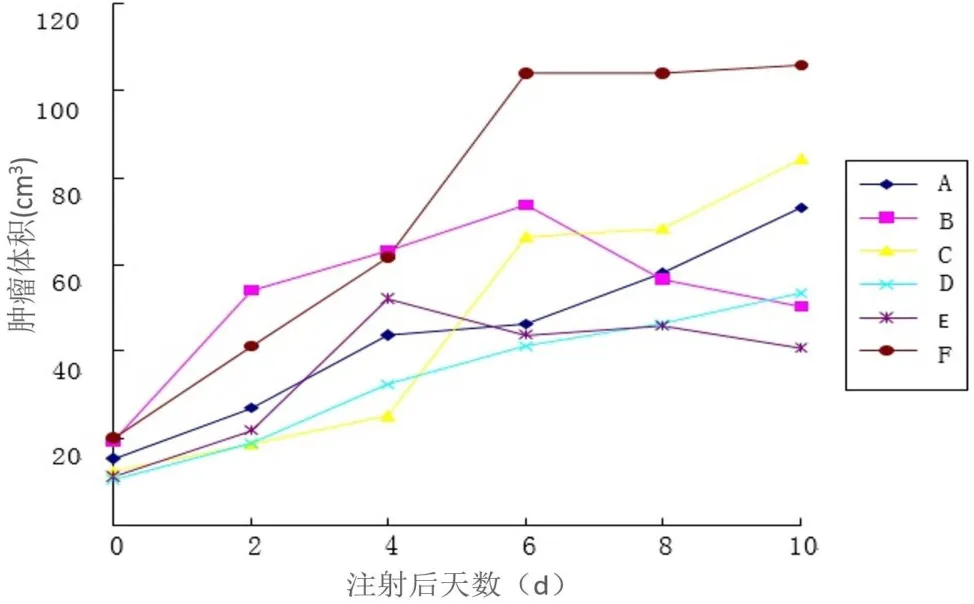
图4 各组肿瘤生长时间曲线
2.5 行KTR27及DMEM注射治疗后24 h的肿瘤组织病理学检查
KTR27注射24 h后的肿瘤标本病理切片可见较多坏死组织(图5)。KTR27注射后7 d的肿瘤标本病理切片可见坏死区域较24 h的标本减小,肿瘤组织有所恢复(图6)。
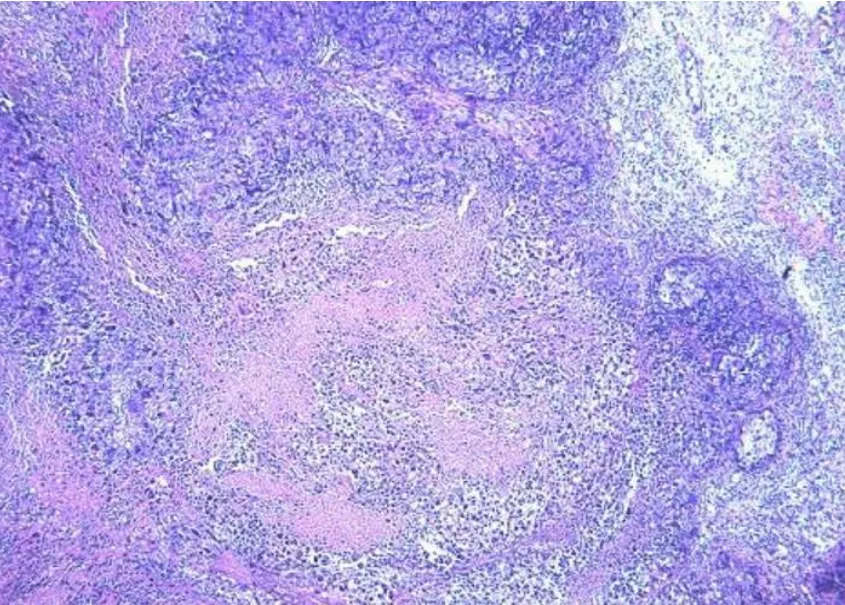
图5 肿瘤注射KTR27后24 h镜下组织病理(HE染色,10×),可见较多坏死组织
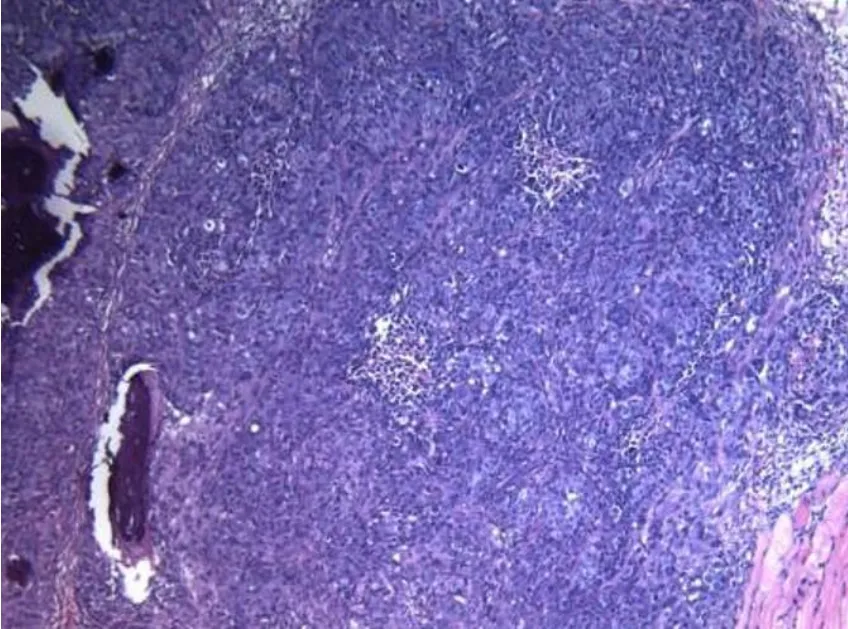
图6 肿瘤注射KTR27后7 d镜下组织病理(HE染色,10×),肿瘤细胞增多,坏死减少
3 讨论
溶瘤病毒治疗的基本策略就是在最大程度上减低对正常组织损伤的前提下利用病毒感染增殖破坏肿瘤细胞。本研究中使用的溶瘤病毒为基因工程改造过的HSV-1。目前已经用于Ⅰ期临床试验的HSV-1载体主要用于复发性胶质瘤、黑色素瘤、高度恶性胶质瘤以及结肠癌肝转移的治疗[4-6],治疗方式以瘤内注射为主,部分病例生存期延长,部分肿瘤出现了坏死或缩小改变。体外细胞实验的研究结果[7]表明,HSV-1对于骨肉瘤细胞存在一定的易感性。在肯定溶瘤病毒的肿瘤治疗效能时,还要考虑病毒使用的安全问题。恶性肿瘤细胞由于本身基因染色体不稳定、细胞防御机制弱、细胞表面病毒受体多等多方面因素更容易感染病毒[8-11]。病毒对肿瘤细胞的这一选择特性,在一定程度上实现了病毒的靶向治疗,但仍有可能造成对正常组织的损伤,因此如何增强病毒的肿瘤特异性,更好的控制病毒在体内的增殖,成为当今研究的主要方向。
本研究采用经过基因工程改造的HSV-1 KTR27进行针对骨肉瘤溶瘤治疗的体内和体外实验研究。KTR27是由哈佛大学医学院开发研制的新型HSV-1载体。该团队开发了一种四环素on/off调控系统(TRExTM;Invitrogen,Carlsbad,CA,USA;美国专利号5972650,10/26,1999),通过基因工程用四环素调控的启动子取代HSV-1的ICP0基因(病毒复制),并控制ICP27基因(病毒复制)的表达,同时在ICP27的5'不表达区域插入一个核酶来减少ICP27的表达,这两个基因的控制明显降低了HSV-1的复制能力。而四环素可以开启ICP27基因片段,去除对病毒复制的抑制,引发病毒在细胞内增殖。研究表明,在不同的人类肿瘤细胞中,四环素的存在可以使KTR27的复制能力增加1000~35万倍。在对人类肺癌裸鼠模型进行基因工程HSV-1 KTR27瘤内注射后,肿瘤的生长有抑制,而使用四环素后抑制作用更为明显[12]。
使用裸鼠建立人类肿瘤的动物模型来评估和预测药物临床药效是一个非常有效的方法[13]。本研究使用人骨肉瘤细胞细胞系U2OS对裸鼠进行皮下注射,建立了异种移植模型。对于体内实验病毒用量的选择,参考之前U2OS体内实验的结果并在此基础上通过向U2OS细胞内转染不同浓度的病毒,观察噬斑的形成情况,空斑出现提示KTR27病毒在U2OS细胞中复制活跃,KTR27对U2OS细胞有抑制作用[14]。
结果显示,注射KTR27的两组裸鼠的肿瘤生长曲线发生了变化,虽然肿瘤没有完全消失,但肿瘤增长趋势受到了抑制,而其他4组肿瘤增长趋势没有明显抑制。这表明KTR27瘤内注射起到了抑制肿瘤生长的作用。按照目前的疗效评估标准,这是一种有效的治疗[13]。肿瘤组织病理切片显示病毒瘤内注射24 h后,肿瘤内的坏死组织明显增加,而作用7 d后再检查病理发现肿瘤内坏死面积有一定程度的缩小,说明肿瘤生长有部分恢复。恶性肿瘤的其他治疗方式,如手术、放疗或化疗,都可以使肿瘤体积明显缩小或者消失。但相比之下,使用溶瘤病毒这种生物治疗的安全性要高得多。溶瘤病毒治疗肿瘤的重要作用机制就是病毒载体转染肿瘤细胞,使肿瘤细胞溶解凋亡,从而抑制肿瘤的生长;此外肿瘤溶解后特异抗原的释放又可以激发机体针对肿瘤的特异免疫,包括细胞免疫和全身免疫,而这一机制对于溶瘤治疗的长期治疗效应的发挥,特别是抑制肿瘤的复发和转移具有非常重要的意义。对于前者,如何实现肿瘤细胞的充分转染是一个难题。随着肿瘤的增大,很多因素都会干扰局部病毒注射的效果,使病毒难以实现充分转染。实体肿瘤体积增大后,内部往往不均匀一致,如坏死、钙化区域会影响溶瘤病毒的疗效[15];此外,体积增大后实体肿瘤内部压力往往会随之明显增加,也会限制溶瘤病毒的播散和转染[16-19],因此,选择在肿瘤多大时进行病毒转染,以及采用何种转染方式很重要。研究发现较小的肿瘤体积容易被感染(<0.4 cm3),局部给药的效果要优于静脉给药[20]。然而肿瘤太小会使瘤内注射的难度增加,无法保证病毒真正进入肿瘤内部,因此选择肿瘤直径在3~5 mm时进行局部瘤内注射操作,兼顾了操作方便和利于病毒充分转染两方面因素。但肿瘤的生长存在一定的差异,后两次药物注射时部分肿瘤已经较大,直径超过了5 mm,且局部质地较硬,形状不规则,甚至呈菜花状,这种情况又增加了药物瘤内二次注射的难度,可能会大大降低病毒的有效播散,直接影响基因工程HSV-1 KTR27的溶瘤作用,这也可以解释为什么后期肿瘤生长会出现部分恢复。该研究提示,溶瘤病毒对于较小的肿瘤组织抑制效果较好,可操作性强。因此临床上可以考虑应用于体积较小的原发肿瘤或肿瘤无法进行切除如头颈部肿瘤进行瘤内注射,还有可能发挥远期控制肿瘤复发转移的作用。结合体外细胞实验,在微观水平上,基因工程HSV-1 KTR27能够选择性实现对骨肉瘤细胞U2OS的转染和溶解。在临床上,常常会遇到骨肉瘤临近一些无法切除的重要结构如主要神经血管束而无法实现理想的手术边界。如果能够局部使用这种溶瘤病毒也许能够取得一些控制作用。
安全性问题是所有临床治疗手段都要考虑的问题,病毒也不例外,要保证在实施肿瘤治疗时的靶向性尽量不损伤正常组织。KTR27的安全保障是通过加入一个强力霉素调控原件实现的,在有强力霉素存在时,ICP27可以表达,KTR27开始高效复制。而没有强力霉素时,病毒低扩增或不扩增。在本实验中,对裸鼠进行KTR27注射后,裸鼠的状态没有明显改变,各组的体重也没有明显变化,这说明基因工程HSV-1 KTR27至少对于裸鼠瘤内注射是安全的。在评估本实验中强力霉素效果时发现,食用含盐酸强力霉素鼠粮与使用普通鼠粮的两组裸鼠的肿瘤体积没有明显区别。分析原因可能主要有以下几点:①U2OS细胞的特殊性。U2OS本身能够产生替代HSV-1的ICP0调节蛋白,而制造KTR27的一个最主要的控制HSV-1复制能力、减低毒性的基因工程改变依靠的就是ICP0基因的删除。这种情况下,靠强力霉素调控打开ICP27表达增加的复制能力有限,体现在宏观实体肿瘤上的变化就更有限了。②局部KTR27的注射剂量。如果剂量偏大,则强力霉素控制放大的复制转染的效果可比性会相对减小。本研究证实溶瘤病毒在骨肉瘤细胞体内外实验中对肿瘤有抑制作用。
综上所述,体外实验显示基因工程HSV-1 KTR27对U2OS细胞有明显的细胞致病作用。在裸鼠骨肉瘤模型局部瘤内注射基因工程HSV-1 KTR27,肿瘤的生长趋势受到了抑制,加用强力霉素后这种抑制没有明显区别。
[1]Martuza RL,Malick A,Markert JM,et al.Experimental therapy of human glioma by means of a genetically engineered virus mutant,Science,1991,252(5007):854-856.
[2]Yao F,Theoplod C,Hoeller D,et al.Highly efficient regulation of gene expression by tetracycline in a replication-defective herpes simplex viral vector.Mol Ther,2006,13(6):1133-1141.
[3]Duguay D,Mercier F,Stagg J,et al.In vivo interferon regulatory factor 3 tumor suppressor activity in B16 melanoma tumors.Cancer Res,2002,62(18):5148-5152.
[4]Rampling R,Cruickshank G,Papanastassiou V,et al.Toxicity evaluation of replication-competent herpes simplex virus(ICP 34.5 null mutant 1716)in patients with recurrent malignant glioma.Gene Ther,2000,7(10):859-866.
[5]Bacci G,Rocca M,Salone M,et al.High grade osteosarcoma of the extremities with lung metastases at presentation:treatment with neoadjuvant chemotherapy and simultaneous resection of primary and metastatic lesions.J Surg Oncol,2008,98(6):415-420.
[6]Markert JM,Liechty PG,Wang W,et al.Phase Ib trial of mutant herpes simplex virus G207 inoculated pre-and posttumor resection for recurrent GBM.Mol Ther,2009,17(1):199-207.
[7]Bharatan NS,Currier MA,Cripe TP.Differential suscepti-bility of pediatric sarcoma cells to oncolysis by conditionally replication-competent herpes simplex viruses.J Pediatr Hematol Oncol,2002,24(6):447-453.
[8]Coffey MC,Strong JE,Forsyth PA,et al.Reovirus therapy of tumors with activated Ras pathway,Science,1998,282(5392):1332-1334.
[9] Mundschau LJ,Faller DV.Endogenous inhibitors of the dsRNA-dependent eIF-2 alpha protein kinase PKR in normal and ras-transformed cells.Biochimie,1994,76(8):792-800.
[10]Krishnamurthy S,Takimoto T,Scroggs RA,et al.Differentially regulated interferon response determines the outcome of Newcastle disease virus infection in normal and tumor cell lines.J Virol,2006,80(11):5145-5155.
[11]Kirn D,Martuza RL,Zwiebel J.Replication-selective virotherapy for cancer:Biological principles,risk management and future directions.Nat Med,2001,7(7):781-787.
[12]Yao F,Schaffer PA.An activity specified by the osteosarcoma line U2OS can substitute functionally for ICP0,a major regulatory protein of herpes simplex virus type 1.J Virol,1995,69(10):6249-6258.
[13]Kelland LR.Of mice and men:values and liabilities of the athymic nude mouse model in anticancer drug development.Eur J Cancer,2004,40(6):827-836.
[14]Knipe DM,Howley PM.Fields Virology.5th Edition.Lippincott Williams&Wilkins,2007:569-570.
[15]Cairns R,Papandreou I,Denko N.Overcoming physiologic barriers to cancer treatment by molecularly targeting the tumor microenvironment.Mol Cancer Res,2006,4(2):61-70.
[16]Jain RK.Delivery of molecular and cellular medicine to solid tumors.Adv Drug Deliv Rev,2001,46(1-3):149-168.
[17]Tanaka T,Yamanaka N,Oriyama T,et al.Factors regulating tumor pressure in hepatocellular carcinoma and implications for tumor spread.Hepatology,1997,26(2):283-287.
[18]Stohrer M,Boucher Y,Stangassinger M,et al.Oncotic pressure in solid tumors is elevated.Cancer Res,2000,60(15):4251-4255.
[19]Minchinton AI,Tannock IF.Drug penetration in solid tumours.Nat Rev Cancer,2006,6(8):583-592.
[20]Grote D,Russell SJ,Cornu TI,et al.Live attenuated measles virus induces regression of human lymphoma xenografts in immunodeficient mice.Blood,2001,97(12):3746-3754.
[21]Gilliam AD,Watson SA.Emerging biological therapies for pancreatic carcinoma.Eur J Surg Oncol,2002,28(4):370-378.
Effect of a novel oncolytic herpes simplex virus KTR27 on nude mouse model of human osteosarcoma
WANG Difan1,XU Lihui2,WU Jie1*
(1.Department of Orthopaedics,Beijing Friendship Hospital,Capital Medical University,Beijing 100050;2.Department of OrthopaedicOncology,Beijing Jishuitan Hospital,FourthClinicalMedicalCollege,PekingUniversity,Beijing100035,China)
Background:In recent years the treatment of osteosarcoma has been on a plateau and it is necessary to explore new ways.With the development of tumor molecular biology and genetic engineering,oncolytic virus has become a hot spot due to its effect in treatment of malignant tumors.Objective:To investigate the effect of a novel oncolytic herpes simplex virus KTR27 on U2OS,a human osteosarcoma cell line,in vitro and nude mouse model of osteosarcoma with local primary tumor.Methods:Observe the cytopathogenic effect of KTR27 on U2OS cell through in vitro experiment.U2OS cell strain was injected into nude mice subcutaneously to establish nude mouse models of osteosarcoma,which were randomly divided into six groups including two blank control groups fed with common food and special food with tetracycline respectively;two groups injected with KTR27 of 1×107PFU/50 µl intratumorally and fed with common food and special food with tetracycline respectively;two groups injected with DMEM 50µl intratumorally and fed with common food and special food with tetracycline respectively.Measure and calculate the volume of tumors.Set up and compare the growth curve.Histological examination was carried out.Results:In vitro experiment showed that KTR27 had an obvious cytopathogenic effect on U2OS cell and many plaques were formed in cell culture.Nude mouse models of osteosarcoma by U2OS cell strain were successfully established and tumor growth curves were obtained.Tumor volumes of all groups were measured after KTR27 injection,and there were no significant difference among groups(P>0.05).The volume-time variation curves of all groups showed that the time tendency was significantly different among groups(p<0.05).After KTR27 injection,the tumor volume reduced and the tumor growth tendency was suppressed,and there was no significant difference between mice fed with common food and mice fed with special food with tetracycline(P>0.05).An increased tumor necrosis at 24 h after KTR27 injection was shown but tumor sites began to grow again after 7 days by pathologic examination.Conclusions:KTR27 has an obvious cytopathogenic effect on U2OS cell,therefore it can suppress the growth of tumor in nude mouse model of osteosarcoma established by injection with human osteosarcoma cell line U2OS subcutaneously.The effect has no change after administration with tetracycline.
Osteosarcoma;Nude Mouse;Oncolytic Virus;Herpes Simplex Virus
2095-9958(2017)08-0 341-06
10.3969/j.issn.2095-9958.2017.04-15
*通信作者:吴杰,E-mail:osteowu@aliyun.com

