普通小麦籽粒过氧化物酶活性全基因组关联分析
时佳,翟胜男,刘金栋,魏景欣,白璐,高文伟,闻伟锷,,何中虎,夏先春,耿洪伟
普通小麦籽粒过氧化物酶活性全基因组关联分析
时佳1,翟胜男2,刘金栋2,魏景欣2,白璐3,高文伟1,闻伟锷1,2,何中虎2,夏先春2,耿洪伟1
(1新疆农业大学农学院/新疆农业大学生物技术重点实验室,乌鲁木齐830052;2中国农业科学院作物科学研究所/国家小麦改良中心,北京100081;3新疆农业大学科学技术学院,乌鲁木齐830091)
小麦籽粒过氧化物酶(peroxidase,POD)活性对面制品加工品质有重要影响,发掘控制籽粒POD活性重要位点,并筛选其候选基因,为小麦品质的改良奠定基础。以151份黄淮冬麦区和82份北部冬麦区品种(系)为材料,分别利用来自于小麦90 K SNP芯片的18 189和18 417个高质量SNP标记,对POD活性进行全基因组关联分析(genome-wide association study,GWAS)。供试材料中POD活性表现出广泛的表型变异和多样性,黄淮麦区材料的POD活性变异系数为15.4%—21.8%,遗传力为0.79,北部麦区材料的POD活性变异系数为15.0%—19.9%,遗传力为0.82。相关性分析表明,不同环境之间材料的POD活性表现出显著的相关性,黄淮麦区相关系数为0.46—0.89(<0.0001),北部麦区相关系数为0.50—0.87(<0.0001)。多态性信息含量值为0.09—0.38,最小等位基因频率MAF值为0.05—0.5。群体结构分析表明,黄淮麦区与北部麦区2个自然群体结构简单,均可分为3个亚群。GWAS分析结果表明,在黄淮冬麦区材料中共检测到20个与POD活性显著关联的位点(<0.001),分布在1A、2A、2B、2D、3A、3B、3D、4A、4B、5A、5B、6A、6D和7A染色体上,单个位点可解释7.8%—13.3%的表型变异。在北部冬麦区材料中共检测到20个与POD活性显著关联(<0.001)的位点,分布在1A、1B、1D、2A、2B、2D、3A、3B、4B、6A、6B、7A、7B和7D染色体上,单个位点可解释14.4%—23.2%的表型变异。加性回归分析表明,随着优异等位基因数量的增多,小麦籽粒POD活性越高。在发现的所有POD活性相关位点中,2个位点在黄淮麦区和北部麦区材料中均能检测到且稳定遗传,可将其转换为STARP(semi-thermal asymmetric reverse PCR)或CAPS标记,以应用于分子标记辅助育种。获得3个与POD活性有关的候选基因,分别编码磷酸甘露糖变位酶()、辣根过氧化物酶()和烷基氢过氧化物还原酶()。黄淮麦区与北部冬麦区2个自然群体遗传多样性丰富,群体结构简单,适用于全基因组关联分析。在2个自然群体中分别发现20个POD活性位点,并在显著相关的位点区域内筛选到3个候选基因。含有越多优异等位变异的材料其POD活性越高。
普通小麦;POD活性;90 K SNP芯片;群体结构;候选基因
0 引言
【研究意义】面粉颜色是评价小麦品质的重要指标[1]。小麦籽粒中多酚氧化酶(polyphenol Oxidase,PPO)、过氧化物酶(peroxidase,POD)和脂肪氧化酶(lipoxidase,LOX)等是面粉和面制品在加工、储藏过程中被漂白和发生褐变的主要原因[2-3]。POD具有与LOX类似的对胡萝卜素等色素类物质的漂白作用,并可以作为主要的天然漂白剂与LOX同时加入到面粉中,使面团得以漂白,因此,高POD活性的小麦面粉白度更高[4]。另外,籽粒中的POD能催化阿魏酸等主要酚酸的氧化,并产生发色基团(如醌式结构),从而使面制品在制作和贮存过程中发生褐变[5-7]。目前,小麦籽粒LOX和PPO活性与颜色相关的指标在育种实践中已受到重视,但对POD与颜色相关性的研究较少[8]。鉴于POD对面制品色泽存在双重作用,深入开展普通小麦POD研究,对明确面制品颜色形成机制、影响因素及其改良策略具有重要意义。【前人研究进展】Žilić等[9]研究表明,普通小麦POD活性显著高于硬粒小麦(<0.05)。在普通小麦的不同品种间POD活性可相差3—10倍[10]。因此,通过遗传途径改良POD活性是可行的。Wei等[11]利用豆麦/石4185重组自交系(recombinant inbred lines,RIL)群体的214个株系和7 391个SNP标记及一个新开发的STS标记对普通小麦POD活性进行了QTL分析,共检测到3个QTL、和,它们在不同环境下分别解释5.3%—9.2%、9.3%—21.2%和5.8%—11.7%的表型变异。连锁分析理论上可以应用于所有性状的遗传解析,但受遗传群体亲本的差异度和群体大小等限制,定位QTL数目有限[12]。而关联作图则是一种能有效克服连锁作图局限的方法,连锁作图和关联作图相结合可以互为补充互为验证[13]。近年来,关联分析已被广泛应用于各种作物复杂农艺性状QTL的发掘。杨胜先等[14]、赖勇等[15]和张焕欣等[16]分别对大豆、大麦和玉米等作物进行了关联分析研究。而在小麦育种工作中,陈广凤等[17]利用24 355个SNP标记对205份中国冬小麦品种进行关联分析,共检测到38个与株高相关的SNP,其中11个位点在2个以上环境稳定表达。Sun等[18]利用90 K芯片对163份黄淮麦区冬小麦品种进行了产量相关性状GWAS,并发现了41个产量相关性状的QTL位点。Dong等[19]利用90K芯片对166份黄淮麦区冬小麦品种进行了碳水化合物进行GWAS,并发现了23个产量相关性状的QTL位点。【本研究切入点】虽然Wei等[11]用RIL群体对POD活性进行了全基因组连锁分析,并发现了3个POD活性位点,但迄今为止尚未有POD活性GWAS的报道。【拟解决的关键问题】本研究以151份黄淮麦区和82份北部冬麦区小麦品种(系)2个自然群体为材料,利用Wheat 90K iSelect SNP芯片,对小麦籽粒POD活性进行GWAS分析,以发掘新的POD活性位点,解析小麦POD遗传机制,为小麦POD活性的遗传改良提供可用分子标记。
1 材料与方法
1.1 供试材料
供试材料包括233份冬小麦品种(系),其中151份来自黄淮冬麦区(Yellow and Huai River Valley Facultative Wheat Region, YHRVWWR),于2012— 2013和2013—2014年度种植于河南安阳和安徽濉溪;82份材料来自于北部冬麦区(Northern Winter Wheat Region,NWWR),于2012—2013和2013—2014年度种植于北京顺义和河北石家庄。试验采用随机区组设计,3次重复,行长2 m,行距25 cm。上述试验材料均由中国农业科学院作物科学研究所小麦品质课题组提供。
1.2 POD活性检测
以25 μL的H2O2、5 μL 2%的愈创木酚和145 μL 0.05 mol·L-1的磷酸-柠檬酸缓冲液(pH 5.0)的混合液为底物,采用Wei等[13]的愈创木酚紫外分光光度法进行POD活性的检测,每个小麦品种的POD活性重复检测2次,2次检测结果相差超过10%的进行重复检测。
1.3 表型数据统计
采用SAS v9.2的PROC UNIVARIATE、RROC CORR程序分别进行描述性统计变量分析、相关分析和方差分析。利用R 3.31程序进行遗传力计算。广义遗传力计算公式:h= σ/ (σ+ σ/r +σ/ re),其中σ、σ和σ分别表示基因型方差、基因型与环境互作方差和误差方差,和分别表示环境个数和每个环境内的重复次数。
1.4 90 K SNP芯片基因型分型
基于Illumina测序平台,应用小麦90 K iSelectSNP芯片(81 587个SNP)对233份小麦品种(系)进行SNP分型,由博奥生物技术有限公司(http://www. capitalbio.com)完成。利用Genome Studio软件(http://www.illumina.com)进行SNP分型,具体操作参照Cavanagh等[20]方法。人工对分型结果进行质量控制,剔除数据缺失率>50%、杂合率>50%和最小等位基因频率(minor allele frequency,MAF)<0.05的SNP标记,保留高质量的SNP标记进行关联分析。使用Power Marker v3.25进行MAF和多态性信息含量(polymorphism information content,PIC)的运算[21]。
1.5 群体结构分析
关联分析前进行群体结构分析可有效降低结果中假阳性概率。采用Structure v2.3.4的Admixture Ancestry模型分析2个自然群体的群体结构。
1.6 全基因组关联分析
采用Tassel v5.0对2个自然群体进行kinship matrix(K matrix)运算。运用Tassel v5.0中的混合线性模型(mixed linear model,MLM),在考虑群体结构和亲缘关系的情况下,进行SNP标记与POD活性的关联分析。关联分析结果中多个SNP标记是否位于同一位点由LD衰减距离决定。在<0.001水平进行SNP标记和籽粒POD活性显著性检测。利用R语言对关联分析结果绘制Manhattan图和quantile-quantile(Q-Q)图。
1.7 候选基因筛选
以与POD活性显著关联的SNP标记序列为探针,在NCBI(http://www.ncbi.nlm.nih.gov/;National center for biotechnology information)和ENA(European Nucleotide Archive;http://www.ebi.ac.uk/ena)数据库中进行BLASTx,筛选与POD活性相关的候选基因。-值<10-5,序列一致性大于75%。
2 结果
2.1 POD活性分析
151份黄淮麦区冬小麦材料在安阳2013、濉溪2013、安阳2014、濉溪2014及均值环境下的POD活性分别为507.0、513.8、781.4、和727.5 U·min-1g-1,变异系数为15.4%—21.8%。各环境之间的POD活性呈极显著正相关,相关系数为0.46—0.89(<0.0001),遗传力为0.79。83份北部冬麦区材料在北京2013、石家庄2013、北京2014、石家庄2014及均值环境下POD活性分别为591.6、567.5、899.5、858.9和729.4 U·min-1g-1,变异系数为15.0%—19.9%。各环境之间POD活性呈极显著正相关,相关系数为0.50—0.87(<0.0001),遗传力为0.82(表1)。以上结果表明中国冬小麦品种(系)的POD活性主要受遗传因素控制,在早期世代对其进行选择是有效的;且籽粒POD活性变异范围广,具有较大的选择潜力。通过育种途径选育高POD活性的品种,进而改良小麦面制品颜色是可行的。

表1 233份品种中POD含量统计分析
***表示在<0.0001水平差异显著;SD:标准差;CV:变异系数
***Significant at<0.0001; SD: Standard deviation; CV: Variable coefficient
2.2 SNP标记的多态性及群体结构分析
利用90 K SNP芯片对151份黄淮麦区及82份北部冬麦区品种(系)进行检测。其中黄淮麦区最终采用18 189个SNP标记进行GWAS分析,平均单条染色体包含866个标记,A、B和D组染色体分别包含1 007、1 338和254个标记;北部冬麦区品种GWAS分析选用18 417个标记,平均每条染色体含有877个标记,A、B和D组染色体平均包含1 005、1 357和269个SNP标记。在2个自然群体中,SNP标记图谱长为3 700 cM,每个标记之间的平均遗传距离为0.2 cM。在2个群体所选标记的A、B和D组染色体中,均表现为A与B组染色体标记密度显著高于D组染色体(表2)。2个自然群体SNP标记值为0.09—0.38,MAF为0.05—0.50。
利用Structure v 2.3.4分别对2个自然群体进行遗传结构分析。当ΔK=3时,2个自然群体的K值均达到最大值(图1)。因此,2个群体均可分为3个亚群(图2)。在黄淮麦区中,第一亚群(记为Pop1)含有57份品种,以山东品种(43.0%)为主,还包括陕西、河南及18份国外品种;第二亚群(记为Pop2)共含有48份品种,以河南品种(37.5%)为主,还包括部分陕西和安徽品种;第三亚群(记为Pop3)中含有46份品种,以河南品种(56.5%)为主。北部冬麦区自然群体的第一亚群(记为Grp1)含有39份品种,主要由国外品种(66.6%)组成,还包括8份北京和5份山西品种;第二亚群(记为Grp2)共有13份国内品种,主要由北京品种(84.6%)组成;第三亚群(记为Grp3)共有30份品种,以国外品种(46.6%)为主,还包含12份北京品种、1份河北品种、1份山西品种和1份宁夏品种。

表2 黄淮麦区与北部冬麦区群体关联分析所用标记统计

图1 使用deltak值估计黄淮冬麦区(a)和北部冬麦区(b)品种亚群数

图2 黄淮冬麦区(a)和北部冬麦区(b)品种的群体结构分析
2.3 POD活性全基因组关联分析
对黄淮麦区151份品种(系)及北部冬麦区82份品种(系)的籽粒POD活性进行全基因组关联分析。当≤0.001时,认为该标记与POD活性显著关联,多个环境检测到的标记视为稳定遗传标记(图3)。由Q-Q图可以看出,2个自然群体的群体结构控制较好,可以避免假阳性的出现(图4)。黄淮麦区151份品种在A、B、D和全基因组水平下的LD衰减距离分别为5、7、11和7 cM,北部麦区82份品种在A、B、D和全基因组水平下的LD衰减距离分别为6、7、10和8 cM。GWAS结果中多个标记是否位于同一位点(Locus)由对应基因组的LD衰减距离决定。
在黄淮麦区共检测到20个位点,包含86个与POD活性显著关联的SNP标记(<0.001),分别位于1A、2A、2B、2D、3A、3B、3D、4A、4B、5A、5B、6A、6D和7A染色体上,单个位点可解释7.8%—13.7%的表型变异,其中4个位点至少在2个环境中稳定遗传,分布在2A(177 cM)、2D(97—103 cM)、5A(80 cM)和6A(7 cM)染色体上。在北部冬麦区群体中筛选到20个位点,包含51个与POD活性显著关联的SNP标记(<0.001),分布在1A、1B、1D、2A、2B、2D、3A、3B、4B、6A、6B、7A、7B和7D染色体上,单个位点可解释14.4%—23.2%的表型变异,其中4个位点至少在2个环境中稳定遗传,分别位于2A(177 cM)、2D(97—99 cM)、7B(98—99 cM)和7D(182—184 cM)染色体上。在发现的所有POD活性相关位点中,2A(177cM,)和2D(99 cM,)2个位点在2个自然群体中均能检测到,且在多个环境下稳定存在(表3)。
2.4 优异等位变异与POD活性的回归分析
每个SNP标记含有2个等位变异,其中与高POD活性对应的等位变异则为优异等位变异。2个自然群体的优异等位变异的加性回归分析表明,黄淮麦区151份冬小麦品种(系)中含有1—16个优异等位基因,POD活性与优异等位基因数量呈正相关(=25.493+499.52,2=0.9517);而北部冬麦区82份冬小麦品种(系)中含有3—17个优异等位变异,POD活性与优异等位基因数量呈正相关(= 34.022+536.06,2=0.7554)(图5)。总之,优异等位基因数量越多,小麦籽粒POD活性越高。供试的233份材料中Soissons、SELYANKA、MV05-08、DONSKI-93、内乡188、鲁麦5号、鲁麦11号和泰山5号等品种含有较多的优异等位基因和较高的POD活性。

X轴表示小麦21条染色体上的SNP标记,Y轴表示-log10(P-value)值,2013SHV:2013濉溪,2013AHV:2013安阳,2014SHV:2014濉溪,2014AHV:2014安阳和H-Average:黄淮麦区4个环境的平均值;2013BBY:2013北京,2013SBY:2013石家庄,2014BBY:2014北京,2014SBY:2014石家庄和B-Average:北部麦区4个环境的平均值
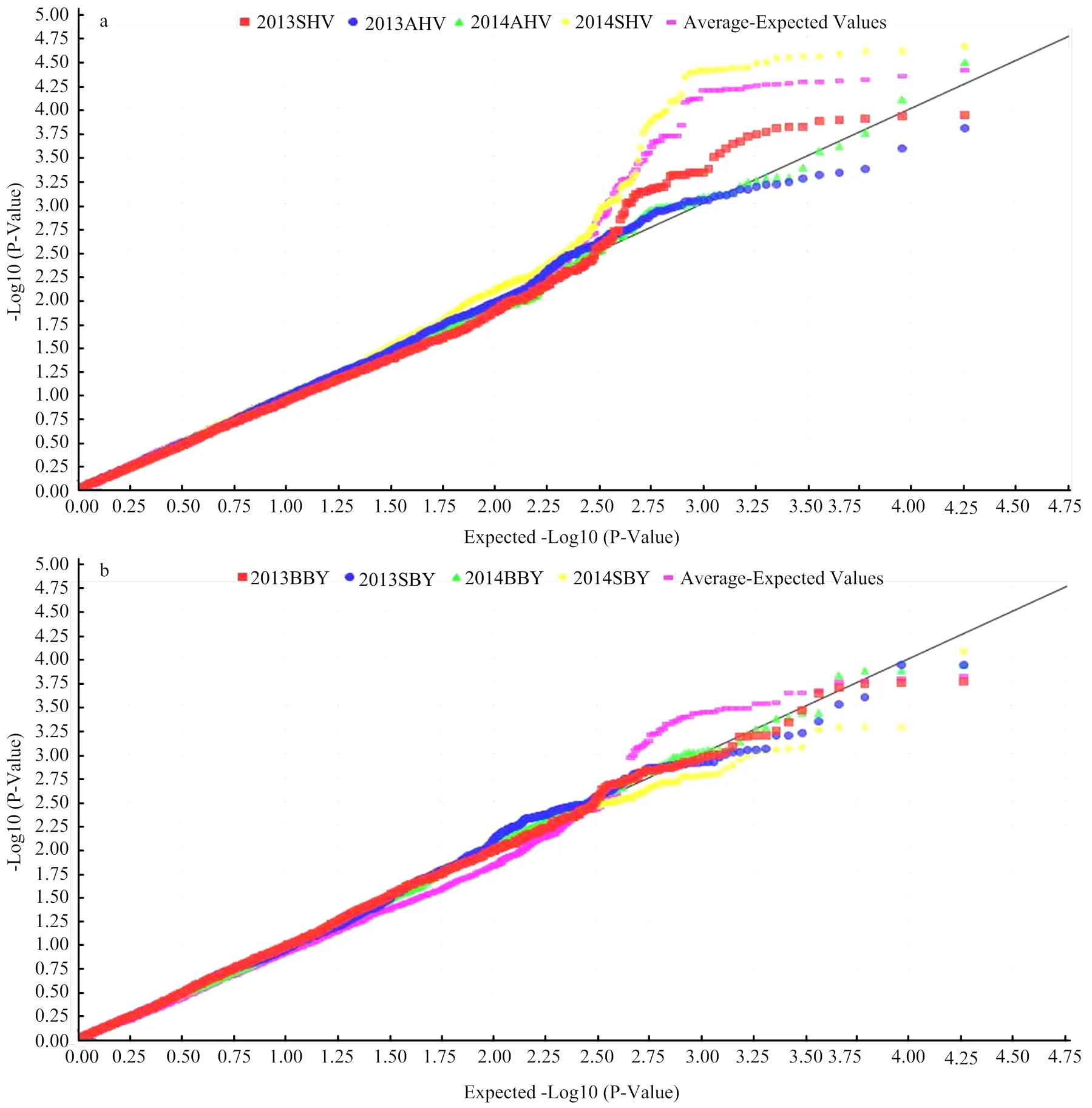
X轴表示经过负常数对数转换的期望P值;Y轴表示经过负常数对数转换观察到的P值。2013SHV:2013濉溪,2013AHV:2013安阳,2014SHV:2014濉溪,2014AHV:2014安阳和Average:4个环境的平均值;2013BBY:2013北京,2013SBY:2013石家庄,2014BBY:2014北京,2014SBY:2014石家庄和Average:4个环境的平均值
2.5 候选基因分析
将51个稳定遗传的与POD活性显著关联的SNP标记序列在NCBI数据库中进行BLASTx,获得3个候选基因,即编码产物为磷酸甘露糖变位酶phosphomannomutase的,编码辣根过氧化物酶和相关的分泌性的植物过氧化物酶的和编码烷基氢过氧化物还原酶(AhpC)的(表4),为后续功能验证及深入揭示POD活性表达机理奠定基础。

表3 黄淮冬麦区与北部冬麦区品种中与POD活性显著关联的SNP标记
aMarker混合线性模型(阈值为1E-03)检测到的SNP标记;bChromosome染色体信息;cPosition连锁图谱中SNP标记的位置;dENV在4个环境中被检测到的次数,One代表在1个环境中均检测到,Two代表在2个环境中均检测到,Three代表在3个环境中均检测到
aMarker, shared markers were detected in MLM models at the threshold -log (P)=3.0;bChromosome;cPosition, the marker position on the linkage map;dENV, times of MTAs identified in four environments. One means MTA identified in one environments; Two means MTA identified in two environments; Three means MTA identified in three environments
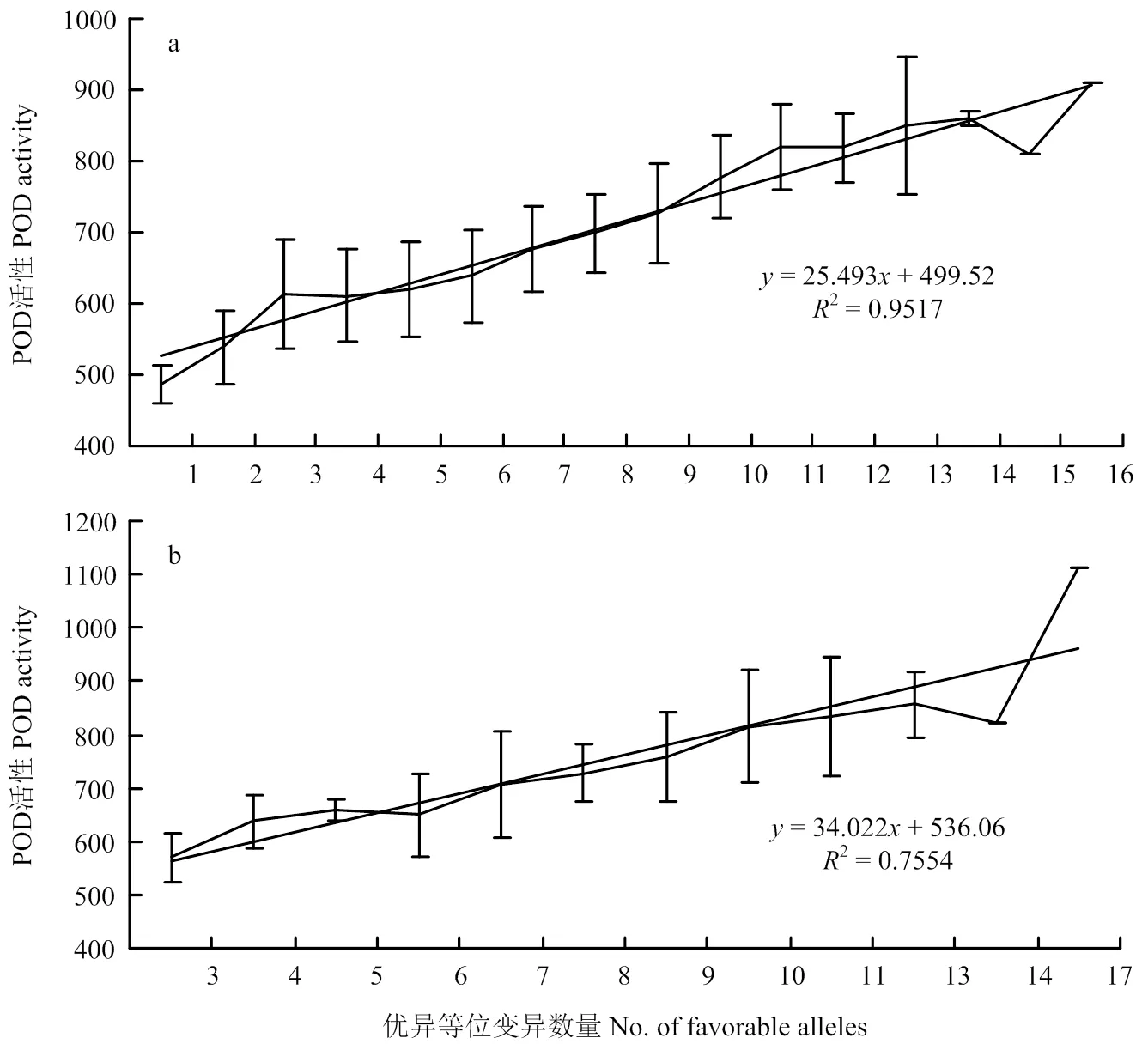
图5 黄淮冬麦区(a)和北部冬麦区(b)品种POD活性与优异等位基因数量的加性回归分析
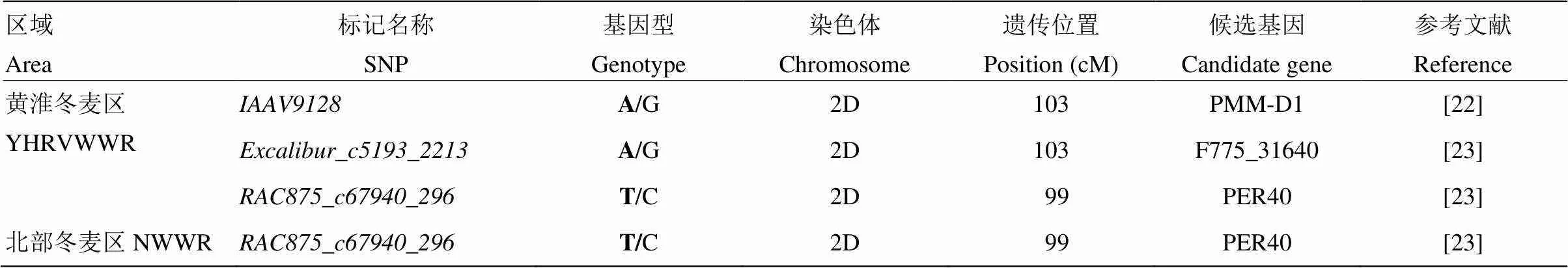
表4 黄淮冬麦区和北部冬麦区品种筛选获得的候选基因
YHRVWWR和NWWR分别代表黄淮冬麦区和北部冬麦区。基因型粗体为优异等位变异
NWWR and YHRFWWR represent Northern China Plain Winter Wheat Region and Yellow & Huai Facultative Winter Wheat Region, respectively. Bold of genotype indicates favorable POD alleles
3 讨论
3.1 POD活性定位及应用
小麦面粉颜色是衡量面制品品质的重要指标。影响面粉颜色的原因有很多,如小麦类胡萝卜素合成限速酶八氢番茄红素合酶(phytoene synthase,PSY)、多酚氧化酶PPO(polyphenol oxidase)与脂肪氧化酶LOX(lipoxygenase)。对PSY、PPO和LOX相关基因进行的研究已经较成熟,但对过氧化物酶POD的研究较少。POD也是影响面粉颜色的重要指标,因此,研究POD活性基因对小麦品质改良具有重要意义。
本研究利用90K SNP基因芯片对2个区域自然群体多个环境下的POD活性进行GWAS,检测到2A、2D、5A、6A、7B和7D等多个稳定遗传的位点。其中2D位点(97—100 cM)在3个环境中均能检测到,是比较稳定的遗传位点,可根据其连锁标记开发新的标记,用于分子标记辅助育种。将与其紧密连锁的12个SNP标记(、、、、、、、、、、和)转化为STARP或CAPS标记[24],将为分子标记辅助育种提供有效的工具。在检测到的多环境稳定遗传的标记位点中,7D位点的贡献率最大,为18.0%—21.4%。因此,在进一步研究中,可以考虑优先选择2D与7D染色体的关联位点进一步进行精细定位、图位克隆及功能标记开发,为分子标记辅助育种提供有益信息。此外,由于单个位点标记的选择效率有限,通过发现新的主效位点,将本研究发现的POD活性位点改进和开发的新的功能标记与小麦3A染色体的POD活性功能标记和[11]相结合,将多个主效位点结合起来进行分子标记辅助选择,能显著提高选择效率,最终选出高POD活性的材料。
另外POD活性与优异等位变异含量显著正相关,因此,含有较多的优异等位基因和较高的POD活性的品种,如Soissons、SELYANKA、MV05-08、DONSKI- 93、内乡188、鲁麦5号、鲁麦11号和泰山5等品种(系),可作为优良亲本用于育种工作,为POD活性改良工作提供基础。
3.2 基于90 K SNP基因芯片的关联分析与连锁分析比较
随着生物芯片技术的不断发展,利用高密度芯片对基因定位的研究越来越广泛。目前小麦中报道的芯片主要有小麦9K SNP芯片、小麦90K SNP芯片、小麦660K SNP芯片和小麦820K SNP芯片等。本研究所利用的小麦90K SNP 芯片:该芯片由美国Illumina公司与Akhunov E、Hayden M.及Cavanagh合作完成,包含81 587个SNP标记。其中有染色体信息的标记共42 104个,占51.61%[25]。90K芯片的分辨率已经很好,并且应用90K芯片来进行小麦基因定位的研究已经很成熟,虽然660K芯片与820K芯片的标记密度较90K芯片更高,但90K芯片较660K与820K芯片的成本较低,性价比更高。
Wei等[11]利用豆麦/石4185 RIL群体结合小麦90K SNP芯片,首次对普通小麦POD活性进行了连锁分析,发现了3个主效QTL。其中5A位点与本研究一致;进一步证明关联分析与连锁分析均能得到与目标性状显著相关的QTL位点,通过自然群体进行关联分析与连锁分析技术互为补充,互为验证。Zhai等[26]同样用90K SNP芯片对面粉颜色性状进行QTL定位,其中2D(84.3—94.0 cM)、5A(71.7—76.3 cM)和7B(109.2—114 cM)QTL与本研究检测到的2D(97—103 cM)、5A(80 cM)和7B(98和99 cM)位点相近。2种方法同时能检测到的重合位点是稳定遗传的关键位点。但是本研究发现大部分POD活性位点与QTL定位的位点并不相同,如GWAS结果中的7D等位点在2个麦区均为稳定遗传位点,但QTL定位并没有检测到,在排除假阳性和伪关联的前提下,可见以自然群体为材料的关联分析可以补充检测到更多与POD活性相关的新位点。近年来利用连锁分析进行QTL定位已经成为现代分子育种领域的研究重点,但受限于遗传群体亲本的差异度,单一以连锁分析的方法进行QTL定位往往会遗漏大量微效甚至主效基因[27]。而关联分析是一种利用自然群体中积累的历史重组结果,发掘性状关联位点的方法,此方法能达到比双亲分离群体更高的分辨率,是连锁分析的有益补充,能对连锁分析结果进行验证的同时,发现新的关键位点[28]。因此,基于高密度基因芯片,采用连锁分析结合关联分析技术发掘作物产量、品质、抗逆等数量性状基因已经成为分子标记研究领域的发展趋势[29-30]。
3.3 候选基因分析
编码产物为磷酸甘露糖变位酶(phosphomannomutase,PMM),在高等植物中,PMM是抗氧化抗坏血酸合成的重要前体物质[31],在高等植物POD调节途径中,PMM可以通过控制抗氧化抗坏血酸的合成来抑制POD活性[32]。编码辣根过氧化物酶和相关的分泌性的植物过氧化物酶,分泌过氧化物酶属于植物血红素依赖性POD超家族Ⅲ类。编码烷基氢过氧化物还原酶(AhpC),在植物体内,AhpC可以通过与POD竞争相同底物H2O2,来抑制POD活性[33]。以上候选基因编码不同蛋白,在植物代谢途径中直接或间接参与POD活性表达,故推测对小麦籽粒POD活性有调节作用,因此,在后续工作中对候选基因进行深入研究有助于为提高小麦籽粒POD活性提供依据。
4 结论
黄淮麦区与北部冬麦区2个自然群体遗传多样性丰富,群体结构简单,适用于全基因组关联分析。在2个自然群体中分别发现20个POD活性位点,其中有2个位点在2个自然群体中均能稳定遗传,发现3个候选基因、和。含有越多优异等位变异的材料,其POD活性越高,可并发掘高POD活性品种为育种工作提供优质材料。
[1] 席德清. 对当前面粉生产中几个问题的探讨. 中国商办工业, 1999, 11(7): 30-32.
XI D Q. Discussion on several problems in the current production of flour. Modern Business Trade Industry, 1999, 11(7): 30-32. (in Chinese)
[2] SIEDOW J N. Plant lipoxygenase: Structure and function. Annual Review of Plant Biology, 1991, 42(1): 145-188.
[3] BORRELLI G M, TROCCOLI A, DI FONZO N, FARES C. Durum wheat lipoxygenase activity and other quality parameters that affect pasta color. Cereal Chemistry, 1999, 76(3): 335-340.
[4] GELINAS P, POITRAS E, MCKINNON C M, MORIN A. Oxido-reductases and lipases as dough-bleaching agents. Cereal Chemistry, 1998, 75(6): 810-814.
[5] FRY S C. Cross-linking of matrix polymers in the growing cell walls of angiosperms. Annual Review of Plant Biology, 2003, 37(1): 165-186.
[6] TAHA S A, SAGI F. Relationships between chemical composition of durum wheat semolina and macaroni quality: Ⅱ. Ash, carotenoid pigments and oxidative enzymes. Cereal Research Communication, 1987, 15(2): 123-129.
[7] FRAIGNIER M P, MICHAUX-FERRIERE N, KOBREHEL K. Distribution of peroxidases in durum wheat (). Cereal Chemistry, 2000, 77(1): 11-17.
[8] HIDALGO A, BRANDOLINI A, POMPEI C. Carotenoids evolution during pasta, bread and water biscuit preparation from wheat flours., 2010, 121(3): 746-751.
[9] Žilić S, DODIG D, Šukalović V, MAKSIMOVIC M, SARATLIC G, SKRBIC B. Bread and durum wheat compared for antioxidants contents, and lipoxygenase and peroxidases activities. International Journal of Food Science &Technology, 2010, 45(7): 1360-1367.
[10] MCDONALD C E. Lipoxygenase and lutein bleaching activity of durum wheat semolina., 1979, 56(2): 84-89.
[11] WEI J X, GENG H W, ZHANG Y, LIU J D, WEN W E, ZHANG Y, XIA X C, HE Z H. Mapping quantitative trait loci for peroxidase activity and developing gene-specific markers foron wheat chromosome 3AL. Theoretical and Applied Genetics, 2015, 128(10): 2067.
[12] 张国华, 高明刚, 张桂芝, 孙金杰, 靳雪梅, 王春阳, 赵岩, 李斯深. 黄淮麦区小麦品种(系)产量性状与分子标记的关联分析. 作物学报, 2013, 39(7): 1187-1199.
ZHANG G H, GAO M G, ZHANG G Z, SUN J J, JIN X M, WANG C Y, ZHAO Y, LI S S. Association analysis of yield traits with molecular markers in Huang-Huai River Valley winter wheat region, China. Acta Agronomica Sinica, 2013, 39(7): 1187-1199. (in Chinese)
[13] WEI T M, CHANG X P, MIN D H, JING R L. Analysis of genetic diversity and tapping elite alleles for plant height in drought-tolerant wheat varieties. Acta Agronomica Sinica, 2010, 36(6): 895-904.
[14] 杨胜先, 牛远, 李梦, 魏世平, 刘晓芬, 吕海燕, 章元明. 栽培大豆农艺性状的关联分析及优异等位变异挖掘. 中国农业科学, 2014, 47(20): 3941-3952.
YANG S X, NIU Y, Li M, WEI S P, LIU X F, LÜ H Y, ZHANG Y M. Association mapping of agronomic traits in soybean (L. Merr.) and mining of novel alleles. Scientia Agricultura Sinica, 2014, 47(20): 3941-3952. (in Chinese)
[15] 赖勇, 王鹏喜, 范贵强, 司二静, 王晋, 杨轲, 孟亚雄, 李葆春, 马小乐, 尚勋武, 王化俊. 大麦SSR标记遗传多样性及其与农艺性状关联分析. 中国农业科学, 2012, 46(2): 233-242.
LAI Y, WANG P X, FAN G Q, SI E J, WANG J, YANG K, MENG Y X, LI B C, MA X L, SHANG X W, WANG H J. Genetic diversity and association analysis using SSR markers in barley. Scientia Agricultura Sinica, 2012, 46(2): 233-242. (in Chinese)
[16] 张焕欣, 翁建峰, 张晓聪, 刘昌林, 雍洪军, 郝转芳, 李新海. 玉米穗行数全基因组关联分析. 作物学报, 2014, 40(1): 1-6.
ZHANG H X, WENG J F, ZHANG X C, LIU C L, YONG H J, HAO Z F, LI X H. Genome-wide association analysis of kernel row number in maize. Acta Agronomica Sinica, 2014, 40(1): 1-6. (in Chinese)
[17] 陈广凤, 陈建省, 田纪春. 小麦株高相关性状与SNP标记全基因组关联分析. 作物学报, 2015, 41(10): 1500-1509.
CHEN G F, CHEN J X, TIAN J C. Genome-wide association analysis between SNP markers and plant height related traits in wheat. Acta Agronomica Sinica, 2015, 41(10): 1500-1509. (in Chinese)
[18] SUN C, ZHANG F, YAN X, ZHANG X, DONG Z, CUI D, CHEN F. Genome-wide association study for 13 agronomic traits reveals distribution of superior alleles in bread wheat from the Yellow and Huai Valley of China.Plant Biotechnology Journal, 2017, doi: 10.1111/pbi.12690.
[19] DONG Y, LIU J, ZHANG Y, GENG H, RASHEED A, XIAO Y, CAO S, FU L, YAN J, WEN W. Genome-wide association of stem water soluble carbohydrates in bread wheat. Plos One, 2016, 11(11): e0164293.
[20] CAVANAGH C R, CHAO S, WANG S, HUANG B E, STEPHEN S, KIANI S, FORREST K, SAINTENAC C, BROWN-GUEDIRA G L, AKHUNOVA A, SEE D, BAI G, PUMPHREY M, TOMAR L, WONG D, KONG S, REYNOLDS M, DA SILVA M L, BOCKELMAN H, TALBERT L, ANDERSON J A, DREISIGACKER S, BAENZIGER S, CARTER A, KORZUN V, MORRELL P L, DUBCOVSKY J, MORELL M K, SORRELLS M E, HAYDEN M J, AKHUNOV E. Genome-wide comparative diversity uncovers multiple targets of selection for improvement in hexaploid wheat landraces and cultivars. Proceedings of the National Academy of Sciences of the USA, 2013, 110(20): 8057-8062.
[21] LUI K, MUSE S V. Power Marker: integrated analysis environment for genetic marker data. Bioinformatics, 2005, 21(9): 2128-2129.
[22] KAWAURA K, MOCHIDA K, ENJU A, TOTOKI Y, TOYODA A, SAKAKI Y, SHINOZAKI K. Assessment of adaptive evolution between wheat and rice as deduced from full-length common wheat cDNA sequence data and expression patterns. BMC Genomics, 2009, 10(1): 271.
[23] JIA J, ZHAO S, KONG X, LI Y, ZHAO G, HE W, JING R.draft genome sequence reveals a gene repertoire for wheat adaptation. Nature, 2013, 496(7443): 91-95.
[24] LONG Y M, CHAO W S, MA G J, XU S S, QI L L. An innovative SNP genotyping method adapting to multiple platforms and throughputs. Theoretical and Applied Genetics, 2017, 130(3): 597-607.
[25] WANG S, WONG D, FORREST K, ALLEN A, CHAO S, HUANG B E, MACCAFERRI M, SALVI S, MILNER S G, CATTIVELLI L. Characterization of polyploid wheat genomic diversity using a high-density 90,000 single nucleotide polymorphism array. Plant Biotechnology Journal, 2014, 12(6): 787.
[26] ZHAI S N, HE Z H, WEN W E, JIN H, LIU J D, ZHANG Y, LIU Z Y, XIA X C. Genome-wide linkage mapping of flour color-related traits and polyphenol oxidase activity in common wheat. Theoretical and Applied Genetics, 2016, 129(2): 377-394.
[27] XIE J Z, HUO N X, ZHOU S G, WANG Y, GUO G H, DEAL K R, QUYANG S H, LIANG Y, WANG Z Z, XIAO L C, ZHOU T T, HU T Z, TIWARIV, ZHANG J W, LI H X, NI Z F, YAO Y Y, RENG H R, ZHANG S L, ANDERSON O D, MCGUIRE P E, DVORAK J, LUO M C, LIU Z Y, GU Y Q, SUN Q X. Sequencing and comparative analyses ofchromosome arm 3DS reveal rapid evolution of Triticeae genomes. Journal of Genetics and Genomics, 2017, 44(1): 51-61.
[28] 周生辉, 吴秋红, 谢菁忠, 陈娇娇, 陈永兴, 傅琳, 王国鑫, 于美华, 王振忠, 张德云, 王令, 王丽丽, 张艳, 梁荣奇, 韩俊, 刘志勇. 小麦燕大1817×北农6号重组自交系群体在正常和盐胁迫水培条件下苗期性状的QTL定位. 作物学报, 2016, 42(12): 1764-1778.
ZHOU S H, WU Q H, XIE J Z, CHEN J J, CHEN Y X, FU L, WANG G X, YU M H, WANG Z Z, ZHANG D Y, WANG L, WANG L L, ZHANG Y, LIANG R Q, HAN J, LIU Z Y. Mapping QTLs for wheat seedling traits in RILs population of Yanda 1817×Beinong 6 under normal and salt-stress conditions. Acta Agronomica Sinica, 2016, 42(12): 1764-1778. (in Chinese)
[29] HUANG X, WEI X, SANG T, ZHAO Q, FENG Q, ZHAO Y, LI C, ZHU C, LU T, ZHANG Z, LI M, FAN D, GUO Y, WANG A, WANG L, DENG L, LI W, LU Y, WENG Q, LIU K, HUANG T, ZHOU T, JING Y, LI W, LIN Z, BUCKLER E S, QIAN Q, ZHANG Q F, LI J, HAN B. Genome-wide association studies of 14 agronomic traits in rice landraces. Nature Genetics, 2010, 42(11): 961-967.
[30] WRIGHT S I, BI I V, SCHROEDER S G,YAMASAKI M, DOEBLEY J F, MCMULLEN M D, GAUT B S. The effects of artificial selection on the maize genome. Science, 2005, 308(5726): 1310-1314.
[31] YU C, LIU X, ZHANG Q, HE X, HUAI W, WANG B, ZHOU R. Molecular genetic analysis of phosphomannomutase genes in Triticummonococcum. The Crop Journal, 2015, 3(1): 29-36.
[32] 刘敏, 曹志军, 李正英, 敖万凤, 李艳梅. 木耳菜过氧化物酶活性及其影响因素的研究. 中国酿造, 2009, 28(11): 50-52.
LIU M, CAO Z J, LI Z Y, AO W F, LI Y M. Activity and its influence factor of peroxidase from. China Brewing, 2009, 28(11): 50-52. (in Chinese)
[33] HUSSAIN R M, ABDULLAH N F, ABDULLAH N F, AMOM Z, Killing ofby allylpyrocatechol is potentiated by induction of intracellular oxidative stress and inhibition of catalase activity. Journal of Integrative Medicine, 2016, 14(6): 456-464.
(责任编辑 李莉)
附表1 黄淮麦区POD活性数据
Table S1 The POD activity in Yellow & Huai Facultative Winter Wheat Region (U·min-1g-1)

品种名称Name来源Origin2013濉溪2013SHV2013安阳2013AHV2014安阳2014AHV2014濉溪2014SHV平均值mean 185中3385 Zhong 33中国河南Henan, China547.5559.8780.3984.9718.1 2Aca 601阿根廷Argentina652.4550.8857.7930.0747.7 3Aca 801阿根廷Argentina417.1387.8797.4610.7553.2 4Barra意大利Italy627.0559.51015.11136.4834.5 5Dorico意大利Italy585.8477.9910.71010.1746.1 6Genio意大利Italy729.6509.9697.7670.3651.9 7Hk1/6/Nvsr3/5/Bez/Tvr/5/Cfn/Bez//Su92/Ci13645/3Nai60土耳其Turkey401.1530.6761.4883.4644.1 8Kanto 107日本Japan498.4434.8764.0781.4619.6 9Kitanokaori日本Japan459.4505.0868.7863.1674.0 10Klein Flecha阿根廷Argentina302.9447.5721.1668.0534.8 11Klein Jabal 1阿根廷Argentina439.0379.4584.7694.4524.4 12Libero意大利Italy416.7535.5807.0876.0658.8 13Mantol意大利Italy496.2476.9783.21182.8734.8 14Nidera Baguette 20阿根廷Argentina322.8846.9899.3946.4753.8 15Norin 61日本Japan632.7444.8785.1952.4703.7 16Norin 67日本Japan491.0705.6956.11046.6799.8 17ProintaColibr 1阿根廷Argentina430.3494.0685.8782.4598.1 18Sagittario意大利Italy392.2398.5761.1707.0564.7 19Abbondanza意大利Italy527.8546.8699.4786.1640.0 20Funo意大利Italy646.3635.9825.5989.7774.3 21矮丰3 Aifeng 3中国陕西Shaanxi, China479.2479.5713.71032.8676.3 22矮抗58 Aikang 58中国河南Henan, China383.4425.8754.5831.3598.8 23安1331 An 1331中国安徽Anhui, China352.2416.1690.6827.0571.5 24百农3217 Bainong 3217中国河南Henan, China416.8406.8537.1780.9535.4 25百农64 Bainong 64中国河南Henan, China351.0404.1625.2713.4523.4 26碧蚂1号 Bima 1中国陕西Shaanxi, China466.3438.1768.3838.7627.8 27碧蚂4号 Bima 4中国陕西Shaanxi, China561.6475.8879.0855.2692.9 28丰产3 Fengchan 3中国陕西Shaanxi, China370.9526.9679.5857.9608.8 29阜936 Fu 936中国安徽Anhui, China463.9655.7644.6886.8662.7 30高优503 Gaoyou 503中国河北Hebei, China503.2546.6669.6822.8635.5 31藁城8901 Gaocheng 8901中国河北Hebei, China365.5188.6524.7646.5431.3 32观35 Guan 35中国河北Hebei, China465.1422.4623.2625.1533.9 33邯6172 Han 6172中国河北Hebei, China483.5594.4795.6898.4693.0 34衡7228 Heng 7228中国河北Hebei, China479.9444.6710.3756.5597.8 35衡观33 Hengguan 33中国河北Hebei, China455.7396.2650.8851.9588.7 36花培5号 Huapei 5中国河南Henan, China393.5336.2660.8693.0520.9 37淮麦18 Huaimai 18中国安徽Anhui, China448.5458.5613.0712.8558.2 38淮麦20 Huaimai 20中国安徽Anhui, China521.3437.0782.4999.5685.0 39淮麦21 Huaimai 21中国安徽Anhui, China361.7452.7752.3802.9592.4 40济麦19 Jimai 19中国山东Shandong, China359.0450.8571.0687.7517.1 41济麦20 Jimai 20中国山东Shandong, China528.2512.6757.4825.0655.8 42济麦21 Jimai 21中国山东Shandong, China644.8710.9772.51203.2832.8 43济麦22 Jimai 22中国山东Shandong, China758.9670.11041.01176.6911.6 44济南17 Jinan 17中国山东Shandong, China468.5416.6661.8824.4592.8 45济宁16 Jining 16中国山东Shandong, China430.7405.6699.6747.3570.8 46冀师02-1 Jishi 02-1中国河北Hebei, China631.9512.8747.6927.5704.9 47金禾9123 Jinhe 9123中国河北Hebei, China573.0390.7671.9757.4598.2 48济麦61 Jinmai 61中国山东Shandong, China460.9341.6642.6879.3581.1 49兰考24 Lankao 24中国河南Henan, China852.2758.71016.91136.4941.1 50兰考2 Lankao 2中国河南Henan, China658.1659.9775.21089.9795.8 51兰考906 Lankao 906中国河南Henan, China784.2489.31081.41151.3876.5 52良星66 Liangxing 66中国山东Shandong, China839.3705.11048.81226.0954.8 53良星99 Liangxing 99中国山东Shandong, China528.1644.41131.51090.4848.6 54临旱2号Linhan 2中国山西Shanxi, China460.3438.2705.9861.8616.6 55临抗12 Linkang 12中国山西Shanxi, China421.6465.0664.4891.0610.5 56临麦2号 Linmai 2中国山东Shandong, China487.2654.51054.41252.4862.1 57临麦4号 Linmai 4中国山东Shandong, China592.3574.5776.41150.5773.4 58鲁麦11 Lumai 11中国山东Shandong, China385.3534.2559.0659.8534.6 59鲁麦14 Lumai 14中国山东Shandong, China473.6633.31144.51228.7870.0 60鲁麦15 Lumai 15中国山东Shandong, China506.3447.2712.4853.7629.9 61鲁麦21 Lumai 21中国山东Shandong, China612.0673.8774.5846.0726.6 62鲁麦23 Lumai 23中国山东Shandong, China527.6558.3898.71014.5749.8 63鲁麦5 Lumai 5中国山东Shandong, China510.3509.9832.8941.3698.6 64鲁麦6 Lumai 6中国山东Shandong, China535.9505.1770.31039.8712.8 65鲁麦7 Lumai 7中国山东Shandong, China571.1647.1808.41043.1767.4 66鲁麦8 Lumai 8中国山东Shandong, China436.1601.0593.9830.9615.5 67鲁麦9 Lumai 9中国山东Shandong, China646.5705.2930.81085.0841.8 68鲁原502 Lunyuan 502中国山东Shandong, China558.6671.11003.2914.7786.9 69洛旱2号 Luohan 2中国河南Henan, China349.6415.2646.1871.8570.7 70洛麦21 Luomai 21中国河南Henan, China451.2565.6776.3921.9678.7 71内乡188 Neixiang 188中国河南Henan, China561.8605.8827.0924.3729.7 72山农20 Shannong 20中国山东Shandong, China498.7650.9931.4799.7720.2 73陕229 Shaan 229中国陕西Shaanxi, China452.4456.4677.9917.1626.0 74陕223 Shaan 253中国陕西Shaanxi, China397.6469.6719.3862.4612.2 75陕354 Shaan 354中国陕西Shaanxi, China519.5471.0760.1726.7619.3 76陕512 Shaan 512中国陕西Shaanxi, China368.4350.4714.5706.7535.0 77陕715 Shaan 715中国陕西Shaanxi, China299.9318.2722.3629.2492.4 78陕麦509 Shaanmai 509中国陕西Shaanxi, China634.9423.4844.8805.1677.0 79陕麦94 Shaanmai 94中国陕西Shaanxi, China570.1564.5873.2998.6751.6 80陕农78-59 Shaannong 78-59中国陕西Shaanxi, China507.7434.6777.0671.4597.7 81陕农981 Shaannong 981中国陕西Shaanxi, China434.6327.0591.8581.1483.6 82陕优225 Shaanyou 225中国陕西Shaanxi, China378.1385.0715.1746.2556.1 83石4185 Shi 4185中国河北Hebei, China443.1392.9796.2665.5574.4 84石家庄15 Shijiazhuang 15中国河北Hebei, China383.1564.2814.2814.9644.1 85石家庄8 Shijiazhuang 8中国河北Hebei, China494.6394.5876.3878.9661.1 86石新733 Shixin 733中国河北Hebei, China525.0396.5622.0819.0590.6 87石新828 Shixin 828中国河北Hebei, China576.8436.9711.6803.0632.1 88石优17 Shiyou 17中国河北Hebei, China520.0366.7955.21079.4730.3 89宿0663 Su 0663中国安徽Anhui, China535.2630.8657.8805.5657.3 90宿农6号 Sunong 6中国安徽Anhui, China518.3739.5982.11049.4822.3 91泰山1号 Taishan 1中国山东Shandong, China692.6607.61013.11183.5874.2 92泰山5号 Taishan 5中国山东Shandong, China512.2579.2780.91078.5737.7 93皖23094 Wan 23094中国安徽Anhui, China411.6667.6753.0870.9675.8 94皖麦29 Wanmai 29中国安徽Anhui, China333.8400.3545.0734.4503.4 95皖麦33 Wanmai 33中国安徽Anhui, China456.5471.5658.6929.0628.9 96皖麦38 Wanmai 38中国安徽Anhui, China517.4407.1695.1862.5620.5 97皖麦50 Wanmai 50中国安徽Anhui, China539.7521.3825.81108.6748.8 98皖麦52 Wanmai 52中国安徽Anhui, China499.1503.3759.9886.5662.2 99皖麦53 Wanmai 53中国安徽Anhui, China470.9544.2746.6805.4641.7 100汶农14 Wennong 14中国山东Shandong, China477.4561.21085.11115.1809.7 101汶农5 Wennong 5中国山东Shandong, China551.4528.1809.4788.7669.4 102汶农148 Wunong 148中国山东Shandong, China410.6417.5664.1836.3582.1 103西农1376 Xinong 1376中国陕西Shaanxi, China478.6478.6699.3804.0615.1 104西农2000-7 Xinong 2000-7中国陕西Shaanxi, China409.4379.8654.8633.3519.3 105西农291 Xinong 291中国陕西Shaanxi, China509.0508.21016.0855.4722.2 106西农88 Xinong 88中国陕西Shaanxi, China458.5522.3715.1775.9617.9 107西农975-005 Xinong 979-005中国陕西Shaanxi, China484.4438.7660.3770.2588.4 108小偃22 Xiaoyan 22中国陕西Shaanxi, China630.7519.9762.3983.4724.1 109小偃54 Xiaoyan 54中国陕西Shaanxi, China499.6424.5737.4790.1612.9 110小偃81 Xiaoyan 81中国陕西Shaanxi, China568.7584.2848.9905.2726.7 111新麦19 Xinmai 19中国新疆Xinjiang, China750.0482.2733.4980.1736.4 112新麦9408 Xinmai 9408中国新疆Xinjiang, China594.8562.4741.51068.3741.7 113新麦9 Xinmai 9中国新疆Xinjiang, China497.6564.0813.5948.0705.8 114烟农15 Yannong 15中国山东Shandong, China751.9520.2880.2968.1780.1 115烟农19 Yannong 19中国山东Shandong, China432.2644.3835.41118.1757.5 116偃展4110 Yanzhan 4110中国河南Henan, China650.5627.7788.4952.1754.7 117豫麦13 Yumai 13中国河南Henan, China367.6361.6677.6737.3536.0 118豫麦18 Yumai 18中国河南Henan, China420.3484.6806.9820.8633.2 119豫麦21 Yumai 21中国河南Henan, China356.9367.9477.5643.3461.4 120豫麦2 Yumai 2中国河南Henan, China435.0536.8787.2780.3634.8 121豫麦34 Yumai 34中国河南Henan, China575.1555.1854.31184.6792.3 122豫麦35 Yumai 35中国河南Henan, China564.3487.8879.0992.3730.8 123豫麦47 Yumai 47中国河南Henan, China639.9463.9727.5942.8693.5 124豫麦49 Yumai 49中国河南Henan, China536.0660.3944.41040.0795.2 125豫麦50 Yumai 50中国河南Henan, China495.6589.6895.7859.7710.1 126豫麦63 Yumai 63中国河南Henan, China336.3613.8823.7864.9659.7 127豫麦7 Yumai 7中国河南Henan, China445.8419.2599.6905.9592.6 128郑9023 Zheng 9023中国河南Henan, China468.4544.5783.3842.1659.6 129郑引1号 Zhengyin 1中国河南Henan, China537.2685.0972.6878.9768.4 130郑州3号 Zhengzhou 3中国河南Henan, China791.9695.2932.41042.1865.4 131中892 Zhong 892中国河南Henan, China797.8561.5978.01066.4850.9 132中麦871 Zhongmai 871中国河南Henan, China531.6474.2781.7860.4662.0 133中麦875 Zhongmai 875中国河南Henan, China491.6495.8808.2960.4689.0 134中麦895 Zhongmai 895中国河南Henan, China460.7478.6745.7922.6651.9 135中育5号 Zhongyu 5中国河南Henan, China306.7398.9821.4530.2514.3 136中育9号 Zhongyu 9中国河南Henan, China401.9517.9757.1761.3609.6 137周8425B Zhou 8425B中国河南Henan, China554.8820.51061.11199.6909.0 138周麦11 Zhoumai 11中国河南Henan, China478.3449.2895.2960.3695.7 139周麦12 Zhoumai 12中国河南Henan, China608.3712.6926.91015.7815.9 140周麦13 Zhoumai 13中国河南Henan, China713.4858.6725.01126.4855.8 141周麦16 Zhoumai 16中国河南Henan, China542.3413.7713.11037.9676.7 142周麦18 Zhoumai 18中国河南Henan, China535.7513.0804.01023.2719.0 143周麦19 Zhoumai 19中国河南Henan, China449.8349.0675.0961.5608.8 144周麦22 Zhoumai 22中国河南Henan, China515.4492.0747.5962.7679.4 145周麦23 Zhoumai 23中国河南Henan, China491.9580.2701.1830.7651.0 146周麦25 Zhoumai 25中国河南Henan, China529.3433.6611.8757.5583.0 147周麦26 Zhoumai 26中国河南Henan, China512.4533.4902.6803.6688.0 148周麦31 Zhoumai 31中国河南Henan, China391.7464.6707.1765.9582.3 149周麦32 Zhoumai 32中国河南Henan, China514.7476.5670.2888.9637.6 150淄麦12 Zimai 12中国山东Shandong, China583.3509.7854.11077.9756.2 151淄选2号 Zixuan 2中国山东Shandong, China588.5541.4834.5870.3708.7
附表2 北部冬麦区POD活性数据
Table S2 The POD activity in Northern China Plain Winter Wheat Region (U·min-1g-1)

品种名称Name来源Origin2013北京2013 BBV2013石家庄2013SBV2014北京2014 BBV2014石家庄2014 SBV平均mean 1Batjko俄罗斯Russia781.2649.81037.41130.9899.8 2Bruta法国France238.1577.6820.1908.9636.2 3C英国Britain482.3368.8849.5698.3599.7 4C 39英国Britain505.9572.9907.5799.7696.5 5CA1119中国北京Beijing, China596.0602.4788.9951.8734.8 6Carimulti法国France717.2636.11155.61128.3909.3 7D法国France669.1523.8900.1975.3767.1 8Darius法国France584.6598.6845.1820.5712.2 9E意大利Italy758.4811.91202.11154.9981.8 10F498U1-1021/Boema罗马尼亚Romania619.6624.81065.8777.3771.9 11F98047G14-2INC罗马尼亚Romania694.5549.1962.4869.7768.9 12Festin法国France521.6521.61033.8984.8765.4 13Fr03717 法国France786.6424.6863.9825.3725.1 14Fr03724法国France627.7428.2819.0918.6698.4 15Fr03725法国France630.0516.9848.1567.3640.6 16Fr3713法国France508.6502.81039.3743.4698.5 17Insignia法国France604.8689.4787.7787.7717.4 18Jagger/W94-244-132美国USA556.4595.0838.7801.9698.0 19Kniish 46俄罗斯Russia767.8639.11014.3736.1789.3 20Lovrin13 罗马尼亚Romania780.9595.7842.7964.8796.0 21Magnus德国Germany525.9525.9825.1825.1675.5 22Manital法国France425.9425.9778.2778.2602.0 23Mason/Jagger意大利Italy440.0436.9831.2824.6633.2 24Mesofold法国France415.3394.4621.6635.1516.6 25NSA09-3645法国France619.7619.71052.7912.5801.1 26RE714挪威Norway629.8527.9990.8891.5760.0 27Salmone法国France478.2486.2857.3801.6655.8 28Soissons法国France883.9772.71590.51200.01111.8 29Thesee法国France675.7537.51175.9851.4810.1 30Wgrc10/3/KS93U69sib/TA2455//KS93U69/4/Jagger美国USA608.0502.7952.1874.5734.3 31北京0045Beijing 0045中国北京Beijing, China595.6540.0826.9789.3688.0 32长武134Changwu 134中国陕西Shaanxi, China571.1766.5914.1743.4748.8 33晋麦45Jinmai 45中国山西Shanxi, China675.6731.1919.9884.1802.7 34京9428Jing 9428中国北京Beijing, China578.1626.0872.1901.2744.4 35农大139Nongda 139中国北京Beijing, China685.0511.3843.5961.4750.3 36秦农151Qinnong 151中国陕西Shaanxi, China513.5574.3956.9708.3688.3 37秦农731Qinnong 731中国陕西Shaanxi, China602.1626.4999.8795.2755.9 38洋小麦Yangxiaomai中国地方种Local species, China801.5561.8881.6989.3808.5 39中优206Zhongyou 206中国北京Beijing, China496.9493.9773.0772.8634.1 40中优9507Zhongyou 9507中国北京Beijing, China738.4729.51031.6901.7850.3 41CA0548中国北京Beijing, China576.0741.4805.4903.9756.7 42CA0816 (white)中国北京Beijing, China488.7649.6853.4880.4718.0 43CA0816 (red)中国北京Beijing, China529.2567.7855.4677.1657.3 44CA0958中国北京Beijing, China546.8654.0775.5990.0741.6 45CA0998中国北京Beijing, China432.5417.8704.3613.2542.0 46CA1055中国北京Beijing, China611.2447.7514.7773.3586.7 47CA1090中国北京Beijing, China605.3646.7905.1933.6772.7 48CA1133中国北京Beijing, China643.4833.61161.91104.0935.7 49CA1135中国北京Beijing, China659.9773.91033.61167.2908.7 50京411Jing 411中国北京Beijing, China690.5715.5924.6841.8793.1 51宁冬11Ningdong 11中国宁夏Ningxia, China619.4592.7958.4912.0770.6 52新麦37Xinmai 37中国新疆Xinjiang, China446.5491.2555.0612.9526.4 53中麦175Zhongmai 175中国北京Beijing, China760.2887.0921.01190.4939.6 54中麦415Zhongmai 415中国北京Beijing, China437.9445.9657.6647.2547.1 5598039G5-103罗马尼亚Romania694.3461.9803.4891.2712.7 56Aztec法国France597.3595.8995.8909.6774.6 57Azulon法国France508.7467.3927.3938.1710.4 58CA1062中国北京Beijing, China502.2354.1695.8540.9523.2 59CA9722中国北京Beijing, China528.7515.3728.3800.9643.3 60Donski-93俄罗斯Russia676.3676.31214.4987.6888.6 61F92080G1-1/F93042G2-1罗马尼亚Romania587.5448.6996.3996.3757.2 62LASEN法国France561.2405.2700.4786.8613.4 63Lovrin10 罗马尼亚Romania625.1649.21101.2915.5822.8 64MV05-08匈牙利Hungary580.5555.71189.0926.6812.9 65Palpich俄罗斯Russia562.9467.2924.3936.6722.7 66Selyanka俄罗斯Russia711.0587.81124.5939.0840.6 67Starshina俄罗斯Russia609.8546.1903.0772.1707.7 68TX03A0148 美国USA610.4610.4834.2881.9734.2 69YANA法国France556.0488.2922.3676.8660.8 70北京841Beijing 841中国北京Beijing, China484.0471.5827.8755.7634.8 71豆麦Doumai中国地方种Local species, China490.9419.4653.8706.2567.6 72丰抗2Fengkang 2中国北京Beijing, China477.4541.5760.1808.2646.8 73晋麦67Jinmai 67中国山西Shanxi, China631.0616.3958.3908.7778.6 74京冬17Jingdong 17中国北京Beijing, China398.4600.0778.5845.1655.5 75京冬22Jingdong 22中国北京Beijing, China744.4613.71086.2920.4841.2 76京冬8Jingdong 8中国北京Beijing, China682.3588.7914.0859.2761.1 77京双16Jingshuang 16中国北京Beijing, China567.5628.8937.5934.5767.1 78科衡6654Keheng 6654中国河北Hebei, China560.1472.6646.8682.2590.4 79轮选987Lunxuan 987中国北京Beijing, China406.7323.4665.2745.1535.1 80宁冬10Ningdong 10中国宁夏Ningxia, China626.3549.1866.1823.2716.2 81农大211Nongda 211中国北京Beijing, China544.7557.2853.4834.5697.4 82农大212Nongda 212中国北京Beijing, China548.8635.2807.6871.8715.9
Genome-Wide Association Study of Grain Peroxidase Activity in Common Wheat
SHI Jia1, ZHAI ShengNan2, LIU JinDong2, WEI JingXin2, BAI Lu3, GAO WenWei1, WEN WeiE1,2, HE ZhongHu2, XIA XianChun2, GENG HongWei1
(1College of Agronomy, Xinjiang Agricultural University/Key Laboratory of Agricultural Biological Technology, Xinjiang Agricultural University, Urumqi 830052;2Institute of Crop Science, Chinese Academy of Agricultural Sciences (CAAS)/National Wheat Improvement Center, Beijing 100081;3College of Science and Technology, Xinjiang Agricultural University, Urumqi 830091)
Peroxidase (POD) activity has browning and bleaching effects on the color of flour and flour-based products during processing and storage. Identification of associated loci and candidate genes for grain POD activity is important for molecular marker-assisted selection (MAS) in wheat quality breeding.In the present study, the POD activities were surveyed with 151 and 82 Chinese bread wheat cultivars from Yellow & Huai Winter Wheat Region (YHRVWWR) and Northern China Plain Winter Wheat Region (NWWR), respectively, and each set of cultivars was planted in four environments. A genome-wide association study (GWAS) was performed using the mixed linear model (MLM) based on 18 189 and 18 417 high-quality SNP markers from 90K SNP array for two sets of cultivars, respectively.The POD activity of the tested materials showed extensive phenotypic variation and diversity. The variation coefficient of YHRVWWR was 15.4%-21.8%, the heritability was 0.79, and the variation coefficient of NWWR was 15.0%-19.9%, the heritability was 0.82. The POD activity of the materials in different environments showed a significant correlation, and the correlation coefficients were 0.46-0.89 (<0.0001) and 0.50-0.87 (<0.0001) in YHRVWWR and NWWR, respectively. The polymorphic information content of value was between 0.09-0.38, and the minimum allele frequency was between 0.05-0.5. The population structure analysis showed that the two natural populations in YHRVWWR and NWWR were simple and could be divided into three subgroups. In the YHRVWWR cultivars, 20 loci were found to be associated with POD activity (<0.001), which were located on chromosomes 1A, 2A, 2B, 2D, 3A, 3B, 3D, 4A, 4B, 5A, 5B, 6A, 6D and 7A, and each explained 7.8%-13.3% of phenotypic variation. In the NWWR cultivars, 20 loci showed significant association with POD activity (<0.001), which were located on chromosomes 1A, 1B, 1D, 2A, 2B, 2D, 3A, 3B, 4B, 6A, 6B, 7A, 7B and 7D, explaining 14.4%-23.2% of phenotypic variation. Two loci were detected in both the YHRVWWR and NWWR cultivars, and the associated SNPs could be used to develop STARP (Semi-thermal asymmetric reverse PCR) or CAPS markers. The regression analysis showed that the POD activity of wheat grain was higher with the increasing number of favorable alleles. Meanwhile, three candidate genes,,andwere scanned, encoding phosphomannomutase, horseradish peroxidasesand alkyl hydro peroxide reductase, respectively.The genetic diversity of the two natural populations in YHRVWWR and NWWR are rich in genetic structure and were suitable for genome-wide association analysis. Twenty POD activity loci were found in 2 natural populations, respectively, and three candidate genes were detected. Regression analysis showed that the more favorable alleles variation, the higher the POD activity.
common wheat; POD activity; SNP; population structure; candidate gene
2017-04-24;接受日期:2017-06-02
国家自然科学基金(31771786)、2016年南京农业大学-新疆农业大学联合基金(KYYJ201602)
时佳,E-mail:shijia0401@126.com。通信作者耿洪伟,E-mail:hw-geng@163.com

