佐太和HgS对药物代谢酶和转运体基因表达的影响
张斌斌 徐尚福 徐亚沙 陆远富 魏立新 刘杰
[摘要]藏药佐太(主要含βHgS)和中药朱砂(96%HgS)是传统医药中的配伍成分,其含重金属(汞)的安全问题和中西药合用时的相互作用问题日益受到关注。本实验就其对药物代谢基因的影響进行了研究。小鼠连续7 d口服给予不同剂量佐太、HgS(10,30,100,300 mg·kg-1),或氯化汞(HgCl2,336 mg·kg-1),RTPCR检测药物代谢酶和转运体蛋白相关基因表达。佐太和HgS对Ⅰ相(CYP1A2,CYP2B10,CYP3A11,CYP4A10)和Ⅱ相(UGT1A1,UGT2A3,SULT1A1,SULT2A1)药物代谢酶以及转运体蛋白(OATP1A1,OATP1A4,OATP1B2,OATP2B1,MRP1,MRP2,MRP3,MRP4)均无明显影响,而HgCl2显著上调CYP2B10,CYP4A10,UGT1A1,UGT2A3,SULT1A1,SULT2A1,OATP1A4,MRP1,MRP3,MRP4,对OATP1A1有抑制作用。综上,佐太和HgS在300 mg·kg-1的剂量下对肝脏代谢基因的表达没有产生明显的影响,而1/10等汞量的HgCl2则明显上调或改变Ⅰ相、Ⅱ相药物代谢基因和转运体基因的表达。
[关键词]佐太; HgS; 氯化汞; 药物代谢酶; 药物转运体; RTPCR
[Abstract]Zuotai and cinnabar(96%HgS) are contained in many traditional medicines To examine their potential effects on drug metabolism genes, mice were orally given Zuotai or HgS at doses of 10, 30, 100, 300 mg·kg-1 for 7 days HgCl2(336 mg·kg-1) was gavaged for control Twentyfour hour later after the last administration, livers were collected, and expressions of genes related to metabolic enzymes and transporters were examined Zuotai and HgS had no effects on major phase1, phase2 and transporter genes; HgCl2 increased the expressions of CYP2B10, CYP4A10, OATP1A4, UGT1A1, UGT2A3, SULT1A1, SULT2A1, MRP1, MRP3 and MRP4; expression of OATP1A1 was decreased by HgCl2, but not by Zuotai and HgS Therefore, Zuotai and HgS have different adverse effects on drugmetabolizing genes from HgCl2.
[Key words]Zuotai; HgS; HgCl2; drugmetabolizing enzyme; drug transporter; RTPCR
藏医药是世界传统医学中的重要组成部分,迄今已有上千年的使用历史,是我国较为完整且具有影响的民族药之一[12]。佐太是藏药中最为核心的贵重药物[1,34],是许多名贵藏成药中的主要原料药之一,如七十味珍珠丸、二十五味松石丸等。朱砂首载于《神农本草经》中,称之为丹砂[5],其用药已有2 000多年历史,约7%的中成药品种中都含有朱砂[6],如朱砂安神丸、益元散、补心丸等。因佐太主要成分是硫化汞(βHgS),属于含重金属藏药的典型代表;而朱砂主要化学成分为硫化汞(96%αHgS)。因此,佐太与朱砂的安全问题和中西药合用时的相互作用问题日益受到关注[711]。但是,汞是重金属物质,其毒性是毋庸置疑的,而佐太与朱砂中主要成分βHgS,αHgS与有毒汞化合物的安全性及其与药物的相互作用是不一样的[12]。
药物代谢酶及转运体是决定药物体内吸收、分布、代谢、排泄、毒性与药效过程(ADMET/Act过程)的关键因素,药物对其抑制或诱导效应是产生药动学相互作用的重要机制[13]。药物相互作用是中药副作用的一个重要因素[14],而佐太和朱砂常配伍传统药物使用,与现代药物合用也越来越多,因此,阐明佐太和朱砂(HgS)对药物代谢酶基因和转运体基因的表达,对于传统药物的基础理论发展和临床上的指导具有重要意义。但佐太和朱砂对药物代谢基因的影响鲜有报道,故本实验在研究其毒性基础上[1112]进一步研究佐太和HgS对肝脏Ⅰ相、Ⅱ相、Ⅲ相代谢基因的影响。
1材料
11动物成年昆明雄性小鼠(25±2) g,购自重庆第三军医大学实验动物中心,合格证号SCXK(渝)20120005,在SPF级动物房适应性饲养1周后用于实验。
12药物和试剂藏药佐太由中国科学院西北高原生物研究所提供;硫化汞(HgS)和氯化汞(HgCl2)购买于SigmaAldrich公司;RNAiso Plus,PCR引物购自大连宝生物工程有限公司;High Capacity cDNA Reverse Transcription Kits为美国Applied Biosystems公司产品;iQTM SYBRGreen SuperMix购自美国BioRad公司;mRNA纯化试剂盒购自上海华舜生物技术有限公司。
13仪器CFX connect型实时荧光定量PCR仪(美国BioRad公司);5417R型台式高速冷冻离心机(德国Eppendorf公司);Mastercycler gradient多功能梯度PCR仪(德国Eppendorf公司);MULTISKAN GO全波长酶标仪(美国Thermo公司);X15R型冷冻离心机(美国Beckman Coulter公司);YQ720C型超声波清洗机(中国上海易净超声波仪器公司)。endprint
2方法
21动物分组及给药小鼠随机分为10组,每组6~8只,包括空白对照组(Control)、佐太不同剂量组(10,30,100,300 mg·kg-1,分别约相当于臨床用量的2,5,15,45倍)[11]、HgS不同剂量组(10,30,100,300 mg·kg-1)[9,12]及HgCl2组(336 mg·kg-1)。空白对照组小鼠给予等量蒸馏水,其他各组灌胃给予不同剂量的佐太、HgS和HgCl2(HgS与佐太于双蒸水中融合,在超声波仪器中进行超声,每次给药前超声30 min,药物为混悬液),连续给药7 d。在实验结束时,记录动物体质量和肝重,摘取肝脏用于进一步分析。
22实时荧光定量RTPCR法检测用Trizol提取肝总RNA。NanoDrop2000紫外分光光度计检测RNA浓度和纯度,A260/A280均在18~20,用High Capacity RT 逆转录为cDNA,用IQTM SYBR Green Supermix进行PCR扩增。用Primer3来设计探针,以βactin做内参基因。用2ΔΔCt值法计算其扩增效率,比较不同组之间的基因表达差异。
23统计学分析实验所有结果均以±s表示,全部数据采用SPSS 160软件分析处理,单因素方差分析统计实验结果,通过多重比较,以P<005为具有显著性差异。
3结果
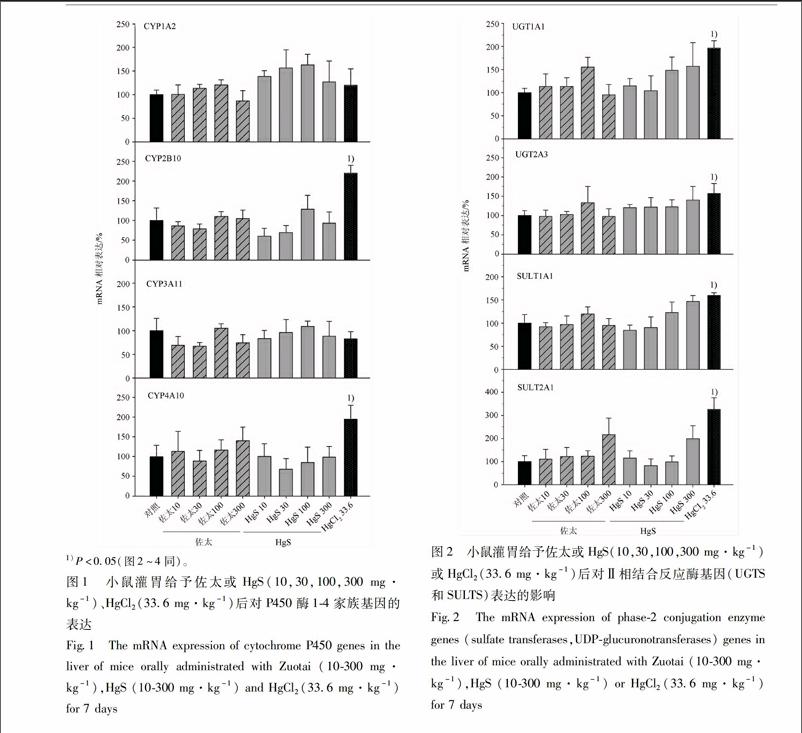
31佐太、HgS和HgCl2对细胞色素P450酶(CYP)表达的影响CYP是肝脏中主要的I相药物代谢酶,见图1,与空白组相比,佐太组和HgS组(10,30,100,300 mg·kg-1)对CYP1A2,CYP2B10,CYP3A11,CYP4A10 mRNA的表达无明显影响,除HgS组上调CYP1A2 mRNA的表达,但无统计学意义。因佐太和朱砂含汞,所以用等汞量的HgCl2 来做比较。HgCl2 组336 mg·kg-1对CYP1A2,CYP3A11 mRNA的表达无明显影响,但明显升高CYP2B10,CYP4A10 mRNA的表达,分别为225,2倍。
32佐太、HgS和HgCl2对Ⅱ相结合酶反应基因表达的影响与空白组相比,佐太组和HgS组不同剂量下对UGT1A1,UGT2A3,SULT1A1,SULT2A1 mRNA的表达无明显影响,而HgCl2组336 mg·kg-1剂量可显著升高UGT1A1,UGT2A3,SULT1A1,SULT2A1 mRNA的表达,分别相当于空白组的2,15,15,33倍,见图2。
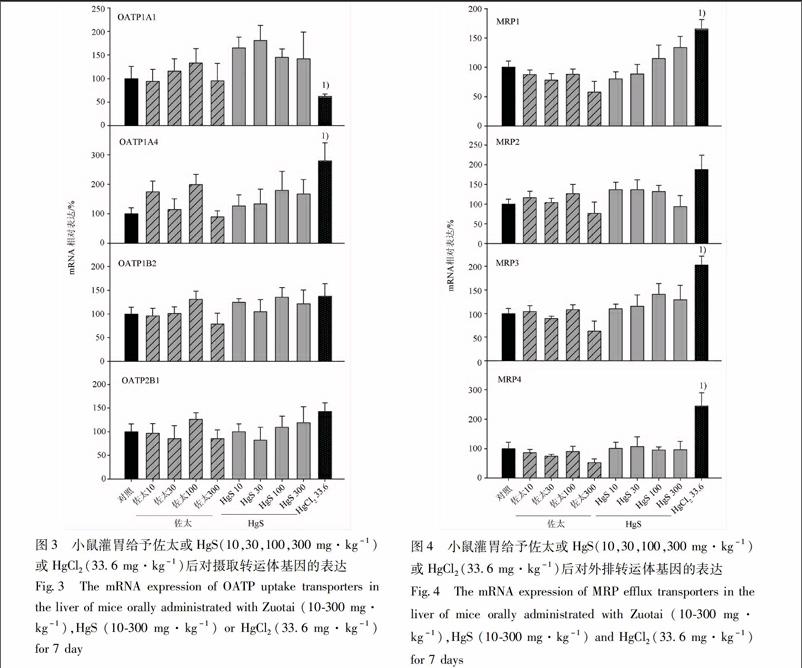
33佐太、HgS和HgCl2对摄取转运体基因表达的影响与空白组相比,佐太组和HgS组不同剂量下对OATP1A1,OATP1A4,OATP1B2,OATP2B1 mRNA的表达无明显影响,但佐太组10,100 mg·kg-1可诱
导OATP1A4 mRNA约18,19倍,但无统计学意义。HgS组可升高OATP1A1 mRNA的表达,但无统计学意义。相比之下,HgCl2组336 mg·kg-1剂量可显著上调OATP1A4 mRNA约28倍,下调OATP1A1 mRNA约为空白组的1/2。未发现佐太和HgS诱导相应摄取转运体的表达,见图3。
34佐太、HgS和HgCl2对外排转运体基因的表达佐太组和HgS组对外排转运体MRP1,MRP2,MRP3,MRP4 mRNA的表达无明显影响,但HgS组300 mg·kg-1剂量升高MRP1 mRNA约14倍,但无统计学意义。而HgCl2组可分别升高MRP1,MRP3,MRP4 mRNA表达量约17,2,25倍。佐太和HgS不影响这些外排转运体的表达,见图4。
4讨论
本研究比较了佐太和朱砂对小鼠肝脏药物代谢酶和转运体基因活性表达的影响。主要实验的方法
是测定基因水平的差异性,在后续实验中会测定活性表达及相关蛋白水平测定和免疫组化等方法,更深入探讨相关机制。在本次实验中共测定了15个基因水平的表达(P450有4个,Ⅱ相4个,转运体7个),发现佐太和HgS在不同剂量下对CYP14家族基因、Ⅱ相结合酶反应基因和转运体基因表达并没有显著影响。而相当于30 mg·kg-1HgS 含汞量的HgCl2 336 mg·kg-1则上调CYP2B10和CYP4A10;对于Ⅱ相结合酶基因,HgCl2对肝OATP1A1有抑制作用,对OATP1A4有诱导作用;对于转运体基因,HgCl2对肝摄取转运体(UGT1A1,UGT2A3,SULT1A1,SULT2A1)有诱导作用,也可上调外排转运体(MRP1,MRP3,MRP4)。因此,佐太和HgS对
小鼠肝脏药物代谢酶基因和转运体基因的表达影响不同于HgCl2。
佐太主要为βHgS(为黑色),朱砂则主要为αHgS(为红色)。在10~300 mg·kg-1,其对药物代谢基因的影响基本相似,没有明显差别。这与作者观察到的毒性作用一致[12]。
药物代谢是指药物分子被机体吸收后发生化学结构转化的过程,其对药物的药效、毒性、作用时间、药物相互作用等都具有重要的影响。
药物进入机体后的生物转化主要有Ⅰ相代谢和Ⅱ相代谢。多数药物进入体内后是在细胞特异酶的催化作用下发生代谢反应。CYP酶系是最主要的Ⅰ相代谢酶系,在肝脏中含量较高,具有广泛的生物学意义[15]。临床上约90%的药物是通过CYP代谢,包括药物在内的多种内源性和外源性物质代谢,Ⅰ相反应与药物的清除率有直接的关系[16]。与空白组相比,佐太和HgS对肝中CYP酶中14家族中的CYP1A2,CYP2B10,CYP3A11,CYP4A10基因活性表达无明显影响,HgS略下调CYP2B10和CYP4A10,但无统计学意义。而相当于30 mg·kg-1HgS含汞量的HgCl2则会显著上调CYP2B10和CYP4A10。CYP1A2在CYP1家族中与药物代谢关系最密切,主要存在于肝脏中,约占肝脏CYP酶总量的13%[1617]。CYP3A4在CYP3亚族中含量最为丰富,主要存在肝脏和小肠中[16]。人类中优势表达的CYP3A酶为CYP3A4,而在小鼠中则为CYP3A11,两者功能类似[18]。本实验表明佐太和HgS高达300 mg·kg-1对P450相关基因表达无明显影响,而1/10等汞量的HgCl2则可产生明显影响。endprint
Ⅱ相反应即结合反应,包括硫酸化、葡萄糖醛酸化等反应,主要是使药物以非活性形式排出体外。Ⅱ相代谢中最主要的酶是葡萄糖醛酸转移酶(UGT)系,UGT在肝脏中的表达最高且具有多态性,约35%的药物Ⅱ相反应都由UGT酶代谢。UGT1A1基因的产物尿苷二磷酸葡糖醛酸转移酶1A1的主要作用是使各种不同外源性药物和内生底物葡萄糖醛酸化,增加其底物的极性,从而能更好地从体内被清除[19]。与空白组相比,佐太和HgS不同剂量对肝UGT1A1和UGT2A3都无明显影响,而相当于30 mg·kg-1HgS含汞量的HgCl2 (336 mg·kg-1)上调UGT1A1和UGT2A3。硫酸基转移酶(SULT)是机体催化多种内源性和外源性物质的重要酶系。SULT1和SULT2是硫酸酯化代谢的关键酶,SULT1A1在肝脏中有很高的表达量,为重要的解毒酶类。与空白组相比,佐太和HgS对肝SULT1A1和SULT2A1无明显作用,而相当于30 mg·kg-1HgS含汞量的HgCl2 (336 mg·kg-1)可上调SULT1A1和SULT2A1。Ⅱ相代谢酶的表达,Ⅱ相代谢酶表达的增高能够有效地减少各种外源性物质引起的相关疾病[20]。Ⅰ相代谢酶类主要是初次发挥作用并为药物排出体内创造条件,如在药物分子上增加极性基团,而Ⅱ相代谢才是真正的“解毒途径”,所得到的产物通常具有更好的水溶性,更容易经胆汁和/或尿液排出体外[21]。肝脏是外源物质代谢作用和解毒作用发生的主要场所,而肝脏中含有大量的药物代谢酶。UGT和SULT是主要的Ⅱ相代谢酶,参与药物结合代谢,对进入机体的外源性毒物有解毒和保护作用[22]。研究表明,UGT主要是催化大多数药物、致癌物、毒物等与葡萄糖醛酸基结合后代谢、解毒、排泄[23]。UGT1A1,UGT2A3,SULT1A1和SULT2A1有明显的诱导作用,这也许是机体对HgCl2中毒的解毒机制之一,说明HgCl2是毒物,诱导机体的解毒酶表达加速代谢排出毒性化学物质。本实验表明佐太和HgS高达300 mg·kg-1的剂量对于Ⅱ相结合酶基因表达无明显作用,而1/10等汞量的HgCl2则可产生明显影响。
药物转运蛋白是药物载体的一种跨膜转运蛋白。研究发现药物转运蛋白主要有多耐药相关蛋白(MRP)、有机阴离子转运多肽(OATP)等[24]。按转运体机制和方向的不同,转运体又可分为摄取性转运体和外排性转运体,可影响药物在肝的分布和清除过程[25]。药物进入体内经过Ⅰ相和Ⅱ相代谢后,再通过调节转运蛋白的活性而改变其转运药物的能力,即可提高或降低药效。药物在体内的过程受生物膜的影响,药物能否通过生物膜不仅取决于药物的理化性质,受转运蛋白的影响[2526]。OATP是转运内源性和外源性化合物的膜蛋白,其可使多种药物从血液向胆汁转运排出体外,从而使药物的作用减弱或消失,达到肝脏灭活解毒的功能[14,25]。OATP1A1,OATP1B2是药物毒物的主要转运体,与空白组相比,佐太和HgS对肝OATP1A1,OATP1A4,OATP1B2,OATP2B1无影响,HgS会略上调OATP1A1,OATP1A4和OATP1B2,但无统计学意义。而HgCl2诱导OATP1A1和OATP1A4。佐太和HgS对肝MRP14家族无明显影响,而相当于30 mg·kg-1HgS含汞量的HgCl2可上调MRP1,MRP3,MRP4。MRP是细胞主要的外排泵,清除药物和毒物,主要是与葡萄糖醛酸基和硫酸酯基结合了毒物或药物。本实验表明佐太和HgS高达300 mg·kg-1的剂量对肝转运体无明显影响,而1/10等汞量的HgCl2则可产生明显影响。作者近期研究进一步发现佐太和HgS不同于HgCl2和甲基汞对肾脏转运体的影响,老年动物更对HgCl2和甲基汞的肾毒性敏感[27]。
药物代谢酶的表达以及活性的改变是直接影响机体对药物处置过程的重要原因,会导致药物的不良反应的发生[14]。肝脏作为药物在机体中消除的器官,其组织细胞上分布的转运体在影响药物体内药动学过程中具有重要地位[25]。本实验研究了不同剂量的佐太和HgS对小鼠肝脏药物代谢酶和转运体基因表达的作用。佐太和HgS在高达300 mg·kg-1的剂量下对肝Ⅰ相、Ⅱ相和Ⅲ相(转运体)药物代谢酶基本无影響,而1/10等汞量的HgCl2则明显上调或改变Ⅰ相、Ⅱ相药物代谢基因和转运体基因的表达,进一步说明不能以HgCl2的作用来评价佐太和朱砂(HgS)的毒性和潜在的药物相互作用。
[参考文献]
[1]索朗佐塔的炮制[J]. 中国民族医药杂志,2007(5):40.
[2]看召本透视藏医珍宝类药品中的“佐太”[J]. 中国中药杂志,2013,38(10) :1621.
[3]黄海波,王奇志,王新为,等藏药“左太”的研究进展[J]. 中国中药杂志,2013,38(17) :2886.
[4]李岑,王东平,魏立新,等藏药佐太安全性研究及其复方当佐的临床安全观察初探[J]. 中国中药杂志,2014,39(13) :2573.
[5]马继兴神农本草经辑注[M].北京:中医古籍出版社,2013:13.
[6]梁爱华,王金华,薛宝云,等朱砂对大鼠的肝肾毒性研究[J]. 中国中药杂志,2009,34(3) :312.
[7]朱洪梅,魏立新,杜玉枝,等藏药佐太长期给药对小鼠毒性的初步研究[J]. 时珍国医国药,2013,24(8) :2022.
[8]张国英,王东平,魏立新,等藏药佐太中汞的长期蓄积性实验研究[J]. 时珍国医国药,2012,23(9) :2146.
[9]郑植元,李岑,魏立新,等含HgS传统药物朱砂和佐太中汞的胃肠道溶出及吸收蓄积研究[J]. 中国中药杂志,2015,40(12) :2455.
[10]Liu J, Shi J Z, Yu L M, et al. Mercury in traditional medicines:is cinnabar toxicologically similar to common mercurial [J]. Exp Biol Med, 2008,233(7):810.endprint
[11]Wu Q, Li W K,Zhou Z P, et al. The Tibetan medicine Zuotai differs from HgCl2 and MeHg in producing liver injury in mice [J]. Regul Toxicol Pharmacol, 2016, 78:1.
[12]张斌斌,李欢,徐尚福,等佐太和HgS对肝脏的量效作用研究[J]. 系统医学,2016,2(7):411.
[13]韩向晖,马越鸣中药调控药物代谢酶和转运体活性及表达研究进展[J]. 中国中医药信息杂志,2013,20(1) :103.
[14]Zhu Q N, Jin T, Wu Q, et al. Rutaecarpine effects on expression of hepatic phase1, phase2 metabolism and transporter genes as a basis of herbdrug interactions [J]. J Ethnopharmacol 2013, 147(1):215.
[15]年华,马明华,徐玲玲,等细胞色素P450酶与药物代谢的研究进展与评价[J]. 中国医院用药评价与分析,2010,10(11):964.
[16]朱立勤,娄建石细胞色素P450与药物代谢的研究现状[J].中国临床药理学与治疗学,2004,9(10):1081.
[17]肖鹏,周宏灏细胞色素氧化酶CYP1A2的研究进展[J]. 中南大学学报:医学版,2008,33(5):456.
[18]杨鑫宝,刘建勋近10年中药与药物代谢酶相互作用的研究进展[J]. 中国中药杂志,2012,37(7):871.
[19]田玉廷,史健 UGT1A1基因多态性研究进展[J]. 实用癌症杂志,2013,28(3):324.
[20]丁月妮,柯尊平,高爱梅 二相药物代谢酶的转录调控[J]. 山西医药杂志,2011,40(12):1217.
[21]Crettol S, Petrovic N, Murray M Pharmacogenetics of phaseⅠand phaseⅡ drug metabolism[J]. Curr Pharm Des,2010,16(2):204.
[22]范景辉,张毕奎姜黄素对药物代谢酶和转运体影响的研究进展[J]. 中南药学,2011,9(7):528.
[23]李坚,张晖 UGT2B7基因多态性与药物代谢关系的研究进展[J]. 医学综述,2014,20(13):2327.
[24]高洋洋,賴泳药物代谢酶和转运蛋白介导的灯盏花素药物相互作用研究进展[J]. 中国医院药学杂志,2014,34(1):76.
[25]朱蓉,马越鸣肝细胞药物转运体研究进展[J]. 中国药理学与毒理学杂志,2014(5):806.
[26]李利生,刘娟,王安斌,等淫羊藿苷对大鼠肝药物代谢Ⅱ相酶和药物转运体的影响[J]. 遵义医学院学报,2012,35(1):13.
[27]Zhang B B, Li W K, Hou W Y, et al. Zuotai and HgS differ from HgCl2 and methyl mercury in Hg accumulation and toxicity in weanling and aged rats[J]. Toxicol Appl Pharmacol, 2017 331:76
[责任编辑张宁宁]endprint

