甘草次酸衍生物18GAGly介导肝主动靶向脂质体的制备及体内相关研究
金粟 王秀丽 李耿
[摘要]基于国内外对甘草次酸配体介导主动肝靶向脂质体的研究情况,该文主要对以甘草次酸为母核的肝靶向配体18GAGly修饰的脂质体的肝靶向效果进行研究。采用薄膜分散高压乳匀法制备18GAGly配体介导的丹参酚酸B丹参酮ⅡA脂质体及未修饰配体的脂质体,考察2种脂质体的制剂学性质,考察粒径、电位、包封率和配体结合率;尾静脉给药后不同时间点获取血浆样本以及小鼠心、肝、脾、肺、肾组织样本,UPLC测定各样本中丹参酚酸B(Sal B)和丹参酮IIA(TSN)含量,评价18GAGly配体的肝靶向效果。结果显示脂质体GlyTSLip和TSLip的粒径、电位、包封率、配体结合率基本符合要求;体内靶向性考察结果显示GlyTSLip组脂质体与TSLip组脂质体血浆数据无显著性差别;甘草次酸衍生物配体18GAGly介导脂质体可以增加Sal B和TSN 在肝组织的峰浓度,但并未显示明显的肝靶向效果。
[关键词]甘草次酸衍生物; 脂质体; 主动肝靶向; 靶向系数; 丹酚酸B; 丹参酮ⅡA
[Abstract]Based on the research of active liver targeting liposomes mediated by glycyrrhetinic acid ligand at home and abroad, this paper focuses on the liver targeting effect of liposomes mediated with 18GAGly, a kind of glycyrrhetinic acid ligand salvianolic acid B(Sal B)tanshinone ⅡA (TSN)liposomes mediated by 18GAGly as well as the liposomes with unmodified ligands were prepared by film dispersionhigh pressure homogenization method, and then the particle size, potential, encapsulation efficiency and ligand binding rate were detected Plasma samples of the heart, liver, spleen, lung and kidney tissues were taken at different time points after tail vein injections The contents of Sal B and TSN in each sample were determined with UPLC methods and the liver targeting effect of 18GAGly ligands was evaluated The results showed that the particle size, potential, encapsulation efficiency and ligand binding rate met the basic requirements; in vivo targeting investigation results showed no difference between GLYTSLip group and TSLip group The liposomes mediated by glycyrrhetinic acid derivative ligand 18GAGly can increase the peak concentration of Sal B and TSN in liver, but showed no significant liver targeting effect.
[Key words]glycyrrhetinic acid derivatives; liposomes; active liver targeting; targeting coefficient; salvianolic acid B; tanshinone ⅡA
脂質体是一种以磷脂为膜材的具有良好生物相容性的脂质载体,属于纳米制剂的一种,在静脉注射入体内后会因被动靶向作用向网状内皮系统丰富的组织分布[1]。通过在脂质体表面进行一定修饰,可以实现特定组织部位的聚集。研究表明甘草次酸衍生物是良好的肝靶向配体,特别是对甘草次酸3位和30位进行一定的修饰得到的衍生物表现出良好的肝细胞靶向性[24],有研究利用荧光成像结果表明,合成的甘草次酸衍生物修饰的脂质体在小鼠体内可以靶向分部到肝脏[5],利用这一特性,将甘草次酸衍生物配体标记载药脂质体给药,对实现主动靶向给药,降低药物的毒副作用具有重要意义。课题组前期对甘草次酸为母核合成肝靶向配体的肝靶向效果进行研究[6],结果显示配体18GAsuc可以修饰在脂质体表面显示出一定得肝靶向效果,本文以新型甘草次酸衍生物甘氨酸丁二酸甘草次酸十八烷酯(18GAGly)作为配体修饰脂质体,并考察脂质体包载模型药物丹酚酸B和丹参酮ⅡA在小鼠体内的药代动力学以及组织分布情况,以评价18GAGly作为配体对脂质体的肝靶向效果。
1材料
11试剂
丹酚酸B对照品(Sal B,中国食品药品检定研究院,批号10113081107);丹参酮 ⅡA对照品(TSN,中国食品药品检定研究院,批号110766200417);配体18GAGly(自合成);TSN(宝鸡国康生物科技有限公司,批号 120428,纯度>98%);Sal B(宝鸡国康生物科技有限公司,批号 MUST12020104,纯度>98%);大豆磷脂(德国Lipoid 公司,批号01/2015,纯度> 94%);胆固醇(美国Amresco公司,批号0433,超纯级);无水乙醇(分析纯);色谱甲醇(赛默飞世尔科技公司,批号101437);乙腈(色谱纯,Fisher Scientific);甘氨酸(国药集团化学试剂有限公司,批号20111215);氯霉素(源叶生物有限公司);甲酸(西陇化工股份有限公司,批号110704);Thermo超纯水机制备超纯水(25 ℃电阻率>182 Ω·cm),娃哈哈纯净水(杭州娃哈哈集团有限公司)。endprint
12仪器
BSl10S 型1/1万电子分析天平(北京賽多利斯仪器系统有限公司);Waters UPLC:二元溶剂管理系统、在线脱气机、自动进样器、PDA检测器(美国 Waters 公司);RW2000A型旋转蒸发器(上海亚荣生化仪器厂);SCIENTZⅡD型超声波细胞粉碎机(浙江新芝);Zetasize Nano ZS纳米粒度仪(英国Malvern公司);JEM1230型透射电镜(日本JEOL);G16型医用高速离心机(白洋离心机厂);Ultracel YM100 超滤管(Millipore)。Thermo 高级超纯水系统(美国Thermo Fisher);KQ5200DE 超声波仪(江苏昆山市超声仪器有限公司);Qilinbeier VORTEX5 涡旋混合仪(北京东南仪诚实验室设备有限公司);TTLDC 型多功能氮吹仪(北京同泰联科技发展有限公司);S10 型高速匀浆机(浙江新芝有限公司)。
13动物
SPF级KM种小鼠,雄性,5周龄,体质量20~25 g(合格证号SCXK 京 20160002,购于北京斯倍福实验动物科技有限公司)。
2方法
21溶液的配置
211对照品溶液的配置精密称取Sal B对照品130 mg,TSN对照品140 mg,18GAGly 115 mg,分别加入到25 mL量瓶中,加入甲醇超声溶解,放置室温后定容,即得到Sal B,TSN,18GAGly对照品储备液,质量浓度分别为0052 0,0056 0,0046 0 g·L-1。
212甘氨酸盐酸缓冲溶液的配置精密称取甘氨酸适量,配置质量分数为1%的甘氨酸溶液,后用02 mol·L-1的盐酸溶液调节pH 332,备用。
22检测方法的建立
221色谱条件的确定对Sal B,TSN及18GAGly进样考察色谱条件,最终确定色谱条件为Waters UPLC,ACQUITY BEH C18色谱柱(21 mm×50 mm,17 μm),流动相05%甲酸水溶液(A)甲醇(B),梯度洗脱(0~3 min,20%~100%B,3~6 min,100%B),流速04 mL·min-1,进样量2 μL,样品室温度-4 ℃,柱温45 ℃,检测波长Sal B 284 nm,TSN 265 nm,18GAGly 254 nm。
222专属性考察分别量取211项下对照品溶液,以纯甲醇配置不同浓度的标准溶液,分别取空白脂质体甲醇破乳液、空白脂质体破乳液混合Sal B,TSN,18GAGly混合溶液,采用221项下色谱条件进样分析,检测图谱见图1,各成分分离度均良好,可以达到含量测定要求。
223线性关系考察精密吸取Sal B,TSN和18GAGly对照品溶液 10,20,40,60,80 μL,分别进样,测定峰面积。分别以色谱峰面积(Y)对质量(X)进行线性回归。Sal B标准曲线为
A. 284 nm; B. 265 nm; C. 254 nm; D. 空白脂质体破乳后溶液;1. Sal B; 2. TSN;3. 18GAGly。
图1UPLC的专属性
Fig1Results of UPLC conditions
Y=1 931 414X-54 675,R2=0999 4,且Sal B在0052~0416 μg线性关系良好; TSN标准曲线为Y=12 425X-3 8796,R2=0999 8,且TSN在0056~0448 μg线性关系良好; 18GAGly标准曲线为Y=1 130 479X-37 466,R2=0999 4,且18GAGly在0046~0368 μg线性关系良好。
224精密度考察取Sal B,TSN和18GAGly对照品溶液适量,过022 μm滤膜,UPLC连续进样6次,测定3个成分峰面积,Sal B,TSN和18GAGly RSD分别为091%,086%,030%。表明仪器精密度良好。
225稳定性考察取供试品溶液,按221项下色谱条件在0,2,4,8,16,24 h分别进样,Sal B,TSN和18GAGly 的RSD分别为12%,13%,12%,说明供试品溶液在24 h内稳定,可用于含量测定。
226重复性考察按照供试品制备方法平行制备6份供试品溶液,按上述色谱条件进样,Sal B,TSN和18GAGly的RSD分别为14%,10%,19%,说明该方法重复性合格。
227加样回收率考察精密吸取空白脂质体05 mL置5 mL量瓶中,分别精密加入500 mg·L-1 Sal B,500 mg·L-1 TSN,500 mg·L-118GAGly对照品储备液各05 mL,制得脂质体混悬液,平行操作6份,分别以022 μm微孔滤膜滤过,分别测定Sal B,TSN,18GAGly含量。回收率实验结果表明Sal B,TSN,18GAGly平均回收率分别为9646%,9766%,9573%,RSD均小于20%,方法回收率合格。
23脂质体的制备及表征
231脂质体制备方法称量TSN,配体18GAGly(TSLip不加入配体),磷脂(SPC),胆固醇(CH)(SPCCH质量比6∶1,SPCTSN物质的量之比30∶1),超声共融于无水乙醇,水浴减压旋蒸除去无水乙醇,圆底烧瓶内壁形成均匀薄膜,加入适量纯水水合,使形成的脂质体从瓶壁分离下来。经水合得到的脂质体混悬液在水浴条件下,经380 W探头超声进行匀化处理,后用高压乳匀机进行均质处理,然后逐滴加入Sal B的甘氨酸盐酸缓冲溶液(pH 332),摇匀后30 ℃水浴孵化30 min得到肝靶向脂质体及普通脂质体(TSLip)。
232脂质体的形态观察采用磷钨酸负染透射电镜观察。取适量样品(稀释25倍)滴于300目铜网表面,15 min 后用滤纸吸去多余液体,再在铜网表面滴入1滴2%磷钨酸溶液染色3 min,滤纸吸去多余液体,自然晾干后测定。endprint
233脂质体的粒径分布及电位测定吸取待测定脂质体混悬液08 mL于塑料離心管中,加入纯水稀释100倍,用马尔文粒径检测仪分别测定粒径、多分散系数(PDI)及电位结果。
234包封率及载药量测定[8] 取1 mL待测定脂质体混悬液于15 mL离心管中2 000 r·min-1离心5 min,取上清加甲醇稀释,超声制备液相样品,UPLC测定脂溶性药物TSN/配体含量为W1;剩余脂质体混悬液继续15 000 r·min-1离心30 min,取上层液体清液置超滤管中6 000 r·min-1离心30 min,精密移取下层滤过液01 mL加入01 mL甲醇超声溶解,UPLC测定Sal B含量为W2;另精密移取未离心脂质体混悬液加入甲醇超声,UPLC测定药物含量为W总。配体结合率计算公式为EE=W1/W总×100%,Sal B包封率计算公式为EE=1-(W2×2)/(W总×10)×100%,TSN包封率计算公式EE=W1/W总×100%。
24小鼠体内分布考察方法
241色谱条件[9] ACQUITY BEH C18色谱柱(21 mm×50 mm,17 μm),流动相乙腈(A)05%甲酸溶液(B),梯度洗脱(0~15 min,20%~25%A;15~3 min,25%~64%A;3~51 min,64%A;51~58 min,64%~90%A;58~60 min,90%~20%A),流速10 mL·min-1,进样量1 μL,样品室温度-4 ℃,检测波长Sal B 289 nm,TSN 265 nm。
242血浆处理方法[8] 精密吸取小鼠血浆150 μL置15 mL EP管中,加入内标氯霉素(IS)10 μL(02 g·L-1),甲酸水溶液(1∶3)50 μL,继续加入乙酸乙酯 1 mL,涡旋振荡 3 min,15 000 r·min-1离心10 min以分离蛋白,将上清液全部转移置另一EP管中,剩余沉淀继续加入乙酸乙酯溶液1 mL 同法第二次萃取后合并上清液,37 ℃水浴条件下于氮吹仪上挥干,残渣用 100 μL甲醇复溶,涡旋振荡1 min后于15 000 r·min-1离心10 min,取上清液1 μL进样UPLC 分析。
243血浆含量检测方法[8] 血浆内检测药物为Sal B,TSN,241项下色谱条件药物与内标物分离良好,可以准确的检测处理后的血浆样品中Sal B和TSN的含量。以待测成分与内标峰面积的计算比值带入标准曲线计算血浆内药物含量。标准曲线为YSal B=18412 3X-0363 6,r=0995 9,在0010 0~0600 0 g·L-1线性良好;YTSN =82369 0X+0071 1,r=0999 4,在0000 25~0100 0 g·L-1线性良好。
244组织处理方法各脏器处理前自然解冻,剪碎后称重,加入15倍生理盐水制备组织匀浆。小鼠心、脾、肺组织全量,肝、肾组织移液枪移取匀浆液500 μL至EP管中,分别加入甲酸水(1∶3)混合溶液,(肝、肾 70 μL;心、脾、肺50 μL),精密加入标准对照IS 10 μL,继续加入乙酸乙酯1 mL,涡旋振荡3 min,15 000 r·min-1离心10 min以分离蛋白,将上清液全部转移至另一EP管中,剩余沉淀继续加入乙酸乙酯溶液1 mL按前述方法涡旋震荡进行萃取,合并2次萃取清液,37 ℃水浴条件氮气吹干,残渣用100 μL甲醇复溶,涡旋振荡1 min后于15 000 r·min-1离心10 min,取上清液1 μL进样UPLC分析。
245各组织含量计算方法[8] 各脏器内检测药物为Sal B,TSN,以待测成分与内标峰面积的计算比值带入标准曲线计算药物含量。标准曲线见表1,2,该方法精密度、稳定性、回收率均良好。
246动物分组和血浆、组织采集KM小鼠100只,雄性,20~25 g,随机分为2组,分别为GlyTSLip组和STLip组,给药前24 h禁食不禁水。各组小鼠分为10个时间点,每个时间点5只,分别尾静脉注射GlyTSLip和TSLip脂质体,每只小鼠025 mL/只,给药剂量折合小鼠剂量含药质量浓度为Sal B 4825 mg·kg-1,TSN 488 mg·kg-1。3组小鼠分别采用尾静脉注射给药方式分别注射2种脂质体,并于给药后0083,0167,033,05,075,1,15,2,4,6 h摘眼球取血,获得心、肝、脾、肺、肾组织用生理盐水冲洗净表面血液,滤纸吸去多余水分,称重后于-20 ℃保存,检测前自然解冻。
247数据处理与分析检测不同脂质体组小鼠血浆及脏器匀浆中的药物含量,为排除模型干扰,采用DAS 32软件按非房室模型对血浆数据及小鼠组织中药物含量进行处理,绘制血药浓度时间曲线,采用SAS 81对数据进行统计分析。两两比较采用T检验,多组之间的两两比较分析采用OneWay ANOVA方差分析法。绘制各组组织药物浓度时间柱形图,可视化的比较配体后脂质体在小鼠体内的靶向效果。并用处理后的药代动力学参数计算相对摄取率(RE),最大峰浓度之比(CE)和靶向效率(TE),评价靶向性的指标[9]。RE=AUC配体修饰脂质体/AUC未加配体脂质体,CE=Cmax配体修饰脂质体/Cmax未加配体脂质体,TE=AUC肝/AUC其他脏器。
3结果
31脂质体制剂学性质考察
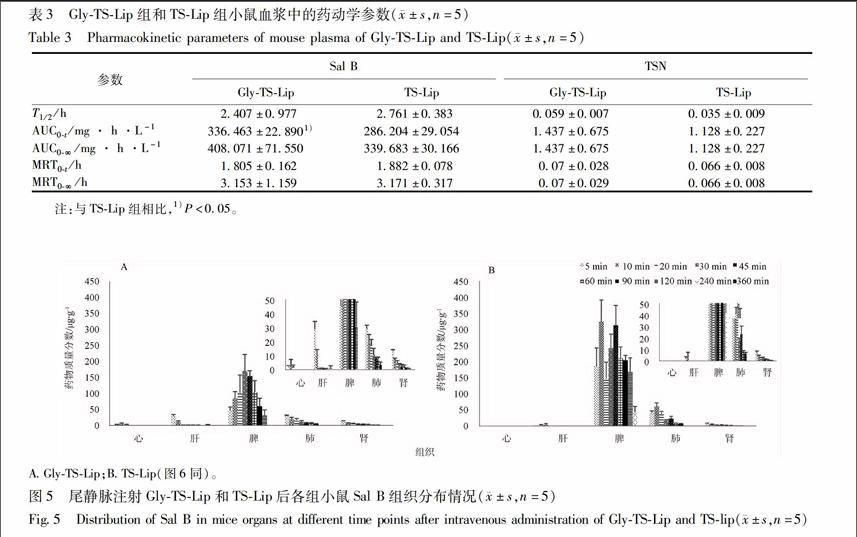
GlyTSLip粒径为(2056 ± 1951)nm,多分散系数PDI(0460 ± 004),电位为(-247 ± 015)mV。Sal B,TSN的包封率和18GAGly结合率分别为(8309 ± 175)%,(7549 ± 223)%,(9795 ± 185)%。电镜结果显示脂质体粒径分散均匀,粒径大小位于200 nm左右,数据表及粒径、电位见图2。endprint
A粒径分布; B电位分布(图3同)。
TSLip粒径为(1786 ± 734)nm,多分散系数PDI(0405 ± 003),电位为(-277 ± 095)mV。Sal B,TSN的包封率分别为(8245 ± 164)%,(7965 ± 1049)%。电镜结果显示脂质体粒径分散均匀,粒径大小位于 150~200 nm,粒径、电位见图3。
由上述结果可以看出,通过旋转蒸发高压乳匀法制备的2种脂质体GlyTSLip,TSLip粒径及电位数据良好,包封率符合要求。
32小鼠血浆及组织药物含量
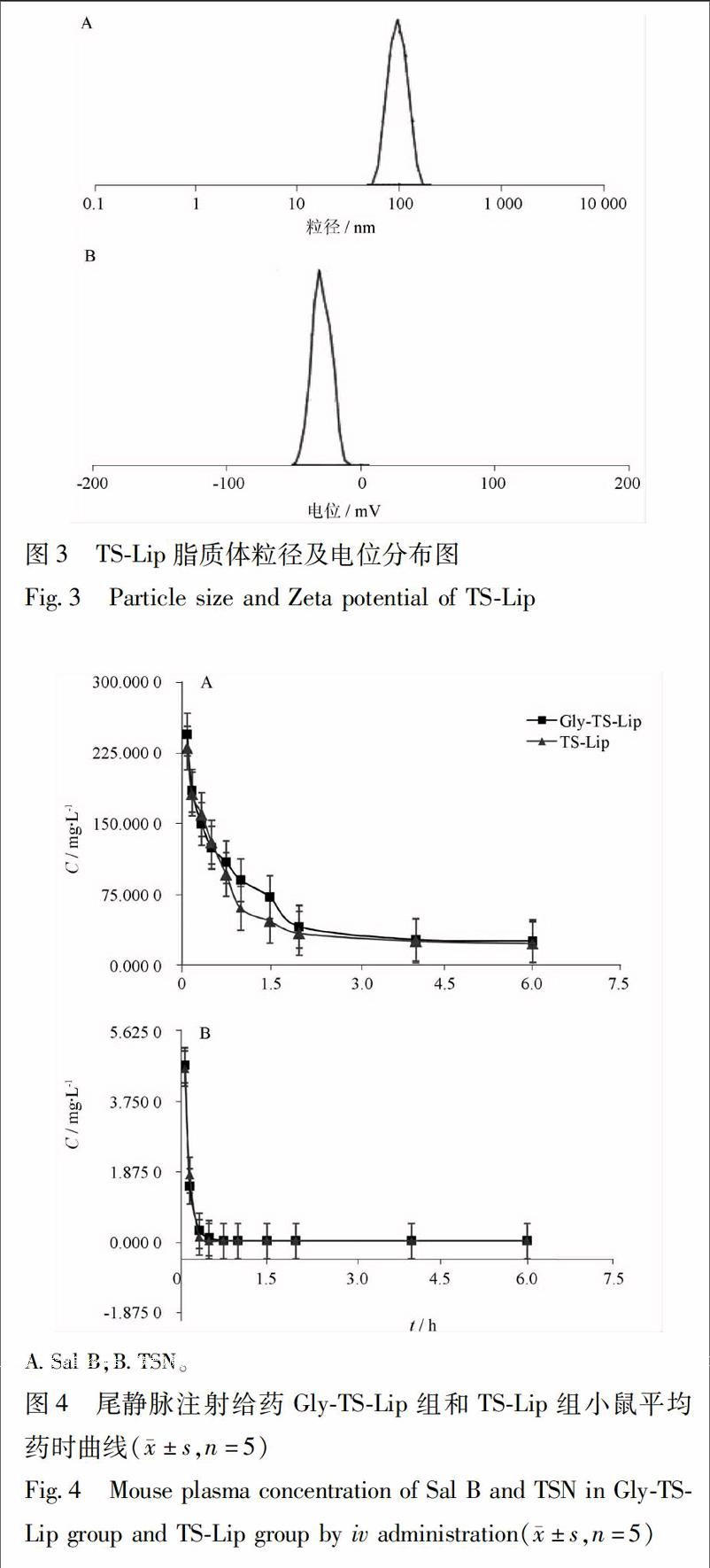
321血药浓度时间曲线及药代动力学参数以取血时间为横坐标,以Sal B,TSN 2种药物浓度为纵坐标,绘制脂质体GlyTSLip和TSLip尾静脉注射后的血药浓度时间曲线,结果见图4。2组小鼠血浆数据经DAS 32处理后的药动学参数结果见表3。
对GlyTSLip与TSLip的血浆数据进行比较,
ASal B;BTSN。
图4尾静脉注射给药GlyTSLip组和TSLip组小鼠平均药时曲线(±s,n=5)
Fig4Mouse plasma concentration of Sal B and TSN in GlyTSLip group and TSLip group by iv administration(±s,n=5)
2组脂质体经尾静脉注射给药后的Sal B和TSN的药动学行为有一定的差别。给药075 h后GlyTSLip组和TSLip组中Sal B均快速降解,但随时间延长,GlyTSLip组Sal B分解减慢,推测修饰配体后的GlyTSLip一定程度上提升了Sal B的稳定性;将2组药动学参数进行比较,GlyTSLip组Sal B的半衰期小于TSLip组,但不存在统计学差异;GlyTS
Lip组与TSLip组AUC差异不明显,Sal B和TSN在GlyTSLip组略大于TSLip组,分别为117,127倍。
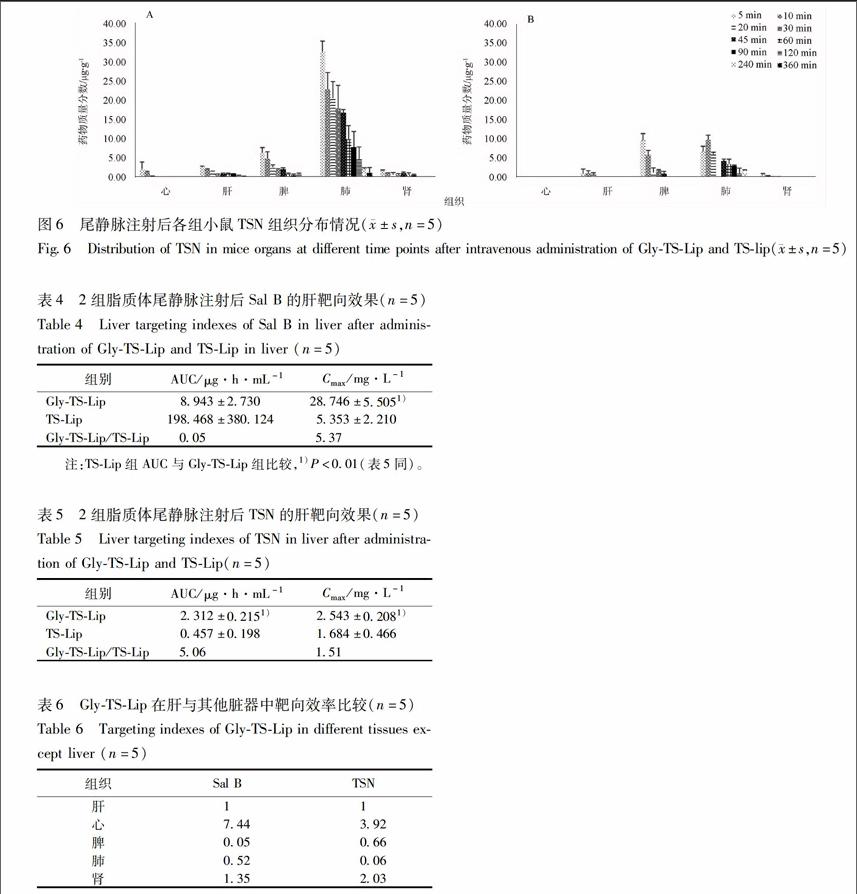
322小鼠体内分布结果根据GlyTSLip及TSLip 2组脂质体尾静脉注射后不同时间点各组织中药物含量绘制组织分布柱状图。
2组小鼠均在脾、肺组织中检测到大量Sal B,这应该与脂质体的被动靶向作用有关,同时前期药剂学性质检验结果显示脂质体理化性质欠佳,也会对脂质体分布结果产生一定影响。2组脂质体给药剂量一致,GlyTSLip组在肝组织中累积的Sal B含量略高于未修饰配体的TSLip组,说明18GAGly配体修饰脂质体对水溶性药物Sal B有一定的肝靶向效果,但结果无显著性差异,见图5。
2组脂质体在肺组织中均积累较多,一方面可能是由于脂质体的被动靶向作用,另一方面,文献[2]发现TSN原药在小鼠体内有明显的肺靶向现
AGlyTSLip;BTSLip(图6同)。
图5尾静脉注射GlyTSLip和TSLip后各组小鼠Sal B组织分布情况(±s,n=5)
Fig5Distribution of Sal B in mice organs at different time points after intravenous administration of GlyTSLip and TSlip(±s,n=5)
象。比较2组小鼠在肝组织积累的TSN含量可以看出,GlyTSLip组相较TSLip组TSN含量检测更高、检测到时间更长,显示18GAGly配体对脂溶性TSN有一定的肝组织靶向作用,见图6。
323靶向性考察结果比较2组小鼠肝组织对Sal B和TSN的相对摄取率(Re)结果,GlySLip组脂质体的水溶性Sal B相较TSLip组在肝组织内含量没有显出相对摄取率提高的效果,统计学结果无显著性差异,见表4,5。GlyTSLip组的TSN为TSLip组的506倍,说明18GAGly配体修饰后可以实现TSN在肝组织的聚集,实现肝组织的靶向效果。推测Sal B和TSN靶向效果差异的原因,可能是脂溶性的TSN相比水溶性Sal B可以牢牢链接于磷脂双分子膜上,实现肝组织靶向。比较Ce结果可以看出,GlyTSLip组在肝组织的Sal B和TSN的Ce大于TSLip组,说明18GAAla配体修饰脂质体可以增大Sal B和TSN在肝组织的峰浓度。GlyTSLip在肝与其他脏器中靶向效率比较,见表6。
4讨论
通过尾静脉方式给药考察血药浓度时间曲线及组织分布情况,结果显示18GAGly配体修饰脂质体可以提升Sal B和TSN在肝组织积累的峰浓度,但是肝靶向效果并不十分明显,GlyTSLip组Sal B在肝组织之中的AUC分别是脾、肺、肾组织的
005,052,135倍,TSN在脾、肺肾的AUC分别是TSLip组对应组织的066,006,203倍。推测脂质体被动靶向作用明显,导致在肝组织积累的药物含量低于脾、肺组织,影响到肝靶向性考察实验结果。
本文选用的肝靶向配体18GAGly,与作者之前文献[8,10]报道肝靶向配体3琥珀酸30硬脂醇甘草次酸酯(18GAsuc)和甘氨酸丁二酸甘草次酸十八烷酯(18GAGly)结构相似。其中18GAsuc是以甘草次酸为母核,同时连接了亲水基团和亲脂基团,使其具备两亲性而便于镶嵌于脂质体磷脂双分子层。但总体而言其亲脂性仍然比较强。18GAGly和18GAAla则是在18GAsuc上进一步分别链接了亲水基团甘氨酸和丙氨酸。作者的目的是希望通过改变亲水性以实现改变肝靶向配体的肝靶向性,以便找出更强肝靶向性的肝靶向配体。但文献[8,10]显示18GAsuc和18GAAla肝靶向性较为明显,结合本文结果推断,推测肝靶向性与配体的亲水性无直接关系,与配体所连接的基团结构有关。
[参考文献]
[1]张宁,张华靶向给药系统研究进展[J]. 辽宁中医药大学学报,2017,doi:1013194/jissn1673842x201702070.
[2]李斌,江涛,万升标,等甘草次酸的化学修饰和结构改造研究进展[J]. 精细化工,2006,23(7):643.
[3]金辉,毛声俊,张昆,等甘草次酸类衍生物的合成及其离体大鼠肝细胞摄取的研究[J]. 华西药学杂志, 2010, 25(6):652
[4]吴超,郭伟英甘草次酸衍生物修饰去甲斑蝥素脂质体在小鼠體内肝靶向性研究[J]. 辽宁医学院学报,2008,29(6):490
[5]陈志鹏,肖璐,李伟东,等活体成像系统检测甘草次酸修饰脂质体在小鼠体内的分布[J]. 中国实验方剂学杂志,2012,18(17):148.
[6]管辉达,王秀丽,林珈好,等甘草次酸衍生物受体靶向复方脂质体的制备及其体外释放研究[J]. 世界科学技术——中医药现代化,2014(10):2190.
[7]林珈好丹参酮ⅡA、丹酚酸B与甘草次酸复方脂质体构建评价及其体内分布与药代动力学研究[D]. 北京:北京中医药大学,2014.
[8]管辉达丹参甘草复方组分受体介导主动靶向脂质体的构建及其体内外评价[D]. 北京:北京中医药大学,2015.
[9]房嫣,彭倩雯药物制剂靶向性评价方法的研究进展[J]. 中国药师,2013,16(8):1232.
[10]金粟甘草次酸衍生物配体介导脂质体的靶向性及脂质体X的稳定性研究[D]. 北京:北京中医药大学,2017.
[责任编辑孔晶晶]endprint

