猪圆环病毒2型ORF2单克隆抗体的制备与鉴定
安春敬,李祥敏,张华伟,莫红芳,郭夏阳,赵泽凯,钱 平*,赵晓玲
(1.西藏大学农牧学院动物科学学院,西藏林芝 860000;2.华中农业大学农业微生物重点实验室,湖北武汉 430070)
猪圆环病毒2型ORF2单克隆抗体的制备与鉴定
安春敬1,2,李祥敏2,张华伟2,莫红芳2,郭夏阳2,赵泽凯2,钱 平2*,赵晓玲1*
(1.西藏大学农牧学院动物科学学院,西藏林芝 860000;2.华中农业大学农业微生物重点实验室,湖北武汉 430070)
以杆状病毒表达系统表达PCV2 ORF2重组蛋白为免疫原,旨在获得针对PCV2的特异性单克隆抗体。用Sf9细胞表达PCV2 ORF2重组蛋白,通过层析柱和超滤管浓缩法纯化PCV2 ORF2重组蛋白。将纯化的PCV2 ORF2重组蛋白免疫6周龄的雌性Balb/c小鼠,3次免疫后,取免疫后小鼠脾脏细胞与骨髓瘤细胞SP2/0融合,采用间接ELISA筛选,经过3次亚克隆获得4株能稳定分泌特异性抗体的杂交瘤细胞,命名为1H9、4C11、5B8和4F12株。IFA和Western blot试验说明,4株杂交瘤细胞分泌的抗体能与ORF2重组蛋白作用。特异性试验表明,4F12株单克隆抗体与猪圆环病毒2型(PCV2 KQ22株)发生特异性反应,经抗体亚型鉴定1H9、4C11和5B8 3株亚型为IgG1/Kappa,4F12株为IgG2b/Kappa,1H9、4C11、5B8和4F12株小鼠腹水效价分别为105、104、106和105。表明获得了与PCV2特异性作用的单克隆抗体。
猪圆环病毒2型;核衣壳蛋白;单克隆抗体
猪圆环病毒首次于1974年由Tischer T等[1]发现,2004年国际病毒分类委员会将PK-15细胞系分离到的圆环病毒命名为PCV1,而引起猪群发病的圆环病毒命名为PCV2[2]。PCV2呈二十面体对称,无囊膜,直径约12 nm~23 nm,为单股环状DNA病毒,是目前已知最小的动物病毒[3]。PCV2主要含ORF1、ORF2、ORF3等开放阅读框,ORF1编码rep蛋白,与病毒的复制相关[4]。ORF2基因位于基因组的反向链,起始密码子位于第1 033位核苷酸或第1 034位核苷酸,702个碱基编码的Cap蛋白由243个氨基酸组成,分子质量大小约为27.8 ku。Cap蛋白是病毒的主要免疫原性蛋白,对疾病诊断和疫苗学的研究具有非常重要的意义[5-6]。ORF3编码的蛋白可能在致病性方面扮演重要角色[7]。
2001年McNeilly F等[8]最早利用PCV2的全病毒制备PCV2的单克隆抗体,并成功建立ELISA方法鉴定PCV2。在我国,2005年也开始研究PCV2的单克隆抗体,商绍彬等[9]利用原核表达的Cap蛋白制备出与PCV2具有中和作用的单克隆抗体。近年来,关于PCV2单克隆抗体的研究逐步增多,但多数研究是针对于Cap蛋白的单克隆抗体。2014年翟淑燕等[10]以纯化的PCV2作为免疫原,得到Cap的单克隆抗体,且与PCV2具有中和作用。2014年曲信芹等[11]利用重组杆状病毒表达的Cap蛋白作为免疫原,获得针对PCV2 Cap的单克隆抗体。此外,有很多利用原核系统表达的Cap蛋白,制备的PCV2单克隆抗体。目前针对Cap蛋白的单克隆抗体有大量的研究,为PCV2抗原表位分析和致病机理提供了一定的基础。本研究通过杆状病毒表达系统表达PCV2 Cap蛋白制备特异性针对PCV2的单克隆抗体,为PCV2的快速检测与诊断以及抗原变异提供了物质基础和条件。
1 材料与方法
1.1 材料
1.1.1 病毒、细胞及动物 AC-ORF2重组杆状病毒、pET28a-ORF2(缺失NLS核定位信号序列)质粒、SP2/0细胞、昆虫细胞Sf9,本实验室(华中农业大学钱平课题组)保存;PCV2 KQ22病毒,由华中农业大学何启盖教授提供;6周龄雌性Balb/c小鼠,购自湖北省疾病预防控制中心。
1.1.2 试剂 1640培养基,HyClone公司产品;PEG4000、HAT(HT)培养基干粉、淋巴细胞分离液、弗氏完全佐剂、弗氏不完全佐剂,Sigma公司产品;HRP羊抗鼠IgG,碧云天生物技术研究所产品;ELISA显色液及终止液,武汉科前生物股份有限公司产品;Cy3 Goat Anti-Mouse IgG,ABclonal公司产品;SuperSignal Chemiluminescent Substrates显色液、Pierce○RRapid ELISA Mouse mAb Isotying Kit,Thermo公司产品。
1.2 方法
1.2.1 ORF2重组蛋白的表达及纯化 将AC-ORF2杆状病毒感染Sf9细胞,表达获得PCV2 ORF2重组蛋白。利用层析柱(superdex 200 prep grade)和超滤管浓缩的方法纯化PCV2 ORF2重组蛋白,通过120 g/L SDS-PAGE检测PCV2 ORF2重组蛋白,获得高纯度的目的蛋白,用于小鼠的免疫。
1.2.2 动物免疫 选择6周龄SPF雌性Balb/c 小鼠,将100 μg PCV2 ORF2重组蛋白与等体积佐剂乳化后,通过颈背部皮下两点注射方式进行首次免疫,14、28 d时以相同的剂量分别进行第2、3次免疫。在融合前3 d将100 μg PCV2 ORF2重组蛋白通过腹腔注射方式,加强免疫1次,3 d后取小鼠脾脏进行细胞融合试验。
1.2.3 细胞融合及亚克隆 取免疫小鼠的脾脏制备脾细胞,将脾细胞与SP2/0瘤细胞按5∶1比例进行细胞融合,用含有饲养细胞的HAT培养基连续培养7 d。融合成功的杂交瘤细胞换HT培养基培养至11 d时,通过间接ELISA筛选阳性杂交瘤细胞,并采用有限稀释法将阳性杂交瘤细胞稀释至每孔细胞数≤1时进行亚克隆。
1.2.4 免疫印迹检测 将原核系统表达的缺失NLS的PCV2 ORF2重组蛋白以及杆状病毒表达系统表达的PCV2 ORF2重组蛋白作为抗原,进行Western blot检测。50 g/L脱脂牛奶室温封闭3 h;加适量的杂交瘤细胞的上清为一抗,室温孵育1 h,PBST洗3遍;进而加入适量的HRP羊抗鼠IgG(1∶5 000)为二抗,室温孵育1 h,PBST洗3遍后,加适量Super Signal Chemiluminescent Substrates显色液,在Bio-Rad照膜仪上进行观察。
1.2.5 间接免疫荧光检测 将Sf9细胞接至48孔板,待细胞长至80%~90%后,以1 MOI接种AC-ORF2重组杆状病毒,培养72 h,洗3遍,加固定液(甲醇∶丙酮=1∶1)100 μL,-20℃固定30 min,洗3遍。加10 g/L PBSA 100 μL室温封闭1 h,洗3遍;杂交瘤细胞上清为一抗,37℃孵育1 h后,洗5遍;避光加Cy3 Goat Anti-Mouse IgG 抗体1∶100稀释,每孔加100 μL,37℃孵育1 h,PBS洗5遍,在倒置荧光显微镜下进行观察。
1.2.6 特异性试验 将PK-15细胞接至48孔板,同步接PCV2 KQ22病毒,24 h后待细胞长至90%时,用D-氨基葡萄糖处理20 min,换细胞维持液培养细胞48 h,进行间接免疫荧光试验[12]。
1.2.7 抗体的亚型鉴定 用Thermo公司Pierce○RRapid ELISA Mouse mAb Isotying Kit试剂盒进行抗体亚型鉴定,按说明书的步骤进行。
1.2.8 单克隆抗体腹水的制备 选用动物体内诱生腹水的方法。选取8周龄~10周龄的雌性Balb/c小鼠,腹腔注射0.5 mL不完全弗氏佐剂进行刺激;7 d~10 d后收集扩大培养的阳性杂交瘤细胞105~106个接种于小鼠腹腔内,7 d~10 d后收集小鼠腹水,用间接ELISA测定小鼠腹水效价。
1.2.9 杂交瘤细胞染色体计数 将杂交瘤细胞传代后培养至48 h(对数期),在细胞上清中添加终浓度为0.6 μg/mL的秋水仙素,置于37℃体积分数为5%的CO2细胞培养箱中培养3 h,将细胞离心,用37℃预热的0.075 mol/L KCl 5 mL重悬细胞沉淀,37℃、静置30 min,加固定液(甲醇∶冰醋酸=1∶3)处理细胞,取2滴细胞至载玻片上,吹散,自然干燥,100 g/L Giemsa染色液染色10 min,单蒸水洗去染色液后自然晾干,显微镜下观察染色体形态并计数。
2 结果
2.1 蛋白纯化分析
通过重组杆状病毒表达的PCV2 ORF2蛋白,用层析柱和超滤管的方法纯化浓缩PCV2 ORF2重组蛋白,SDS-PAGE 的方法检测,结果显示有一条27.5 ku的特异条带,与预期大小一致(图1)。经薄层扫描分析蛋白纯度达到90%以上,达到免疫要求。

M.蛋白分子质量标准;1.纯化后重组蛋白M.Protein molecular weight Marker;1.Purified recombinant protein图1 纯化后重组蛋白的SDS-PAGEFig.1 SDS-PAGE of purified recombinant protein
2.2 阳性抗体筛选结果
将免疫小鼠的脾细胞与SP2/0细胞进行融合后7 d,观察细胞生长状态,对长出杂交瘤细胞的孔补加HT培养基,以减少假阳性孔的出现。用纯化的PCV2 ORF2重组蛋白作为包被蛋白,通过方阵滴定法,确定最佳包被浓度为0.125 μg/mL,间接ELISA筛选出阳性杂交瘤细胞后,采用有限稀释法进行3次亚克隆,最终得到4株稳定分泌特异性抗体的杂交瘤细胞株,命名为1H9、4C11、5B8和4F12。
2.3 蛋白免疫印迹分析
以原核表达系统表达的缺失NLS的PCV2 ORF2重组蛋白,以及杆状病毒表达系统PCV2 ORF2重组蛋白作为待检样品。1H9、4C11、5B8和4F12株杂交瘤细胞分泌的抗体为一抗,HRP标记的羊抗鼠IgG为二抗检测PCV2 ORF2重组蛋白。结果显示,1H9株和4C11株杂交瘤细胞分泌的抗体不与PCV2 ORF2重组蛋白作用,5B8和4F12株杂交瘤细胞分泌的抗体与PCV2 ORF2重组蛋白作用(图2)。
2.4 蛋白间接免疫荧光分析
以1 MOI AC-ORF2重组杆状病毒接种48孔板Sf9细胞72 h后,进行IFA试验,结果显示,4C11、1H9、5B8和4F12株抗体与重组杆状病毒AC-ORF2的细胞有较强的红色荧光,而空白对照的细胞无红色荧光,表明4株抗体能与Cap蛋白具有良好的反应(图3)。
2.5 病毒间接免疫荧光分析
用PCV2 KQ22病毒为抗原,分别以4C11、1H9、5B8和4F12株分泌的抗体为一抗,以FITC标记的羊抗鼠IgG为二抗,在荧光显微镜下观察,结果显示,只有4F12有较强的绿色荧光,而空白对照的细胞无绿色荧光。表明4F12株是特异性针对PCV2的单克隆抗体(图4)。
2.6 抗体亚型的测定
用Thermo公司Pierce○RRapid ELISA Mouse mAb Isotyping Kit试剂盒进行抗体亚型鉴定,结果显示,1H9、4C11、5B8 3种抗体亚型轻链都为IgG1,重链均为Kappa,4F12抗体亚型轻链都为IgG2b,重链均为Kappa,此4株亚型的抗体比较容易纯化和长时间保存。
2.7 抗体效价的测定
以0.125 μg/mL的PCV2 ORF2重组蛋白作为抗原包被酶标板,用间接ELISA检测杂交瘤细胞上清和小鼠腹水效价,结果显示,4C11、1H9、5B8、4F12株细胞上清效价分别为1∶256、1∶2 048、1∶8 192、1∶4 096;小鼠腹水效价分别为1∶104、1∶105、1∶106、1∶105,4株抗体效价都达到较高的水平。
2.8 染色体计数结果
SP2/0、1H9、4C11、5B8和4F12株5种细胞染色体数分别为64、93、94、127、97对。分析发现,1H9、4C11和4F12这3株杂交瘤细胞的染色体数大约是SP2/0细胞和脾细胞染色体数的和,5B8株杂交瘤细胞的染色体数为SP2/0细胞与2个脾细胞染色体数的和。说明杂交瘤细胞的融合成功。

A.4C11;B.1H9;C.5B8;D.5F12
M.蛋白分子质量标准;1.Sf9细胞表达的重组蛋白;2.原核表达的缺失重组蛋白;3.Sf9细胞对照
M.Protein molecular weight Marker;1.Recombinant protein in Sf9 cells;2.Recombinant protein in prokaryotic cells;3.Sf9 cell control
图2抗体的免疫印迹检测
Fig.2 Western blot of detection antibodies
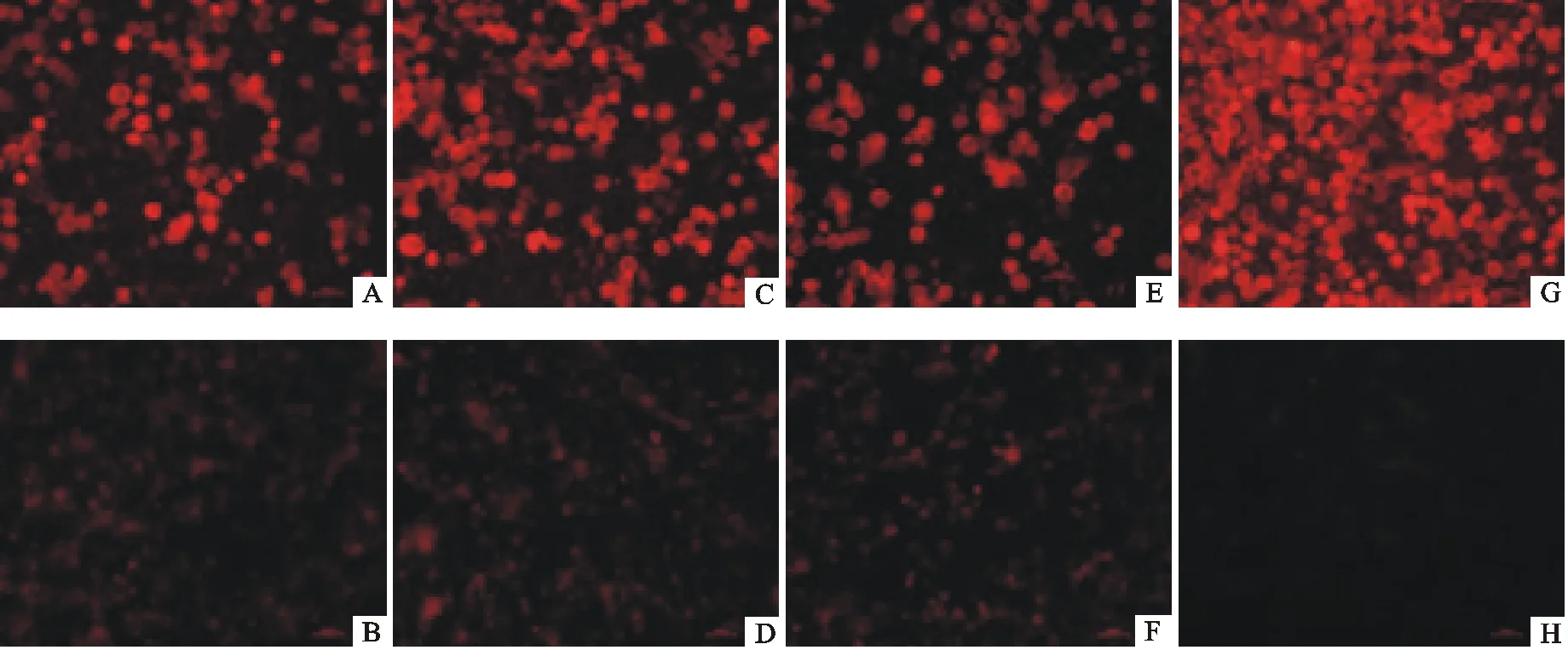
A.杆状病毒与4C11检测;B.Sf9细胞与4C11检测;C.杆状病毒与1H9检测;D.Sf9细胞与1H9检测;E.杆状病毒与5B8检测;F.Sf9细胞与5B8检测;G.杆状病毒与4F12检测;H.Sf9细胞与4F12检测
A.AC-ORF2 and 4C11;B.Sf9 cell and 4C11;C.AC-ORF2 and 1H9;D.Sf9 cell and 1H9;E.AC-ORF2 and 5B8;F.Sf9 cell and 5B8;G.AC-ORF2 and 4F12;H.Sf9 cell and 4F12
图3抗体与重组蛋白的间接免疫荧光检测
Fig.3 IFA of recombinant protein and antibodies

A.猪圆环病毒与4C11;B.猪肾细胞与4C11;C.猪圆环病毒与1H9;D.猪肾细胞与1H9;E.猪圆环病毒与5B8;F.猪肾细胞与5B8;G.猪圆环病毒与4F12;H.猪肾细胞与4F12
A.PCV2 and 4C11;B.PK-15 cell and 4C11;C.PCV2 and 1H9;D.PK-15 cell and 1H9;E.PCV2 and 5B8;F.PK-15 cell and 5B8;G.PCV2 and 4F12;H.PK-15 cell and 4F12
图4抗体与猪圆环病毒的间接免疫荧光检测
Fig.4 IFA of PCV2 and antibodies
3 讨论
PCV2目前仍在世界范围内广泛传播,没有得到完全控制[13-14],而在我国PCV2仍旧严重制约着养猪业的发展[15],PCV2可以在短时间内快速传播,且缺少快速简便的诊断方法。由于PCV2特殊的生物学特性,不易引起细胞病变,且在细胞上增殖滴度较低,使传统的灭活疫苗和弱毒疫苗制备的难度加大。PCV2的核衣壳蛋白Cap亚单位疫苗的研究难度相对较低,并且亚单位疫苗安全性高,且易于规模化生产。鉴于Cap蛋白是PCV2的主要免疫原性蛋白,本研究利用PCV2 ORF2重组蛋白作为免疫原,制备针对PCV2的单克隆抗体,相对于PCV2全病毒作为免疫原,更容易筛选到针对PCV2 Cap蛋白的单克隆抗体。
单克隆抗体制备过程中,小鼠免疫和杂交瘤细胞的筛选至关重要,要避免在小鼠产生免疫耐受和抗体效价偏低时进行融合试验;间接ELISA筛选特异性单克隆抗体过程中,要避免假阳性的出现。本研究在细胞融合前,对免疫小鼠血清抗体效价进行检测,达到104以上进行融合试验。间接ELISA筛选利用PCV2 ORF2重组蛋白和Sf9细胞作为阴性对照,分别包被酶标板,选取PCV2 ORF2重组蛋白OD值较高,且Sf9细胞对照组OD值较低的为特异性针对PCV2 ORF2的单克隆抗体。以此两方面,保证筛选到针对PCV2的特异性单克隆抗体。
本研究获得4株针对PCV2 ORF2重组蛋白的特异性单克隆抗体,其中4C11株和1H9株用IFA可以检测到PCV2 ORF2重组蛋白,说明此两株单克隆抗体是针对PCV2 ORF2的构象表位,5B8和4F12株可以用IFA和Western blot检测PCV2 ORF2重组蛋白,说明此株单克隆抗体针对的是PCV2 ORF2的线性表位,而4F12株抗体不仅能与Cap蛋白作用,而且还能与PCV2 KQ22病毒用IFA检测,其具体针对的抗原表位有待进一步研究。本试验利用重组杆状病毒表达系统表达Cap蛋白且无标签,用过层析柱的方法得到纯度较高的PCV2病毒样粒子蛋白免疫小鼠,使得较容易筛选到与PCV2作用的单克隆抗体,但也可能在纯化过程中使得部分抗原二级结构被破坏,导致部分得到的单克隆抗体只能与变性的蛋白反应,而不与天然结构的病毒反应。本研究获得的1H9、4C11、5B8和4F12单克隆抗体为进一步研究ORF2基因的功能和建立PCV2感染的检测技术奠定了一定基础。
[1] Tischer I,Rasch R,Tochtermann G.Characterization of papovavirus and picornavirus-like particles in permanent pig kidney cell lines [J].Zentralbl Bakteriol Orig A,1974,226(2):153-167.
[2] Allan G,McNeilly F,Ellis J,et al.PMWS:experimental model and co-infections[J].Vet Microbiol,2004,98:165-168.
[3] Segales J,Kekarainen T,Cortey M.The natural history of porcine circovirus type 2:From an inoffensive virus to a devas-tating swine disease [J].Vet Microbiol,2013,165:13-20.
[4] Mankertz A,Mankertz J,Wolf K,et al.Identification of a porcine essential for replication of porcine circovirus[J].J Gen Virol,1998a,79(2):381-384.
[5] Liu Q,Tikoo S K,Babiuk L A.Nuclear localization of the ORF2 protein encoded by porcine circovirus type 2[J].Virology,2001a,285(1):91-99.
[6] Nawagitgul P,Morozov I,Boli S R,et al.Open reading frame 2 of porcine circovirus type 2 encodes a major capsid protein[J].J Gen Virol,2000,81(9):2281-2287.
[7] Liu J,Chen I,Du Q,et al.The ORF3 protein of porcine circovirus type 2 is involved in viral pathogenesisinvivo[J].J Viro,2006,80(10):5065-5073.
[8] McNeilly F,McNair I,Mackie D P,et al.Production,characterisation and application of monoclonal antibodies to procine circovirus 2[J].Arch Virol,2001.146(5):909-922.
[9] 商绍彬,周继勇,吴建祥,等.重组表达猪圆环病毒2型衣壳蛋白的抗原特性分析[J].微生物学报,2005,45(3):377-381.
[10] 翟淑燕,陈兴慧,白 娟,等.猪圆环病毒2型Cap蛋白单克隆抗体的制备与应用[J].中国兽医科学,2014,44(10):1022-1028.
[11] 曲信芹,何乃珠,涂 伟,等.猪圆环病毒重组Cap蛋白单克隆抗体的制备及初步应用[J].中国兽医学报,2014,34(7):1053-1058.
[12] 严伟东,李文洁,李文涛,等.猪圆环病毒2型的分离鉴定及优化培养[J].养猪,2012(4):125-128.
[13] Zhou W,Ullman K,Chowdry V,et al.Molecular investigations on the prevalence and viral load of enteric viruses in pigs from five European countries[J].Vet Microbiol,2016,182:75-81.
[14] Afghah Z,Webb B,Meng X J,et al.Ten years of PCV2 vaccines and vaccination:is eradication a possibility?[J].Vet Microbiol,2016,10:2.
[15] Zhai S L,Chen S N,Xu Z H,et al.Porcine circovirus type 2 in China:an update on and insights to its prevalence and control[J].Virol J,2014,11:88.
PreparationandIdentificationofMonoclonalAntibodiesagainstORF2ofPorcineCircovirusType2
AN Chun-jing1,2,LI Xiang-min2,ZHANG Hua-wei2,MO Hong-fang2,GUO Xia-yang2,ZHAO Ze-kai2,QIAN Ping2,ZHAO Xiao-ling1
(1.DepartmentofAnimalScienceandTechnology,CollegeofAgricultureandAnimalHusbandry,TibetUniversity,Linzhi,Tibet,860000,China;2.StateKeyLaboratoryofAgricultureMicrobiology,HuazhongAgricultureUniversity,Wuhan,Hubei,430070,China)
In order to prepare monoclonal antibodies(mAb)against porcine circovirus type 2 (PCV2),ORF2 protein of PCV2 was expressed by baculovirus expression system as an immunogen and purified by column chromatography and ultrafiltration tube.The SPF female Balb/c mice were immunized with purified ORF2 proteins.After three times immunization,the spleen cells of the immunized mice were isolated and fused with SP2/0 cells.Hybridoma colonies were screened for mAb against ORF2 by indirect ELISA.Finally,four anti-ORF2 mAb were successfully generated and named as 1H9,4C11,5B8 and 4F12,respectively.All four mAb can recognize ORF2 specifically by Western blot and immunofluorescence assay (IFA).The 4F12 mAb was specifically reacted with ORF2 by IFA.The subtypes of the 1H9,4C11,5B8 mAbs were IgG1/κappa,4F12 mAb were IgG2b/κappa and ascites titers were 105,104,106and 105,respectively.In conclusion,the specific mAbs against PCV2 ORF2 were successfully prepared.
Porcine circovirus type 2;ORF2 protein;monoclonal antibody
S852.4;S852.659.2
A
1007-5038(2017)10-0032-06
2017-01-15
广西科学研究与技术开发(桂科合14125008-1-18);华中农业大学自主科技创新基金(2662016PY003,2662016PY004)
安春敬(1990-),女,河北邢台人,硕士研究生,主要从事动物病毒学研究。*

