木犀草素和槲皮素体外抗炎作用研究
周霄楠,韩 超,宋鹏琰,赵兴华,2* 钟秀会,2
(1.河北农业大学动物医学院, 河北保定 071001;2.河北农业大学中兽医研究所, 河北保定 071001)
木犀草素和槲皮素体外抗炎作用研究
周霄楠1,韩 超1,宋鹏琰1,赵兴华1,2*钟秀会1,2
(1.河北农业大学动物医学院, 河北保定 071001;2.河北农业大学中兽医研究所, 河北保定 071001)
旨在观察木犀草素及槲皮素对脂多糖(LPS)诱导小鼠巨噬细胞瘤细胞系(RAW264.7)分泌NO、TNF-α、IL-1β、IL-6以及IL-10的影响,评价其抗炎效果。试验采用LPS诱导RAW264.7细胞炎症模型,选对数生长期细胞,设对照组、LPS组、木犀草素5、2.5、1.25 μg/mL组,槲皮素10、5、2.5 μg/mL组。药物预处理4 h后致炎24 h,Griess法测定细胞培养上清液中NO的含量,ELISA测定上清液中TNF-α、IL-1β、IL-6以及IL-10的含量。 试验数据表明,木犀草素及槲皮素均可极显著地抑制LPS诱导RAW264.7细胞后NO、TNF-α、IL-1β以及IL-6含量的升高(P<0.01), 且在一定程度上呈剂量依赖性。结果表明,木犀草素及槲皮素在体外具有良好的抗炎效果。
木犀草素;槲皮素;抗炎作用;小鼠巨噬细胞瘤细胞系
炎症反应是临床常见的病理过程,是指动物机体针对促炎因子、致炎因素、外界对机体的刺激发生的以防御反应为主的应答反应,以局部组织的变质、渗出和增生变化为主要表现[1]。中兽医所述痈肿、疮疡、疔毒等病证与西医中的炎症病理过程类似,可用有清热解毒、活血化淤等药效的中药进行治疗[2]。蒲公英(TaraxacummongolicumHand.-Mazz.)为菊科多年生草本蒲公英属植物的干燥全草,广泛分布于我国,是药食兼用的植物,其药味苦甘、性寒、无毒,入肝、胃经,具清热解毒,消肿散结,利尿通淋之功效。可用于治疗疔疮肿毒,乳痈,瘰疬,目赤,咽痛,肺痈,肠痈,湿热黄疸,热淋涩痛[3]。蒲公英中含多种药用活性成分,前期研究中发现黄酮类粗提物表现出较强的体内外抗炎活性。木犀草素(luteolin)及槲皮素(quercetin)为蒲公英中黄酮类的代表化合物[4],本文通过脂多糖(lipopolysaccharide,LPS)诱导RAW264.7细胞建立炎症模型,通过测定木犀草素、槲皮素对细胞因子的影响,观察体外抗炎效果,并初步阐明其抗炎作用机理,以期为临床应用提供依据。
1 材料与方法
1.1 材料
1.1.1 细胞 RAW264.7小鼠巨噬细胞瘤细胞,中国医学科学院基础医学研究所细胞资源中心。
1.1.2 药品、试剂与仪器 木犀草素(批号Z14J6L1),上海源叶公司产品;槲皮素(批号SLBD8415V)、LPS(批号121M4024V)、MTT,Sigma公司产品;DMEM(高糖)、DMSO,北京索莱宝公司产品;胎牛血清,杭州四季青公司产品。Griess法NO检测试剂盒,Promega公司产品;TNF-α、IL-1β、IL-6、IL-10非即用型ELISA检测试剂盒,R&D公司产品;所用其他化学试剂均为国产分析纯。SYNERGY HTX全波长酶标仪,BioTek公司产品;Series II Water Jacket二氧化碳培养箱,Thermo公司产品;CKX41光学显微镜,Olympus公司产品。
1.2 方法
1.2.1 木犀草素、槲皮素对RAW264.7细胞的毒性作用 取处于对数生长期的RAW264.7细胞,接种于96孔培养板,细胞密度约为5×105个/mL,每孔100 μL细胞混悬液,培养液为含100 mL/L胎牛血清的DMEM(高糖)培养液,四周每孔加入200 μL PBS作为保湿孔,37℃、体积分数为5%的CO2条件下培养12 h待其贴壁且恢复至静息状态。吸弃全部培养液,后续使用的培养液均为不含胎牛血清的DMEM(高糖)培养液。针对不同组别加入含不同成分的DMEM(高糖)培养液各100 μL,具体为:对照组,加入DMEM(高糖)培养液;LPS组,在DMEM(高糖)培养液中加入浓度为100 μg/mL的LPS母液,使LPS终浓度为1 μg/mL;木犀草素组,在DMEM(高糖)培养液中加入浓度为100 μg/mL的木犀草素母液或槲皮素母液,0.22 μm过滤,木犀草素组终浓度分别为10、9、8、7、6 μg/mL,槲皮素组终浓度分别为20、15、10、5 μg/mL,每组6个复孔,继续培养24 h。各组均加入20 μL浓度为5 mg/mL的MTT,继续培养2 h。终止培养,吸弃全部液体,不要损失贴壁的细胞,各组均加入100 μL DMSO,振荡10 min,使细胞内结晶充分溶解,酶标仪520 nm波长处测定各孔OD值。
1.2.2 木犀草素、槲皮素对RAW264.7细胞分泌细胞因子的影响
1.2.2.1 木犀草素、槲皮素对RAW264.7细胞分泌NO的影响 取处于对数生长期的 RAW264.7细胞,接种于6孔培养板,细胞密度约为5×105个/mL,每孔2 mL细胞混悬液,培养液为含100 mL/L胎牛血清的DMEM(高糖)培养液,37℃、体积分数为5%的CO2条件下培养12 h,待其贴壁且恢复至静息状态。后续使用的培养液均为不含胎牛血清的DMEM(高糖)培养液。细胞恢复至静息状态后,吸弃全部培养液,针对不同组别加入含不同成分的DMEM(高糖)培养液2 m L,具体为:对照组及LPS组,加入DMEM(高糖)培养液;用药组,在DMEM(高糖)培养液中加入浓度为100 μg/mL的木犀草素及槲皮素母液,0.22 μm过滤后稀释,木犀草素组终浓度分别为5、2.5、1.25 μg/mL,槲皮素组终浓度分别为10、5、2.5 μg/mL,每组3个复孔,培养4 h。预处理后吸弃全部培养液,对照组加入DMEM(高糖)培养液;LPS组及各用药组加入含LPS(终浓度为1 μg/mL)的DMEM(高糖)培养液,培养24 h。分别于培养达6、12、18、24 h时,收集细胞培养上清液,使用Griess试剂盒测定各组样品的NO含量。
1.2.2.2 木犀草素、槲皮素对RAW264.7细胞分泌TNF-α的影响 细胞处理同1.2.2.1。分别于培养达6、12、18、24 h时,收集细胞培养上清液,使用非即用型ELISA检测试剂盒测定各组样品的TNF-α含量。
1.2.2.3 木犀草素、槲皮素对RAW264.7细胞分泌IL-1β、IL-6以及IL-10的影响 细胞处理同1.2.2.1。于培养达24 h时,收集细胞培养上清液,使用非即用型ELISA检测试剂盒测定各组样品的IL-1β、IL-6和IL-10含量。

2 结果
2.1 木犀草素、槲皮素对细胞活性的影响
浓度≤8 μg/mL的木犀草素及浓度≤15 μg/mL的槲皮素在24 h内对RAW264.7细胞无毒性作用,OD值与对照组无显著差异(P>0.05)(图1)。后续试验中的药物剂量均在安全范围内选取。

1.对照;2.脂多糖;3.9 μg/mL木犀草素;4.8 μg/mL木犀草素;5.7 μg/mL木犀草素;6.6 μg/mL木犀草素;7.20 μg/mL槲皮素;8.15 μg/mL槲皮素;9.10 μg/mL槲皮素;10.5 μg/mL槲皮素
1.Control;2.LPS;3.9 μg/mL luteolin;4.8 μg/mL luteolin;5.7 μg/mL luteolin;6.6 μg/mL luteolin;7.20 μg/mL quercetin;8.15 μg/mL quercetin;9.10 μg/mL quercetin;10.5 μg/mL quercetin
**表示与对照组相比差异极显著(P<0.01)
**indicates extremely significant difference compared with control group(P<0.01)
图1木犀草素和槲皮素对RAW264.7的细胞毒性作用
Fig.1 The toxic effect of luteolin and quercetin on RAW264.7
2.2 木犀草素、槲皮素对RAW264.7分泌NO的影响
如图2所示,LPS组细胞在致炎药物刺激12 h后,其NO分泌量极显著地高于对照组(P<0.01),且在12 h~24 h刺激时间与NO分泌量呈正相关。木犀草素组(图2A)、槲皮素组(图2B)细胞经4 h不同浓度的药物保护后再经LPS刺激12、18、24 h,各剂量组的NO分泌量均极显著地低于LPS组(P<0.01),其中槲皮素10、5 μg/mL组在18 h时,10 μg/mL组在24 h时,NO的分泌量与对照组相比无显著差异(P>0.05),但其余各时间-剂量点的NO分泌量均极显著地高于对照组(P<0.01)。LPS刺激6 h内各组间的NO分泌量无显著差异(P>0.05)。
2.3 木犀草素、槲皮素对RAW264.7分泌TNF-α的影响
如图3所示,LPS组细胞在致炎药物刺激6 h后,TNF-α分泌量极显著地高于对照组(P<0.01),且在24 h内刺激时间与TNF-α分泌量呈正相关。木犀草素组(图3A)、槲皮素组(图3B)细胞经4 h不同浓度的药物保护后再经LPS刺激6、12、18、24 h,各剂量组的TNF-α分泌量均极显著地低于LPS组(P<0.01),但同时均极显著地高于对照组(P<0.01)。分析数据得出,木犀草素组、槲皮素组抑制TNF-α分泌的作用在24 h内呈剂量依赖性,即在用药安全范围内,药物浓度越高抑制TNF-α分泌的效果越好。

A.木犀草素;B.槲皮素
A.Luteolin;B.Quercetin
图2木犀草素和槲皮素对RAW264.7分泌NO的影响
Fig.2 Effects of luteolin and quercetin on NO secretion of RAW264.7
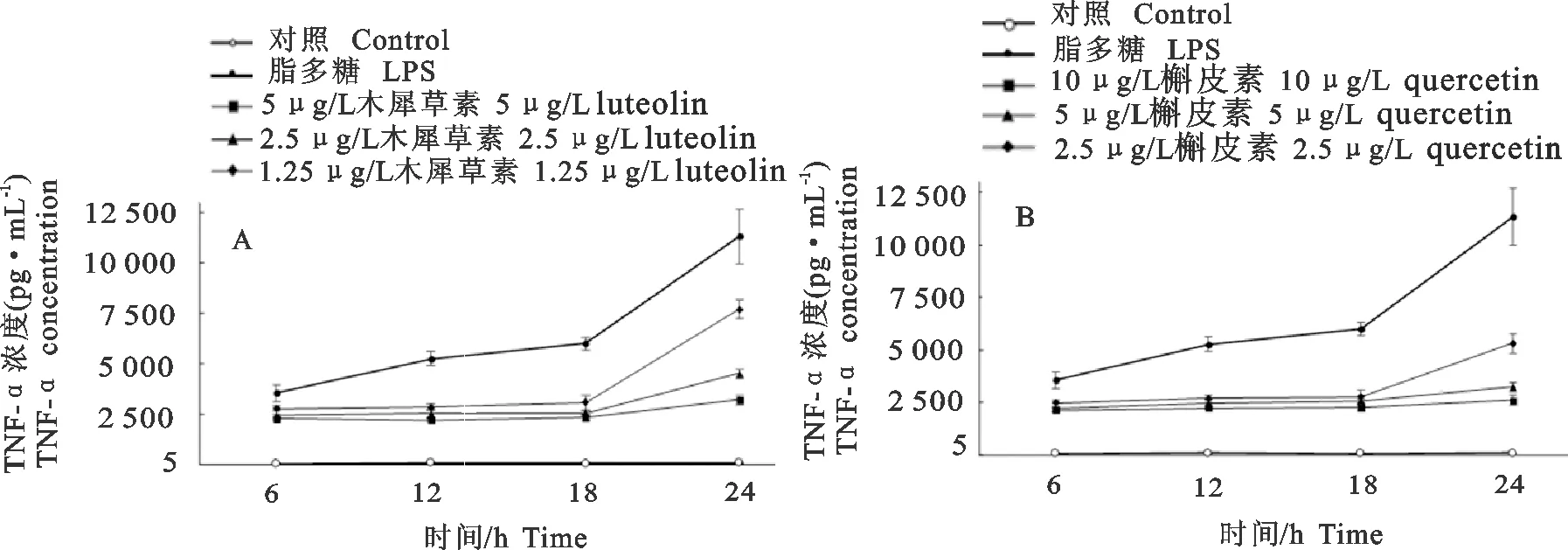
A.木犀草素;B.槲皮素
A.Luteolin;B.Quercetin
图3木犀草素和槲皮素对RAW264.7分泌TNF-α的影响
Fig.3 Effects of luteolin and quercetin on TNF-α secretion of RAW264.7
2.4 木犀草素、槲皮素对RAW264.7分泌IL-1β、IL-6的影响
LPS组细胞在致炎药物刺激24 h后,IL-1β(图4)、IL-6(图5)分泌量均极显著地高于对照组(P<0.01)。木犀草素组、槲皮素组细胞经4 h不同浓度的药物保护后再经LPS刺激24 h,其中木犀草素组的IL-1β、IL-6分泌量均极显著地低于LPS组(P<0.01),且在24 h内呈剂量依赖性,即在用药安全范围内,药物浓度越高抑制IL-1β、IL-6分泌的效果越好,但IL-1β及IL-6分泌量依然极显著地高于对照组(P<0.01)。槲皮素组的IL-1β分泌量均极显著地低于LPS组(P<0.01),但依然极显著地高于对照组(P<0.01);槲皮素10、5 μg/mL组的IL-6分泌量均极显著地低于LPS组(P<0.01),但依然极显著地高于对照组(P<0.01),其2.5 μg/mL组的IL-6分泌量与LPS组相比无显著差异(P>0.05)。
2.5 木犀草素、槲皮素对RAW264.7分泌IL-10的影响
如图6所示,LPS组细胞在致炎药物刺激24 h后,IL-10分泌量极显著地高于对照组(P<0.01)。木犀草素组、槲皮素组细胞经4 h不同浓度的药物保护后再经LPS刺激24 h,其中木犀草素各剂量组的IL-10分泌量均极显著地低于LPS组(P<0.01),且呈剂量依赖性,即在用药安全范围内,药物浓度越高,IL-10分泌量越小,但IL-10分泌量依然极显著地高于对照组(P<0.01)。槲皮素10、5 μg/mL组的IL-10分泌量极显著地低于LPS组(P<0.01),但均极显著地高于对照组(P<0.01),其2.5 μg/mL组的IL-10分泌量与LPS组相比无显著差异(P>0.05)。
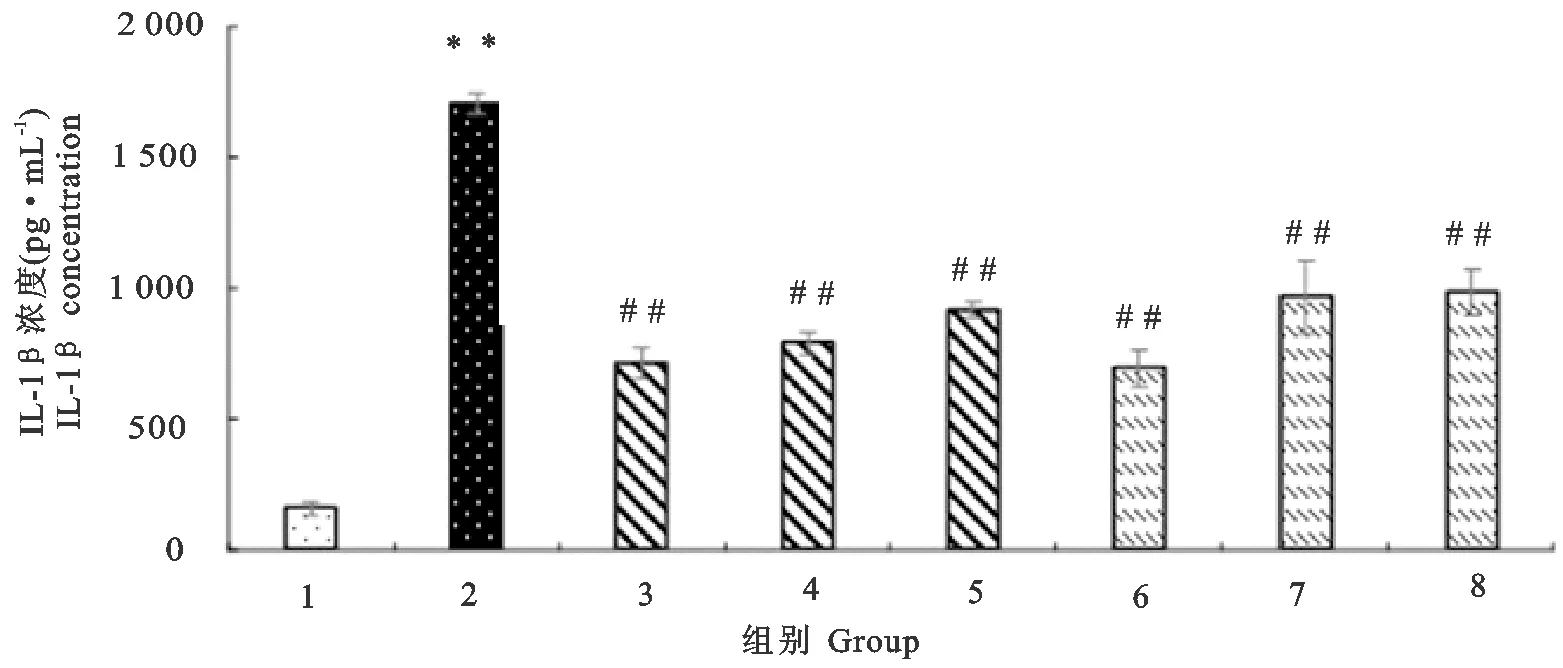
1.对照;2.脂多糖;3.5 μg/mL木犀草素;4.2.5 μg/mL木犀草素;5.1.25 μg/mL木犀草素;6.10 μg/mL槲皮素;7.5 μg/mL槲皮素;8.2.5 μg/mL槲皮素
1.Control;2.LPS;3.5 μg/mL luteolin;4.2.5 μg/mL luteolin;5.1.25 μg/mL luteolin;6.10 μg/mL quercetin;7.5 μg/mL quercetin;8.2.5 μg/mL quercetin
**表示与对照组相比差异极显著(P<0.01);##表示与LPS组相比差异极显著(P<0.01)
**indicates extremely significant difference compared with control group (P<0.01);##indicates extremely significant difference compared with LPS group(P<0.01)
图4木犀草素和槲皮素对RAW264.7分泌IL-1β的影响
Fig.4 Effects of luteolin and quercetin on IL-1β secretion of RAW264.7

1.对照;2.脂多糖;3.5 μg/mL木犀草素;4.2.5 μg/mL木犀草素;5.1.25 μg/mL木犀草素;6.10 μg/mL槲皮素;7.5 μg/mL槲皮素;8.2.5 μg/mL槲皮素
1.Control;2.LPS;3.5 μg/mL luteolin;4.2.5 μg/mL luteolin;5.1.25 μg/mL luteolin;6.10 μg/mL quercetin;7.5 μg/mL quercetin;8.2.5 μg/mL quercetin
**表示与对照组相比差异极显著(P<0.01);##表示与LPS组相比差异极显著(P<0.01)
**indicates extremely significant difference compared with control group (P<0.01);##indicates extremely significant difference compared with LPS group(P<0.01)
图5木犀草素和槲皮素对RAW264.7分泌IL-6的影响
Fig.5 Effects of luteolin and quercetin on IL-6 secretion of RAW264.7
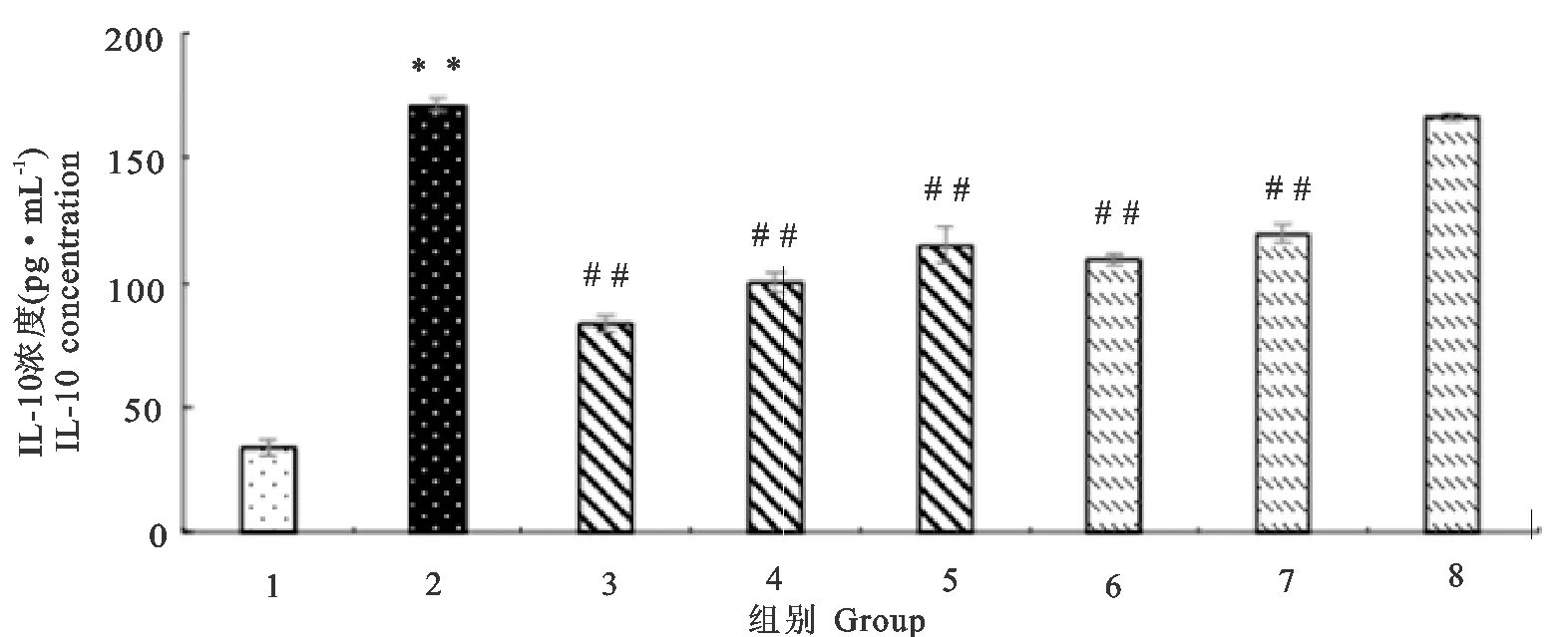
1.对照;2.脂多糖;3.5 μg/mL木犀草素;4.2.5 μg/mL木犀草素;5.1.25 μg/mL木犀草素;6.10 μg/mL槲皮素;7.5 μg/mL槲皮素;8.2.5 μg/mL槲皮素
1.Control;2.LPS;3.5 μg/mL luteolin;4.2.5 μg/mL luteolin;5.1.25 μg/mL luteolin;6.10 μg/mL quercetin;7.5 μg/mL quercetin;8.2.5 μg/mL quercetin
**表示与对照组相比差异极显著(P<0.01);##表示与LPS组相比差异极显著(P<0.01)
**indicates extremely significant difference compared with control group(P<0.01);##indicates extremely significant difference compared with LPS group(P<0.01)
图6木犀草素、槲皮素对RAW264.7分泌IL-10的影响
Fig.6 Effects of luteolin and quercetin on IL-10 secretion of RAW264.7
3 讨论
本试验采用LPS诱导RAW264.7细胞作为体外炎症模型来研究木犀草素及槲皮素的体外抗炎作用。LPS选用剂量参考Park C M等[5]的试验数据,经MTT试验验证,浓度为1 μg/mL的LPS在24 h内对RAW264.7细胞无毒性作用,并确定木犀草素的药物安全范围为≤8 μg/mL,槲皮素的药物安全范围为≤15 μg/mL。试验中,作者发现加入MTT孵育4 h后[6],细胞内有大量呈放射状生长的深蓝色结晶,可能导致试验数据失真,故本试验采用加入MTT后孵育2 h的方法检测药物的细胞毒性。
RAW264.7细胞作为一种巨噬细胞系,参与机体的免疫过程。LPS是激发炎症反应的一种很重要的触发剂,能够刺激体内多种细胞特别是巨噬细胞合成和释放众多内源性生物活性因子,导致炎症反应[7]。NO是机体重要的炎症介质,可在LPS的诱导下由巨噬细胞产生,在炎症的每个阶段都发挥着重要的调节作用[8]。范精华等[9]认为,NO在高浓度状态下可激活NF-κB信号通路,诱导促炎细胞因子TNF-α和IL-1β的分泌,并且这一过程还能形成正反馈, 最终导致炎症反应持久且剧烈,对机体造成严重的损伤,因此抑制 NO的合成能够使炎症症状得到改善。TNF-α是机体受到有害刺激后初期分泌,起关键始动作用的促炎性细胞因子,其亦可在LPS的诱导下由巨噬细胞产生。TNF-α和IL-1β在炎症反应初期即会高度表达,其核心作用是在炎症反应中激活细胞因子级联反应,直接反应了炎症反应的强烈程度。TNF-α可刺激IL-6的产生,并可相互作用形成正反馈,从而导致炎症反应的持续加重[10]。因此抑制TNF-α的过量释放是预防和治疗炎症的关键措施之一。
本试验中LPS诱导RAW264.7细胞6 h后,与对照组进行比较,促炎性细胞因子TNF-α分泌量极显著地升高(P<0.01);诱导12 h后,NO分泌量极显著地升高(P<0.01);诱导24 h后,IL-1β及IL-6分泌量极显著地升高(P<0.01),提示体外炎症模型成功。试验中,给予用药组不同质量浓度的木犀草素或槲皮素预处理4 h后,能够极显著地抑制LPS诱导RAW264.7细胞分泌炎症介质NO以及促炎性细胞因子TNF-α、IL-1β以及IL-6(P<0.01),且在一定程度上呈剂量依赖性,即在药物安全范围内,浓度越高越能够抑制促炎性细胞因子的分泌,提示木犀草素及槲皮素有理想的体外抗炎效果。用药后,抗炎性细胞因子IL-10的分泌量未见显著提高,与其他抗炎药物的报道不同[11],可能是因为木犀草素及槲皮素并不直接影响IL-10的分泌。本试验中IL-10的分泌量可能与炎症的严重程度正相关,即炎症越严重,IL-10分泌量越大而与木犀草素及槲皮素无关。抑制TNF-α、IL-1β以及IL-6释放的原因是否为NF-κB、MAPK、JAK-STAT等炎症通路被抑制[12],有待进一步深入探究。
目前针对木犀草素与槲皮素抗炎活性的研究多停留在理论或实验室阶段,药物开发和临床应用方面的研究较少,仅在呼吸系统疾病中偶有涉及[13-14]。希望随着国家对中药开发重视程度及资金投入地不断加大,木犀草素与槲皮素能够早日广泛应用于临床抗炎。
[1] Li Y,Yao J,Han C,et al.Quercetin,inflammation and immunity[J].Nutrients,2016,8(3):167.
[2] 董竞成,吴金峰,曹玉雪,等.若干同证疾病或状态异病同治的科学基础初探[J].世界中医药,2013(7):715-720.
[3] 国家药典委员会.中华人民共和国药典:2015年版.一部[M].北京:中国医药科技出版社,2015:352-353.
[4] 许 丹,侯凤飞,吴立军,等.蒲公英的化学研究[J].中国中药杂志,2004(3):90.
[5] Park C M,Cho C W,Song Y S.Top 1 and 2,polysaccharides fromTaraxacumofficinale,inhibit NFkappaB-mediated inflammation and accelerate Nrf2-induced antioxidative potential through the modulation of PI3K-Akt signaling pathway in RAW 264.7 cells[J].Food Chem Toxicol,2014,66:56-64.
[6] 彭珍桂,卢小玲.MTT法和CCK-8法检测人肝癌细胞活性的对比研究[J].生物技术世界,2016(3):319.
[7] Brune B,Dehne N,Grossmann N,et al.Redox control of inflammation in macrophages[J].Antioxid Redox Signal,2013,19(6):595-637.
[8] Geissmann F,Manz M G,Jung S,et al.Development of monocytes, macrophages, and dendritic cells[J].Science,2010,327(5966):656-661.
[9] 范精华,刘 康,刘保林.NO在炎症及免疫应答中的调节作用[J].中外医疗,2009(25):163-166.
[10] Zelova H,Hosek J.TNF-alpha signalling and inflammation:interactions between old acquaintances[J].Inflamm Res,2013,62(7):641-651.
[11] Hou X L,Tong Q,Wang W Q,et al.Suppression of inflammatory responses by dihydromyricetin,a flavonoid fromAmpelopsisgrossedentata,via inhibiting the activation of NF-kappaB and MAPK signaling pathways[J].J Nat Prod,2015,78(7):1689-1696.
[12] 刘 辉,姚咏明.细胞内炎症信号通路交汇作用研究进展[J].中国病理生理杂志,2005(8):1607-1613.
[13] 朱荣辉.木犀草素对稳定期COPD患者血清炎症细胞因子及肺功能的影响评价[J].北方药学,2015(2):96-97.
[14] 王广发,夏瑞雪.木犀草素在治疗呼吸系统损伤中的应用及其制备的药物[P].北京:CN105193783A,2015-12-30.
Anti-inflammatoryEffectsofLuteolinandQuercetininVitro
ZHOU Xiao-nan1,HAN Chao1,SONG Peng-yan1,ZHAO Xing-hua1,2,ZHONG Xiu-hui1,2
(1.CollegeofVeterinaryMedicine,AgriculturalUniversityofHebei,Baoding,Hebei,071001,China;2.InstituteofTraditionalChineseVeterinaryMedicine,AgriculturalUniversityofHebei,Baoding,Hebei,071001,China)
The aim of the study was to evaluate the anti-inflammatory effects of luteolin and quercetininvitroby observing the effect of luteolin and quercetin on NO,TNF-α,IL-1β,IL-6 and IL-10 in culture supernatant of RAW264.7 cells activated by lipopolysaccharides (LPS).RAW264.7 cells at logarithmic growth phase were allocated to blank control group,model group (treated with LPS),luteolin groups (treated with 5,2.5,1.25 μg/mL luteolin respectively),and quercetin groups (treated with 10,5,2.5 μg/mL quercetin respectively).After being treated with luteolin and quercetin for 4 h and then incubated with 1 μg/mL LPS for 24 h,the changes of NO levels were observed by Griess assay,the levels of TNF-α,IL-1β,IL-6 and IL-10 were evaluated by ELISA.The results showed that the luteolin and quercetin decreased the contents of NO,TNF-α,IL-1β and IL-6 significantly in RAW264.7 cells activated by LPS (P<0.05) and in a dose-dependent manner in certain degrees.The combined data showed that luteolin and quercetin has obviously anti-inflammatory effectsinvitro.
luteolin; quercetin; anti-inflammation; RAW264.7
2017-02-19
公益性行业(农业)科研专项(201403051);河北省教育厅优秀青年基金项目(YQ2013019)
周霄楠(1983-),男,北京人,硕士研究生,主要从事中兽药药理及中兽医现代化研究。*
S853.74
A
1007-5038(2017)10-0056-06

