结直肠癌组织Ephrin B2表达变化及其对上皮间质转化的影响
张旭,陈秀,陈旺盛
(西南医科大学附属医院,四川泸州646000)
结直肠癌组织Ephrin B2表达变化及其对上皮间质转化的影响
张旭,陈秀,陈旺盛
(西南医科大学附属医院,四川泸州646000)
目的探讨结直肠癌组织肝配蛋白B2(Ephrin B2)表达变化及其对上皮间质转化(EMT)的影响。方法选择结直肠癌组织、癌旁组织及正常结直肠组织各45例份,采用qRT- PCR法、Western blotting法检测Ephrin B2 mRNA和蛋白表达。采用免疫组化法检测Ephrin B2蛋白及EMT标记物N- cadherin、Vimentin、E- cadherin蛋白阳性表达。分析Ephrin B2蛋白阳性表达与结直肠癌患者临床病理参数的关系及其与N- cadherin、Vimentin、E- cadherin蛋白阳性表达的关系。结果结直肠癌组织及癌旁组织Ephrin B2 mRNA和蛋白相对表达量均高于正常结直肠组织(P均<0.05);结直肠癌组织Ephrin B2 mRNA及蛋白相对表达量与癌旁组织比较差异无统计学意义(P均>0.05)。Ephrin B2蛋白阳性表达与结直肠癌患者性别、年龄无关(P均>0.05),与肿瘤临床分期、组织分化程度、淋巴结转移及远处转移有关(P均<0.05)。结直肠癌组织Ephrin B2蛋白阳性表达与E- cadherin蛋白阳性表达呈负相关关系(r=-0.216,P<0.05),与N- cadherin、Vimentin蛋白阳性表达均呈正相关关系(r分别为0.401、0.379,P均<0.05)。结论结直肠癌组织中Ephrin B2高表达,其表达变化能促进EMT,增强肿瘤的侵袭、转移能力。
结直肠癌;肝配蛋白B2;上皮间质转化;肿瘤侵袭;肿瘤转移
结直肠癌的发生、发展是一个多基因、多阶段的演变过程,细胞恶变首先是分子水平的改变[1,2]。因此,寻找结直肠癌的特异性分子生物学标志物对早期诊断和靶向治疗意义重大。但目前对结直肠癌早期诊断缺乏特异性分子生物学标志物。产生促红细胞生成素的肝细胞受体(EPH)家族是酪氨酸蛋白激酶受体家族(RTKs)中最大的一个亚族,在肿瘤侵袭和转移中发挥重要作用。EPH家族包括受体Eph及配体肝配蛋白(Ephrin)两部分,肝配蛋白B2(Ephrin B2)是配体Ephrin的亚型之一,已被证实与结直肠癌的发生有关[3]。上皮间质转化(EMT)是指上皮细胞获得间质细胞表型的生物学过程,这个过程是可逆的[4,5]。近年研究证实,在上皮来源的恶性肿瘤中EMT发挥了至关重要的作用,与肿瘤的侵袭和转移密切相关[6,7]。但目前关于Ephrin B2与EMT在结直肠癌中的关系鲜见报道。2015年9月~2016年9月,我们观察了结直肠癌组织中Ephrin B2表达变化,现分析结果并探讨其对EMT的影响。
1 资料与方法
1.1 临床资料 选择同期于西南医科大学附属医院行手术治疗的结直肠癌患者45例,男29例、女16例,年龄45~70岁、平均55岁。所有患者术前未接受新辅助化疗或其他治疗,术后经组织病理检查明确诊断。排除术前接受过抗肿瘤治疗者,无法手术或手术无法切除者。临床分期:Ⅰ、Ⅱ期17例,Ⅲ、Ⅳ期28例;组织分化程度:低分化29例,中高分化16例;有淋巴结转移31例,有远处转移9例。
1.2 结直肠癌组织、癌旁组织及正常结直肠组织Ephrin B2表达检测 取手术切除的结直肠癌组织、癌旁组织(距肿瘤组织边缘≤2 cm)及正常结直肠组织各45例份,迅速置于液氮中,- 80 ℃冰箱保存备用。①Ephrin B2 mRNA表达:采用qRT- PCR法。采用TRIzol法提取各组织总RNA,蛋白核酸分析仪检测总RNA纯度,OD260/OD280为1.8~2.0。取0.8 μg总RNA,按PCR逆转录试剂盒说明逆转录为cDNA,然后进行PCR扩增。引物设计由华大基因设计合成。引物序列:Ephrin B2上游引物:5′- CGATTGAGCCTTACGACAC- 3′,下游引物:5′- TTTTAAGCGCTGAGCATTG- 3′,片段大小256 bp;GAPDH上游引物: 5′- TGACTTCAACAGCGACACCC-A- 3′,下游引物:5′- CACCCTGTTGCTGTAGCCAAA- 3′,片段大小102 bp。PCR扩增体系共25 μL:ddH2O 8.5 μL,上下游引物各1 μL,cDNA 2 μL,SYBR Green Mix Taq 12.5 μL;反应条件:94 ℃ 30 s,94 ℃ 5 s、56 ℃ 30 s共40个循环,然后65 ℃ 5 s、95 ℃ 5 min。以GAPDH为内参,采用2-ΔΔCt法计算Ephrin B2 mRNA相对表达量。实验重复3次,取平均值。②Ephrin B2蛋白表达:采用Western blotting法。按全蛋白提取试剂盒说明提取组织中总蛋白,BCA法蛋白定量后,加入上样缓冲液,100 ℃水浴10 min,使其充分变性。取40 μg蛋白行SDS- PAGE(5%浓缩胶+12%分离胶),浓缩胶电泳电压80 V、分离胶电泳电压100 V,当Marker蓝色条带跑至电泳槽底部时停止电泳。按湿转法将蛋白转印至PVDF膜(恒流:250 mA,时间:1 kd/min)。取出PVDF膜,5%脱脂牛奶封闭1 h,分别加入GAPDH(1∶5 000)、Ephrin B2一抗(1∶2 000),4 ℃孵育过夜。TBST洗膜10 min×3次,避光条件下二抗(1∶5 000)室温孵育1 h,TBST洗膜10 min×3次,ECL显影,采用ChimiDox- XR凝胶成像仪对蛋白电泳条带进行灰度扫描,Quantity One软件分析蛋白电泳条带的灰度值。以Ephrin B2蛋白电泳条带灰度值/GAPDH蛋白电泳条带灰度值作为Ephrin B2蛋白相对表达量。分析Ephrin B2蛋白表达与结直肠癌患者临床病理参数的关系。
1.3 结直肠癌组织Ephrin B2、N- cadherin、E- cadherin、Vimentin蛋白阳性表达检测 采用免疫组化法。取结直肠癌组织,10%中性甲醛固定,石蜡包埋,4 μm厚连续切片。切片经二甲苯脱腊、梯度乙醇脱水,PBS冲洗5 min×3次;0.01 mol/L枸橼酸钠缓冲液抗原热修复,内源性过氧化物酶37 ℃封闭20 min;PBS冲洗5 min×3次,一抗[Ephrin B2(稀释倍数1∶200),N- cadherin、Vimentin、E- cadherin(稀释倍数1∶250)]4 ℃孵育过夜;室温复温30 min,PBS冲洗5 min×3次,HRP标记的二抗37 ℃孵育30 min,DAB显色,苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片,显微镜下拍照观察。Ephrin B2、N- cadherin蛋白阳性染色定位于细胞膜和细胞质,Vimentin蛋白阳性染色定位于细胞质,E- cadherin蛋白阳性染色定位于细胞膜,均呈黄色或褐色颗粒。在阳性细胞最多的区域选择5个400倍视野,计数不少于100个细胞,观察细胞着色强度,计算阳性细胞所占比例。细胞着色强度:未着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞所占比例:≤5%为0分,>5%~≤25%为1分,>25%~≤50%为2分,>50%~≤75%为3分,>75%为4分。根据细胞着色强度和阳性细胞所占比例综合判定,二者乘积≥3分为阳性。所有结果由两位病理医师分别评价,取二者平均值。分析Ephrin B2蛋白阳性表达与E- cadherin、N- cadherin、Vimentin蛋白阳性表达的关系。

2 结果
2.1 结直肠癌组织、癌旁组织及正常结直肠组织Ephrin B2表达比较 见表1。
表1 结直肠癌组织、癌旁组织及正常结直肠组织Ephrin B2 mRNA和蛋白相对表达量比较
注:与正常结直肠组织比较,*P<0.05。
2.2 Ephrin B2蛋白阳性表达与结直肠癌患者临床病理参数的关系 见表2。
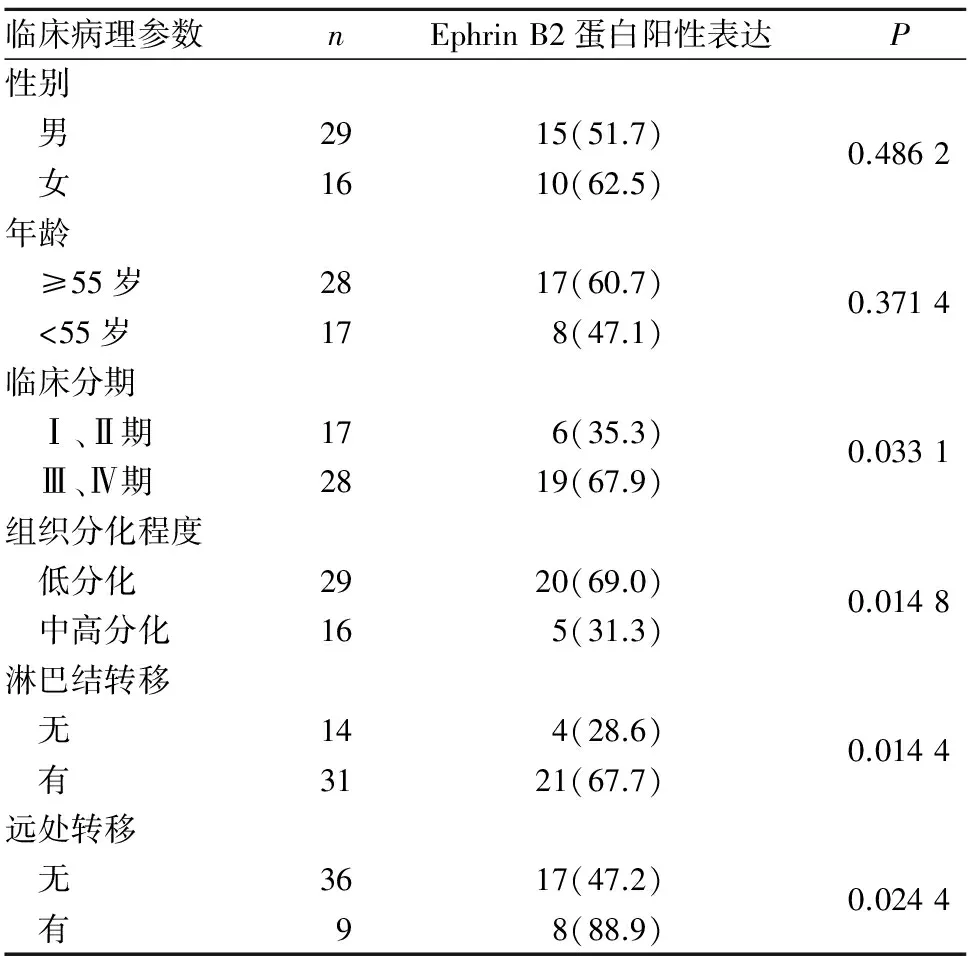
表2 Ephrin B2蛋白阳性表达与结直肠癌患者 临床病理参数的关系[例(%)]
2.3 结直肠癌组织Ephrin B2蛋白阳性表达与E- cadherin、N- cadherin、Vimentin蛋白阳性表达的关系 结直肠癌组织Ephrin B2、E- cadherin、N- cadherin、Vimentin蛋白阳性表达率分别为55.6%(25/45)、33.3%(15/45)、51.1%(23/45)、62.2%(28/45)。Ephrin B2蛋白阳性表达与E- cadherin蛋白阳性表达呈负相关关系(r=-0.216,P<0.05),与N- cadherin、Vimentin蛋白阳性表达均呈正相关关系(r分别为0.401、0.379,P均<0.05)。见表3。
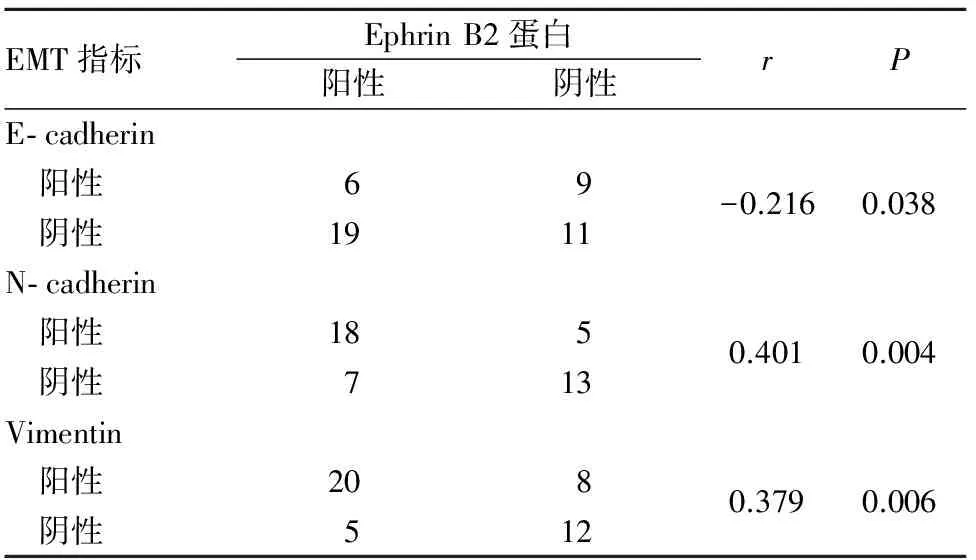
表3 结直肠癌组织Ephrin B2蛋白阳性表达与E- cadherin、N- cadherin、Vimentin蛋白阳性表达的关系(例)
3 讨论
EPH家族受体Eph及其配体Ephrin均可分为两大类,即Eph A1~Eph A10、Eph B1~Eph B6和Ephrin A1~Ephrin A6、Ephrin B1~Ephrin B3[8]。EPH家族均为跨膜蛋白,包含相对保守的胞内区、跨膜区、胞外区三部分,其活化依赖细胞间紧密连接。Ephrin配体嵌合在细胞膜中并与特定细胞的Eph受体结合才能发挥作用[9]。研究发现,Ephrin B2与其介导的受体Eph B4形成特有的双向信号传导系统,在肿瘤的发生、发展中发挥重要作用[10,11]。在许多恶性肿瘤组织中,Ephrin B2高表达,如食管癌[12]、乳腺癌[13]、卵巢癌[14],而在正常组织中低表达或不表达。有研究表明,Ephrin B2在细胞癌变过程中发挥重要作用。Ephrin B2不仅参与恶性肿瘤的发生过程,还与恶性肿瘤的侵袭、转移过程密切相关[15]。提示Ephrin B2可能是良性肿瘤恶变过程中的早期作用因子,并在肿瘤发生、发展和侵袭、转移过程中具有积极作用。但目前鲜见Ephrin B2与结直肠癌关系的报道。
本研究结果显示,结直肠癌组织及癌旁组织Ephrin B2 mRNA及蛋白相对表达量均高于正常结直肠组织;结直肠癌组织Ephrin B2 mRNA及蛋白相对表达量虽高于癌旁组织,但差异无统计学意义。提示Ephrin B2可能在结直肠癌的发生、发展过程中发挥重要作用,有可能作为结直肠癌早期诊断的分子生物学标志物。本研究还发现,Ephrin B2蛋白阳性表达与患者性别、年龄无关,与肿瘤临床分期、组织分化程度、淋巴结转移及远处转移有关。说明Ephrin B2在促进结直肠癌侵袭和转移方面可能发挥积极作用。但目前关于Ephrin B2在结直肠癌侵袭和转移中的作用机制研究甚少。
研究证实,在肿瘤的侵袭和转移过程中EMT发挥关键作用。EMT使具有极性的、相对稳定的上皮细胞,通过一系列的生化过程获得间质细胞表型,从而提高肿瘤细胞的侵袭和迁移能力[16]。间质细胞标志分子N- cadherin、Vimentin上调,而上皮细胞标志分子E- cadherin缺失或下调,与EMT密切相关,被认为是肿瘤细胞侵袭和迁移能力增强的标志[17]。目前关于Eph- Ephrin系统在恶性肿瘤侵袭、转移中的作用越来越受到关注[18~20]。研究发现,Ephrin B2能够增强细胞在细胞外基质的游走能力,继而促进肿瘤细胞的扩散和转移[21];Eph A2可能通过促进EMT在胃癌的发生、发展过程中发挥重要作用[22]。本研究结果显示,Ephrin B2蛋白阳性表达与E- cadherin蛋白阳性表达呈负相关关系,与Vimentin、N- cadherin蛋白阳性表达呈正相关关系。提示Ephrin B2可能通过调控N- cadherin、E- cadherin、Vimentin表达,促进EMT进程,参与结直肠癌的侵袭和转移。
综上所述,结直肠癌组织Ephrin B2高表达,其表达变化能促进EMT进程,增强肿瘤的侵袭和转移能力。Ephrin B2有可能作为结直肠癌早期诊断、分子靶向治疗及预后判断的分子生物学标志。Ephrin B2及其配体形成的双向信号传导系统对肿瘤调控的机制相当复杂,可能在同一种肿瘤中发挥致癌和抑癌双重作用,故其在结直肠癌中的作用及其与EMT的关系尚需进一步研究。
[1] Siegel RL, Miller KD, Jemaal A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016,66(1):7- 30.
[2] 李道娟,李倩,贺宇彤.结直肠癌流行病学趋势[J].肿瘤防治研究,2015,42(3):305- 310.
[3] Li P, Chen W, Wang Y, et al. Effects of ephrinB2 gene siRNA on the biological behavior of human colorectal cancer cells[J]. Oncol Rep, 2015,33(2):758- 766.
[4] Lee MH, Kachroo P, Pagano PC, et al. Combination treatment with apricoxib and IL- 27 enhances inhibition of epithelial- mesenchymal transition in human lung cancer cells through a STAT1 dominant pathway[J]. J Cancer Sci Ther, 2014,6(11):468- 477.
[5] 陈文浩,杨明,张艳桥.上皮-间质转化在恶性肿瘤中发生机制的研究进展[J].中国肿瘤,2016,25(1):51- 57.
[6] 李倩,徐春燕,彭鹏,等.姜黄素对TNF- α诱导人结直肠癌细胞上皮间充质转化、迁移的影响[J].山东医药,2016,56(34):1- 3.
[7] Shao S, Zhao X, Zhang X, et al. Notch1 signaling regulates the epithelial- mesenchymal transition and invasion of breast cancer in a slug- dependent manner[J]. Mol Cancer, 2015(14):28.
[8] Salvucci O, Tosato G. Essential roles of EphB receptors and EphrinB ligands in endothelial cell function and angiogenesis[J]. Adv Cancer Res, 2012(114):21- 57.
[9] Mosch B, Reissenweber B, Neuber C, et al. Eph receptors and Ephrin ligands: important players in angiogenesis and tumor angiogenesis[J]. J Oncol, 2010,2010:135285.
[10] Herath NI, Spanevello MD, Doecke JD, et al. Complex expression patterns of Eph receptor tyrosine kinases and their ephrin ligands in colorectal carcinogenesis[J]. Eur J Cancer, 2012,48(5):753- 762.
[11] 刘成霞,刘海燕,李学峰,等.锯齿状息肉癌变途径中Eph B2及Ephrin B2的表达及作用[J].世界华人消化杂志,2014,22(31):4872- 4877.
[12] 郑庆丰,柳硕岩,王海燕,等.Eph B4及其配体Ephrin B2在食管鳞癌中表达及其与血管生成的关系[J].中国肿瘤临床,2013,40(10):579- 582.
[13] 赵薇,马冲.Ephrin- B2在乳腺癌组织中的表达及临床意义[J].牡丹江医学院学报,2012,33(6):3- 5.
[14] Alam SM, Fujimoto J, Jahan I, et al. Coexpression of EphB4 and ephrinB2 in tumor advancement of ovarian cancer[J]. Br J Cancer, 2008,98(4):845- 851.
[15] Zhang R, Zhao Y, Zhang S, et al. The expressions of EphrinB2 and VEGF in nasopharyngeal carcinoma and their clinical significance[J]. Lin Chung Er Bi Yan Hou Tou Jing Wai Ke Za Zhi, 2013,27(4):178- 180.
[16] Zhu QC, Gao RY, Wu W, et al. Epithelial- mesenchymal transition and its role in the pathogenesis of colorectal cancer[J]. Asian Pac J Cancer Prev, 2013,14(5):2689- 2698.
[17] Ficher KR, Durrans A, Lee S, et al. Epithelial- to- mesenchymal transition is not required for lung metastasis but contributes to chemoresistance[J]. Nature, 2015,527(7579):472- 476.
[18] 傅明杰,邢雪.Eph受体家族与肿瘤及肿瘤血管的相关性研究进展[J].临床普外科电子杂志,2014,2(2):53- 58.
[19] 徐华林,赵娟娟,郑文,等.Eph及其配体Ephrin在肿瘤转移中的研究进展[J].肿瘤,2016,35(6):707- 712.
[20] 钱光,梅炯,蔡宣松.Eph- ephrin系统与肿瘤的血管生成[J].同济大学学报(医学版),2004,25(5):431- 433.
[21] Meyer S, Hafner C, Guba M, et al. Ephrin- B2 overexpression enhances integrin- mediated ECM- attachment and migration of B16 melanoma cells[J]. Int J Oncol, 2005,27(5):1197- 1206.
[22] Hou F, Yuan W, Huang J, et al. Overexpression of EphA2 correlates with epithelial- mesenchymal transition- related proteins in gastric cancer and their prognostic importance for postoperative patients[J]. Med Oncol, 2012,29(4):2691- 2700.
西南医科大学青年基金资助项目(2014QN088)。
陈旺盛(E- mail: wangzhai_147@163.com)
10.3969/j.issn.1002- 266X.2017.36.021
R735.3
B
1002- 266X(2017)36- 0065- 04
2017- 01- 15)

