腹膜纤维化大鼠模型构建及其腹膜组织中热休克蛋白的表达变化
王乙安,宴玥,赵恒,陆琪,凡碟,者星炜
(昆明医科大学第一附属医院,昆明650000)
·基础研究·
腹膜纤维化大鼠模型构建及其腹膜组织中热休克蛋白的表达变化
王乙安,宴玥,赵恒,陆琪,凡碟,者星炜
(昆明医科大学第一附属医院,昆明650000)
目的构建腹膜纤维化大鼠模型,探讨其腹膜组织中热休克蛋白(HSP27、HSP70、HSP90)的表达变化。方法将40只SD大鼠随机均分为空白对照组及造模2周组、造模4周组、造模6周组。模型组每日给予4.25%葡萄糖持续非卧床性腹膜透析液(100 mL/kg)腹腔注射,建立腹膜纤维化大鼠模型,空白对照组每日给予等量的生理盐水腹腔注射。各组于末次腹膜透析后48 h行腹膜平衡试验评估腹膜转运功能(超滤量、小分子溶质转运率);采集大鼠腹膜组织,用HE染色法和Masson染色法观察其组织病理学变化;采用免疫组化法检测大鼠腹膜组织TGF-β1、Smad2/3、HSP27、HSP70、HSP90蛋白表达。结果随腹膜透析时间延长,模型组大鼠腹膜超滤量逐渐降低,小分子溶质转运率逐渐升高(P均<0.05);腹膜逐渐增厚,间质有炎症细胞浸润伴水肿及毛细血管增生;腹膜基质层增厚,胶原纤维增多,各组大鼠肠系膜组织厚度、腹膜组织厚度比较差异有统计学意义(P均<0.05)。各组大鼠腹膜组织TGF-β1、Smad2/3、HSP27、HSP70、HSP90蛋白表达比较差异有统计学意义(P均<0.05)。结论成功构建腹膜纤维化大鼠模型;其腹膜组织中HSP27、HSP70、HSP90蛋白呈高表达,且透析时间越长,以上指标表达变化越明显。
腹膜纤维化;腹膜透析;热休克蛋白27;热休克蛋白70;热休克蛋白90;大鼠
持续非卧床性腹膜透析(CAPD)是目前终末期肾脏病的重要替代疗法之一[1]。但腹膜组织在非生物相容性腹膜透析液的长期刺激下发生形态学改变,引起腹膜纤维化[2]。腹膜纤维化致超滤丧失是CAPD患者退出腹膜透析治疗的主要原因,限制了CAPD的临床应用。TGF-β/Smad信号蛋白的活化是多种器官和组织(肾、肝、肺、腹膜)纤维化发生发展最关键的信号通路[3]。热休克蛋白(HSP)家族是机体应激时表达的蛋白质,是胶原成熟的必要条件,可能在纤维化过程中发挥重要作用[4]。近年来研究显示,HSP27[5]、HSP70[6]、HSP90[7]在多种组织纤维化中表达异常,但与腹膜纤维化的关系尚未见报道。2016年9月~2017年6月,本研究建立大鼠腹膜纤维化模型,观察随透析时间的延长大鼠腹膜形态学、功能的改变以及HSP27、HSP70、HSP90蛋白在大鼠腹膜组织中的表达变化。
1 材料与方法
1.1 材料来源 SD雄性大鼠40只,体质量(200±20)g,购自昆明医科大学实验动物中心,每笼5只,于恒温(22±2)℃、恒湿55%±5%条件下标准饲料喂养,自由饮水。4.25%葡萄糖透析液购自广州百特医疗有限公司;兔抗大鼠TGF-β1、Smad2/3多克隆抗体购自Santa Cruze公司;兔抗大鼠HSP27、HSP70、HSP90多克隆抗体购自Cell Signaling Technology公司;山羊血清封闭液购自Bioss公司;即用型快捷免疫组化二抗试剂盒购自迈新公司;阳离子防脱破片购自北京中杉金桥公司;其他生化试剂均为进口分装或国产分析纯。
1.2 动物分组及模型制备 将40只大鼠随机均分为空白对照组及造模2周组、造模4周组、造模6周组。模型组每日给予4.25%葡萄糖腹膜透析液(100 mL/kg)腹腔注射;空白对照组每日给予等量生理盐水腹腔注射。大鼠取头低位,以右下腹靠腹股沟中点处为穿刺点,朝左上方进针,针头与腹平面呈30°。注射过程中留意有无刺到腹壁及观察有无肛门、尿道漏液。
1.3 取材方法 造模组分别于末次腹膜透析后48 h、空白对照组于喂养6周肌内注射10%水合氯醛进行麻醉,腹腔注射4.25%葡萄糖腹膜透析液25 mL,4 h后打开腹腔,抽取腹腔内腹膜透析液2 mL作为4 h腹透液标本;从腹透液袋中抽取透析液2 mL作为0 h腹透液标本。用纱布吸干腹腔内剩余液体,称重,计算出液量。分别于腹腔注射4.25%葡萄糖腹膜透析液25 mL前(0 h)及4 h后从大鼠眼内眦抽静脉血2 mL。将透析液、静脉血分别以1 500、3 000 r/min离心10 min取上清液,置入-80 ℃冰箱保存,进行后续血生化检测。沿两侧腹中线上、中位置且避开穿刺部位取材,留取腹膜组织,用4%多聚甲醛固定,制作石蜡切片,进行形态学分析及免疫组化检测;取大鼠幽门下段5~20 cm肠系膜组织,平展于清洁的白色有机玻璃上,肉眼观察肠系膜组织变化。
1.4 腹膜转运功能评估 采用腹膜平衡试验。取透析液、静脉血上清液,采用全自动生化分析仪测定透析液、血浆葡萄糖(Glu)、白蛋白(Alb)、总蛋白(Tp)、肌酐(Cr)、尿素(Ure)水平。计算透析液与血浆Alb比值(D/Ptp)、Tp比值(D/Palb)、Cr比值(D/PCr)、Ure比值(D/Pure),4 h透析液Glu浓度与0 h透析液Glu浓度比值(D4/D0)。超滤量=最后出水量-25 mL;葡萄糖转运量(MTG)=(透析液初始葡萄糖浓度×注入透析液体积)-(透析末葡萄糖浓度×终末透析液出量);透析液与血浆溶质浓度之比(D/P)=透析液某时间点某溶质浓度/血浆该时间点该溶质浓度。
1.5 腹膜组织及肠系膜组织形态学变化观察 将留取的腹膜组织及肠系膜组织用4%的多聚甲醛固定48~72 h,常规梯度乙醇脱水,二甲苯透明,石蜡包埋,切片(厚度4 μm),脱蜡。采用HE染色法,苏木素、伊红染色,梯度脱水,中性树脂封片,显微镜下观察腹膜组织及肠系膜组织形态学变化。每组取6个样本,每个样本做3张切片,每张切片观察10个视野,测量5个不同位点肠系膜组织厚度,取平均值。切片脱蜡后,采用Masson染色法,分别经天青石兰染液、Weiger铁苏木素液、丽春红酸性品红液染色,脱水透明,中性树胶封片。显微镜下观察胶原沉积情况并测量腹膜组织厚度。每张切片观察10个高倍视野,测量5个不同位点腹膜组织厚度,取平均值。
1.6 腹膜组织中TGF-β1、Smad2/3、HSP27、HSP70、HSP90蛋白表达检测 采用免疫组化法。石蜡切片脱蜡后,柠檬酸缓冲液修复抗原,山羊血清封闭,滴加稀释后的一抗(TGF-β11∶100、Smad2/3 1∶100、HSP27 1∶100、HSP70 1∶300、HSP90 1∶300),4 ℃过夜,磷酸盐缓冲液冲洗3次后加二抗,37 ℃孵育15 min,PBS冲洗,DAB显色,镜下控制反应时间,中性树胶封片。显微镜下观察,阳性信号为棕黄色,信号越强,颜色越深,观察棕褐色沉积的部位与深浅。每张切片随机选择10个高倍视野进行图像采集,使用Image J图像处理软件对染色结果进行分析。有效测量面积范围内目标染色区累积光密度值(IOD)/有效测量区域面积累积IOD作为目标蛋白相对表达量。

2 结果
2.1 各组腹膜转运功能比较 超滤量、D4/D0各组比较:空白对照组>造模2周组>造模4周组>造模6周组;小分子溶质转运率(D/PCr、D/Pure、D/Ptp、D/Palb、MTG)各组比较:空白对照组<造模2周组<造模4周组<造模6周组。以上指标四组两两比较差异有统计学意义(P均<0.05)。见表1。
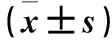
表1 各组大鼠腹膜转运功能指标比较
2.2 各组大鼠腹膜及肠系膜组织病理变化比较
2.2.1 HE染色结果 壁层腹膜组织HE染色显示,空白对照组壁层腹膜表面覆盖一层连续的扁平间皮细胞,细胞完整呈多边形,核扁圆形,位于细胞中央,间皮下基质薄而致密;造模2周组腹膜间皮细胞肿胀变圆,间质有炎细胞浸润伴水肿;造模4周组腹膜增厚,间皮细胞肿胀变圆,部分脱落,间质有炎细胞浸润伴水肿,间皮下基质增厚伴毛细血管增生;造模6周组腹膜明显增厚,间皮细胞皱缩,脱落,纤维裸露,炎细胞减少。肠系膜HE染色结果显示:随造模时间延长,肠系膜组织厚度增厚、肠外纵肌层增厚。肠系膜肉眼可见随着造模时间的延长,肠系膜透明度减低,系膜上小血管明显增生,且肠系膜根部有白色纤维样物质沉积。各组大鼠肠系膜组织厚度两两比较差异有统计学意义(P均<0.05)。见表2。
2.2.2 Masson染色结果 空白对照组腹膜组织薄而连续,致密光滑,随着造模时间的延长,间皮下致密层增厚,胶原纤维增多,腹膜组织厚度增加;随着腹膜透析时间延长,以上改变更加明显。各组大鼠腹膜厚度两两比较差异有统计学意义(P均<0.05)。见表2。
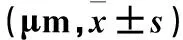
表2 各组大鼠肠系膜组织及腹膜组织厚度比较
2.3 各组大鼠腹膜组织TGF-β1、Smad2/3、HSP27、HSP70、HSP90蛋白表达比较 各组大鼠腹膜组织TGF-β1、Smad2/3、HSP27、HSP70、HSP90蛋白相对表达量两两比较差异有统计学意义(P均<0.05)。见表3。
3 讨论
国内外大量研究表明,CAPD透析效率与血液透析相当,且对于心功能欠佳、血压偏低、有出血倾向的患者效果更佳[1]。但透析过程中腹膜组织长期暴露在高渗、高糖的非生理性透析液中,引起腹膜形态学和功能的改变,继而发生腹膜纤维化,导致小分子溶质转运率升高和超滤衰竭[2]。最终患者无法持续进行CAPD。腹膜透析时腹膜纤维化呈渐进性,过程隐匿,不易被察觉。目前,国内外判别腹膜纤维化的主要方法是观察腹膜组织形态变化及检测间皮细胞和间充质细胞标志物表达的变化。临床上则采用定期行腹膜平衡试验观察小分子溶质转运率的变化来判断患者腹膜情况及是否发生超滤衰竭,但该方法特异性不强,且与腹膜纤维化的严重程度无相关性。HSP因参与胶原的合成,近年来引起关注。
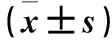
表3 各组大鼠腹膜组织TGF-β1、Smad2/3、HSP27、HSP70、HSP90蛋白表达比较
CAPD患者腹膜功能的改变主要为腹膜溶质转运率增高,超滤量下降,而腹膜溶质高转运以小分子溶质转运率增加为特征,其中小分子溶质包括Glu、Alb、Tp、Cr、Ure等[8]。本研究通过采用4.25%葡萄糖透析液建立腹膜纤维化大鼠模型,发现从造模第2周起,大鼠腹膜形态开始发生改变,腹膜间皮细胞数量减少,大量新生血管形成,炎症细胞浸润,腹膜基质层胶原堆积,超滤量降低,小分子溶质转运率增高。且随着透析时间延长,以上指标改变更加明显,至第6周达高峰。与相关文献[9]结果一致,证明成功建立了大鼠腹膜纤维化模型。
多器官、组织的纤维化如肾、肝、肺等器官以及腹膜纤维化的发生发展均与TGF-β有关[3]。TGF-β主要通过激活下游信号蛋白Smads,促进成纤维细胞增殖和聚集,使上皮细胞转化为成纤维细胞。本研究结果显示,透析组大鼠TGF-β1、Smad2/3的表达逐渐升高,且随着腹膜纤维化的进展呈升高趋势,与相关文献[10]结果一致。
HSP是机体应激时表达的一种蛋白质,既能通过模式识别受体激活先天免疫系统启动或促进炎症反应,也能作为前胶原的“分子伴侣”参与胶原合成及成熟,并调控胶原产量,进而促进纤维化进程[4]。近年来研究发现,HSP家族在肺、肝、肾等多种纤维化疾病中表达异常[5~7]。Vidyasagar等[11]研究发现,肾脏纤维化过程中HSP27的表达升高,且HSP27与纤维化相关因子TGF-β1、肌动蛋白、E-钙黏蛋白相关。HSP70在纤维化中发挥不同的作用。Tanaka等[12]研究证实HSP70具有抗纤维化的作用,过表达HSP70的转基因小鼠肺部炎症和纤维化病变减轻;而抑制HSP70的表达可促进TGF-β1分泌及细胞外基质的合成,进而促进纤维细胞向肌成纤维细胞分化和增生,加剧小鼠肺纤维化进程。与之相反,部分研究发现,HSP70可激活先天免疫系统及促进炎症反应,并促进胶原合成[6]。HSP70发挥的作用不同,可能是因为随着造模时间的延长,机体度过恢复期,HSP70的保护作用逐渐减弱,促纤维化作用占主导地位,从而加重纤维化。故HSP70在纤维化中具体作用机制尚待进一步明确。抑制HSP90的表达可通过抑制肌成纤维细胞、纤维连接蛋白及胶原蛋白的表达来抑制肾脏纤维化与肝纤维化[13]。机制可能为:其低表达可阻遏TGF-β1靶基因的转录及磷酸化,从而抑制TGF-β1信号通路,阻止纤维化的发生。本研究发现,造模2~4周组中HSP27、HSP70、HSP90蛋白表达量不断增加,说明HSP27、HSP70、HSP90蛋白表达随着腹膜纤维化进程而逐渐增加,提示在腹膜纤维化过程中,HSP27、HSP70、HSP90的主导作用为促进胶原的合成,参与腹膜纤维化的病理进展。
综上所述,HSP27、HSP70、HSP90可能参与大鼠腹膜纤维化的发生发展。HSP可能成为早期诊断腹膜纤维化的新型分子标志物。因此深入探讨HSP与腹膜纤维化的相关分子机制,对HSP家族分子进行调控,可能影响腹膜纤维化的进展,为临床腹膜纤维化的诊断、治疗及预后提供参考。
[1] Khama R. Solute and water transport in peritoneal dialysis: a case-based primer[J]. Am J Kidney Dis, 2017,69(3):461-472.
[2] Mizumasa T, Hirakata H, Kuroki Y, et al. Diabetes influences peritoneal morphology in uremic patients at the initiation of peritonealdialysis[J]. Perit Dial Int, 2013,33(2):175-181.
[3] Mizuno S, Matsumoto K, Li MY, et al. HGF reduces advancing lung fibrosis in mice: a potential role for MMP-dependent myofibroblast apoptosis[J]. FASEB J, 2005,19(6):580-598.
[4] Bellaye PS, Burgy O, Causse S, et al. Heat shock proteins in fibrosis and wound healing: good or evil[J]. Pharmacol Ther, 2014,143(2):119-132.
[5] Musiani D, Konda JD, Pavan S, et al. Heat-shock protein 27 (HSP27, HSPB1) is up-regulated by MET kinase inhibitors and confersresistance to MET-targeted therapy[J]. FASEB J, 2015,14(9):17-25.
[6] Shin JU, Lee WJ, Tran TN, et al. Hsp70 knockdown by siRNA decreased collagen production in keloid fibroblasts[J]. Yonsei Med J, 2015,56(6):1619-1626.
[7] Noh H, Kim HJ, Mi RY, et al. Heat shock protein 90 inhibitor attenuates renal fibrosis through degradation of transforming growth factor-beta type ii receptor[J]. Lab Invest, 2012,92(11):1583-1596.
[8] Qayyum A, Oei EL, Paudel K, et al. Increasing the use of biocompatible, glucose-free peritoneal dialysis solutions[J]. World J Nephrol, 2015,4(1):92-97.
[9] Pawlaczyk K, Baum E, Schwermer K, et al. Animal models of peritoneal dialysis: thirty years of our own experience[J]. Biomed Res Int, 2015,2015:261813-262822.
[10] Lv ZD, Wang HB, Li FN, et al. TGF-β1induces peritoneal fibrosis by activating the smad2 pathway in mesothelial cells and promotes peritoneal carcinomatosis[J]. Int J Mol Med, 2012,29(3):373-379.
[11] Vidyasagar A, Reese SR, Hafez O, et al. Tubular expression of heat-shock protein 27 inhibits fibrogenesis in obstructive nephropathy[J]. Kidney Int, 2013,83(1):84-92.
[12] Tanaka K, Tanaka Y, Namba T, et al. Heat shock protein 70 protects against bleomycin-induced pulmonary fibrosis in mice[J]. Biochem Pharmacol, 2010,80(6):920-931.
[13] Sun X, Zhang XD, Cheng G, et al. Inhibition of hepatic stellate cell proliferation by heat shock protein 90 inhibitors in vitro[J]. Mol Cell Biochem, 2009,330(1-2):181-195.
10.3969/j.issn.1002-266X.2017.37.008
R656.4
A
1002-266X(2017)37-0025-04
中国医院协会血液净化中心管理分会研究项目(CHABP2016-07)。
2017-07-08)

