利用传感器技术测定琥珀酸亚铁片中铁元素的含量
李欣+张健+杨焱媛
摘要:利用滴数传感器和氧化还原电势传感器等数字化实验仪器,通过对高锰酸钾溶液的配制和标定,测定了琥珀酸亚铁片中铁元素的含量。在高中化学实验中引入此方法可以扩大定量实验的范围及内容,培养学生的实验能力和信息技术水平。
关键词:琥珀酸亚铁片;传感器技术;铁含量测定;实验探究
文章编号:1005–6629(2017)10–0055–04 中图分类号:G633.8 文献标识码:B
1 问题提出
铁是生命体内必需的微量元素,在生命体内起着重要的作用,例如组成血红蛋白和肌红蛋白,直接参与氧的运输和存储;参与某些酶的合成和能量释放,对免疫系统和其他微量元素均有重要的影响。缺铁或缺铁性贫血会导致免疫力低下,难以维持正常的工作状态。缺铁性贫血的治疗方法是补充足够的铁直到恢复至正常的存储量。铁盐主要以正二价铁的形式被吸收,目前补铁剂种类多样,如复方硫酸亚铁片、琥珀酸亚铁片、二维亚铁缓释片、朴雪口服液等[1]。
基于铁元素在人体内的重要作用,高中人教版化学教科书《实验化学》(选修6)专门设置了用目视比色法测定抗贫血药物中铁含量的实验。目视比色法是一种半定量的测定方法,即配制一系列不同浓度的标准溶液,溶液的颜色因浓度的不同而形成递变的色阶,利用人眼做检测器,在相同实验条件下,比较待测溶液与标准溶液的色阶,找出颜色最接近的标准液,从而确定待测组分的含量。若待测溶液的颜色介于两相邻标准溶液之间,则待测组分的浓度可取两标准溶液浓度的平均值。与目视比色法相比,利用滴数传感器和氧化还原电势传感器定量测定铁元素的含量,提高了准确度[2]。在高中化学实验中引入此方法可以强化学生的化学信息意识,提升学生的信息获取、信息处理、信息理解和分析能力。
2 实验原理
2.1 滴数传感器的工作原理
滴数传感器有一个5.7厘米(2.25英寸)长度的光学通道槽孔。当红外射线在来源和探测器之间被滴定的1滴试剂阻拦时,一个数字信号便被发送到Lab Pro,采集数据软件Logger Pro记录一滴试剂,然后使用软件中的标准刻度将试剂滴数转换成体积单位(例如毫升)(如图1所示)。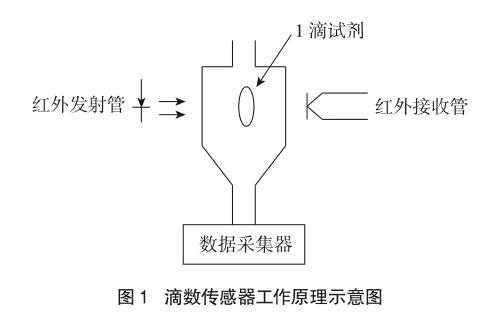
2.2 氧化还原传感器的工作原理
氧化还原电势传感器能够测量在-450至+1100毫伏范围内的氧化还原电势。这范围内偏向正数区域的读数表明一个强氧化试剂,反之接近负数区域范围内的读数表明一个强还原试剂。电极有两个组件:一个测量的半电池的组成是铂金属浸在一个氧化还原反应发生的溶液内,另一个组件是参考半电池,密封的银/氯化银凝胶是用作铂半电池的标准液。随着滴定剂的加入,发生化学反应而使待测离子的浓度发生改变,使得指示电极的电位亦随之改变,并于化学变化计量点附近发生突变(如图2所示)。
3 实验过程
3.1 實验仪器及试剂
实验仪器(如图3所示):
滴数传感器、氧化还原电势传感器、数据采集器(数据采集软件均为Vernier公司生产)、笔记本电脑、电磁搅拌器、滴液器、移液管、量筒、100mL容量瓶、烧杯、过滤器、酒精灯、石棉网、三脚架、玻璃棒、研钵、电烘箱
实验试剂:
琥珀酸亚铁片、草酸钠、高锰酸钾、18.4 mol·L-1硫酸、KSCN溶液、pH=4的HAc-NaAc缓冲溶液、Zn粒、活性炭(试剂均为国内市售分析纯,使用前未进一步纯化,水为处理过的超纯水)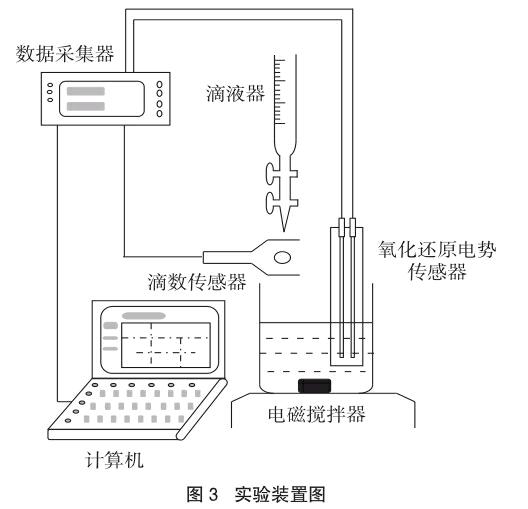
3.2 实验步骤
3.2.1 高锰酸钾溶液的配制与标定
称取3.16g高锰酸钾,溶于1000mL水中,缓缓煮沸15min,冷却于暗处放置2周后,过滤,贮存于棕色试剂瓶。
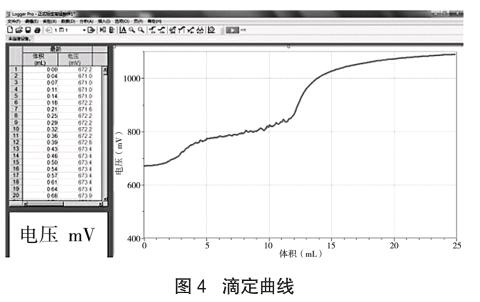
称取50mg草酸钠于105~110℃电烘箱中干燥至恒重,溶于100mL硫酸溶液(8+92)中(即8体积浓硫酸和92体积水混合而成)。用移液管量取5mL草酸钠溶液于烧杯中,将配制好的高锰酸钾溶液装入滴液器中,打开电磁搅拌器开关,点击Logger Pro软件“采集”按钮。再打开滴液器的旋塞,让高锰酸钾溶液逐滴滴入小烧杯中(滴定过程中保持恒温65℃),绘制滴定曲线(如图4),完成后按“停止”按钮。用滴数传感器测得消耗高锰酸钾溶液的体积,用氧化还原电势传感器监测滴定终点,重复此步骤3次。利用Logger Pro软件求导分析滴定终点,得到滴定终点消耗高锰酸钾溶液的体积,取3次平均值,从而计算得到高锰酸钾溶液的浓度。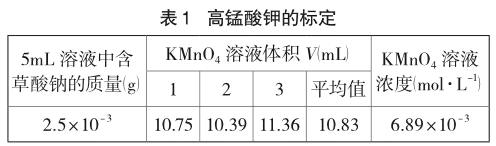
3.2.2 待测样品溶液的配制
取4粒琥珀酸亚铁片,在研钵中研碎,称取0.113g的样品于100mL烧杯中,加入20mL蒸馏水使其溶解,加入适量活性炭脱色,过滤,向滤液中加入足量Zn粒(取少量滤液用KSCN检验,确保溶液中无Fe3+),继续向滤液加入100mL pH为4的HAc-NaAc缓冲溶液,并混合均匀[4]。
3.2.3 待测样品中铁元素含量的测定
移取10mL待测溶液于烧杯中,用标准高锰酸钾溶液滴定(实验操作中传感器的使用与软件的运用与高锰酸钾溶液的标定过程相同),重复操作3次,得到滴定终点消耗高锰酸钾溶液的体积(如图5、图6),计算得到待测溶液中Fe2+的浓度。再根据Fe2+浓度计算得出该药片中铁元素含量。endprint
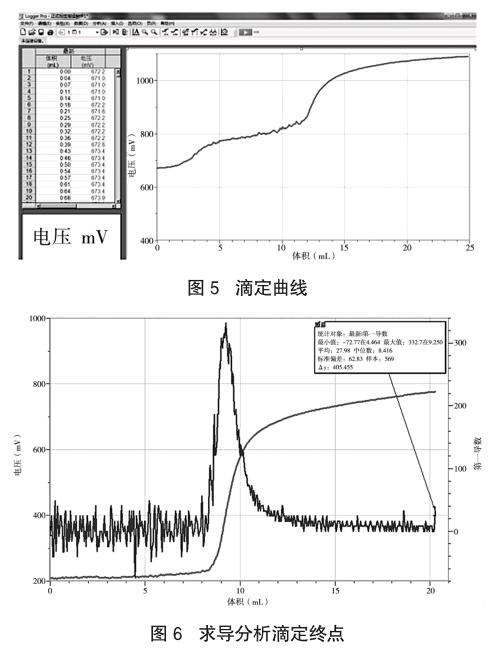

根据上述实验数据可计算得出每片琥珀酸亚铁中(0.1g)约含16毫克的铁元素,而根据说明书可计算得出每片琥珀酸亚铁(0.1g)含30毫克铁元素,实际测得的铁元素含量略小于琥珀酸亚铁片说明书中铁元素的含量,这可能是由于在待测样品的处理过程中有部分铁元素损失所致。
4 实验注意事项
本实验可以定量测定琥珀酸亚铁片中铁元素的含量,实验方法简单易行,结果可靠,在实验过程中应该注意如下问题:
(1)市售高锰酸钾纯度在90%左右,其中含有少量的MnO2及其他杂质,同时蒸馏水中也常含有还原性物质如尘埃、有机物等,这些物质都能促使高锰酸钾还原。因此高锰酸钾标准溶液不能用直接法配制,必须配制成近似浓度,然后用基准物标定。
(2)在低温时高锰酸钾与草酸钠溶液反应过慢,滴定过程中需保持恒温65℃。
(3)配制待测样品溶液时,保证溶液的pH= 4,以免Fe2+发生水解反应,加入足量Zn粒防止Fe2+氧化为Fe3+。
(4)用标准高锰酸钾溶液滴定待测样品溶液时重复操作3次,条件应保持一致,以确保数据的有效性和准确性。
5 结束语
本文利用滴数传感器和氧化还原电势传感器测定琥珀酸亚铁片中铁元素的含量,在高中化学实验中引入此方法可以扩大定量实验的范围,培养学生定量的化学思想和实验能力。学生运用化学软件处理数据,通过对数据、图形的处理和分析,提升化学信息素养,增进对化学现象和原理本质的认识,以及提高分析问题、解决问题的方法和能力。在中学化学教学中合理应用数字化实验,将传统的实验操作方法改进为数字化教学,发挥数字化实验在教学中的优势,使之与课堂教学更为合理、紧密地结合大有潜力可挖。
参考文献:
[1]计亮年,毛宗万,黄锦汪.生物无机化学导论(第三版)[M].北京:科学出版社,2010:381~382.
[2]南京大学《无机及分析化学》编写组.无机及分析化学(第四版)[M].北京:高等教育出版社,2007:395~408.
[3]魏瑞,王磊,劉强.含铁物质中铁元素含量的测定——基于传感技术的实验设计[J].化学教育,2006,(7):50~54.
[4]董金水.利用DIS测定黑木耳中铁元素的含量[J].化学教学,2011,(9):40~41.endprint

