离线SPE-LVI-GC-FID法分析婴儿配方奶粉中的饱和烃类矿物油
刘玲玲,张贞霞,李冰宁,武彦文,*
(1.北京市理化分析测试中心,北京市食品安全测试工程技术研究中心,北京市科学技术研究院分析测试技术重点实验室,北京 100089;2.国防科技大学西安通信学院,陕西 西安 710106)
离线SPE-LVI-GC-FID法分析婴儿配方奶粉中的饱和烃类矿物油
刘玲玲1,张贞霞2,李冰宁1,武彦文1,*
(1.北京市理化分析测试中心,北京市食品安全测试工程技术研究中心,北京市科学技术研究院分析测试技术重点实验室,北京 100089;2.国防科技大学西安通信学院,陕西 西安 710106)
建立婴儿配方奶粉中饱和烃类矿物油(mineral oil saturated hydrocarbons,MOSH)的离线固相萃取(solid phase extraction,SPE)结合大体积进样-气相色谱-氢火焰离子化检测器(large volume injection-gas chromatographyflame ionization detection,LVI-GC-FID)的分析方法。该方法以正己烷为提取溶剂,提取液经硝酸银渍硅胶SPE柱净化;通过比较不同长径比SPE柱的净化效果,确定以5 m L玻璃注射器作为分离MOSH的SPE柱,收集洗脱液5 m L,浓缩后注入LVI-GC-FID测定。GC的进样口升温程序为:初始温度45 ℃,保持1 m in(分流比200∶1),以250 ℃/m in升温至360 ℃(分流阀关闭2 m in),并保持27 m in(分流比为100∶1);柱温箱升温程序为:35 ℃保持3 m in,以25 ℃/m in升温至350 ℃,再以5 ℃/m in升温至370 ℃,保持10 m in;FID温度380 ℃;进样量40 μL。结果表明:MOSH的标准品液体石蜡在2~500 mg/kg范围内呈良好线性关系,相关系数为0.999,方法的定量限为0.05 mg/kg,加标回收率在92.62%~102.86%之间,相对标准偏差在0.85%~2.57%之间,适用于婴儿配方奶粉中MOSH的定量分析。应用该方法检测市售10 种婴儿配方奶粉中的MOSH含量,其结果在0.24~1.30 mg/kg之间,其中MOSH(C16~C35)含量在0.12~0.85 mg/kg之间,表明有必要对婴儿配方奶粉中的矿物油污染进行监管。
婴儿配方奶粉;饱和烃类矿物油(MOSH);固相萃取(SPE);大体积进样-气相色谱-氢火焰离子化检测器(LVI-GC-FID)
矿物油是从石油原油分离得到的碳数为C10~C50的复杂烃类化合物,主要包括直链、支链烷烃和烷基取代的环烷烃(m ineral oil saturated hydrocarbons,MOSH)以及烷基取代的芳香烃(m ineral oil aromatic hydrocarbons,MOAH)两大类[1]。食品中矿物油污染由来已久[2],主要来源于包装迁移、环境污染、食品加工过程等[1,3-4]。矿物油毒理学研究发现,人体皮下脂肪、淋巴结、脾脏、肝脏、肺、肾脏等器官中均含有相当数量的MOSH,其中以淋巴结和脾脏中MOSH含量最高,却未检测到MOAH[5]。欧洲食品安全局的研究显示,MOSH(C16~C35)经膳食摄入后在体内积聚,会导致淋巴结、脾脏和肝脏等器官产生肉芽肿和慢性炎症[1]。有研究发现,MOSH是人体内累积量最大的污染物[6],其主要来源于食物摄入。因此,食品中MOSH的污染物值得关注[7]。在各类食品中,婴儿食品最受重视,原因是婴儿各脏器发育尚不成熟,如果长期食用受MOSH污染的食品,很可能产生健康危害。随着社会发展,越来越多的婴儿配方奶粉帮助婴儿成长。因此,加强婴儿配方奶粉中MOSH的监测非常必要。
MOSH化学组成复杂,其定量分析一般采用气相色谱-氢火焰离子化检测(gas chrom atography-flame ionization detection,GC-FID)。原因是FID系唯一对所有矿物油组分响应完全一致的检测器,GC是与FID联用的理想分离方式[8]。MOSH的GC谱图是一个类似“驼峰”的宽峰,宽峰上方的尖峰为食品中的天然正构烷烃,定量计算时需要扣除,即MOSH含量通过计算GC谱图的基线与驼峰之间的“空白”面积得到。然而,FID的灵敏度低、选择性差,需要高度地净化与富集目标物[4]。目前,液相色谱(liquid ch rom atog raphy,LC)与气相色谱联用(LC-GC)是最为常用的矿物油分析技术,它通过LC与GC的接口技术实现在线净化、富集,有效提高了矿物油的纯度与浓度[9-11]。然而,LC-GC仪器昂贵,无法普及,离线净化技术成为另外一种解决途径[12-14]。
目前,已有文献主要集中在食用油、谷物、饼干、面包和巧克力等食品中MOSH的分析[15-27],婴儿配方奶粉中的矿物油调查尚未见报道。由于矿物油组成复杂,不同样品基质中的干扰成分不同,因此,分析不同食品样品中矿物油的具体方法不尽相同。本实验采用配备了大体积进样系统(large volume injection,LVI)的GC-FID建立婴儿奶粉中MOSH的检测方法,其创新之处在于:1)采用了操作简便的固相萃取(solid phase extraction,SPE)柱净化方法并优化了分离条件;2)通过优化LVIGC-FID条件将方法的定量限降低至0.05 mg/kg;3)根据奶粉基质的干扰特点,选择了合适的内标(环己基环己烷(cyclohexyl cyclohexane,Cycy))进行准确定量。该方法操作简便、实验条件要求不高,适用于市售奶粉中MOSH含量的日常检测。
1 材料与方法
1.1 材料与试剂
婴儿配方奶粉样品10 个 市购。
硝酸银(优级纯) 天津佳烨贵研科技有限公司;正己烷、丙酮(均为色谱纯) 美国Fisher Scientific公司;硅胶(0.063~0.200 mm,600 ℃烘烤6 h后置于干燥器中备用) 美国M erck公司;MOSH标准液体石蜡(paraffin oil,PO)、内标Cycy、正十八烷烃(n-octadecane,C18)、MOSH洗脱终止标记物胆甾烷(5-α-cho lestane,Cho)、MOAH洗脱开始标记物1,3,5-三叔丁基苯(1,3,5-tri-tert-butylbenzene,TBB)、C7~C40正构烷烃混合标准溶液(均为色谱纯) 美国Sigma-A ldrich公司。
1.2 仪器与设备
GC-2010 p lus气相色谱仪(配备程序升温蒸发进样器和FID) 日本Shimadzu公司;N-EVAP氮气吹干仪美国Organom ation公司;M illi-Q超纯水设备 美国M illipore公司;HY-5A型回旋式振荡器 江苏省金坛市荣华仪器制造有限公司;5 m L玻璃注射器(内径13 mm) 上海玻利鸽工贸有限公司。
1.3 方法
1.3.1 标准溶液的配制
分别配制10 mg/m L的C18、Cho、TBB、Cycy贮备液。各取0.5 m L C18、Cho、TBB贮备液置于50 m L容量瓶,用正己烷定容得到100 m g/L混合标准溶液;取Cycy贮备液1 m L置于50 m L容量瓶,用正己烷定容得到200 mg/L内标溶液。
配制50 g/L液体石蜡贮备液,然后分别取2、5、10、20、50、100、500 μL于50 m L容量瓶中,正己烷定容得到质量浓度为2、5、10、20、50、100、500 mg/L的标准工作溶液。
1.3.2 样品提取
分别称取婴儿配方奶粉样品10.0 g于50 m L具塞锥形瓶中,加入60 µL 200 mg/L Cycy内标溶液,20 m L正己烷溶剂,振荡2 h后静置过夜。取10 m L上清液氮吹浓缩,并定容至1 m L备用。
1.3.3 样品纯化
1.3.3.1 0.3%硝酸渍硅胶制备
称取99 g硅胶于1 000 m L铝箔纸包裹外壁的圆底烧瓶中,用玻璃滴管逐滴加入1%硝酸银溶液100 m L,然后用旋蒸仪继续混匀2~3 h,静置12 h后放入125 ℃烘箱干燥12 h。称取37 g上述银渍硅胶与63 g活化硅胶混匀得到0.3%硝酸银渍硅胶,干燥器内避光保存,2 周内使用。
1.3.3.2 SPE柱制备
取5 m L玻璃注射器(外层包裹铝箔纸),底部放入圆形玻璃纤维滤纸(经正己烷浸泡过夜),装填3 g银渍硅胶,轻轻敲实,上面再放入一层滤纸。用10 m L正己烷预淋洗SPE柱,弃去流出液,待液面近干时,加入1 m L上清液(1.3.2节),待上清液近干时,用10 m L正己烷洗脱,弃去先前流出的2 m L死体积洗脱液,收集后续的5 m L洗脱液,浓缩至0.2 m L,备用。
1.3.4 色谱条件
色谱柱:A g i len t D B-5H T石英毛细管柱(15 m×0.25 mm,0.1 μm);载气为高纯氮气,恒压模式,压力60 kPa;进样量40 μL。
PTV参数:初始温度45 ℃,保持1 m in(分流阀打开,分流比200∶1),以250 ℃/m in升温至360 ℃并保持27 m in,分流阀关闭2 m in,使目标组分进入分析柱;随后打开分流阀,分流比为100∶1,吹走衬管中残留物质。
GC分析条件:起始温度35 ℃,保持3 m in,然后以25 ℃/m in升温至350 ℃,再以5 ℃/m in升温至370 ℃,保持10 m in;FID温度380 ℃。
2 结果与分析
2.1 样品提取
MOSH是非极性有机物,根据相似相溶原理,常用正己烷、异辛烷、正庚烷或者正构烷烃混合物(沸点65~75 ℃)提取食品中的MOSH。异辛烷、正庚烷沸点高于正己烷,样品提取液浓缩时需要更长的挥发时间,因此选取正己烷作为样品中MOSH提取溶剂。奶粉中的脂肪被酪蛋白包裹,须用碱性乙醚法或者酸水解法破坏酪蛋白使脂肪游离出来后实现脂肪的完全提取,但本实验主要关注婴儿配方奶粉中外部引入(食品包装、加工等)的MOSH的污染情况,因此,采用正己烷浸泡过夜法对奶粉中MOSH进行提取[8]。
2.2 样品净化
SPE柱净化的关键是填料。硅胶能够有效吸附甘油三酯,是去除样品中油脂的首选填料。此外,硅胶经过活化(400~600 ℃灼烧4~6 h)不仅可以增大吸附容量,而且能够消除外来干扰。同时,硝酸银渍硅胶具有吸附角鲨烯等烯烃干扰物的作用[13]。因此,采用的3 g的银渍硅胶(0.3%)作为SPE柱填料(1.3.3.1节)用于吸附奶粉提取液中的油脂和烯烃,从而达到净化矿物油的目的。
SPE柱的长径比(即分离塔板数)对于分离效果也会产生影响。由于目前尚没有净化食品中矿物油的商品化SPE柱,本实验参考Fiselier等[14]应用的内径11 mm玻璃柱,定制了同样内径的玻璃分离柱,并同时比较了5 m L玻璃注射器(内径13 mm)制备的SPE柱对1 m L奶粉基质下混和标准溶液(C18、Cho、TBB)的分离效果。实验方法为将0.1 m L混和标准溶液(1.3.1节)加入奶粉提取液并定容至1 m L,分别上样至两种内径的SPE柱,采用正己烷洗脱,洗脱液每流出1 m L即注入GC分析。结果表明:两种内径SPE柱的死体积均为2 m L,随后都流出了MOSH的标记物C18和Cho,然后均在第8管开始流出MOAH前端的标记物TBB(图1)。通常,同等量的柱填料装入不同内径的SPE柱中,柱管内径越小,填料长度越长,相应的塔板数越高,分离效果越好。实验结果也表明:内径11 mm的SPE柱在第7管完成了MOSH的全部分离,即C18和Cho全部流出(图1A);然而,内径13 mm净化柱到7管也收集到了99%以上MOSH,仅有极少量(1%以下)C18和Cho在第8管与TBB共流出(图1B)。由于实际应用中玻璃注射器方便易得、价格便宜。因此,本实验采用5 m L玻璃注射器作为净化矿物油的SPE柱。

图1 混合标准溶液经过内径11 mm(A)和内径13 mm(B)SPE柱的洗脱顺序Fig. 1 Selective elution of m ixture standard solution through SPE column w ith 11 mm and 13 mm i.d.
2.3 样品分析
2.3.1 PTV初始温度的确定

图2 PTV优化条件下C10~C40的峰面积Fig. 2 Peak areas of n-alkanes (C10–C40)in GC chromatogram under optimal PTV conditions
MOSH由不同碳数的烷烃组成,碳数越低,沸点越低,如若PTV进样口的温度过高则会造成低沸点物质的挥发损失。本实验采用C7~C40正构烷烃标准溶液(2 mg/L)直接注入GC,考察进样过程的挥发损失。由图2可见,正构烷烃中C10~C40的峰面积基本一致,说明C10之后的烷烃几乎没有挥发损失。即进样口初始温度设为45 ℃时可以有效抑制低沸点物质的分流逸出。因此,本实验选用该进样条件用于奶粉中MOSH的定量分析。此外,该实验结果也表明可以选择C10或碳数更高的烷烃作为MOSH的定量内标。
2.3.2 GC升温速率的确定
MOSH的GC谱图为跨度较长保留时间的一个宽峰(或“驼峰”),为了缩短保留时间,增大宽峰的高度便于定量。通常,程序升温的速率越快,宽峰越“尖锐”,分析灵敏度越高。文献中大多采用的升温速率为20~25℃/m in,有的高达50℃/m in[8]。为了保持谱图的基线稳定,本实验优化GC的升温程序为:起始温度35 ℃(保持3 m in),选择25 ℃/m in升温至350 ℃,再以5 ℃/m in升温至370 ℃(保持10 m in)。
2.3.3 定量方法的确定
内标法定量可以有效避免进样量与样品制备过程对分析准确度的影响[8]。一般内标法要求内标物应不受待测样品中各组分的干扰,保留时间相近,但又必须可以完全分开。然而,由于MOSH呈宽峰形式,不同样品MOSH宽峰位置会有偏左或偏右的位移(因为不同来源MOSH的组成不尽相同,其碳数范围也略有差异),因此,选择一个与之完全分离的内标物较为困难。

图3 婴儿配方奶粉提取液中MOSH的GC谱图Fig. 3 GC chromatogram of MOSH in supernatant of infant formula
测定食用油中的MOSH的国际标准(ISO 17780)的定量内标采用C18[28]。由图3可知,奶粉提取液的GC谱图中存在C18的共流出物,因此,不能采用C18作为奶粉中MOSH的定量内标。而MOSH宽峰右边的高沸点烷烃(如C40)的溶解性较差[8]。经过反复实验,本实验选取Cycy作为奶粉提取液中MOSH的定量内标,其出峰位置在C13附近,样品的共流出干扰物较少,且不存在挥发损失。
2.4 方法学考察
2.4.1 线性范围
将1.3.1节配制的液体石蜡系列工作溶液,在1.3.4节条件下分析。以GC谱图中的宽峰面积(y)与相应质量浓度(x)绘制曲线,所得标准曲线为y = 47 554x-37 294,相关系数0.999,说明液体石蜡在2~500 mg/L质量浓度范围内线性关系良好。
2.4.2 定量限
定量限根据注入GC-FID的MOSH的浓度和体积确定。一般经验认为注入FID的MOSH为50 ng以上时,其形成的GC宽峰才能满足定量要求[8]。本实验将5.0 g奶粉上清液浓缩至1 m L,经SPE柱净化,将5 m L洗脱液浓缩至0.2 m L,注入GC-FID分析的体积为40 μL,即1.0 g奶粉被注入FID分析,因此对应的奶粉中MOSH的LOQ为0.05 mg/kg。
2.4.3 回收率实验结果
任意选取一种奶粉作为样品基质,分别添加液体石蜡标准溶液进行回收率实验,添加量为0.5、1.0、2.0 mg/kg。提取液经3 g银渍硅胶SPE柱净化,每个试样及空白分别平行测定3 次,计算平均加标回收率和相对标准偏差(表1)。结果表明,加标回收率在92.62%~102.86%之间,相对标准偏差在0.85%~2.57%之间,该方法的回收率和相对标准偏差均符合检测要求。
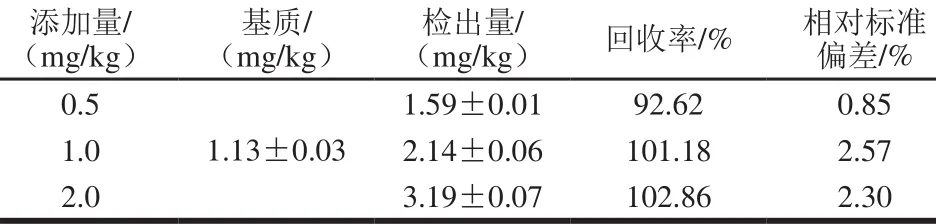
表1 液体石蜡的加标回收率和相对标准偏差(n= 3)Table 1 Recoveries and RSD of paraffin oil (n= 3)
2.5 实际样品的检测

表2 市售婴儿配方奶粉中的MOSH含量Table 2 Contents of MOSH in commercial in fant formu la
本实验采用上述方法,检测了市售不同厂家与品牌婴儿配方奶粉中MOSH含量,结果见表2。结果表明,10 个婴儿配方奶粉中只有样品4和5未检出MOSH,其余8 个样品的MOSH含量在0.24~1.30 mg/kg之间,其中4 个样品的C16~C35含量在0.12~0.30 mg/kg之间,其余4 个样品的含量为0.66~0.85 mg/kg。按照联合国粮农组织和世界卫生组织的食品添加剂联合专家委员会规定的中低黏度矿物油(Ⅱ类和Ⅲ类)的每日容许摄入量(acceptable daily intake,ADI)0.01 mg/kg bw估算[29-30],如果液体配方奶中含10%奶粉,婴儿每日奶量800 m L,那么对于一个5 kg的婴儿,每日即摄入80 g配方奶粉,对应的矿物油的特定迁移量(specific m igration lim it,SML)为0.625 mg/kg。参照此限量,粗略估计我国市售婴儿配方奶粉中的40%(4/10)超过了食品添加剂联合专家委员会的ADI值,因此我国奶粉中的MOSH污染情况不容忽视。
婴儿配方奶粉中MOSH来源广泛,主要污染可能来自于使用了含矿物油颜料印刷的回收包装纸,也可能源于奶粉生产过程中添加的各种组分(如食用油)和生产过程中使用的润滑油等[1]。本实验仅选取我国市场上的10 个婴儿配方奶粉作为样本,后续将加大样本量并判断可能的污染来源,从而为监管婴儿配方奶粉安全提供技术基础。
3 结 论
建立一种离线SPE结合LVI-GC-FID法测定婴儿配方奶粉中MOSH的方法,正己烷作为提取溶剂,净化采用市售5 m L玻璃注射器装填3 g银渍硅胶SPE柱,净化洗脱液经浓缩后注入LV I-GC-FID分析,其结果满足方法学考察要求。与在线联用的HPLC-GC-FID相比,离线SPE-LVI-GC-FID方法操作简单、成本低,适用于普通实验室对婴儿配方奶粉中MOSH的检测。本实验测定了10 个市售婴儿配方奶粉中MOSH的含量,结果表明:仅有2 个样品未检出,其中40%的样品中MOSH(C16~C35)的含量超过了食品添加剂联合专家委员会规定的ADI值,因此建议相关部门加强婴儿配方奶粉中矿物油污染物的监管。
[1] European Food Safety Authority (EFSA). Scientific opinion on m ineral oil hydrocarbons in food[J]. EFSA Journal, 2012, 10(6): 2704.DOI:10.2903/j.efsa.2012.2704.
[2] GROB K, BIEDERMANN M, GARAMASCHI A, et al. LC-GC analysis of the aromatics in a m ineral oil fraction: batching oil for jute bags[J]. Journal of High Resolution Chromatography, 1991, 14(1):33-39. DOI:10.1002/jhrc.1240140109.
[3] 张闽, 曹万新, 史宣明, 等. 食用油脂生产中矿物油污染及检测方法的研究进展[J]. 中国油脂, 2015, 40(3): 62-65.
[4] 武彦文, 王颖, 李冰宁, 等. 定量分析食品中的矿物油污染物[J].食品安全质量检测学报, 2015, 6(6): 2145-2150.
[5] BARP L, KORNAUTH C, WUERGER T, et al. M ineral oil in human tissues, Part I: Concentrations and molecular mass distributions[J].Food Chem ical Toxicology, 2014, 72: 312-321. DOI:10.1016/j.fct.204.04.029.
[6] GROB K. Update on recycled paperboard and its compliance for food contact[J]. Journal of Consumer Protection and Food Safety, 2014,9(3): 213-219. DOI:10.1007/s00003-014-0903-y.
[7] VOLLMER A, BIEDERMANN M, GRUNDBÖCK F, et al. M igration of m ineral oil from printed paperboard into dry foods: survey of the German market[J]. European Food Research and Technology, 2011,232(3): 175-182. DOI:10.1007/s00217-010-1376-6.
[8] BIEDERMANN M, GROB K. On-line coup led high performance liquid chromatography-gas chromatography for the analysis of contamination by mineral oil. Part 1: Method of analysis[J]. Journal of Chromatography A, 2012, 1255(17): 56-75. DOI:10.1016/j.chroma.2012.05.095.
[9] MORET S, GROB K, CONTE L S. On-line high-performance liquid chromatography-solvent evaporation-high-performance liquid chromatography-capillary gas chromatography-flame ionisation detection for the analysis of m ineral oil polyaromatic hydrocarbons in fatty foods[J]. Journal of Chromatography A, 1996, 750(1/2): 361-368.DOI:10.1016/0021-9673(96)00453-0.
[10] BARP L, PURCARO G, MORET S, et al. A high-sample-throughput LC-GC method for m ineral oil determ ination[J]. Journal Separation Science, 2013, 36(18): 3135-3139. DOI:10.1002/jssc.201300114.
[11] PURCARO G, ZOCCALI M, TRANCHIDA P Q, et al. Comparison o f tw o different multidimensional liquid-gas chromatography interfaces for determ ination of m ineral oil saturated hydrocarbons in foodstuffs[J]. Analytical and Bioanalytical Chem istry, 2013, 405(2/3):1077-1084. DOI:10.1007/s00216-012-6535-0.
[12] MORET S, BARP L, GROB K, et al. Optimised off-line SPE-GC-FID method for the determination of m ineral oil saturated hydrocarbons(MOSH) in vegetab le oils[J]. Food Chem istry, 2011, 129(4):1898-1903. DOI:10.1016/j.foodchem.2011.05.140.
[13] MORET S, BARP L, PURCARO G, et al. Rapid and sensitive solid phase extraction-large volume injection-gas chromatography for the analysis of m ineral oil saturated and aromatic hydrocarbons in cardboard and dried foods[J]. Journal of Chromatography A, 2012,1243(12): 1-5. DOI:10.1016/j.chroma.2012.04.040.
[14] FISELIER K, GRUNDBÖCK F, SCHÖN K, et al Development of a manual method for the determ ination of m ineral oil in foods and paperboard[J]. Journal of Chromatography A, 2013, 1271(1): 192-200.DOI:10.1016/j.chroma.2012.11.034.
[15] TRANCHIDA P Q, ZOCCALI M, PURCARO G, et al. A rapid multidimensional liquid-gas chromatography method for the analysis of m ineral oil saturated hydrocarbons in vegetable oils[J]. Journal of Chromatography A, 2011, 1218(48): 7476-7480. DOI:10.1016/j.chroma.2011.06.089.
[16] FIORINI D, FISELIER K, BIEDERMANN M, et al. Contam ination of grape seed oil w ith m ineral oil paraffins[J]. Journal of Agricultural and Food Chemistry, 2008, 56(23): 11245-11250. DOI:10.1021/jf802244r.
[17] 刘玲玲, 武彦文, 李冰宁, 等. 固相萃取-大体积进样-气相色谱法定量分析油茶籽油中的矿物油[J]. 分析化学, 2016, 44(9): 1419-1424.DOI:10.11895/j.issn.0253-3820.160138.
[18] ZOCCALI M, BARP L, BECCARIA M, et al. Im provement of m ineral oil saturated and aromatic hydrocarbons determ ination in edible oil by liquid-liquid-gas chromatography w ith dual detection[J].Journal Separation Science, 2016, 39(3): 623-631. DOI:10.1002/jssc.201501247.
[19] LI B N, WU Y W, LIU L L, et al. Determination of mineral oil-saturated hydrocarbons (MOSH) in vegetable oils by large scale off-line SPE Combined w ith GC-FID[J]. Journal of the American Oil Chem ists’Society, 2017, 94(2): 215-223. DOI:10.1007/s11746-016-2936-0.
[20] BIEDERMANN M, GROB K. Is recycled newspaper suitable for food contact materials? Technical grade m ineral oils from printing inks[J].European Food Research and Technology, 2010, 230(5): 785-796.DOI:10.1007/s00217-010-1223-9.
[21] BARP L, SUMAN M, LAMBERTINI F, et al. M igration of selected hydrocarbon contam inants into dry semolina and egg pasta packed in direct contact w ith virgin paperboard and polypropylene fi lm[J]. Food Additives & Contam inants: Part A, 2015, 32(9): 1542-1551. DOI:10.1 080/19440049.2015.1075176.
[22] BIEDERMANN-BREM S, GROB K. Removal of m ineral oil m igrated from paperboard packing during cooking of foods in boiling water[J].European Food Research and Technology, 2011, 232: 1035-1041.DOI:10.1007/s00217-011-1478-9.
[23] 安红梅, 柯润辉, 刘秀, 等. 固相萃取结合气相色谱-火焰离子化检测器分析面包中饱和烃类矿物油的方法研究[J]. 食品与发酵工业,2016, 42(1): 152-156. DOI:10.13995/j.cnki.11-1802 /ts.201601028.
[24] CONCIN N, HOFSTETTER G, PLATTNER B, et al. M ineral oil paraffins in human body fat and m ilk[J]. Food and Chem ical Toxicology, 2008, 46(2): 544-552. DOI:10.1016/j.fct.2007.08.036.
[25] NOTI A, GROB K, BIEDERMANN M, et al. Exposure of babies to C15-C45m ineral paraffins from human m ilk and breast salves[J].Regulatory Toxicology and Pharmacology, 2003, 38(3): 317-325.DOI:10.1016/S0273-2300(03)00098-9.
[26] MONDELLO L, ZOCCALI M, PURCARO G, et al. Determ ination of saturated-hydrocarbon contam ination in baby foods by using online liquid-gas chromatography and off-line liquid chromatographycom p rehensive gas ch rom atog raphy com bined w ith m ass spectrometry[J]. Journal of Chromatography A, 2012, 1259: 221-226.DOI:10.1016/j.chroma.2012.03.096.
[27] 李冰宁, 刘玲玲, 张贞霞, 等. 银离子固相萃取-程序升温大体积进样-气相色谱法定量分析市售巧克力中的饱和烷烃矿物油[J]. 分析化学, 2017, 45(4): 514-520. DOI:10.11895/j.issn.0253-3820.160828.
[28] International Organization for Standardization. Animal and vegetable fats and oils determination of aliphatic hydrocarbons in vegetable oils:ISO 17780:2015(E)[S]. Sw itzerland: ISO copyright office, 2015: 1-29.
[29] World Health Organization. Evaluation of certain food additives[R].Geneva: WHO, 2002.
[30] Joint FAO/WHO Expert Comm ittee on Food Additives. Summary of evaluations performed by the joint FAO/WHO expert comm ittee on food additives[EB/OL].(2003-04-25). http://www.inchem.org/documents/jecfa/jeceval/jec_1655.htm.
Off-Line Solid Phase Extraction-Large Volume Injection-Gas Chromatography-Flame Ionization Detection(SPE-LVI-GC-FID) for the Analysis of M ineral Oil Saturated Hydrocarbons (MOSH) in Infant Formula
LIU Lingling1, ZHANG Zhenxia2, LI Bingning1, WU Yanwen1,*
(1. Beijing Center for Physical and Chemical Analysis, Beijing Food Safety Analysis and Testing Engineering Research Center,Key Laboratory of Analysis and Testing, Beijing Academy of Science and Technology, Beijing 100089, China;2. Xi’an Communication Institute, National University of Defense Technology, Xi’an 710106, China)
An alternative method based on an off-line solid phase extraction (SPE) combined w ith large volume injection-gas chromatography-flame ionization detection (LVI-GC-FID) was developed to determ ine mineral oil saturated hydrocarbons(MOSH) in infant formula. The MOSH in samples were extracted w ith n-hexane. The extract was purified by solid phase extraction (SPE) on a column packed w ith silica gel impregnated silver nitrate and the optimal SPE cartridge was 5 m L glass syringe as indicated by comparison of different length to diameter ratios. Five m illiliter of the pooled eluate was concentrated and then injected into the LVI-GC-FID system. The PTV parameters were as follows: the initial temperature was set at 45 ℃and held for 1 min (split ratio was 200:1), then increased to 360 ℃ at a linear gradient of 250 ℃/min and held for 27 min (split valve was closed for 2 m in followed by split ratio of 100:1). The GC column was heated from 35 ℃ (3 m in) to 350 ℃ at 25 ℃/min, and then raised to 370 ℃ (10 min) at 5 ℃/min. FID temperature was set at 380 ℃. The GC injection volume was 40 μL. The calibration curve of paraffin oil was linear in the range of 2–500 mg/kg w ith correlation coefficient of 0.999. The quantification limit (LOQ) of MOSH in infant formula was 0.05 mg/kg. The recoveries from spiked samples were between 92.62% and 102.86%, w ith relative standard deviation (RSD) of 0.85%–2.57%. This procedure was appliedto analyze MOSH in 10 commercial infant formula samples and the contam inant levels ranged from 0.24 to 1.30 mg/kg(0.12-0.85 mg/kg of MOSH between C16and C35). The results suggested that it is necessary to routinely detect m ineral oil contamination in infant formula for infant health.
infant formula; m ineral oil-saturated hydrocarbons (MOSH); SPE; LVI-GC-FID
2016-11-14
北京市科技计划课题(Z161100000616005);北京市科学技术研究院财政专项(PXM 2016_178305_000013;PXM 2017_178305_000001)
刘玲玲(1987—),女,硕士,主要从事食品分析方法研究。E-mail:lingling2@163.com
*通信作者:武彦文(1973—),女,研究员,博士,主要从事食品与油脂分析研究。E-mail:wu_yanwen@163.com
10.7506/spkx1002-6630-201722045
TS201.6
A
1002-6630(2017)22-0303-06
刘玲玲, 张贞霞, 李冰宁, 等. 离线SPE-LVI-GC-FID法分析婴儿配方奶粉中的饱和烃类矿物油[J]. 食品科学, 2017,38(22): 303-308. DOI:10.7506/spkx1002-6630-201722045. http://www.spkx.net.cn
LIU Lingling, WU Yanwen, LI Bingning, et al. Off-line solid phase extraction-large volume injection-gas chromatographyflame ionization detection (SPE-LVI-GC-FID) for the analysis of m ineral oil saturated hydrocarbons (MOSH) in infant formula[J]. Food Science, 2017, 38(22): 303-308. (in Chinese w ith English abstract)
10.7506/spkx1002-6630-201722045. http://www.spkx.net.cn

